È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Valutazione della Neuromuscolare Funzione Con percutanea stimolazione elettrica del nervo
In questo articolo
Riepilogo
We present a protocol to assess changes in neuromuscular function. Percutaneous electrical nerve stimulation is a non-invasive method that evokes muscular responses. Electrophysiological and mechanical properties of these responses permit the evaluation of neuromuscular function from brain to muscle (supra-spinal, spinal and peripheral levels).
Abstract
Percutaneous electrical nerve stimulation is a non-invasive method commonly used to evaluate neuromuscular function from brain to muscle (supra-spinal, spinal and peripheral levels). The present protocol describes how this method can be used to stimulate the posterior tibial nerve that activates plantar flexor muscles. Percutaneous electrical nerve stimulation consists of inducing an electrical stimulus to a motor nerve to evoke a muscular response. Direct (M-wave) and/or indirect (H-reflex) electrophysiological responses can be recorded at rest using surface electromyography. Mechanical (twitch torque) responses can be quantified with a force/torque ergometer. M-wave and twitch torque reflect neuromuscular transmission and excitation-contraction coupling, whereas H-reflex provides an index of spinal excitability. EMG activity and mechanical (superimposed twitch) responses can also be recorded during maximal voluntary contractions to evaluate voluntary activation level. Percutaneous nerve stimulation provides an assessment of neuromuscular function in humans, and is highly beneficial especially for studies evaluating neuromuscular plasticity following acute (fatigue) or chronic (training/detraining) exercise.
Introduzione
Stimolazione elettrica percutanea è ampiamente utilizzato per valutare la funzione neuromuscolare 1. Il principio di base è costituito da indurre uno stimolo elettrico di un nervo motore periferici per evocare una contrazione muscolare. Meccanica (misura della coppia) ed elettrofisiologici (attività elettromiografico) le risposte sono contemporaneamente registrati. Coppia, registrato presso il comune considerato, viene valutata utilizzando un ergometro. Il segnale elettromiografico (EMG) registrati con elettrodi di superficie è stato dimostrato per rappresentare l'attività del muscolo 2. Questo metodo non invasivo, non è doloroso e più facilmente attuabile di registrazioni intramuscolari. Entrambi gli elettrodi monopolari e bipolari possono essere usati. La configurazione degli elettrodi monopolare ha dimostrato di essere più sensibile alle variazioni di attività muscolare 3, che possono essere utili per piccoli muscoli. Tuttavia, elettrodi bipolari hanno dimostrato di essere più efficace nel migliorare la r segnale-rumoreazio 4 e sono più comunemente usato come metodo di registrazione e quantificare l'attività gruppo motore. La metodologia descritta di seguito si concentrerà sulle registrazioni bipolari. Attività EMG è un indicatore dell'efficacia e l'integrità del sistema neuromuscolare. L'uso di stimolazione del nervo percutanea offre ulteriori approfondimenti funzione neuromuscolare, cioè cambiamenti a livello muscolare, spinale, o sovra-spinale (Figura 1).

Figura 1:. Panoramica delle misurazioni neuromuscolari STIM: la stimolazione del nervo. EMG: elettromiografia. VAL: Livello di attivazione volontaria. RMS: Root Mean Square. M max: massima ampiezza M-onda.
A riposo, il potenziale d'azione muscolare composto, chiamato anche M-onda, è la risposta a breve latenza osservata dopo stimolo manufatto, e rappresenta la massa muscolare eccitabile dalla Activ diretta zione di assoni motori portano al muscolo (Figura 2, il numero 3). Ampiezza M-onda aumenta con l'intensità fino a raggiungere un plateau del suo valore massimo. Questa risposta, denominato M max, rappresenta la sommatoria sincrono di tutte le unità del motore e / o potenziali di azione delle fibre muscolari registrate sotto gli elettrodi EMG 5. L'evoluzione dell'area ampiezza o onda di picco-picco viene utilizzato per identificare alterazioni della trasmissione neuromuscolare 6. Variazioni nelle risposte meccanici associati M-onda, cioè picco contrazione coppia / forza, possono essere causa di alterazioni dell'eccitabilità muscolare e / o all'interno delle fibre muscolari 7. L'associazione di M max ampiezza e ampiezza coppia massima contrazione (rapporto Pt / M) fornisce un indice di efficienza elettromeccanica del muscolo 8, cioè risposta meccanica per un determinato comando elettrico del motore.
52974 / 52974fig2.jpg "/>
Figura 2:. Motore e percorsi riflessivi attivate dalla stimolazione del nervo stimolazione elettrica di un (/ sensoriale motore) nervo misto (STIM) induce una depolarizzazione sia assoni motori e Ia afferente cottura. Depolarizzazione Ia afferenti verso il midollo spinale attiva un motoneurone alfa, che a sua volta evoca una risposta H-reflex (percorso 1 + 2 + 3). A seconda della intensità dello stimolo, assone motore depolarizzazione evoca una risposta muscolare diretta: M-wave (via 3). Alla massima intensità M-onda, una corrente antidromic viene anche generato (3 ') e si scontra con volley reflex (2). Questa collisione parzialmente o totalmente annulla la risposta H-reflex.
L'H-riflesso è una risposta elettrofisiologica usato per valutare i cambiamenti nella Ia-α motoneuroni sinapsi 9. Questo parametro può essere valutato a riposo o durante le contrazioni volontarie. H-reflex rappresenta una variante del riflesso di stiramento (Figura 2, number 1-3). L'H-reflex attiva unità motorie monosinaptica reclutati da Ia vie afferenti 10,11, e può essere sottoposto a influenze periferici e centrali 12. Il metodo di evocare un H-reflex è noto per avere una elevata affidabilità intra-soggetto per valutare l'eccitabilità spinale a riposo 13,14 e durante contrazioni isometriche 15.
Durante una contrazione volontaria, la grandezza della spinta neurale volontario può essere valutato utilizzando la ampiezza del segnale EMG, generalmente quantificata usando l'Mean Square Root (RMS). RMS EMG è comunemente utilizzato un mezzo di quantificare il livello di eccitazione del sistema motorio durante la contrazione volontaria (Figura 1). A causa della variabilità intra e inter-soggetto 16, RMS EMG deve essere normalizzati con il EMG registrato durante un massimale contrazione volontaria muscolo-specifica (RMS EMGmax). Inoltre, perché i cambiamenti nel segnale EMG possono be a causa di alterazioni a livello periferico, la normalizzazione con un parametro periferico, come M-onda è tenuta a valutare solo la componente centrale del segnale EMG. Questo può essere fatto dividendo il RMS EMG dalla massima ampiezza o RMS Mmax dell'M-onda. Normalizzazione utilizzando RMS Mmax (cioè RMS EMG / RMS Mmax) è il metodo preferito in quanto prende in considerazione il possibile cambiamento della durata M-wave 17.
Comandi motori possono anche essere valutati calcolando il livello di attivazione volontaria (VAL). Questo metodo utilizza la tecnica di interpolazione contrazione 18 sovrapponendo una stimolazione elettrica a M intensità massima nel corso di una massima contrazione volontaria. L'extra-coppia indotta dalla stimolazione del nervo viene confrontato con una contrazione di controllo prodotto da stimolazione del nervo in un identico rilassante muscolare potenziato 19. Per valutare la massima VAL, la contrazione INTERPO originaletecnica mento descritta da Merton 18 comporta un singolo stimolo interpolato su una contrazione volontaria. Recentemente, l'uso della stimolazione accoppiato è diventato più popolare perché gli incrementi di coppia evocati sono più grandi, più facilmente rilevata e meno variabile rispetto alle risposte stimolazione singole 20. Il VAL fornisce un indice della capacità del sistema nervoso centrale per attivare massimo muscoli di lavoro 21. Attualmente, VAL valutata utilizzando la tecnica di interpolazione contrazione è il metodo più importante della valutazione del livello di attivazione muscolare 22. Inoltre, la coppia massima valutata utilizzando un ergometro è il parametro di prova di forza più propriamente studiati applicabile uso nella ricerca e contesti clinici 23.
Stimolazione nervosa elettrica può essere utilizzata in una varietà di gruppi muscolari (ad esempio flessori del gomito, del polso, flessori estensori del ginocchio, flessori plantari). Tuttavia, l'accessibilità dei nervi rende iltecnica difficile in alcuni gruppi di muscoli. I muscoli flessori plantari, soprattutto tricipite surale (soleo e gastrocnemii) muscoli, sono spesso studiati in letteratura 24. In effetti, questi muscoli sono coinvolti nella locomozione, giustificando il loro particolare interesse. La distanza tra il sito di stimolazione e elettrodi di registrazione permette l'identificazione delle diverse onde evocati di tricipite surale muscoli. La parte superficiale del nervo tibiale posteriore nella fossa poplitea e il gran numero di mandrini facilitano registrare risposte riflesse rispetto ad altri muscoli 24. Per queste ragioni, la metodologia reflex attualmente presentato si concentra sul gruppo tricipite surale dei muscoli (soleo e gastrocnemio). Lo scopo di questo protocollo è quindi di descrivere percutanea tecnica di stimolazione del nervo indagare funzione neuromuscolare nella tricipite surale.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Le procedure sperimentali delineate ricevuto approvazione etica istituzionale e sono in accordo con la Dichiarazione di Helsinki. I dati sono stati raccolti da un partecipante rappresentante che era a conoscenza delle procedure e ha dato il suo consenso informato scritto.
1. Strumento Preparazione
- Pulire la pelle in corrispondenza della posizione degli elettrodi per la rasatura, e rimuovere lo sporco con alcool per ottenere bassa impedenza (<5 k).
- Inserire due elettrodi di superficie AgCl (registrazione diametro di 10 mm) a 2/3 della linea tra i condylis mediali del femore al malleolo mediale del muscolo soleo; sul rigonfiamento più importante del muscolo gastrocnemio mediale per la; a 1/3 della distanza lungo una linea tra la testa del perone e tallone per gastrocnemio laterale; e a 1/3 della distanza lungo una linea tra la punta del perone e la punta del malleolo mediale per il muscolo tibiale anteriore, con un interelectrodistanza de (da centro a centro) 2 cm, secondo le raccomandazioni SENIAM 30.
Nota: Gli elettrodi muscolo soleo devono essere posizionato sotto l'inserzione distale dei muscoli gastrocnemii per garantire che non stanno registrando attività dalle teste dei muscoli gastrocnemii (cross-talk). - Collocare un elettrodo di riferimento in posizione centrale sulla stessa gamba (tra stimolazione e siti di registrazione).
- Regolare l'altezza e la profondità della sedia per ottenere un angolo di 90 ° caviglia (0 ° = massima flessione plantare), in modo che il soleo e muscoli gastrocnemii non sono allungati e l'H-reflex non è alterata 11,12.
- Impostare l'angolo del ginocchio a 90 ° (0 ° = estensione del ginocchio) a causa della natura biarticolare dei muscoli gastrocnemii. Tuttavia, l'angolo della caviglia ottimale per eseguire una coppia massima volontaria dei flessori plantari è 70-80 ° (0 ° = flessione plantare piena) 26. Così, l'angolo caviglia dipenderà dalla parametro di interessi (elettrofisiologiche contro registrazioni meccaniche).
Nota: Indipendentemente dal angolo iniziale prescelta, deve rimanere costante durante l'esperimento di standardizzare eccitabilità neuromuscolare 11,12,27,28. - Prestare particolare attenzione quando si controllano postura dei soggetti durante il test di mantenere influenze cortico-vestibolare costanti sulla eccitabilità della piscina motore 29.
- Impostare l'angolo del ginocchio a 90 ° (0 ° = estensione del ginocchio) a causa della natura biarticolare dei muscoli gastrocnemii. Tuttavia, l'angolo della caviglia ottimale per eseguire una coppia massima volontaria dei flessori plantari è 70-80 ° (0 ° = flessione plantare piena) 26. Così, l'angolo caviglia dipenderà dalla parametro di interessi (elettrofisiologiche contro registrazioni meccaniche).
- Cinghia saldamente la caviglia per un ergometro, con l'asse anatomico del giunto (malleolo esterno) allineato con l'asse di rotazione del ergometro 25.
- Avere la pressione soggetto esercitano su una pedana collegata al ergometro per registrare la coppia flessore plantare. Tenere il piede immobile durante l'esperimento in modo che le piccole variazioni di coppia possono essere rilevati.
- Nota: In determinate circostanze, il tallone potrebbe sollevare leggermente la piastra forza se il piede e la caviglia non sono garantiti, che può leannuncio a una trasmissione incompleta della coppia contro la piastra. Figura 3 presenta una descrizione del setup sperimentale.
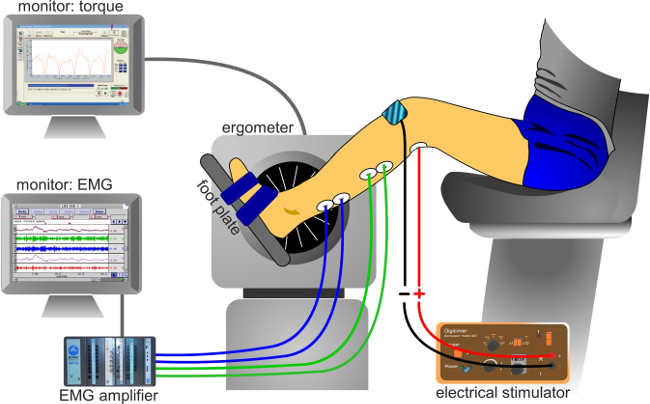
Figura 3:. Apparato sperimentale classico setup sperimentale per registrare i segnali (EMG) e di coppia elettromiografici.
- Collegare gli elettrodi all'amplificatore con cavi.
- Impostare la frequenza di campionamento per le misure di coppia e EMG per 2-5 kHz. Registrare il segnale EMG utilizzando un (AD) sistema di conversione analogico-digitale. Il segnale viene visualizzata su un monitor con un sistema di acquisizione dati, che dà istantaneamente valori di alcuni parametri (ad esempio il valore massimo, ampiezza picco-picco, durata). Lo spettro del segnale EMG può variare tra 5 Hz e 2 kHz frequenze, ma è contenuta soprattutto tra 10 Hz e 31 kHz 1. Pertanto, la frequenza di campionamento deve essere sufficientemente alta per preservare dur forma del segnaleing registrazione EMG. Amplificare e filtrare i segnali EMG (guadagno = 500-100) con una frequenza di banda tra 10 Hz e 1 kHz 8,21,32.
- Inserire l'anodo per la stimolazione elettrica sul tendine rotuleo.
- Determinare il miglior sito di stimolazione del nervo tibiale posteriore per ottenere un ottimale soleus H reflex per una data intensità, utilizzando un elettrodo catodico palla a mano nella fossa poplitea. Testare diversi siti di stimolazione con l'elettrodo a sfera catodo fino a raggiungere un valore massimo del riflesso H.
- Record tibiale anteriore attività EMG per garantire che il nervo peroneo comune non si attiva per evitare l'influenza da antagonista Ia afferenze 12. Impostare la larghezza di impulso a 1 msec per fornire una attivazione ottimale delle fibre nervose, specialmente fibre afferenti 10.
- Posizionare un AgCl catodo autoadesiva in corrispondenza della posizione del sito di stimolazione al fine di garantire condizioni di costante stimolo (ad esempio pressione, orientezione).
Nota: Tutti questi parametri (posizione del soggetto, la posizione degli elettrodi e del sito di stimolazione) non cambiare per la valutazione delle varie misurazioni elettrofisiologiche. Solo l'intensità della stimolazione e la condizione (resto contro contrazione) variano.
2. procedure di test a riposo
- Istruire il soggetto di rimanere rilassati e per mantenere i suoi / i suoi muscoli a riposo.
- Regolare l'intensità di stimolazione per ottenere soleo massima H-reflex ampiezza (H max; consueta gamma: 20-50 mA). Un M-onda del muscolo soleo può essere osservato in H intensità max.
Nota: Per misure ripetute (per esempio prima e dopo un protocollo faticosa), l'intensità ottimale per ottenere una risposta max H possono variare durante la sessione. Come mantenere una intensità costante può portare a una sottovalutazione di H max di ampiezza, si raccomanda che lo sperimentatore rivaluta regolarmente H max33 intensità. - Registrare un minimo di 3 soleo risposte H-reflex a questa intensità, con un intervallo minimo di 3 secondi per evitare post-attivazione depressione 34.
Nota: Sebbene registrazione diverse risposte è più adatto a causa della particolare sensibilità del riflesso H, un singolo stimolazione può essere sufficiente in alcune circostanze, ad esempio quando si cerca di evitare gli effetti di recupero rapido (ad esempio durante un protocollo affaticante). - Aumentare l'intensità di stimolazione per ottenere la massima ampiezza soleo M-onda (M max; consueta gamma: 40-100 mA). Normalmente, impostare l'incremento nell'intensità di stimolo a 2-4 mA, con un intervallo di 8-10 sec tra due stimoli 12,35. L'intensità desiderata è raggiunto quando si ottiene M max, e nessuna risposta H-riflesso può essere osservato.
- Impostare l'intensità finale al 120-150% della M max intensità dello stimolo per garantire che il M-onda raggiunge un plateau del suo valore massimo. Questo intensity è chiamato intensità sovramassimale nelle istruzioni riportate di seguito.
- Tenere intensità di stimolazione costante per soleo registrazioni M-onda per tutta la sessione.
- Record 3 soleo M-onde e 3 coppie di contrazione associati a questa intensità.
3. Procedure di test durante la contrazione volontaria
- Come un warm-up, chiedere al soggetto di eseguire 10 brevi e non affaticante contrazioni submassimali dei muscoli flessori plantari, con un riposo di alcuni secondi tra ciascuna delle contrazioni. Alla fine del warm-up, prendere un 1 minuto di riposo minimo per evitare effetti affaticanti 11.
- Attività EMG tricipite surale continuamente discografiche. Registrazione soleo e muscoli gastrocnemii permette l'analisi del comportamento di diverse tipologie muscolari per un singolo sito di stimolazione 24.
- Istruire il soggetto di eseguire una contrazione isometrica massimale volontaria (MVC) dei flessori plantari. Il soggetto deve spingere come posBLE contro l'ergometro contraendo i muscoli flessori plantari. Dare un feedback visivo per il soggetto durante lo sforzo, e standardizzato incoraggiamento verbale 19. Il MVC si raggiunge quando si osserva un plateau.
- Fornire una stimolazione accoppiato (frequenza 100 Hz) ad intensità sopramassimale durante l'altopiano del MVC (doppietto sovrapposti), e un altro stimolo associato quando il muscolo è completamente rilassato subito dopo la contrazione (doppietto potenziato) per valutare il livello di attivazione volontaria. Consegnare questa stimolazione accoppiato attraverso un dispositivo specifico (ad esempio Digitimer D185 MultiPulse stimolatore) o attraverso un programma di stimolazione associata ad un singolo impulso stimolatore.
- Istruire il soggetto di eseguire una seconda MVC del flessore plantare con almeno 1 minuto di riposo tra ogni prova 11. Se la coppia di picco dalla seconda prova non è entro il 5% del primo, ulteriori prove devono essere effettuate 36. La coppia massima raggiunta dalil soggetto è preso come la coppia MVC.
Analisi 4. I dati
- Analisi dei dati a riposo
- Selezionare una finestra temporale compresa la risposta EMG associato alla contrazione a riposo (H-onda o M-wave).
- Misurare la durata ampiezza picco-picco, picco-picco, e / o l'area delle onde (Figura 4A). Se l'ampiezza non è fornita direttamente dal software, sottrarre il minimo per i valori massimi.
- Per la durata, misurare il periodo di tempo a partire dal picco massimo e termina al picco minimo. Per l'area, calcolare l'integrale di segnale EMG partire dall'inizio dell'onda e termina alla fine dell'onda.
Nota: l'ampiezza picco-picco può riflettere: 1) la trasmissione neuromuscolare, 2) azione di gruppo motore potenziale ampiezza e / o 3) la dispersione temporale di unità dell'azione motoria potenziale 37. Durata M-onda riflette neuromuscolare propagazione 37.
- Per la durata, misurare il periodo di tempo a partire dal picco massimo e termina al picco minimo. Per l'area, calcolare l'integrale di segnale EMG partire dall'inizio dell'onda e termina alla fine dell'onda.
- Per prove multiple, calcolare la media delle onde. Se la media non può essere fornito direttamente dal software, software uso foglio di calcolo (ad esempio, la funzione di formula in un foglio di calcolo) per calcolare questo valore da diversi studi (almeno 3).
- Selezionare la contrazione di riposo.
- Misurare la coppia di picco associata alla contrazione riposo (Figura 4B).
- In caso di più prove, calcolare la coppia media di picco delle contrazioni di riposo. Se la media non può essere fornito direttamente dal software, software uso foglio di calcolo (ad esempio, la funzione di formula in un foglio di calcolo) per calcolare questo valore dai numerosi studi (almeno 3).
- Ripetere queste procedure di cui al punto 4.1.2 per gli altri parametri desiderati (tempo contrazione o tempo mezza di relax). L'analisi dei parametri di contrazione fornisce indicazioni in merito alla efficienza di accoppiamento eccitazione-contrazione 17. In particolare, il contrattotempo ioni fornisce un indice di cinetica di contrazione 8, che può dipendere il gruppo muscolare scelto 38.
- Calcolare il rapporto tra la coppia massima e la somma di m-onde utilizzando software di foglio (ad esempio Excel), per quantificare l'efficienza elettromeccanico (P t / M). Poiché le risposte meccaniche evocate dalla stimolazione del nervo tibiale posteriore corrispondono all'attivazione del tricipite surale nel suo complesso, ampiezze di soleus e gastrocnemii M-onde devono essere sommati 39.
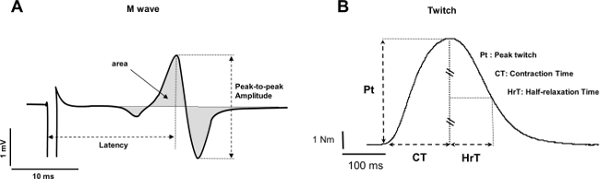
Figura 4: Spiegazione delle risposte elettrofisiologiche e meccaniche (A) Misurazione di picco-picco di ampiezza (mV), latenza (ms) e l'area (mV.ms) di un tipico M-onda.. (B) Misura della coppia contrazione di picco (Nm), tempo di contrazione (ms) e il tempo di rilassamento metà (msec) di una contrazione. Clicca qui per vedere una versione più grande di questa figura.
- L'analisi dei dati in contrazione
- Selezionare una finestra di 500 msec di attività EMG soleo durante l'altopiano di coppia MVC tra cui la coppia di picco, ma escluso il tempo tra l'artefatto di stimolazione e la fine del periodo di silenzio di EMG. Il periodo di silenzio corrisponde alla soppressione del corso attività di volontariato EMG dopo stimolazione.
- Se il valore quadratico medio (RMS) non viene fornita direttamente dal software, calcolare il RMS per quantificare l'attività EMG utilizzando la seguente formula 40: RMS EMG
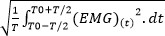
- Misurare o calcolare RMS di M max a riposo per tutta la durata dell'onda.
- Calcolare il rapporto RMS EMG / RMS Mmax utilizzando il software foglio di calcolo.Valore RMS EMG e valore efficace Mmax devono essere selezionati dallo stesso muscolo.
- Misurare la coppia picco massimo della MVC dalla linea di coppia a riposo al valore massimo della coppia MVC escludendo sovrapposto indotto dalla stimolazione doppietto (Figura 5).
- Misurare la coppia sovrapposta indotto dalla stimolazione doppietto durante il MVC, dal valore di coppia volontaria al momento della comparsa della stimolazione al picco della risposta evocata (Figura 5).
- Selezionare il doppietto potenziato.
- Misurare la coppia di picco associata al doppietto potenziato.
- Calcolare il livello di attivazione volontaria (VAL) mediante la seguente formula 40:

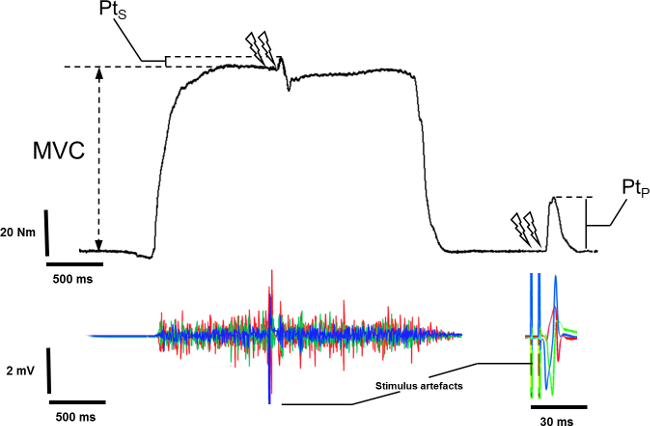
Figura 5: Misura della sovrapposte epotenziato doppietto sul segnale meccanico. Per registrare la coppia di picco sovrapposto (Pt), la stimolazione doppietto è evocato durante l'altopiano di isometrica massima contrazione volontaria (MVC). Per registrare una coppia massima potenziata (Pt G), la stimolazione doppietto è evocato a riposo dopo l'offset del MVC.
Access restricted. Please log in or start a trial to view this content.
Risultati
Aumentando intensità dello stimolo conduce ad una diversa evoluzione delle ampiezze di risposta tra H e M-onde. A riposo, l'H-reflex raggiunge un valore massimo prima di essere totalmente assente dal segnale EMG, mentre M onda aumenta progressivamente fino a raggiungere un plateau ad intensità massima (vedere Figura 4 per una rappresentazione grafica del M-onda e la Figura 6 per l'evoluzione di M-onde e H-reflex con intensità). Per il muscolo...
Access restricted. Please log in or start a trial to view this content.
Discussione
Stimolazione nervosa percutanea consente la quantificazione di numerose caratteristiche del sistema neuromuscolare non solo di comprendere il controllo fondamentale della funzione neuromotoria in esseri umani sani, ma anche per essere in grado di analizzare adattamenti acute o croniche per fatica o formazione 17. Ciò è molto utile soprattutto per i protocolli affaticanti, dove le misurazioni devono essere effettuate il più presto possibile dopo la fine esercizio per evitare gli effetti di rapido recupero <...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
The authors have no acknowledgements.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Biodex dynamometer | Biodex Medical System Inc., New York, USA | www.biodex.com | |
| MP150 Data Acquisition System | Biopac Systems Inc., Goleta, USA | ||
| Acknowledge 4.1.0 software | Biopac Systems Inc., Goleta, USA | www.biopac.com | |
| DS7A constant current high voltage stimulator | Digitimer, Hertfordshire, UK | www.digitimer.com | |
| Silver chloride surface electrodes | Control Graphique Medical, Brie-Comte-Robert, France | ||
| Computer | |||
| 1 Cable for connecting the Biodex to the MP150 | |||
| 1 Cable for connecting the Digitimer to the MP150 | |||
| 1 Cable for connecting the MP150 to the computer |
Riferimenti
- Desmedt, J. E., Hainaut, K. Kinetics of myofilament activation in potentiated contraction staircase phenomenon in human skeletal muscle. Nature. 217 (5128), 529-532 (1968).
- Bouisset, S., Maton, B. Quantitative relationship between surface EMG and intramuscular electromyographic activity in voluntary movement. American Journal of Physical Medicine. 51 (6), 285-295 (1972).
- Gabriel, D. A. Effects of monopolar and bipolar electrode configurations on surface EMG spike analysis. Medical Engineering and Physics. 33 (9), 1079-1085 (2011).
- Merletti, R., Rainoldi, A., Farina, D. Surface electromyography for noninvasive characterization of muscle. Exercise and Sport Sciences Reviews. 29 (1), 20-25 (2001).
- Lepers, R. Aetiology and time course of neuromuscular fatigue during prolonged cycling exercises. Science, & Motricité. 52, 83-107 (2004).
- Baudry, S., Klass, M., Pasquet, B., Duchateau, J. Age related fatigability of the ankle dorsiflexor muscles during concentric and eccentric contractions. European Journal of Applied Physiology. 100 (5), 515-525 (2007).
- Place, N., Yamada, T., Bruton, J. D., Westerblad, H. Muscle fatigue From observations in humans to underlying mechanisms studied in intact single muscle fibres. European Journal of Applied Physiology. 110 (1), 1-15 (2010).
- Scaglioni, G., Narici, M. V., Maffiuletti, N. A., Pensini, M., Martin, A. Effect of ageing on the electrical and mechanical properties of human soleus motor units activated by the H reflex and M wave. The Journal of Physiology. 548 (Pt. 2), 649-661 (2003).
- Schieppati, M. The Hoffmann reflex a means of assessing spinal reflex excitability and its descending control in man. Progress in Neurobiology. 28 (4), 345-376 (1987).
- Pierrot Deseilligny, E., Burke, D. The circuitry of the human spinal cord: its role in motor control and movement disorders. , Cambridge University Press. (2005).
- Duclay, J., Pasquet, B., Martin, A., Duchateau, J. Specific modulation of corticospinal and spinal excitabilities during maximal voluntary isometric shortening and lengthening contractions in synergist muscles. The Journal of Physiology. 589 (Pt. 11), 2901-2916 (2011).
- Grosprêtre, S., Papaxanthis, C., Martin, A. Modulation of spinal excitability by a sub threshold stimulation of M1 area during muscle lengthening. Neuroscience. 263, 60-71 (2014).
- Mynark, R. G. Reliability of the soleus H reflex from supine to standing in young and elderly. Clinical Neurophysiology. 116 (6), 1400-1404 (2005).
- Palmieri, R. M., Hoffman, M. A., Ingersoll, C. D. Intersession reliability for H reflex measurements arising from the soleus peroneal and tibialis anterior musculature. The International Journal of Neuroscience. 112 (7), 841-850 (2002).
- Chen, Y. S., Zhou, S., Cartwright, C., Crowley, Z., Baglin, R., Wang, F. Test retest reliability of the soleus H reflex is affected by joint positions and muscle force levels. Journal of Electromyography and Kinesiology. 20 (5), 987-987 (2010).
- Lehman, G. J., McGill, S. M. The importance of normalization in the interpretation of surface electromyography A proof of principle. Journal of Manipulative and Physiological Therapeutics. 22 (7), 444-446 (1999).
- Lepers, R. Interest and limits of percutaneous nerve electrical stimulation in the evaluation of muscle fatigue. Science, & Motricité. 70 (70), 31-37 (2010).
- Merton, P. A. Voluntary strength and fatigue. The Journal of Physiology. 123, 553-564 (1954).
- Gandevia, S. C. Spinal and supraspinal factors in human muscle fatigue. Physiological Reviews. 81 (4), 1725-1789 (2001).
- Shield, A., Zhou, S. Assessing voluntary muscle activation with the twitch interpolation technique. Sports Medicine. 34 (4), 253-267 (2004).
- Rozand, V., Pageaux, B., Marcora, S. M., Papaxanthis, C., Lepers, R. Does mental exertion alter maximal muscle activation. Frontiers in Human Neuroscience. 8, 755(2014).
- Place, N., Maffiuletti, N. A., Martin, A., Lepers, R. Assessment of the reliability of central and peripheral fatigue after sustained maximal voluntary contraction of the quadriceps muscle. Muscle and Nerve. 35 (4), 486-495 (2007).
- Kannus, P. Isokinetic evaluation of muscular performance: implications for muscle testing and rehabilitation. International Journal of Sports Medicine. 15, Suppl 1. S11-S18 (1994).
- Tucker, K. J., Tuncer, M., Türker, K. S. A review of the H reflex and M wave in the human triceps surae. Human Movement Science. 24 (5-6), 667-688 (2005).
- Taylor, N. A., Sanders, R. H., Howick, E. I., Stanley, S. N. Static and dynamic assessment of the Biodex dynamometer. European Journal of Applied Physiology and Occupational Physiology. 62 (3), 180-188 (1991).
- Sale, D., Quinlan, J., Marsh, E., McComas, A. J., Belanger, A. Y. Influence of joint position on ankle plantarflexion in humans. Journal of Applied Physiology. 52 (6), 1636-1642 (1982).
- Cattagni, T., Martin, A., Scaglioni, G. Is spinal excitability of the triceps surae mainly affected by muscle activity or body position. Journal of Neurophysiology. 111 (12), 2525-2532 (2014).
- Gerilovsky, L., Tsvetinov, P., Trenkova, G. Peripheral effects on the amplitude of monopolar and bipolar H-reflex potentials from the soleus muscle. Experimental Brain Research. 76 (1), 173-181 (1989).
- Schieppati, M. The Hoffmann reflex a means of assessing spinal reflex excitability and its descending control in man. Progress in Neurobiology. 28 (4), 345-376 (1987).
- Hermens, H. J., Freriks, B., Disselhorst Klug, C., Rau, G. Development of recommendations for SEMG sensors and sensor placement procedures. Journal of Electromyography and Kinesiology. 10 (5), 361-374 (2000).
- Kamen, G., Sison, S. V., Du, C. C., Patten, C. Motor unit discharge behavior in older adults during maximal effort contractions. Journal of Applied Physiology. 79 (6), 1908-1913 (1995).
- Neyroud, D., Rüttimann, J., et al. Comparison of neuromuscular adjustments associated with sustained isometric contractions of four different muscle groups. Journal of Applied Physiology. 114, 1426-1434 (2013).
- Rupp, T., Girard, O., Perrey, S. Redetermination of the optimal stimulation intensity modifies resting H-reflex recovery after a sustained moderate-intensity muscle contraction. Muscle and Nerve. 41 (May), 642-650 (2010).
- Zehr, E. P. Considerations for use of the Hoffmann reflex in exercise studies. European Journal of Applied Physiology. 86 (6), 455-468 (2002).
- Gondin, J., Duclay, J., Martin, A. Soleus and gastrocnemii evoked V wave responses increase after neuromuscular electrical stimulation training. Journal of Neurophysiology. 95 (6), 3328-3335 (2006).
- Rochette, L., Hunter, S. K., Place, N., Lepers, R. Activation varies among the knee extensor muscles during a submaximal fatiguing contraction in the seated and supine postures. Journal of Applied Physiology. 95 (4), 1515-1522 (2003).
- Fuglevand, A. J., Zackowski, K. M., Huey, K. A., Enoka, R. M. Impairment of neuromuscular propagation during human fatiguing contractions at submaximal forces. The Journal of Physiology. 460, 549-572 (1993).
- Vandervoort, A. A., McComas, A. J. Contractile changes in opposing muscles of the human ankle joint with aging. Journal of Applied Physiology. 61 (1), 361-367 (1986).
- Grosprêtre, S., Martin, A. Conditioning effect of transcranial magnetic stimulation evoking motor evoked potential on V wave response. Physiological Reports. 2 (11), e12191(2014).
- Allen, G. M., Gandevia, S. C., McKenzie, D. K. Reliability of measurements of muscle strength and voluntary activation using twitch interpolation. Muscle and Nerve. 18 (6), 593-600 (1995).
- Cooper, M. A., Herda, T. J., Walter Herda, A. A., Costa, P. B., Ryan, E. D., Cramer, J. T. The reliability of the interpolated twitch technique during submaximal and maximal isometric muscle actions. Journal of Strength and Conditioning Research. 27 (10), 2909-2913 (2013).
- Froyd, C., Millet, G. Y., Noakes, T. D. The development of peripheral fatigue and short term recovery during self paced high intensity exercise. The Journal of Physiology. 591 (Pt 5), 1339-1346 (2013).
- Pierrot Deseilligny, E., Morin, C., Bergego, C., Tankov, N. Pattern of group I fibre projections from ankle flexor and extensor muscles in man. Experimental Brain Research. 42 (3-4), 337-350 (1981).
- Brooke, J. D., McIlroy, W. E., et al. Modulation of H reflexes in human tibialis anterior muscle with passive movement. Brain Research. 766 (1-2), 236-239 (1997).
- Hultborn, H., Meunier, S., Morin, C., Pierrot Deseilligny, E. Assessing changes in presynaptic inhibition of I a fibres a study in man and the cat. The Journal of Physiology. 389, 729-756 (1987).
- Meunier, S., Pierrot Deseilligny, E. Cortical control of presynaptic inhibition of Ia afferents in humans. Experimental Brain Research. 119 (4), 415-426 (1998).
- Aymard, C., Baret, M., Katz, R., Lafitte, C., Pénicaud, A., Raoul, S. Modulation of presynaptic inhibition of la afferents during voluntary wrist flexion and extension in man. Experimental Brain Research. 137 (1), 127-131 (2001).
- Abbruzzese, G., Trompetto, C., Schieppati, M. The excitability of the human motor cortex increases during execution and mental imagination of sequential but not repetitive finger movements. Experimental Brain Research. 111 (3), 465-472 (1996).
- Garland, S. J., Klass, M., Duchateau, J. Cortical and spinal modulation of antagonist coactivation during a submaximal fatiguing contraction in humans. Journal of Neurophysiology. 99, 554-563 (2008).
- Rodriguez Falces, J., Place, N. Recruitment order of quadriceps motor units Femoral nerve vs direct quadriceps stimulation. European Journal of Applied Physiology. 113, 3069-3077 (2013).
- Rodriguez Falces, J., Maffiuletti, N. A., Place, N. Spatial distribution of motor units recruited during electrical stimulation of the quadriceps muscle versus the femoral nerve. Muscle and Nerve. 48 (November), 752-761 (2013).
- Bathien, N., Morin, C. Comparing variations of spinal reflexes during intensive and selective attention (author’s transl). Physiology, & Behavior. 9 (4), 533-538 (1972).
- Earles, D. R., Koceja, D. M., Shively, C. W. Environmental changes in soleus H reflex excitability in young and elderly subjects. The International Journal of Neuroscience. 105 (1-4), 1-13 (2000).
- Paquet, N., Hui Chan, C. W. Human soleus H reflex excitability is decreased by dynamic head and body tilts. Journal of Vestibular Research Equilibrium, & Orientation. 9 (5), 379-383 (1999).
- Miyahara, T., Hagiya, N., Ohyama, T., Nakamura, Y. Modulation of human soleus H reflex in association with voluntary clenching of the teeth. Journal of Neurophysiology. 76 (3), 2033-2041 (1996).
- Pinniger, G. J., Nordlund, M. M., Steele, J. R., Cresswell, a GH reflex modulation during passive lengthening and shortening of the human triceps surae. Journal of Physiology. 534 (Pt 3), 913-923 (2001).
- Tallent, J., Goodall, S., Hortobágyi, T., St Clair Gibson, A., French, D. N., Howatson, G. Repeatability of corticospinal and spinal measures during lengthening and shortening contractions in the human tibialis anterior muscle). PLoS ONE. 7 (4), e35930(2012).
- Grospretre, S., Martin, A. H. reflex and spinal excitability methodological considerations. Journal of Neurophysiology. 107 (6), 1649-1654 (2012).
- Hugon, M. Methodology of the Hoffmann reflex in man. New Developments in Electromyography and Chemical Neurophysiology. 3m, 277-293 (1973).
- Bigland Ritchie, B., Zijdewind, I., Thomas, C. K. Muscle fatigue induced by stimulation with and without doublets. Muscle and Nerve. 23 (9), 1348-1355 (2000).
- Kent Braun, J. A., Le Blanc, R. Quantitation of central activation failure during maximal voluntary contractions in humans. Muscle and Nerve. 19 (7), 861-869 (1996).
- Herbert, R. D., Gandevia, S. C. Twitch interpolation in human muscles mechanisms and implications for measurement of voluntary activation. Journal of Neurophysiology. 82, 2271-2283 (1999).
- Miller, M., Downham, D., Lexell, J. Superimposed single impulse and pulse train electrical stimulation A quantitative assessment during submaximal isometric knee extension in young healthy men. Muscle and Nerve. 22 (8), 1038-1046 (1999).
- Button, D. C., Behm, D. G. The effect of stimulus anticipation on the interpolated twitch technique. Journal of Sports Science and Medicine. 7 (4), 520-524 (2008).
- Goss, D. a, Hoffman, R. L., Clark, B. C. Utilizing Transcranial Magnetic Stimulation to Study the Human Neuromuscular System. Journal of Visualized Experiments. (59), e3387(2012).
- Sartori, L., Betti, S., Castiello, U. Corticospinal excitability modulation during action observation. Journal Of Visualized Experiments: Jove. (82), 51001(2013).
- Rozand, V., Lebon, F., Papaxanthis, C., Lepers, R. Does a mental training session induce neuromuscular fatigue. Medicine and Science in Sports and Exercise. 46 (10), 1981-1989 (2014).
- Rozand, V., Cattagni, T., Theurel, J., Martin, A., Lepers, R. Neuromuscular fatigue following isometric contractions with similar torque time integral. International Journal of Sports Medicine. 36, 35-40 (2015).
- Belanger, A. Y., McComas, A. J. Extent of motor unit activation during effort. Journal of Applied Physiology. 51 (5), 1131-1135 (1981).
- Morse, C. I., Thom, J. M., Davis, M. G., Fox, K. R., Birch, K. M., Narici, M. V. Reduced plantarflexor specific torque in the elderly is associated with a lower activation capacity. European Journal of Applied Physiology. 92 (1-2), 219-226 (2004).
- Dalton, B. H., McNeil, C. J., Doherty, T. J., Rice, C. L. Age related reductions in the estimated numbers of motor units are minimal in the human soleus. Muscle and Nerve. 38 (3), 1108-1115 (2008).
- Hunter, S. K., Todd, G., Butler, J. E., Gandevia, S. C., Taylor, J. L. Recovery from supraspinal fatigue is slowed in old adults after fatiguing maximal isometric contractions. Journal of Applied Physiology. 105 (4), 1199-1209 (2008).
- Jakobi, J. M., Rice, C. L. Voluntary muscle activation varies with age and muscle group. Journal of Applied Physiology. 93 (2), 457-462 (2002).
- Lepers, R., Millet, G. Y., Maffiuletti, N. a Effect of cycling cadence on contractile and neural properties of knee extensors. Medicine and Science in Sports and Exercise. 33 (11), 1882-1888 (2001).
- Duchateau, J., Hainaut, K. Isometric or dynamic training differential effects on mechanical properties of a human muscle. Journal of Applied Physiology. 56 (2), 296-301 (1984).
- Millet, G. Y., Martin, V., Martin, A., Vergès, S. Electrical stimulation for testing neuromuscular function From sport to pathology. European Journal of Applied Physiology. 111, 2489-2500 (2011).
- Cattagni, T., Scaglioni, G., Laroche, D., Van Hoecke, J., Gremeaux, V., Martin, A. Ankle muscle strength discriminates fallers from non fallers. Frontiers in Aging Neuroscience. 6, 336(2014).
- Horstman, A. M., Beltman, M. J., et al. Intrinsic muscle strength and voluntary activation of both lower limbs and functional performance after stroke. Clinical Physiology and Functional Imaging. 28 (4), 251-261 (2008).
- Sica, R. E., Herskovits, E., Aguilera, N., Poch, G. An electrophysiological investigation of skeletal muscle in Parkinson’s disease. Journal of the Neurological Sciences. 18 (4), 411-420 (1973).
- Knikou, M., Mummidisetty, C. K. Locomotor Training Improves Premotoneuronal Control after Chronic Spinal Cord Injury. Journal of Neurophysiology. 111 (11), 2264-2275 (2014).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon