Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Transporteigenschaften von Ibuprofen Encapsulated in Cyclodextrin Nanosponge Hydrogele: Ein Proton HR-MAS-NMR-Spektroskopie-Studie
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Die Bewegungsregime in β-Cyclodextrin nanosponges Polymer-Netzwerk gekapselt Ibuprofen werden untersucht unter Verwendung von gepulstem Feld-Gradienten-Spin-Echo (PGSE) NMR-Technik. Synthese, Reinigung, Wirkstoffbeladung, die Umsetzung der NMR-Pulssequenz und Datenanalyse die mittlere quadratische Verschiebung des Medikaments an mehreren Beobachtungszeiten zu arbeiten, werden im Detail beschrieben.
Zusammenfassung
Die chemische Vernetzung von β-Cyclodextrin (β-CD) mit Ethylendiamintetraessigsäure Dianhydrid (EDTA) führte zu verzweigten Polymeren bezeichnet als Cyclodextrin nanosponges (CDNSEDTA). Zwei verschiedene Präparate werden beschrieben mit 1: 4 und 1: 8 CD-EDTA Molverhältnissen. Die entsprechenden vernetzten Polymeren wurden mit 0,27 M wässrigen Lösung von Ibuprofen-Natriumsalz (IP), die zu homogenen, farblose, wirkstoffbeladenen Hydrogele in Kontakt gebracht.
Die Systeme wurden durch hochauflösende magic angle spinning (HR-MAS) NMR-Spektroskopie charakterisiert. PFG - Spin - Echo (PGSE) NMR - Spektroskopie wurde die mittlere quadratische Verschiebung (MSD) von IP innerhalb des Polymer - Gel mit unterschiedlichen Beobachtungszeiten t d zu bestimmen. Die Daten wurden weiter verarbeitet , um die Zeitabhängigkeit von MSD zu studieren: MSD = f (t d). Die vorgeschlagene Methodik ist nützlich, um die unterschiedlichen Diffusionsregime zu charakterisieren, die,Grundsätzlich kann der gelöste Stoff im Inneren des Hydrogels auftreten, nämlich normale oder anomale Diffusion. Die vollständigen Protokolle einschließlich der Polymerherstellung und Reinigung, die Gewinnung von wirkstoffbeladene Hydrogele, die NMR-Probenvorbereitung, die Messung von MSD durch HR-MAS-NMR-Spektroskopie und der endgültigen Datenverarbeitung die Zeitabhängigkeit von MSD zu erreichen, werden hier berichtet und diskutiert . Die hier vorgestellten Experimente stellen einen paradigmatischen Fall, und die Daten werden in Form von innovativen Ansatz zur Charakterisierung der Transporteigenschaften eines verkapselten Gast in einem polymeren Vielzahl von möglichen Anwendung zur Arzneimittelabgabe diskutiert.
Einleitung
Es gibt ein wachsendes Interesse in der Entwicklung und Formulierung von Polymersystemen, die einschließenden, über nicht-kovalente Wechselwirkungen, kleine Moleküle mit möglichen biochemischen Aktivität. Solche Materialien werden erwarteten Anwendungen in den Transport des Wirkstoffs zu einer selektiven Ziel und Freigabe bei Einwirkung äußerer Reize wie etwa pH - Schwankungen zu finden, Temperatur etc. In diesem Zusammenhang stellte sich Hydrogele vielseitig und leistungsfähigen Materialien für Nano erwiesen im Hinblick auf die kontrollierte Freisetzung von Wirkstoffen 1. Die Bildung polymerer Hydrogele können durch Verbinden der makromolekularen Ketten durch i) physikalische, nicht-kovalente Wechselwirkungen, wie Wasserstoffbindungen, ii) kovalente Vernetzung der Ketten zu einem dreidimensionalen Netzwerk in der Lage, in Gegenwart aufquellen führenden erreicht werden von eine wässrige Lösung oder iii) eine Kombination der beiden genannten Methoden 2-4.
Eine besonders vielseitige Klasse von drei Cent8, die zu Cyclodextrin nanosponges (CDNS) - nsional, quellbare Polymere zur Verkapselung von organischen und anorganischen Spezies können mit geeigneten, aktivierte Derivate einer Tetracarbonsäure 5 aus Ausgangs natürlichen β-Cyclodextrin (β-CD) durch Kondensation erhalten werden. Die Synthese, Charakterisierung und Anwendung von CDNS ist eine konsolidierte Forschungsthema unserer Gruppe. In den letzten Jahren die Ergebnisse zeigen , dass CDNS zeigen interessante Eigenschaften von Schwellungen, Absorption / Aufnahme von Chemikalien, und die Freisetzung von kleinen Wirkstoffmolekülen, mit Anwendungen in der kontrollierten Freisetzung von pharmazeutischen Wirkstoffen 9. - 11. und Umweltchemie 12. - 14..
Vor dem Hintergrund dieser Räumlichkeiten, zwei wichtige Fragen zu Besorgnis die effiziente Beladung des Wirkstoffs in der Einzel Polymer - Gel und einem verbesserten Verständnis von gelösten Stoffen Mobilität in den Gel - Matrizes 15 . Die Literatur liefert sowohl experimentelle Studien und Theorien zur Diffusionsmechanismen von kleinen Molekülen in hochmolekularen Netzwerken im Zusammenhang mit 16,17. Pulsfeld-Gradienten - Spin-Echo (PGSE) NMR - Spektroskopie ist eine gut etablierte strukturelle Verfahren weit die translatorische Diffusion von kleinen Molekülen in Lösungsmitteln 18 oder die Selbstdiffusion von reinen Flüssigkeiten zu untersuchen verwendet. Die jüngsten Entwicklungen von hochauflösenden magic angle spinning (HR-MAS) NMR - Technologie machte es möglich , 20,21 hochauflösende NMR - Daten von mobilen Molekülen in heterogenen Suspensionen 19, Gele und quellbare Polymere zu sammeln. Tatsächlich stellt der experimentelle Aufbau Kombination HR-MAS-NMR-Spektroskopie und die PGSE Impulsfolge eine einzigartige Gelegenheit, um die gelösten Moleküle in der Host-molekularen Umgebung zu beobachten. Wichtige Daten über die Transporteigenschaften des eingeschlossenen Arzneimittelmoleküls innerhalb einer Gelmatrix können so erhalten werden. Hochwertige experimentellen Daten kann somit obtained so dass eine rationale Design von nanostrukturierten Wirt-Gast-Systeme.
In der vorliegenden Arbeit beschreiben wir die detaillierten Protokolle für die folgenden Schritte: i) Synthese und Reinigung von zwei unterschiedlichen Formulierung von CDNS vernetzt mit EDTA Polymere (Abbildung 1), die als CDNSEDTA, und von verschiedenen CD / Vernetzer Molaren gekennzeichnet Verhältnis: 1: 4 (CDNSEDTA 1: 4) und 1: 8 (CDNSEDTA 1: 8); ii) die Herstellung von wirkstoffbeladenen Hydrogele für beide CDNSEDTA 1: 4 und CDNSEDTA 1: 8. In diesem Schritt haben wir, als Modell Wirkstoffmolekül, das beliebte nicht-steroidale entzündungshemmende Ibuprofen-Natriumsalz (IP); iii) die gründliche Untersuchung der Transporteigenschaften von IP innerhalb der CDNSEDTA Hydrogele über PGSE-HRMAS NMR-Spektroskopie. Die Methode, die wir hier vorschlagen wird, gefolgt von der Analyse der Zeitabhängigkeit des MSD innerhalb des Hydrogels auf die Messung des mittleren quadratischen Verschiebung (MSD) des verkapselten Medikament basiert.
Wir wish zu betonen, dass die Methodik oben genannten -, die auf der Zeitabhängigkeit des Medikaments MDS in der Matrix fokussiert ist - ein breiteres Spektrum an Informationen, die im Vergleich zu der konsolidierten Methodologie basiert nur auf der Bestimmung des Diffusionskoeffizienten des Präparates. Wir haben kürzlich gezeigt , 21 , dass dieser Ansatz für die Unterscheidung von normalen und anomale Diffusion Regime von IP in CDNS Hydrogele beschränkt erfahren dürfen.
Wir glauben daher, dass der Schritt-für-Schritt-Beschreibung der Polymersynthese / Reinigung, Bildung der wirkstoffbeladene Hydrogele, HR-MAS-NMR-Charakterisierung und Datenverarbeitung von MDS-Daten, ein leistungsstarkes Toolkit ist für die Wissenschaftler interessiert bei der Charakterisierung von nanostrukturierten Systeme für die Haft und die Freisetzung von kleinen Molekülen.
Access restricted. Please log in or start a trial to view this content.
Protokoll
1. Synthese von CDNSEDTA Polymers
- Trocken β-Cyclodextrin (β-CD) in einem Ofen bei 80 ° C für 4 Stunden vor dem Gebrauch. Trockenen 500 ml Dimethylsulfoxid (DMSO) und 100 ml Triethylamin (Et 3 N) über Molekularsieb (4 Å) für 24 Stunden , bevor sie in dem Protokoll.
- Einführung 25 ml DMSO in einem 50 ml-Hals-Rundkolben. Unter magnetischem Rühren hinzufügen 5,675 g β-CD (5 mmol). Um die Bildung von Klumpen zu verringern, fügen Sie das β-CD-Pulver in kleinen Portionen zu DMSO.
- Nach etwa 30 Minuten, fügen Sie 6 ml Et 3 N zu der homogenen Lösung eine 10 ml Messpipette. Halten der Mischung für 15 min bei RT unter Rühren. Tauchen die Kolben in ein Wasserbad bei RT.
HINWEIS: Die Reaktion zwischen β-CD und EDTA ist exotherm. Daher in das Wasserbad des Kolbens eintauchen begünstigt den Wärmeaustausch das Überhitzen des Reaktionsgemisches vermieden wird. - In 5.124 g (20 mmol, Herstellung von CDNSEDTA 1: 4) oder 10,248 g (40 mmol, Herstellung von CDNSEDTA 1: 8) von EDTA-Dianhydrid unter intensivem Rühren.
- Nach 3 Stunden, entfernen Sie das feste Material (CDNSEDTA 1: 4 oder CDNSEDTA 1: 8) aus dem Kolben mit einem Spatel und zerquetschen sie grob mit einem Mörser und Stößel.
- Waschen des festen Materials auf Filterpapier mit Aceton bei RT (100 ml × 5 mal), mit HCl 0,1 M (200 ml × 5 mal), und deionisiertes Wasser (200 ml x 3 Mal).
- Schließlich trocken alle das feste Material in der Luft bei RT für 48 Stunden, zerdrücken sie fein in einem Mörser und Stößel und es dann unter Vakuum zu halten (<15 mbar) für 2 Stunden bei 45 ° C.
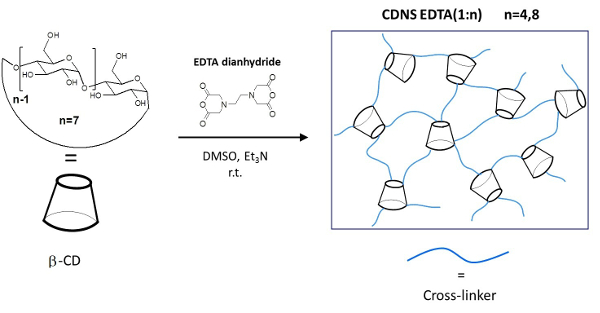
Abb . 1: Schematische Darstellung der CDNSEDTA Polymers Schematic Syntheseweg. Links: Molekularstruktur des Monomers β-Cyclodextrin (β-CD) und Vernetzungsmittel EDTA-dianhydrid. Auf dem Pfeil die Gesamtreaktionsbedingungen. Recht:. Skizze des vernetzten Polymeren Bitte klicken Sie hier eine größere Version dieser Figur zu sehen.
2. HR-MAS-NMR-Messungen
- HR-MAS - NMR - Probenvorbereitung
- Bereiten Sie eine Lösung 0,27 M von Ibuprofen-Natriumsalz (IP) in deuteriertem Wasser (99,8%).
- Hinzufügen 20 mg CDNSEDTA 1: 4 und 2 mg wasserfreies Natriumcarbonat (Na 2 CO 3) zu 150 ul der Lösung an dem Punkt 2.1.1 hergestellt) in ein 2 ml Glasfläschchen. Mischen Sie den Inhalt des Fläschchens mit einem kleinen Spatel, um sie zu homogenisieren. Warten Sie 2 Stunden, bevor Sie das Gel mit diesem Verfahren gebildet werden. Wiederholen Sie diesen Punkt für die CDNSEDTA 1: 8-Polymer.
- Legen Sie das Gel in einem 5-mm-NMR-Rotor geeignet für HR-MAS-NMR-Experimente einen kleinen Spachtel. Die Gesamtmenge des Gels zu verwenden, um auf das Innenvolumen des Rotors abhängt (12 & mgr; l empfohlen).
- HR-MAS 1 H - NMR - Experimente
- Legen Sie die folgenden Geräteparameter: Rotorspinngeschwindigkeit von 4 kHz bei der MAS-pneumatische Steuereinheit, die Probentemperatur bei 305 K in der variablen Temperatureinheit.
- Erwerben die 1 H HR-MAS - NMR - Spektren von Ibuprofen in CDNSEDTA (1: 4) und CDNSEDTA (1: 8) Polymersysteme mit einem herkömmlichen Impulssequenz auf der Protonenresonanz.
- Erstellen Sie einen neuen Datensatz. Klicken Sie auf das "AcquPars" aus. Wählen Sie die PULPROG: zg.
- Wählen Sie die Anzahl der Scans (NS = 4) und die Zeitverzögerung zwischen ihnen (D1 = 5 sec) .Set der spektralen Breite (SW = 8 ppm), die Zeitbereich (TD = 16K) und die Empfängerverstärkung (RG = 32 ).
- Geben Sie "zg" auf der Konsole und es wird einen freien Induktionszerfalls (FID) auf dem Bildschirm. Um die Daten klicken Sie auf den "ProcPars" Registerkarte verarbeiten. Stellen Sie die spektrale Größe (SI = 32K), eine exponentielle Vervielfachung Fensterfunktion (WDW = EM) und Linienverbreiterung (LB = 1).Geben Sie "ft", um die Fourier-Transformation durchzuführen. Phase das Spektrum der Phasen Registerkarte auf dem Bildschirm. Besorgen Sie sich eine hohe Auflösung gut aufgelöste Spektrum.

Abbildung 2: Die Bipolare Pulspaare Längswirbelstrom Delay (BPPLED) Impulsfolge Schematische Darstellung der Pulssequenz verwendet , um die PFGSE Experimente durchzuführen.. Der Phasenzyklus für die 90 ° -Impulse ist: P1: (0) 16, P2: (0022) 4, P3: (0) 4 (2) 4 (1) 4 (3) 4, P4: (0202 2020 1313 3131 ), P5: (0) 4 (2) 4 (1) 4 (3) 4. Die 180 ° Impulse + x. (von ref.18 modifiziert) Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
- HR-MAS 1 H-NMR-Experimente PGSE
HINWEIS: Die PGSE Experimente durchgeführt werden , um die Impulsfolge 18 in Figur 2 angegeben BPPLED verwenden. Dies ist ein pseudo zweidimensionalen Experiment mit einem Gradienten Rampe in der indirekten Dimension linear von 2% bis 100% erhöht wird. Die Signalintensität wird in Abhängigkeit von der Diffusionszeit Δ und dem Gradientenimpuls δ gedämpft. Die Optimierung dieser Parameter ist erforderlich, bevor richtig ein PGSE Experiment läuft. Die Optimierung wird durch Ausführen ein paar 1D-Messungen durchgeführt, bei denen Δ konstant gehalten wird, während δ variiert wird.- Parameter - Optimierung
- Erstellen Sie einen neuen Datensatz - Experiment Nummer 1. Klicken Sie auf den "AcquPars" aus. Wählen Sie die PULPROG: ledbpgp2s1d der 1D-Impulsfolge für die Diffusion Optimierung.
- Wählen Sie die Anzahl der Scans (NS = 16) und die Zeitverzögerung zwischen ihnen (D1 = 10 sec). Stellen Sie die spektrale Breite (SW = 8 ppm), ter Zeitbereich (TD = 16K) und die Empfängerverstärkung (RG = 32).
- Set Δ (D20 in der Reihenfolge) gleich einem konstanten Wert und δ (p30) auf einen Versuch Wert. Startwert Δ = 50 ms, δ = 3 ms (maximal zulässige Wert für hochauflösende Instrumente).
- Lesen Sie den Wert der spektralen Frequenz (SFO1) aus dem 1 H - Experiment und verwenden nun diesen Wert. Stellen Sie die GPZ6 Gradientenstärke bis 2%. Wiederholen Sie Schritt 2.2.2.3. Verwenden Sie dieses Spektrum als Referenz für die Optimierung.
- Im gleichen Datensatz erstellt haben das Experiment Nummer 2. alle experimentellen Parameter zu beachten. Erhöhen Sie die GPZ6 Gradientenstärke bis 95%. Wiederholen Sie Schritt 2.2.2.3. Vergleichen Sie dieses Spektrum mit dem Referenzspektrum das Dual-Display-Symbol verwenden und die Änderung der Signalintensität zu beobachten.
HINWEIS: Ein gut abgeschwächte Spektrum sollte etwa 5% Restsignalintensität im Vergleich mit dem Referenzspektrum haben. Wenn die Signalintensität verloren geht, verringern den Wert von δ und resherb im Abschnitt 2.3.1 ab Punkt 2.3.1.3 bis der richtige Wert für δ gefunden wird. - Wiederholen Sie die Parameter Optimierungsprozedur in Abschnitt 2.3.1 für alle fünf Δ Werte.
HINWEIS: Wählen fünf Wert für Δ = 50, 80, 110, 140 und 170 msec und optimiert, um die entsprechenden δ bis 3, 2.7, 2.4, 2.1, 1.8 msec (für IP in CDNSEDTA 1: 8) und & dgr; 2,7, 2,4 , 2, 1,7, 1,4 (für IP in CDNSEDTA in 1: 4).
- Akquisition der 2D - Diffusion Data Set
- In der gleichen Daten, die die Versuchsnummer 3 gesetzt zu erstellen, die alle werden experimentellen Parameter 1D geladen werden. Geben Sie "eda". Wählen Sie das PULPROG: ledbpgp2s die Pulssequenz 2D und ändern Sie die parmode auf 2D.
- Set FnMODE = QF. Stellen Sie den Zeitbereich TD in F2 Abmessung gleich 32, die Anzahl der Schritte Gradienten. Alle anderen Parameter richtig eingestellt sind. Geben Sie "DOSY" und die Steigung Rampe wird in einer Datei erzeugt und gespeichert werden. Die stKunst und Endwerte der Rampe (2-95) werden als Eingabeparameter angegeben. Die Akquisition wird jetzt gestartet.
- Parameter - Optimierung
- Datenverarbeitung
- Geben Sie "xf2", um die Fourier-Transformation in der F2-Dimension auszuführen. Geben Sie "ABS2", um die Basislinienkorrektur in der F2-Dimension durchzuführen. Geben Sie "setdiffparm" zu erinnern an die experimentellen Parameter (Δ, δ und Gradienten Liste) für den nächsten Bearbeitungsschritt.
- Klicken Sie auf "T1 / T2-Relaxation-Modul" in der Registerkarte Analyse und definieren die Spitzen mit dem ersten Spektrum des 2D-Experiment eingebaut werden. Definieren Sie die Spitzenbereiche und die Montage durchführen. Die Signalintensitäten an jedem Gradienten Schritt aufgebracht werden erhalten.
HINWEIS: Die Signalintensitäten I (q, t d) für jeden Wert Δ, auf den experimentellen Variablen abhängt: angelegten Impuls eingereicht Gradienten (g), Zeitvariable (δ), gyromagnetische Verhältnis (γ) q = (γgδ) nach die following Gleichung:
mit dem Molekular MSD = z 2. - Exportieren Sie die Signalintensitäten in einer Tabelle und führen eine lineare Anpassung der Daten den Wert von z 2 für jeden beobachteten Diffusionszeit t d zu erhalten.
HINWEIS: Der MSD - Wert wird auf die Beobachtungszeit t d bezogen gemäß:
- Führen Sie die log-log Plot von z 2 gegen t d für jede Versuchs t d Wert. Der Exponent α-Wert ist die Steigung der linearen Regression. Eine ausführlichere Diskussion der physikalischen Aspekte der Gleichungen, die oben angegeben sind in Lit. werden. 21 und in den Referenzen darin.
HINWEIS: In Abhängigkeit vom Wert des Exponenten α wird die Diffusionsregime definiert als: i) isotrope uneingeschränkte Diffusion für α = 1, ii) anomal subdiffusive Regelung für die 0 <α <1, iii) anomale superdiffusive Regelung für α> 1.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Wir wandten zunächst diese Methodik an das Molekül IP Medikament in einer Wasserlösung aufgelöst, um die Lebensfähigkeit dieses Ansatzes zu überprüfen. Eine vollständige Beschreibung der repräsentativen Ergebnisse sind in Lit. werden. Vielmehr 21., werden wir hier auf die methodischen Aspekte konzentrieren und die Muttern-und Schrauben - Ansatz zur Datenerhebung und Datenanalyse. Abbildung 3 zeigt, auf einer halb logarithmische Skala, die normalisierte experimen...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Wir präsentieren eine experimentelle Methodik der Diffusions Regime eines kleinen Arzneimittelmoleküls in zwei repräsentativen Formulierungen von CDNSEDTA Hydrogele eingekapselt zu bestimmen. HR-MAS NMR PGSE ermöglicht die Bestimmung des mittleren quadratischen Verschiebung von kleinen Molekülen in einer Diffusionszeit gegeben (im Bereich von wenigen Millisekunden bis zu Sekunden), dann wird die Überwachung Abstände in den Mikrometer-Skalen. Im Bereich beobachtet (50-170 msec) nur eine Art der Bewegung wird für ...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
The authors gratefully acknowledge PRIN 2010-2011 NANOMED prot. 2010 FPTBSH and PRIN 2010-2011 PROxy prot. 2010PFLRJR_005 for funding.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| HR-MAS probe | BRUKER | N/A | Probe for NMR measurements on semi-solid samples |
| NMR Spectrometer | BRUKER | DRX 500 | FT NMR spectrometer for liquid ans semi-solis state |
| β-cyclodextrin (β-CD) | Alfa-Aesar | J63161 | Reagent |
| Ethylenediaminetetracetic (EDTA) dianhydride | Sigma-Aldrich | 332046 | Reagent |
| Dimethylsulfoxide (DMSO) | Alfa-Aesar | D0798 | Solvent |
| Triethylamine | Sigma-Aldrich | 471283 | Base (reagent) |
| Ibuprofen (IP) sadium salt | Sigma-Aldrich | I1892 | Antinflammatory drug |
| Excel 2010 | Microsoft | N/A | speadsheet for data analysis |
| Origin 8 SR0 | OriginLab Co. | speadsheet for data analysis |
Referenzen
- Sharpe, L. A., Daily, A. M., Horava, S. D., Peppas, N. A. Therapeutic applications of hydrogels in oral drug delivery. Expert Opin. Drug Deliv. 11, 901-915 (2014).
- Hennik, W. E., van Nostrum, C. F. Novel crosslinking methods to design hydrogels. Adv. Drug Deliv. Rev. 54, 13-36 (2002).
- Yu, L., Ding, J. D. Injectable hydrogels as unique biomedical materials. Chem. Soc. Rev. 37, 1473-1481 (2008).
- Ma, M., Kuang, Y., Gao, Y., Zhang, Y., Gao, P., Xu, B. Aromatic-Aromatic Interactions Induce the Self-Assembly of Pentapeptidic Derivatives in Water To Form Nanofibers and Supramolecular Hydrogels. J. Am. Chem. Soc. 132, 2719-2728 (2010).
- Trotta, F., Tumiatti, W. Patent WO. , 03/085002 (2003).
- Trotta, F., Tumiatti, W., Cavalli, R., Zerbinati, O., Roggero, C. M., Vallero, R. Ultrasound-assisted synthesis of cyclodextrinbased nanosponges. Patent WO. , 06/002814 (2006).
- Trotta, F., Cavalli, R. Characterization and applications of new hyper-cross-linked cyclodextrins. Compos. Interface. 16, 39-48 (2009).
- Cavalli, R., Trotta, F., Tumiatti, W. Cyclodextrin-based nanosponges for drug delivery. J. Incl. Phenom. Macrocycl. Chem. 56, 209-213 (2006).
- Trotta, F., et al. Cyclodextrin-based nanosponges as a vehicle for antitumoral drugs. Patent WO. , 09/003656 (2009).
- Vyas, A., Shailendra, S., Swarnlata, S. Cyclodextrin based novel drug delivery systems. J. Incl. Phenom. Macrocycl. Chem. 62, 23-42 (2008).
- Swaminathan, S., Vavia, P. R., Trotta, F., Torne, S. Formulation of beta-cyclodextrin based nanosponges of itraconazole. J. Incl. Phenom. Macrocycl. Chem. 57, 89-94 (2007).
- Mamba, B. B., Krause, R. W., Malefetse, T. J., Gericke, G., Sithole, S. P. Cyclodextrin nanosponges in the removal of organic matter to produce water for power generation. Water SA. 34, 657-660 (2008).
- Mamba, B. B., Krause, R. W., Malefetse, T. J., Nxumalo, E. N. Monofunctionalized cyclodextrin polymers for the removal of organic pollutants from water. Environ.Chem. Lett. 5, 79-84 (2007).
- Mhlanga, S. D., Mamba, B. B., Krause, R. W., Malefetse, T. J. Removal of organic contaminants from water using nanosponge cyclodextrin polyurethanes. J. Chem. Technol. Biot. 82, 382-388 (2007).
- Lehmann, S., Seiffert, S., Richtering, W. Spatially Resolved Tracer Diffusion in Complex Responsive Hydrogels. J. Am. Chem. Soc. 134, 15963-15969 (2012).
- Ferrer, G. G., Pradas, M. M., Ribelles, J. L. G., Colomer, F. R., Castilla-Cortazar, I., Vidaurre, A. Influence of the nature of the porous confining network on the sorption, diffusion and mechanical properties of hydrogel IPNs. Eur. Polym. J. 46, 774-782 (2010).
- Santoro, M., Marchetti, P., Rossi, F., Perale, G., Castiglione, F., Mele, A., Masi, M. Smart approach to evaluate drug diffusivity in injectable agar-carbomer hydrogels for drug delivery. J. Phys. Chem B. 115, 2503-2510 (2011).
- Johnson, C. S. Diffusion ordered nuclear magnetic resonance spectroscopy: principles and applications. Prog. Nucl. Magn. Reson. Spectroscopy. 34, 203-256 (1999).
- Viel, S., Ziarelli, F., Caldarelli, S. Enhanced diffusion-edited NMR spectroscopy of mixtures using chromatographic stationary phases. Proc. Natl. Acad. Sci. U. S. A. 100, 9696-9698 (2003).
- Alam, T. M., Hibbs, R. M. Characterization of heterogeneous solvent diffusion environments in anion exchange membranes. Macromolecules. 47, 1073-1084 (2014).
- Ferro, M., Castiglione, F., Punta, C., Melone, L., Panzeri, W., Rossi, B., Trotta, F., Mele, A. Anomalous diffusion of Ibuprofen in cyclodextrin nanosponges hydrogels: an HR-MAS NMR study. Beilstein J. Org. Chem. 10, 2715-2723 (2014).
- Wolf, G., Kleinpeter, E. Pulsed Field Gradient NMR Study of Anomalous Diffusion in a Lecithin-Based Microemulsion. Langmuir. 21, 6742-6752 (2005).
- Rossi, F., Castiglione, F., Ferro, M., Marchini, P., Mauri, E., Moioli, M., Mele, A., Masi, M. Drug-Polymer interactions in hydrogel-based drug-delivery systems: an experimental and theoretical study. Chem. Phys. Chem. , (2015).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten