Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Propriétés Transport d'Ibuprofen encapsulé dans cyclodextrine Nanosponge hydrogels: une étude Spectroscopie RMN Proton HR-MAS
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Les régimes de mouvement de l'ibuprofène encapsulé dans le réseau de polymère nanoéponges ß-cyclodextrine sont étudiées à l'aide spin-écho technique (PGSE) RMN à champ pulsé-gradient. Synthèse, purification, la charge de médicament, la mise en œuvre de la séquence d'impulsions RMN et l'analyse de données pour travailler sur le déplacement quadratique moyen de la drogue à plusieurs reprises d'observation sont décrits en détail.
Résumé
La réticulation chimique du β-cyclodextrine (β-CD) avec un dianhydride éthylènediaminetétraacétique (EDTA) a conduit à des polymères ramifiés appelés nanoéponges de cyclodextrine (CDNSEDTA). Deux préparations différentes sont décrites avec 1: 4 et 1: rapports molaires 8 CD-EDTA. Les polymères réticulés correspondants ont été mis en contact avec une solution aqueuse 0,27 M de sel de sodium de l'ibuprofène (IP), conduisant à des hydrogels homogènes incolores chargées de médicament.
Les systèmes ont été caractérisés par une grande résolution l'angle magique (HR-MAS) spectroscopie RMN. Pulsed champ de gradient écho de spin (PGSE) spectroscopie RMN a été utilisé pour déterminer le déplacement carré moyen (MSD) de la propriété intellectuelle à l' intérieur du gel polymère à différents moments d'observation t d. Les données ont été traitées ultérieurement dans le but d'étudier la dépendance temporelle de TMS: TMS = f (t d). La méthodologie proposée est utile pour caractériser les différents régimes de diffusion que,En principe, le soluté peut rencontrer à l'intérieur de l'hydrogel, à savoir la diffusion normale ou anormale. Les protocoles complets, y compris la préparation de polymère et de la purification, l'obtention d'hydrogels chargés de médicament, la préparation des échantillons de RMN, la mesure des TMS par spectroscopie HR-MAS RMN et le traitement de données final pour atteindre la dépendance temporelle des TMS sont ici rapportés et discutés . Les expériences présentées représentent un cas paradigmatique et les données sont discutées en termes d'approche novatrice pour la caractérisation des propriétés de transport d'un client encapsulé dans un polymère hôte d'application potentielle pour la délivrance de médicaments.
Introduction
Il y a un intérêt croissant dans la conception et la formulation des systèmes polymères capables de piégeant, par l'intermédiaire d'interactions non-covalentes, de petites molécules ayant une activité biochimique potentiel. Sont attendus tels matériaux pour trouver des applications dans le transport du principe actif à la cible sélective et libérer sur l'action des stimuli externes, tels que les variations de pH, température, etc. Dans ce contexte, les hydrogels se sont avérés être des matériaux polyvalents et puissants pour nanomédecine en vue de la libération contrôlée de médicaments 1. La formation d'hydrogels polymères peut être obtenue en reliant entre elles les chaînes macromoléculaires par i), les interactions non covalentes physiques telles que les liaisons hydrogène, ii) la reticulation covalente des chaînes menant à un réseau tridimensionnel capable de gonfler en présence de une solution aqueuse ou iii) une combinaison des deux méthodes précitées 2-4.
Une classe particulièrement polyvalent trois-dimensional, les polymères pouvant gonfler pour l'encapsulation des espèces organiques et inorganiques peuvent être obtenus à partir de β-cyclodextrine naturelle (β-CD) par condensation avec des dérivés activés convenables d'un acide tétracarboxylique 5-8 donnant lieu à des nanoéponges de cyclodextrine (CDN). La synthèse, la caractérisation et l'application de CDNS est un thème de recherche consolidé de notre groupe. Les résultats de ces dernières années indiquent que CDNS montrent des propriétés intéressantes de gonflement, absorption / inclusion de produits chimiques, et la libération de petites molécules de médicaments, avec des applications dans la libération contrôlée de principes actifs pharmaceutiques 9 - 11 et chimie de l' environnement 12-14.
Compte tenu de ces prémisses, deux grandes questions à traiter concernent le chargement efficace du composé actif dans le gel polymère et une meilleure compréhension des solutés mobilité dans les matrices de gel 15 . La littérature fournit à la fois des études expérimentales et des théories relatives à des mécanismes de diffusion de petites molécules dans les réseaux macromoléculaires 16,17. Écho de spin (PGSE) , la spectroscopie par impulsions de champ à gradient de RMN est une méthode de structure bien établie largement utilisée pour étudier la diffusion translationnelle de petites molécules dans des solvants 18 ou de l'auto-diffusion des liquides purs. Les développements récents de haute résolution l' angle magique (HR-MAS) la technologie de RMN ont permis de recueillir des données haute résolution RMN de molécules mobiles dans des suspensions hétérogènes 19, gels et polymères gonflables 20,21. En effet, le dispositif expérimental combinant la spectroscopie HR-MAS RMN et la séquence d'impulsions PGSE offre une occasion unique d'observer les molécules de soluté dans un environnement moléculaire de l'hôte. Des données importantes sur les propriétés de transport de la molécule de médicament piégé dans une matrice de gel peuvent ainsi être obtenus. les données expérimentales de haute qualité peuvent ainsi être obtened permettant une conception plus rationnelle des systèmes nanostructurés hôte-invité.
Dans le présent travail , nous décrivons les protocoles détaillés pour les étapes suivantes: i) la synthèse et la purification de deux formulation différente de CDNS réticulé avec des polymères EDTA (figure 1), dénommée CDNSEDTA, et caractérisé par différents CD / agent de réticulation molaire rapport 1: 4 (CDNSEDTA 1: 4) et 1: 8 (CDNSEDTA 1: 8); ii) la préparation d'hydrogels chargés de médicament pour les deux CDNSEDTA 1: 4 et CDNSEDTA 1: 8. Dans cette étape, nous avons utilisé, comme molécule modèle de médicament, le sel de sodium de l'ibuprofène non-stéroïdiens anti-inflammatoire populaire (IP); iii) l'enquête approfondie sur les propriétés de transport de la propriété intellectuelle au sein du CDNSEDTA hydrogels par spectroscopie PGSE-HRMAS RMN. La méthode que nous proposons ici est basé sur la mesure du déplacement carré moyen (MSD) du médicament encapsulé dans l'hydrogel suivie par l'analyse de la dépendance temporelle de la MSD.
Nous wish de souligner que la méthodologie décrite ci-dessus - qui se concentre sur la dépendance temporelle du MDS du médicament dans la matrice - fournit un spectre plus large de l'information par rapport à la méthodologie consolidée sur la base de la détermination du coefficient de diffusion du médicament seulement. Nous avons récemment démontré 21 que cette approche a permis la discrimination des régimes de diffusion normales et anormales rencontrées par IP confiné dans hydrogels cdns.
Nous croyons donc que la description étape par étape de synthèse du polymère / purification, la formation des hydrogels chargés de médicament, HR-MAS RMN caractérisation et le traitement des données des données MDS, est un outil puissant pour les scientifiques intéressés à caractériser les systèmes nanostructurés pour la confinement et la libération de petites molécules.
Access restricted. Please log in or start a trial to view this content.
Protocole
1. Synthèse des polymères CDNSEDTA
- β-cyclodextrine sèche (β-CD) dans un four à 80 ° C pendant 4 heures avant son utilisation. Sec 500 ml de diméthylsulfoxyde (DMSO) et 100 ml de triéthylamine (Et 3 N) sur des tamis moléculaires (4 A) pour 24 heures avant de les utiliser dans le protocole.
- Introduire 25 ml de DMSO dans un flacon ml à un col à fond rond 50. Sous agitation magnétique, ajouter 5,675 g de β-CD (5 mmol). Afin de réduire la formation de grumeaux, ajouter la poudre β-CD en petites portions à du DMSO.
- Après environ 30 min, ajouter 6 ml d'Et3N à la solution homogène à l' aide d' une pipette graduée de 10 ml. Maintenir le mélange sous agitation pendant 15 min à température ambiante. Plonger le ballon dans un bain d'eau à température ambiante.
NOTE: La réaction entre β-CD et de l'EDTA est exothermique. Par conséquent, plongeant le ballon dans le bain d'eau favorise l'échange de chaleur en évitant la surchauffe du mélange réactionnel. - Ajouter 5.124 g (20 mmol, préparation de CDNSEDTA 1: 4), soit 10,248 g (40 mmol, préparation de CDNSEDTA 1: 8) de l'EDTA dianhydride sous agitation intense.
- Après 3 heures, retirer la matière solide (CDNSEDTA 1: 4 ou CDNSEDTA 1: 8) à partir du flacon à l'aide d'une spatule et écraser grossièrement avec un mortier et un pilon.
- Laver le matériau solide sur le papier filtre avec de l'acétone à la température ambiante (100 ml x 5 fois), avec du HCl 0,1 M (200 ml x 5 fois) et de l'eau déminéralisée (200 ml x 3 fois).
- Enfin, tout le matériel solide sec dans l'air à température ambiante pendant 48 heures, l'écraser finement dans un mortier et un pilon, puis le maintenir sous vide (<15 mbar) pendant 2 heures à 45 ° C.
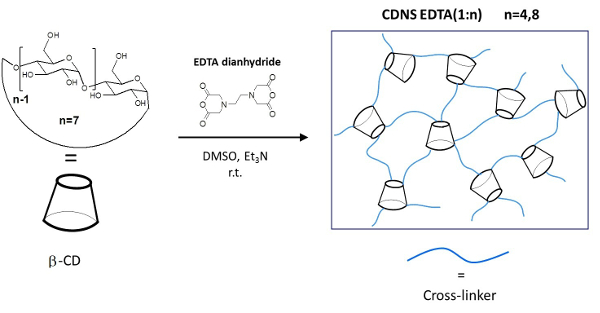
Figure 1:. Représentation schématique des polymères CDNSEDTA voie de synthèse schématique. A gauche: la structure moléculaire du monomère β-cyclodextrine (β-CD) et de l'agent EDTA dianhydride de réticulation. Sur la flèche les conditions de la réaction globale. Droite:. Croquis du polymère réticulé S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
2. HR-MAS RMN Mesures
- HR-MAS RMN Préparation de l' échantillon
- Préparer une solution 0,27 M de sel de sodium de l'ibuprofène (IP) dans de l'eau deutérée (99,8%).
- Ajouter 20 mg de CDNSEDTA 1: 4 et 2 mg de carbonate de sodium anhydre (Na 2 CO 3) pour 150 ul de la solution préparée au point 2.1.1) dans un flacon de 2 ml en verre. Mélanger le contenu du flacon avec une petite spatule afin de l'homogénéiser. Attendre 2 heures avant d'utiliser le gel formé avec cette procédure. Répétez ce point pour le CDNSEDTA 1: polymère 8.
- Insérez le gel dans une RMN rotor de 5mm approprié pour les expériences HR-MAS RMN à l'aide d'une petite spatule. La quantité totale de gel à utiliser dépend du volume interne du rotor (12 pi recommandé).
- HR-MAS 1 Expériences H RMN
- Définir les paramètres instrumentaux suivants: vitesse du rotor de filage de 4 KHz à l'unité de commande pneumatique MAS, la température de l'échantillon à 305 K dans l'unité de température variable.
- Acquérir les spectres 1 H RMN HR MAS de l' ibuprofène dans CDNSEDTA (1: 4) et CDNSEDTA (1: 8) , des systèmes de polymères en utilisant une séquence d'impulsions une conventionnelle sur la résonance du proton.
- Créer un nouvel ensemble de données. Cliquez sur l'onglet "AcquPars". Sélectionnez le PULPROG: zg.
- Sélectionnez le nombre de balayages (NS = 4) et le délai entre eux (D1 = 5 sec) .Set la largeur spectrale (SW = 8 ppm), le domaine temporel (TD = 16K) et le gain du récepteur (RG = 32 ).
- Tapez "zg" sur la console et il y aura une décroissance d'induction libre (FID) à l'écran. Pour traiter les données, cliquez sur l'onglet "ProcPars". Définissez la taille spectrale (SI = 32K), une fonction de fenêtre de multiplication exponentielle (WDW = EM) et l'élargissement de la ligne (LB = 1).Type "ft" pour effectuer la transformation de Fourier. Phase du spectre en utilisant l'onglet de phase sur l'écran. Obtenir une haute résolution spectre bien résolu.

Figure 2: Le bipolaires paires d'impulsions longitudinales Eddy retard actuel (BPPLED) Séquence d'impulsions Représentation schématique de la séquence d'impulsions utilisée pour réaliser les expériences de PFGSE.. Le cycle de phase pour des impulsions de 90 ° est la suivante : P1: (0) 16 P2: (0022) 4, P3: (0) 4 (2) 4 (1) 4 (3) 4, P4: (0202 2020 1313 3131 ) P5: (0) 4 (2) 4 (1) 4 (3) 4. Les impulsions de 180 ° sont + x. (modifié à partir de Ref.18) S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
- HR-MAS 1 H RMN Experiments PGSE
REMARQUE: Les expériences de PGSE sont effectuées en utilisant la séquence d'impulsions BPPLED 18 rapporté sur la figure 2. Ceci est une pseudo-expérience en deux dimensions avec une rampe de gradient croissant de façon linéaire de 2% à 100% de la dimension indirecte. L'intensité du signal est atténué en fonction du temps de diffusion et le Δ δ d'impulsions de gradient. L'optimisation de ces paramètres est nécessaire avant d'exécuter correctement une expérience de PGSE. L'optimisation se fait en exécutant quelques mesures 1D dans lequel Δ est maintenue constante, tandis que δ est varié.- Paramètres Optimisation
- Créer un nouvel ensemble de données - numéro d'expérience 1. Cliquez sur l'onglet "AcquPars". Sélectionnez le PULPROG: ledbpgp2s1d la séquence d'impulsions 1D pour l'optimisation de la diffusion.
- Sélectionnez le nombre de balayages (NS = 16) et le délai entre eux (D1 = 10 sec). Régler la largeur spectrale (SW = 8 ppm), til domaine temporel (TD = 16K) et le gain du récepteur (RG = 32).
- Δ défini (d20 dans la séquence) égale à une valeur constante et δ (P30) à une valeur d'essai. Valeur initiale Δ = 50 msec, δ = 3 msec (valeur maximale autorisée pour les instruments à haute résolution).
- Lire la valeur de la fréquence spectrale (SFO1) à partir de l'expérience 1 H et maintenant utiliser cette valeur. Régler le gradient de force GPZ6 à 2%. Répétez l'étape 2.2.2.3. Utilisez ce spectre comme référence pour l'optimisation.
- Dans le même ensemble de données créer le numéro de l'expérience 2. Observez tous les paramètres expérimentaux. Augmenter le gradient de force GPZ6 à 95%. Répétez l'étape 2.2.2.3. Comparer ce spectre avec le spectre de référence en utilisant l'icône d'affichage double et d'observer la variation de l'intensité du signal.
NOTE: Un spectre bien atténué devrait avoir environ 5% l'intensité du signal résiduel par rapport au spectre de référence. Si l'intensité du signal est perdu, réduire la valeur de δ et restarte à la section 2.3.1 procédure du point 2.3.1.3 jusqu'à ce que la bonne valeur pour δ est trouvé. - Répétez la procédure d'optimisation des paramètres dans la section 2.3.1 pour tous les cinq Δ valeurs.
REMARQUE: Choisissez cinq valeur Δ = 50, 80, 110, 140 et 170 msec et optimisé le δ correspondant à 3, 2.7, 2.4, 2.1, 1.8 msec (pour IP dans CDNSEDTA 1: 8) et ô à 2,7, 2,4 , 2, 1.7, 1.4 (pour IP dans CDNSEDTA 1: 4).
- Acquisition de la 2D Diffusion Data Set
- Dans les mêmes données définies créer le numéro de l'expérience 3, tous les paramètres expérimentaux 1D seront chargés. Tapez "eda". Sélectionnez le PULPROG: ledbpgp2s la séquence d'impulsions 2D et changer le parmode 2D.
- Set FnMODE = QF. Définir le domaine du temps TD dans la dimension F2 égale à 32, le nombre d'étapes de gradient. Tous les autres paramètres sont correctement définis. Tapez "DOSY" et la rampe de gradient sera généré et stocké dans un fichier. La start et les valeurs finales de la rampe (2-95) sont donnés comme paramètres d'entrée. L'acquisition est maintenant commencé.
- Paramètres Optimisation
- Traitement de l'information
- Le type "xf2" pour exécuter la transformation de Fourier dans la dimension F2. Le type "ABS2" pour effectuer la correction de ligne de base dans la dimension F2. Tapez "setdiffparm" pour rappeler les paramètres expérimentaux (A, δ, et la liste gradient) pour la prochaine étape de traitement.
- Cliquez sur "module de relaxation T1 / T2" dans l'onglet d'analyse et de définir les pics à être montés avec le premier spectre de l'expérience 2D. Définir les plages de pointe et d'exécuter le montage. Les intensités de signal à chaque pas de gradient appliqué sont obtenues.
NOTE: Les intensités de signal I (q, t d), pour chaque valeur Δ, dépend des variables expérimentales: appliquée impulsion déposée gradient (g), variable de temps (δ), le rapport gyromagnétique (γ) q = (γgδ) selon la foéquation de llowing:
avec la formule moléculaire TMS = z 2. - Exporter les intensités de signal dans une feuille de calcul et d' effectuer un ajustement linéaire des données pour obtenir la valeur de z 2 pour chaque observé le temps de diffusion t d.
Remarque: la valeur de TMS est lié au temps t d d'observation en fonction de:
- Effectuer le tracé log-log de z 2 par rapport t d pour chaque valeur t d expérimental. La valeur de l'exposant α est la pente de la régression linéaire. Une discussion plus exhaustive des aspects physiques des équations rapportées ci-dessus peut être trouvé dans la réf. 21 et dans les références qui s'y trouvent.
NOTE: En fonction de la valeur de l'exposant α, le régime de diffusion est définie comme suit: i) isotrope diffusion sans restriction pour α = 1, ii) subdiffusiv anormalerégime de e pour 0 <α <1, iii) régime superdiffusive anormale pour α> 1.
Access restricted. Please log in or start a trial to view this content.
Résultats
Nous avons appliqué cette méthodologie première à la molécule de médicament IP dissous dans une solution d'eau afin de vérifier la viabilité de cette approche. Une description complète des résultats représentatifs peuvent être trouvés dans ref. 21. Au contraire, nous allons nous concentrer ici sur les aspects méthodologiques et l'approche des écrous et boulons à la collecte et l' analyse des données. La figure 3 montre, sur une échelle semi-...
Access restricted. Please log in or start a trial to view this content.
Discussion
Nous présentons une méthodologie expérimentale pour déterminer le régime de diffusion d'une petite molécule de médicament encapsulé dans deux formulations représentatives des hydrogels CDNSEDTA. HR-MAS PGSE RMN permet la détermination du déplacement quadratique moyen de petites molécules dans un temps de diffusion donné (dans l'intervalle de quelques millisecondes jusqu'à seconde), puis distances de surveillance dans les échelles micrométriques. Dans la gamme observée (50 - 170 msec), un seu...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
The authors gratefully acknowledge PRIN 2010-2011 NANOMED prot. 2010 FPTBSH and PRIN 2010-2011 PROxy prot. 2010PFLRJR_005 for funding.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| HR-MAS probe | BRUKER | N/A | Probe for NMR measurements on semi-solid samples |
| NMR Spectrometer | BRUKER | DRX 500 | FT NMR spectrometer for liquid ans semi-solis state |
| β-cyclodextrin (β-CD) | Alfa-Aesar | J63161 | Reagent |
| Ethylenediaminetetracetic (EDTA) dianhydride | Sigma-Aldrich | 332046 | Reagent |
| Dimethylsulfoxide (DMSO) | Alfa-Aesar | D0798 | Solvent |
| Triethylamine | Sigma-Aldrich | 471283 | Base (reagent) |
| Ibuprofen (IP) sadium salt | Sigma-Aldrich | I1892 | Antinflammatory drug |
| Excel 2010 | Microsoft | N/A | speadsheet for data analysis |
| Origin 8 SR0 | OriginLab Co. | speadsheet for data analysis |
Références
- Sharpe, L. A., Daily, A. M., Horava, S. D., Peppas, N. A. Therapeutic applications of hydrogels in oral drug delivery. Expert Opin. Drug Deliv. 11, 901-915 (2014).
- Hennik, W. E., van Nostrum, C. F. Novel crosslinking methods to design hydrogels. Adv. Drug Deliv. Rev. 54, 13-36 (2002).
- Yu, L., Ding, J. D. Injectable hydrogels as unique biomedical materials. Chem. Soc. Rev. 37, 1473-1481 (2008).
- Ma, M., Kuang, Y., Gao, Y., Zhang, Y., Gao, P., Xu, B. Aromatic-Aromatic Interactions Induce the Self-Assembly of Pentapeptidic Derivatives in Water To Form Nanofibers and Supramolecular Hydrogels. J. Am. Chem. Soc. 132, 2719-2728 (2010).
- Trotta, F., Tumiatti, W. Patent WO. , 03/085002 (2003).
- Trotta, F., Tumiatti, W., Cavalli, R., Zerbinati, O., Roggero, C. M., Vallero, R. Ultrasound-assisted synthesis of cyclodextrinbased nanosponges. Patent WO. , 06/002814 (2006).
- Trotta, F., Cavalli, R. Characterization and applications of new hyper-cross-linked cyclodextrins. Compos. Interface. 16, 39-48 (2009).
- Cavalli, R., Trotta, F., Tumiatti, W. Cyclodextrin-based nanosponges for drug delivery. J. Incl. Phenom. Macrocycl. Chem. 56, 209-213 (2006).
- Trotta, F., et al. Cyclodextrin-based nanosponges as a vehicle for antitumoral drugs. Patent WO. , 09/003656 (2009).
- Vyas, A., Shailendra, S., Swarnlata, S. Cyclodextrin based novel drug delivery systems. J. Incl. Phenom. Macrocycl. Chem. 62, 23-42 (2008).
- Swaminathan, S., Vavia, P. R., Trotta, F., Torne, S. Formulation of beta-cyclodextrin based nanosponges of itraconazole. J. Incl. Phenom. Macrocycl. Chem. 57, 89-94 (2007).
- Mamba, B. B., Krause, R. W., Malefetse, T. J., Gericke, G., Sithole, S. P. Cyclodextrin nanosponges in the removal of organic matter to produce water for power generation. Water SA. 34, 657-660 (2008).
- Mamba, B. B., Krause, R. W., Malefetse, T. J., Nxumalo, E. N. Monofunctionalized cyclodextrin polymers for the removal of organic pollutants from water. Environ.Chem. Lett. 5, 79-84 (2007).
- Mhlanga, S. D., Mamba, B. B., Krause, R. W., Malefetse, T. J. Removal of organic contaminants from water using nanosponge cyclodextrin polyurethanes. J. Chem. Technol. Biot. 82, 382-388 (2007).
- Lehmann, S., Seiffert, S., Richtering, W. Spatially Resolved Tracer Diffusion in Complex Responsive Hydrogels. J. Am. Chem. Soc. 134, 15963-15969 (2012).
- Ferrer, G. G., Pradas, M. M., Ribelles, J. L. G., Colomer, F. R., Castilla-Cortazar, I., Vidaurre, A. Influence of the nature of the porous confining network on the sorption, diffusion and mechanical properties of hydrogel IPNs. Eur. Polym. J. 46, 774-782 (2010).
- Santoro, M., Marchetti, P., Rossi, F., Perale, G., Castiglione, F., Mele, A., Masi, M. Smart approach to evaluate drug diffusivity in injectable agar-carbomer hydrogels for drug delivery. J. Phys. Chem B. 115, 2503-2510 (2011).
- Johnson, C. S. Diffusion ordered nuclear magnetic resonance spectroscopy: principles and applications. Prog. Nucl. Magn. Reson. Spectroscopy. 34, 203-256 (1999).
- Viel, S., Ziarelli, F., Caldarelli, S. Enhanced diffusion-edited NMR spectroscopy of mixtures using chromatographic stationary phases. Proc. Natl. Acad. Sci. U. S. A. 100, 9696-9698 (2003).
- Alam, T. M., Hibbs, R. M. Characterization of heterogeneous solvent diffusion environments in anion exchange membranes. Macromolecules. 47, 1073-1084 (2014).
- Ferro, M., Castiglione, F., Punta, C., Melone, L., Panzeri, W., Rossi, B., Trotta, F., Mele, A. Anomalous diffusion of Ibuprofen in cyclodextrin nanosponges hydrogels: an HR-MAS NMR study. Beilstein J. Org. Chem. 10, 2715-2723 (2014).
- Wolf, G., Kleinpeter, E. Pulsed Field Gradient NMR Study of Anomalous Diffusion in a Lecithin-Based Microemulsion. Langmuir. 21, 6742-6752 (2005).
- Rossi, F., Castiglione, F., Ferro, M., Marchini, P., Mauri, E., Moioli, M., Mele, A., Masi, M. Drug-Polymer interactions in hydrogel-based drug-delivery systems: an experimental and theoretical study. Chem. Phys. Chem. , (2015).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon