Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Ice-Generation und die Wärme- und Stoffübertragung Phänomene der Einführung in Wasser zu einem Kältebad von Brine
In diesem Artikel
Zusammenfassung
Hier stellen wir ein Protokoll die Erzeugung von Eis zu zeigen, wenn Wasser in ein kaltes Bad von Salzlake eingebracht wird, als ein sekundäres Kältemittel, bei einem Bereich von Temperaturen weit unter dem Gefrierpunkt von Wasser. Es kann zur Herstellung von Eis für die Industrie als Alternative verwendet werden.
Zusammenfassung
Wir zeigen, ein Verfahren zur Untersuchung der Wärme- und Massenübertragung und der Gefrier Phänomene in einer unterkühlten Salzlösung Umwelt. Unser Experiment zeigte, dass unter den richtigen Bedingungen kann Eis hergestellt werden, wenn Wasser in einem Bad von kalter Sole eingebracht wird. Um Eis Form, zusätzlich zu den mit der Sole und Wasser-Mischung, die Geschwindigkeit der Wärmeübertragung machen muss, dass der Massentransfer umgehen. Wenn Wasser in Form von winzigen Tröpfchen an den Soleoberfläche eingeführt wurde, ist die Art der Wärme- und Stoffaustausch durch Diffusion. Der Auftrieb verhindert, dass Wasser von unten mit dem Sole Mischen, aber das Eis dicker wächst, es verlangsamt die Geschwindigkeit der Wärmeübertragung nach unten, so dass Eis schwieriger als Ergebnis zu wachsen. Wenn Wasser in der Salzlösung in der Form eines Fluss eingeführt werden eine Reihe von Faktoren ab, wie viel Eis bilden kann, zu beeinflussen, zu finden. Brine Temperatur und Konzentration, die die treibenden Kräfte der Wärme- und Stoffübertragung sind, können jeweils beeinflussen das Wasser-zu-Eis Umwandlung RatiO; niedrigere Badtemperaturen und Solekonzentrationen ermutigen, mehr Eis zu bilden. Die Strömung Rheologie, die direkt sowohl die Wärme- und Stoffübergangskoeffizienten beeinflussen können, ist auch ein wichtiger Faktor. Außerdem ändert sich die Strömungs Rheologie, die Kontaktfläche des Strömungs mit dem Hauptfluid.
Einleitung
Ice - Slurries werden in großem Umfang in der Industrie verwendet, und eine besonders erfolgreiche Anwendung ist das Eis-Molchtechnik 1, 2. Im Vergleich zu dem herkömmlichen Schaum und feste Schwein, kann das Eis pig durch komplexe Topologien über eine lange Strecke fahren wegen der Schmierwirkung der flüssigen Phase und der Höhe seines Gefrierpunktes als einige der Eiskristalle 3 schmelzen, 4, 5 . Auch wenn das Schwein stecken bleibt, kann man einfach für die Eisbrei warten, um später den Reinigungsprozess schmelzen und wieder aufzunehmen. Dieses Verfahren der Rohrreinigung ist billig und einfach zu bedienen.
Das Eis Fraktion spielt eine Schlüsselrolle bei der Erfüllung des Eises Schwein. Um das Eis Fraktion messen, kann man eine cafetière (Französisch Presse) verwenden , um festzustellen , ob die Eisbrei ist dick genug , um 6,"> 7. Eine hohe cafetière Eis - Fraktion, in der Regel 80%, ist erforderlich, wenn Eis Molch Durchführung. Neuere Forschungen auf Online - Eis Fraktion Nachweis zeigte , dass beide elektromagnetischen und Ultraschallwellen geeignet sind für den Job 8, 9, 10, 11.
Das Eis Schwein wird in der Regel durch eine Kratz Eisbereiter aus einer 5 Gew% igen NaCl-Lösung (Sole) durchgeführt. Es ist auch der primäre Weg Eisbrei in der Industrie zu machen. Diese Art der Eismaschine gefriert Wasser oder Sole auf eine kalte Metalloberfläche, in der Regel eine glatte 316 Stahloberfläche und dann schert zyklisch die Eispartikel aus. Die Flüssigkeit-zu-Metall - Grenzflächen sind sehr komplex und werden von einem breiten Spektrum von Faktoren beeinflusst , die unerlässlich sind , um Eis 12 zu machen. Die Schnittstelle zwischen nicht-metallischen und Wasser kann sehr unterschiedlich sein, und ein besonders interessantes Beispiel ist Kaolinit. Die Kaolstimmter-Wasser - Grenzfläche ist besonders , weil es keine günstige Eisstruktur Angrenzend an die feste Oberfläche ist, sondern eine Schicht aus amphoteren Substratflüssigkeit, die die eisähnliche Wasserstoff-gebundenen Clustern fördert 14 auf es 13, zu bilden. Ein anderer Weg, um das Eis Schwein zu produzieren erfordert die premade Eisblöcke Zerkleinern während hochkonzentrierte Sole gleichzeitig zugegeben wird. Für dieses Verfahren kann das Kühlsystem mit einer viel höheren Verdampfungstemperatur ausgeführt werden, da kein Gefrierpunktserniedrigungs (FPD) vor der Bildung von Eis gegeben; Es ist daher effizienter aufgrund der abgesenkten Verdichtungsverhältnis und verringert Leistung für eine gegebene Kälteleistung 15, 16, 17 betrachtet.
Es gibt zwei weitere Eisproduktion Methoden: Herstellung von Eis von unterkühltem Wasser und setzen Kältemittel und Wasser in direktem Kontakt 18, 19. Die Kühlungs Verfahren beinhaltet die metastabilen unterkühlten Wasser störende Eisbildung und Wachstum zu generieren. Das größte Problem bei diesem Verfahren ist der unerwünschte Eisbildung, die das System blockieren kann. Der direkte Kontakt Methode wird für Eis Molch nicht geeignet betrachtet, da weder Kältemittel noch Schmieröl in der letzten Eisprodukts gewünscht werden.
Die Bildung von Eis erfordert Wärme- und Stoffübertragung aufgrund der latenten Schmelzwärme in dem Prozess erzeugt wird. Es wurde zuerst von Osborn Reynolds 1874 entdeckt , dass der Transport von Wärme und Masse in Gasen stark gekoppelt sind und 20 in ähnlichen mathematischen Formeln ausgedrückt werden. Diese Arbeit bildete die Pionier Papier zum Thema Dynamik, Wärme und Stoffübertragung in Flüssigkeiten und wurde mehrmals 21 nachgedruckt, 22. Dieses Thema wurde dann durch ein StudiumReihe von anderen, von beiden analytischen und empirischen Ansätzen für Gase, Flüssigkeiten und geschmolzenes Metall 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33. Abgesehen von der Wärme- und Stoffübertragung, muss die Flüssigkeit Keimstellen, wo dendritische Eis Wachstum entwickeln können. Eine moderne Einblick in das Wachstum von Eiskristallen verwendet constructal Law, entwickelt von Adrian Bejan, zu erklären , warum Eis auf diese Weise wächst 34, 35, 36.
Die Eisbildung in Salzlösung ist sehr verschieden von dem in reinem Wasser aufgrund der Existenz des Salzes. Als erstes, Salz ändert die Thermodynamik des Fluids und drückt seinen Gefrierpunkt. Zweitens Salz kann in der Eis-Matrix (außer Hydrohalit, die nur bilden, wenn die Temperatur der eutektische Punkt erreicht) nicht lösen, und es ist mit dem Hauptfluid abgelehnt, wenn Eis beginnt zu wachsen. Die Ablehnung von Salz wurde in beiden Meereis und Eis im Labor 37, 38 studierte entdeckt. Da die zurückgewiesene hochkonzentrierte Salzlösung bei einer Temperatur weit unter dem Gefrierpunkt von Meerwasser ist, wie es steigt, wächst Eis an der Grenzfläche zwischen dem strömenden Sole und dem Ruhe bulk Flüssigkeit. Diese Eisstalaktiten, auch brinicles genannt, wurden zum ersten Mal in McMurdo Sound, Antarktis entdeckt und untersucht experimentell 39, 40, 41, 42. Im Jahr 2011, um die Bildung von brinicles in seiner Frozen Planet Serie BBC gefilmt"xref"> 43, 44.
In unserem Labor wurde entdeckt , dass die fließenden und ruhenden Flüssigkeiten durch Umkehren , wenn das Wasser zu einem Bad aus kalter Sole eingeführt wird, kann das Wasser in Eis 45 unter den richtigen Bedingungen zu transformieren. Es wurde festgestellt, dass der Ort, wo das Wasser eingeleitet wird, Rheologie fließen, und Soletemperatur und Konzentration sind entscheidende Faktoren beeinflussen, wie viel Eis hergestellt werden. Das übergeordnete Ziel dieser Studie ist es zu untersuchen, ob eine Eismaschine durch diesen Mechanismus entwickelt werden können, um Eisbrei erzeugen, wenn man bedenkt, dass die erhöhte Verdampfungstemperatur und die hohe Rate der Flüssigkeit-zu-Flüssigkeit-Wärmeübertragung, um die Effizienz der Energienutzung verbessern können. Dieser Artikel Aktien wesentliche Aspekte des Experiments.
Access restricted. Please log in or start a trial to view this content.
Protokoll
Achtung: Es gibt zwei giftige Chemikalien, Methanol und Ethylenglykol, die in diesen Experimenten verwendet. Methanol kann in den menschlichen Körper verstoffwechselt werden Formaldehyd zu erzeugen, und dann in Ameisensäure oder Formiatsalz. Diese Substanzen sind giftig für das Zentralnervensystem und kann sogar zum Tod führen. Ethylenglycol kann oxidiert werden Säure zu Glycolsäure, der dann in Oxalsäure drehen kann. Dies kann Nierenversagen und zum Tod führen. Sie nicht, diese Chemikalien zu trinken. Sofort einen Arzt aufsuchen, wenn sich ein Unfall ereignet.
1. Das Kühlsystem
HINWEIS: Es ist sehr schwierig, die Sole zu halten, bei -18 ° C oder so, wenn die Umgebungstemperatur in etwa bei Raumtemperatur ist. Es ist wichtig, dass die Tanks, die Ethylenglykol und Sole sind gut isoliert und von einer angemessenen Größe Speicherung überschüssigen Stromverbrauch zu vermeiden und eine optimale Systemleistung sicherzustellen. Es wird empfohlen, dass die Tankgröße nicht mehr als 30 L. nicht überschreitet
- Bereiten Sie die sekundären Kühlflüssigkeit
- Gießen Sie 1 l Ethylenglykol in den sekundären Kühltank, Tank A (Basis: 400 mm × 200 mm, Höhe: 350 mm). In etwa ,6-,65 L (600-650 g) Wasser zu Tank A.
- Wiederholen Sie Schritt 1.1.1 mehrere Male, bis es genügend Flüssigkeit in Tank A (25 L).
- Rühren Sie die Flüssigkeit, so dass die Flüssigkeit homogen ist.
- Einschalten der beiden Pumpen in Tank A in den Vollleistungseinstellung (2500 L / h). Stellen Sie sicher, dass alle Blasen in den Wärmetauschern gefangen und Leitungen freigesetzt.
- Schalten Sie die Pumpe zu beobachten, wenn alle Blasen freigesetzt werden. Wenn nicht, wiederholen Sie Schritt 1.1.4.
- Herstellung der Sole
HINWEIS: In diesem Beispiel werden 22 Gew% Kochsalzlösung wird hergestellt. Wenn andere Konzentrationen erforderlich sind, die zugegebene Masse des Salzes sollte auch entsprechend geändert werden. Die Referenzsolekonzentration und Dichtewerte finden Sie auf Seite D-257 von der 64. Auflage (1983) von th findene CRC Handbook of Chemistry and Physics 46.- In 4 kg Wasser in einen 5-L-Plastikbecher.
- Maßnahme 1 kg NaCl Salz auf einer elektronischen Waage und gießen dieses Salz in den Becher mit dem Wasser.
- Rühren Sie die Mischung , bis die Lösung klar ist (dh, es gibt keine Salzpartikel oder Wasserblasen sichtbar in der Lösung).
- Nehmen Sie eine Probe, ~ 10 ml, der Lösung, die eine 10-ml-Spritze.
- Spritzen Sie die Flüssigkeit in das U-Rohr-Dichtemessgerät.
- Prüfen Sie, ob Luftblasen in der Röhre. Wenn es welche gibt, injizieren mehr Flüssigkeit, sie drücken aus.
- Drücken Sie auf "Quick Settings" und wählen Sie "Dichte Temperatur." Typ in 20 ° C ein und drücken Sie "OK". Die Dichtemessgerät misst nun die Flüssigkeitsdichte bei dieser Temperatur.
- Drücken Sie starten und auf das Ergebnis warten.
- Vergleichen Sie die Dichtewert mit 1164,00 kg / m 3.
- Fügen Sie mehr Salz, wenn der Wert unter dem VERGLEICH istn Dichte. Fügen Sie Wasser, wenn aus anderen Gründen.
- Wiederholen Sie die Schritte 1.2.3-1.2.10 , bis die Flüssigkeitsdichte korrekt (1164,00 kg / m 3).
- Gießen Sie diese Lösung in einen größeren Behälter, Container A.
- Führen Sie die Schritte 1.2.1-1.2.12 35-40 l Kochsalzlösung zu machen und setzen Container A in eine Gefriertruhe bei -40 ° C. Halten Sie die Sole dort für 48-72 h, bis seine Temperatur erreicht -19,18 ° C (Gefrierpunkt dieser 22 Gew% Sole).
2. Herstellung des Eis für den injizierenden und Waschwasser
- Bereiten Sie Eis für das Einspritzen von Wasser
- Gießen Sie 1 l Wasser in einen kleinen Behälter (200 × 200 × 50 mm).
- Wiederholen Sie Schritt 2.1.1 mit einem anderen Behälter und legen die beiden Behälter in der Gefriertruhe bei -40 ° C.
- Halten sie in den Gefrierschrank für 10 h oder mehr, um sicherzustellen, dass das gesamte Wasser gefroren ist.
- Bereiten Sie das Eis Shell Waschwasser
- Füllen Sie einen 5-Liter-Becher mit 5 l Wasser.
- Füllen Sie einen 2-Liter-Becher mit 2 l Wasser.
- Platzieren Beide Becher in die Gefriertruhe bei -40 ° C für 8-10 h, so daß eine dicke Schale aus Eis Umwickeln ungefrorenen Wasser ist.
- Verwenden Sie ein Hochgeschwindigkeits-Wasserstrahl mit einer Geschwindigkeit von 3-5 m / s aus dem Hahn einen 3-cm Durchmesser Loch an der Spitze des Eis-Shell zu öffnen.
- Lassen Sie das Wasser im Inneren des Eis-Shell.
- Legen Sie die beiden Becher zurück in den Gefrierschrank.
- Wenn die Masse des Eises Schale nicht erreicht 3 kg und 1 kg für die beiden Bechergläser bzw. wiederholen Sie die Schritte 2.2.1-2.2.5, aber die Becher halten in den Gefrierschrank länger in Schritt 2.2.3. Die beiden Bechergläser sollten nun in der Lage sein, zu enthalten 2 l und 1 l Wasser, beziehungsweise.
3. Wasser Einleitung Position und die Rheologie Kontrollexperiment
- Führen Wasser an der Oberfläche Sole
- Dekantieren 2 l 22 Gew% Kaltsole aus Behälter A in dieAluminium Eimer der Eismaschine und Schalter an der Kühleinheit.
- Messen der Temperatur der Sole mit einem Thermometer / Thermoelement (entweder K-Typ- oder T-Typ sind geeignet). Tragen Sie auf das Experiment, wenn die Sole ist -15 ° C oder niedriger.
- Füllen Sie die 100-ml-Glasspritze mit Leitungswasser bei Raumtemperatur. Bringen Sie ein 2-mm Innendurchmesser, 1 mm dick und 1 m langen Silikonschlauch auf die Spitze der Spritze.
- Platzieren Sie die Spritze an einer bestimmten Position, so dass es einen Kopf zwischen dem Wasser in der Spritze und dem Ausgang der Silikonschlauch. Der hydrostatische Druck wird das Wasser aus dem Schlauch quetschen.
- Unterzutauchen eine gewisse Länge des Silikonschlauch, typischerweise 70 cm, in die Salzlösung.
- Stellen Sie die relative Position zwischen der Spritze und dem Rohrausgang, so dass der hydrostatische Druck groß genug ist, damit das Wasser die Spritze zu verlassen. Wenn das Rohr verstopft ist, erhöhen Sie den Kopf durch die Spritze in eine höhere vertikale Position erhebend, until der hydrostatische Druck der Schubspannung innerhalb der Röhre zu überwinden.
- Halten Sie die Rohrausgang etwa 1 cm oder weniger über die Sole Oberfläche.
- Stellen Sie die Länge des Tauchrohr und die Spritze Höhe der Wasseraustrittstemperatur lassen und Flussrate zu steuern, um zu bestimmen, wie viel Eis gemacht werden kann oder wie viel Mischen der Salzoberfläche tritt an. Das Einfrieren Phänomen sollte nun an der Soleoberfläche beobachtet werden. Siehe Referenz 45 für die weitere Richtung.
- Führen Sie Wasser durch die Sole
- Wiederholen Sie die Schritte 3.1.1-3.1.6.
- Halten Sie die Rohrausgang in der Sole, vorzugsweise am Boden des Behälters.
- Die Länge des Tauchrohres und die Spritze Höhe.
- Den Winkel des Rohrausgang der Rheologie der Strömung zu steuern.
- Wiederholen Sie die Schritte 3.2.3-3.2.4 die besten gekoppelt Fluss Rheologie zu finden und Flussrate, die die meiste Eis produzieren kann.
4. Eisproduktion, Sammlung und Messung
- Machen Eis
- Wenn Blasen in den Rohren sind, wechseln Sie auf die beiden Pumpen im Inneren Tank A die Blasen aus dem Glykol-Kreislauf-System zu lösen, und dann die Pumpen abschalten.
- Schalten Sie die drei Kühleinheiten und lassen Sie sie für 10-16 h laufen die Ethylenglykol-Lösungen abzukühlen.
- Messung der Ethylenglykollösung mit einem Thermometer / Thermoelement. Die Glykoltemperatur sollte bei etwa -25 ° C sein.
- Messen Sie die Temperatur der Sole in Behälter A sicherstellen, dass es bei -19 ° C ist, bevor Sie fortfahren 4.1.5 Schritt.
- Füllen Sie den Soletank, Tank-B, mit etwa 30 l Kochsalzlösung aus Behälter A und Schalter an den beiden Pumpen in Behälter A.
- Messen Sie die Temperatur des Glykol in Behälter A. Wenn es kälter als -19 ° C ist, schalten Sie ein oder mehrere Kühleinheiten, die die Ausfällung von Eispartikeln außerhalb der Wärmetauscher zu verhindern in-Behälter B. Wenn die Temperatur wärmer ist als die erwartete Soletemperatur, schalten Sie alle drei Kühleinheiten. Führen Sie das Experiment bei -17 ° C bis -19 ° C.
- Legen Sie die beiden premade Eisblöcke aus Schritt 2.1 in dem isolierten 5-l-Becher, Behälter B, und gießen Sie ungefähr 3 l Wasser in den Becher.
- Messen Sie die Wassertemperatur und hält sie bei 2 ° C durch die Mischung zwischen den Experimenten gerührt, wenn die Temperatur steigt.
- Füllen Sie das Glas Spritze mit 100 ml der 2 ° C Wasser.
- Gelten 5-10 ml Methanol zu dem Glasfenster der Behälter B Kondensation und die Bildung von Eis zu verhindern.
- Injizieren das Wasser in die Sole durch die relative Position zwischen der Spritze und Regelung des Austritts der Röhre, so dass ein konstanter hydrostatischer Druck ist und somit eine konstante Strömungsrate. Etwa 70 cm des Siliconschlauchs sollte in der Sole getaucht werden. Den Winkel der Einspritzung auf 0 °, so daß die anfängliche Wassergeschwindigkeit in der Aufwärts direction 0 m / s.
HINWEIS: Die Spritze kann entweder von Hand gehalten oder an einem Stativ eingespannt. Handgehaltene ist besser geeignet, wenn die Soletemperatur kälter ist, weil es mehr Zeit in Anspruch nimmt einen Stand einzustellen, und Eis kann das Rohr blockieren. Halten die Strömungs Rheologie während des gesamten Experiments in Einklang mit einer konstanten Strömungsrate und Einspritzwinkel gewährleistet (0 °) und durch das Gefrieren Grenze etwa 3 cm über dem Rohrausgang zu halten. Nicht der Fluss lassen die Region betreten , wo es beginnt 47 turbulent zu machen. Siehe Referenz 45 für die weitere Richtung. - Sammeln Sie das Eis als 4.2 und 4.3 in Schritten beschrieben. Wiederholen Sie die Schritte 4.1.8 - 4.1.11 bei verschiedenen Soletemperaturen.
- Sammeln Sie die erzeugte Eis und schätzen , wie viel Eis produziert wird (trockene Sammlung)
- Stellen Sie einen Behälter (200 × 200 × 50 mm) auf der Skala und Null das Lesen durch Drücken der "Turn On" -Taste.
- Verwenden Sie das Sieb, das Eis zu schaufeln und abschüttelndie Sole.
- Setzen Sie dieses Eis im Behälter. Messen Sie die Masse des Eises mit der Skala.
- Nachdem das Eis geschmolzen ist, verwenden Sie die 10-ml-Spritze eine Probe zu nehmen. Injizieren Sie diese Probe von Flüssigkeit in die Dichtemessgerät.
- Führen Sie die Schritte 1.2.6-1.2.9.
- Notieren Sie sich die Dichtewert.
- Berechnen Sie die Netto-Wassermasse aus seiner Dichte (dh die Masse von Wasser in Eis umgewandelt) mit folgender Formel:
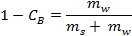
woher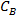 ist die Solekonzentration Gew% und
ist die Solekonzentration Gew% und 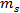 und
und 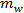 bzw. sind die Massen von Salz und Wasser.
bzw. sind die Massen von Salz und Wasser.
- Sammeln Sie die erzeugte Eis und schätzen , wie viel Eis produziert wird (wet - Sammlung)
- Füllen Sie das 5-Liter-Becher mit einem Eis-Shell (Schritt 2.2) und bei Raumtemperatur Leitungswasser. Legen Sie es zurück in den Gefrierschrank bei -40 ° C.
- Dekantiert das Wasser mit dem Eismantel aus dem 5-l-Becherglas in einen 2-L-Becherglas, wenn seine Temperatur bei 0 ° C ist. Füllen Sie das 5-Liter-Becher. Halten Sie beide Becher in den Gefrierschrank.
- Scoop aus dem Eis produziert in den Schritten 4.1.8 und 4.1.9 und gießen 200-500 ml Wasser aus dem 2-Liter-Becher auf das Eis, es zu waschen. Sie nicht das Sieb schütteln, bevor Sie die 0 ° C Wasser anwenden.
- Schütteln Sie die Flüssigkeit in dem Sieb ab.
- Wiederholen Sie die Schritte 4.2.2-4.2.7.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Figur 1 vergleicht die Wirkung von Wasser in den Soleoberfläche zu Wasser durch das Salzlösung injiziert eingeführt. In der "Eiskappe" Szenario ist das gebildete Eis solide, weil das Wasser nicht viel mit dem Bulk-Flüssigkeit mischen hat. Die Temperatur und der Dichteunterschied zwischen den beiden Fluiden erzeugt Auftriebskraft auf dem Wasser und hindert sie daran, zu vermischen. Beide Flüssigkeiten sind statisch (dh die Wärmeübertragung wesent...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Der Prozess der Eiserzeugung Sole als Sekundär-Kältemittel verwendet, beinhaltet die Kombination von Wärme und Stoffübergang. Wenn die Wärmeübertragung größer ist, dann bildet sich Eis vor dem Wasser hat die Chance, mit dem Bulk-Flüssigkeit zu mischen. Es wurde beobachtet , dass bei einer Relativbewegung zwischen dem eingeführten Wasser und dem Ruhe bulk Sole (dh Einspritzen von Wasser in der Salzlösung), die Strömung des Wärmeübertragungs hilft und fördert Eis schnell zu bilden. Wenn es jedoch i...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Die Autoren haben keine Bestätigungen.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| DMA 4500 M | Anton Paar | 81546022 | Density Metre |
| GELATO Chef 2200 | magimix | 0036500504R13 | Ice Cream Maker |
| 280D | FREEZE MASTER | 241-1441 | Pipe Freezer |
| M17.5X2 | BLUE ICE MACHINES | GK924 | Slushy Puppy Machine |
| HH68K | OMEGA | 140045 | Thermometer |
| OHAUS | TS4KW | 1324 | Scale |
| ZFC321WA/BNI225 | ZANUSSI | 920672574-00 | Freezer |
| EIS Heater Matrix | Vauxhall | 214720041 | Heat Exchanger |
| 2500LPH | JBA | AP-2500 | Pump |
| Glass syringe | FORTUNA Optima | 100 mL | |
| OAT concentrated coolant | wilko | P30409014 | Ethylene Glycol |
| pure dried vacuum salt | INEOS Enterprise | 1433324 | NaCl Salt |
| Methylated Spirits | Barrettine | 1170 | Methanol |
Referenzen
- Cleaning and separation in conduits. UK patent. , GB2358229, WO0151224 (2001).
- Quarini, J. Ice-pigging to reduce and remove fouling and to achieve clean-in-place. Appl. Therm. Eng. 22, 747-753 (2002).
- Evans, T. S., Quarini, G. L., Shire, G. S. F. Investigation into the transportation and melting of thick ice slurries in pipes. Int. J. Refrig. 31, 145-151 (2008).
- Shire, G. S. F., Quarini, G. L., Rhys, T. D. L., Evans, T. S. The anomalous pressure drop behaviour of ice slurries flowing through constrictions. Int. J. Multiph. Flow. 34, 510-515 (2008).
- Shire, G. S. F., Quarini, G. L., Evans, T. S. Pressure drop of flowing ice slurries in industrial heat exchangers. Appl. Therm. Eng. 29, 1500-1506 (2009).
- Evans, T. S. Technical Aspects of Pipeline Pigging with Flowing Ice Slurries [dissertation]. , Department of Mechanical Engineering, University of Bristol. (2007).
- Shire, G. S. F. The behaviour of ice pigging slurries [dissertation]. , Department of Mechanical Engineering, University of Bristol. (2006).
- Hales, A., et al. Ice fraction measurement of ice slurries through electromagnetic attenuation. Int. J. Refrig. 47, 98-104 (2014).
- Hales, A., et al. The effect of salinity and temperature on electromagnetic wave attenuation in brine. Int. J. Refrig. 51, 161-168 (2015).
- Hales, A. Ice slurry diagnostics through electromagnetic wave attenuation and other techniques [dissertation]. , Department of Mechanical Engineering, University of Bristol. (2015).
- Lucas, E. J. K., Hales, A., McBryde, D., Yun, X., Quarini, G. L. Noninvasive Ultrasonic Monitoring of Ice Pigging in Pipes Containing Liquid Food Materials. J. Food Process. Eng. 40, e12306(2015).
- Carrasco, J., Hodgson, A., Michaelides, A. A molecular perspective of water at metal interfaces. Nat. Mater. 11, 667-674 (2012).
- Hu, X. L., Michaelides, A. Ice formation on kaolinite: Lattice match or amphoterism? Surf. Sci. 601, 5378-5381 (2007).
- Hu, X. L., Michaelides, A. The kaolinite (0 0 1) polar basal plane. Surf. Sci. 604, 111-117 (2010).
- Leiper, A. N., Ash, D. G., McBryde, D. J., Quarini, G. L. Improving the thermal efficiency of ice slurry production through comminution. Int. J. Refrig. 35, 1931-1939 (2012).
- Leiper, A. Carnot cycle optimisation of ice slurry production through comminution of bulk ice [dissertation]. , Department of Mechanical Engineering, University of Bristol. (2012).
- Leiper, A. N., Hammond, E. C., Ash, D. G., McBryde, D. J., Quarini, G. L. Energy conservation in ice slurry applications. Appl. Therm. Eng. 51, 1255-1262 (2013).
- Bédécarrats, J. -P., David, T., Castaing-Lasvignottes, J. Ice slurry production using supercooling phenomenon. Int. J. Refrig. 33, 196-204 (2010).
- Wijeysundera, N. E., Hawlader, M. N. A., Andy, C. W. B., Hossain, M. K. Ice-slurry production using direct contact heat transfer. Int. J. Refrig. 27, 511-519 (2004).
- Reynolds, O. On the extent and action of the heating surface of steam boilers. Proc. Lit. Philos. Soc. Manch. 14, 7-12 (1874).
- Reynolds, O. Papers on mechanical and physical subjects: reprinted from various transactions and journals. , Cambridge University Press. Vol. I, 1869-1882, Ch. 14. On the extent and action of the heating surface of steam boilers 81-85 (1900).
- Reynolds, O. Papers on mechanical and physical subjects. Int. J. Heat Mass Transfer. 12, 129-136 (1969).
- Prandtl, L. Eine Beziehung zwischen Wärmeaustausch und Strömungswiderstand der Flüssigkeiten (On the relation between heat exchange and stream resistance of fluid flow). Physik. Z. 11, 1072-1078 (1910).
- Prandtl, L. Bemerkung über den Wärmeübergang im Rohr (Note on heat transmission in pipes). Physik. Z. 29, 487-489 (1928).
- Taylor, G. I. Conditions at the surface of a hot body exposed to the wind. Rep. Memo. ACA. 272, (1916).
- Taylor, G. I. The Application of Osborne Reynolds' Theory of Heat Transfer to Flow through a Pipe. Proc. R. Soc. A. 129, 25-30 (1930).
- Kármán, T. v Proceedings of the Fourth International Congress for Applied Mechanics. , Cambridge, UK. 54-91 (1934).
- Kármán, T. v The analogy between fluid friction and heat transfer. Trans. Am. Soc. Mech. Eng. 61, 705-710 (1939).
- Martinelli, R. C. Heat transfer to molten metals. Trans. Am. Soc. Mech. Eng. 69, 947-959 (1947).
- Colburn, A. P. A method of correlating forced convection heat-transfer data and a comparison with fluid friction. Trans. Am. Inst. Chem. Eng. 29, 174-210 (1933).
- Colburn, A. P. A method of correlating forced convection heat-transfer data and a comparison with fluid friction. Int. J. Heat Mass Transfer. 7, 1359-1384 (1964).
- Chilton, T. H., Colburn, A. P. Mass Transfer (Absorption) Coefficients Prediction from Data on Heat Transfer and Fluid Friction. Ind. Eng. Chem. 26, 1183-1187 (1934).
- Friend, W. L., Metzner, A. B. Turbulent heat transfer inside tubes and the analogy among heat, mass, and momentum transfer. AIChE J. 4, 393-402 (1958).
- Bejan, A. Constructal-theory network of conducting paths for cooling a heat generating volume. Int. J. Heat Mass Transfer. 40, 799-816 (1997).
- Bejan, A., Lorente, S. Constructal theory of generation of configuration in nature and engineering. J. Appl. Phys. 100, 041301(2006).
- Bejan, A., Lorente, S., Yilbas, B. S., Sahin, A. Z. Why solidification has an S-shaped history. Sci. Rep. 3, 1711(2013).
- Lake, R. A., Lewis, E. L. Salt rejection by sea ice during growth. J. Geophys. Res. 75, 583-597 (1970).
- Wettlaufer, J. S., Worster, M. G., Huppert, H. E. Natural convection during solidification of an alloy from above with application to the evolution of sea ice. J. Fluid Mech. 344, 291-316 (1997).
- Paige, R. A. Stalactite Growth beneath Sea Ice. Science. 167, 171-172 (1970).
- Dayton, P. K., Martin, S. Observations of ice stalactites in McMurdo Sound, Antarctica. J. Geophys. Res. 76, 1595-1599 (1971).
- Eide, L. I., Martin, S. The formation of brine drainage features in young sea ice. J. Glaciol. 14, 137-154 (1975).
- Martin, S. Ice stalactites: comparison of a laminar flow theory with experiment. J. Fluid Mech. 63, 51-79 (1974).
- Jeffs, K., Attenborough, D. Frozen Planet: Episode 5 'Winter'. , BBC. (2011).
- Fothergill, A., Berlowitz, V., Attenborough, D. Ch. Winter: Life closes down. in Frozen Planet: A World Beyond Imagination. , BBC books. (2011).
- Yun, X., et al. Ice formation in the subcooled brine environment. Int. J. Heat Mass Transfer. 95, 198-205 (2016).
- Weast, R. C. CRC Handbook of Chemistry and Physics. 64, 64 edn, CRC Press. 257-258 (1983).
- Bejan, A., Lage, J. L. The Prandtl Number Effect on the Transition in Natural Convection Along a Vertical Surface. J. Heat Transfer. 112, 787-790 (1990).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten