É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Geração de gelo e de Transferência de Calor e Massa Fenômenos de introdução de água para um banho frio de salmoura
Neste Artigo
Resumo
Aqui, nós apresentamos um protocolo para demonstrar a geração de gelo quando a água é introduzida para um banho frio de salmoura, tal como um refrigerante secundário, numa gama de temperaturas bem abaixo do ponto de congelação da água. Ele pode ser usado como um meio alternativo de produção de gelo para a indústria.
Resumo
Nós demonstramos um método para o estudo da transferência de calor e massa e os fenómenos de congelação em um ambiente de salmoura sub-arref ecido. A nossa experiência mostrou que, sob as condições adequadas, o gelo pode ser produzido quando a água é introduzida para um banho de salmoura fria. Para tornar a forma de gelo, para além de ter a mistura de água e salmoura, a taxa de transferência de calor deve ignorar a de transferência de massa. Quando a água é introduzida na forma de pequenas gotas à superfície da solução salina, o modo de calor e transferência de massa é por difusão. A flutuabilidade pára de água se misture com a água salgada por baixo, mas como o gelo cresce mais espessa, ela diminui a taxa de transferência de calor, fazendo com que o gelo mais difícil crescer como resultado. Quando a água é introduzida dentro da solução salina na forma de um fluxo, um número de factores são encontrados para influenciar a quantidade de gelo que se formam. temperatura salmoura e concentração, que são as forças motrizes de calor e transferência de massa, respectivamente, podem afetar a rati conversão água-geloO; mais baixas temperaturas do banho e concentrações de salmoura incentivar mais a formação de gelo. A reologia do fluxo, o que pode afectar directamente tanto o calor e os coeficientes de transferência de massa, é também um factor chave. Além disso, o fluxo muda a reologia da área de contacto do fluxo de fluido com a granel.
Introdução
Lamas de gelo são amplamente utilizados na indústria, e uma aplicação particularmente bem sucedida é a tecnologia de raspagem de gelo 1, 2. Em comparação com a espuma convencional e porco sólido, o porco gelo pode viajar através topologias complexas a uma grande distância devido ao efeito de lubrificação da fase líquida e a elevação do seu ponto de congelamento, como alguns dos cristais de gelo derreter 3, 4, 5 . Mesmo se o porco fica preso, pode-se simplesmente esperar que as suspensões de gelo a derreter e retomar o processo de limpeza mais tarde. Este método de limpeza de tubos é barato e fácil de usar.
A fracção de gelo desempenha um papel chave no desempenho do raspador de gelo. Para medir a fracção de gelo, uma pode utilizar um cafetière (prensa Francesa) para determinar se a pasta de gelo é suficientemente espessa 6,"> 7. Uma fração de gelo alta cafetière, normalmente 80%, é necessário aquando da realização de raspagem de gelo. Uma pesquisa recente na detecção fração de gelo on-line mostrou que ambas as ondas eletromagnéticas e ultra-som são adequados para o trabalho 8, 9, 10, 11.
O porco gelo é geralmente feito por um máquina de fazer gelo de superfície raspada a partir de uma solução de NaCl a 5% em peso (salmoura). É também a principal maneira de fazer suspensões de gelo na indústria. Este tipo de máquina de fazer gelo congela água ou salmoura em uma superfície metálica fria, tipicamente uma superfície de 316 aço suave e, em seguida, corta ciclicamente as partículas de gelo off. As interfaces líquido-metal são muito complexas e são afetados por uma ampla gama de fatores que são essenciais para fazer gelo 12. A interface entre o não-metálica e de água podem ser muito diferentes, e um exemplo especialmente interessante é caulinite. o Kaolinterface de água INITE é especial porque não existe uma estrutura favorável gelo adjacente à superfície do sólido, mas, em vez de uma camada de substrato de fluido anfotérico que encoraja os aglomerados ligados a hidrogénio do tipo ICE para formar no topo de 13, 14. Uma outra maneira de produzir o porco gelo requer o esmagamento dos blocos de gelo enquanto premade salmoura de elevada concentração são adicionados em simultâneo. Por este método, o sistema de refrigeração pode ser executado a uma temperatura de evaporação muito maior porque não depressor do ponto de congelação (DPF) é adicionada antes da formação do gelo; É, portanto, considerado mais eficiente devido à taxa de compressão reduzido e poder diminuído para um determinado serviço de arrefecimento 15, 16, 17.
Existem dois outros métodos de produção de gelo: a produção de gelo da água super e colocando refrigerante e água em contacto directo 18, 19. O método envolve supercooling perturbar a água super metaestável para gerar a nucleação do gelo e crescimento. O maior problema para este método é a formação de gelo não desejado que pode bloquear o sistema. O método de contato direto é considerado não adequado para raspagem de gelo porque nem refrigerante nem óleo de lubrificação são desejados no produto final gelo.
A formação de gelo requer calor e transferência de massa devido ao calor latente de fusão gerada no processo. Foi descoberto pela primeira vez por Osborn Reynolds em 1874 que o transporte de calor e massa em estufa estão fortemente acoplados e podem ser expressos em fórmulas matemáticas semelhantes 20. Este trabalho formou o papel pioneiro sobre o assunto do momento, calor e transferência de massa em fluidos e foi reeditado várias vezes 21, 22. Este assunto foi então estudado por umnúmero de outros, de ambas as abordagens analíticas e empíricas, por gases, líquidos e metal fundido 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33. Para além da transferência de calor e massa, o fluido precisa de locais de nucleação de gelo em que o crescimento dendrítica pode desenvolver. Uma visão moderna para o crescimento de cristais de gelo utiliza Lei Constructal, desenvolvido por Adrian Bejan, para explicar por que o gelo cresce deste modo 34, 35, 36.
A formação de gelo em salmoura é muito diferente do que em água pura, devido à existência de sal. Em primeiro lugar, sal muda a termodinâmica do fluido e deprime seu ponto de congelamento. Em segundo lugar, o sal não pode dissolver-se na matriz de gelo (excepto para hydrohalite, que só pode formar-se quando a temperatura atinge o ponto eutéctico), e é rejeitado para o fluido a granel quando o gelo começa a crescer. A rejeição de sal foi descoberto em ambos gelo do mar e gelo estudada no laboratório 37, 38. Uma vez que a salmoura de alta concentração é rejeitada a uma temperatura bem abaixo do ponto de congelação da água do mar, à medida que desce, gelo cresce na interface entre a solução salina que flui e o fluido em massa quiescente. Estas estalactites de gelo, também chamados brinicles, foram descobertos pela primeira vez em McMurdo Sound, Antarctica e foram estudados experimentalmente 39, 40, 41, 42. Em 2011, a BBC filmou a formação de brinicles em sua série planeta congelado"xref"> 43, 44.
No nosso laboratório, foi descoberto que invertendo os fluidos de fluidez e quiescentes quando a água é introduzida para um banho de salmoura fria, a água pode transformar-se em gelo sob as condições correctas 45. Verificou-se que o local onde é introduzida a água, o fluxo de reologia, temperatura e salmoura e concentração são todos os principais factores que influenciam a quantidade de gelo pode ser produzida. O objetivo geral deste estudo é investigar se uma máquina de gelo podem ser desenvolvidas através deste mecanismo para gerar pastas de gelo, considerando que a temperatura do evaporador elevada e a alta taxa de transferência de calor líquido-líquido pode aumentar a eficiência do uso de energia. Este artigo compartilha alguns aspectos fundamentais da experiência.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Cuidado: Existem dois produtos químicos venenosos, de metanol e de etileno-glicol, utilizadas nestas experiências. O metanol pode ser metabolizado no corpo humano para gerar formaldeído e, em seguida, com o ácido fórmico ou sal de formato. Estas substâncias são venenosas para o sistema nervoso central e podem mesmo causar a morte. Etileno glicol pode ser oxidado para se obter o ácido glicólico, o que pode, em seguida, se transformar em ácido oxálico. Isto pode causar falha renal e morte. Não beba estes produtos químicos. Consulte um médico imediatamente se ocorrer um acidente.
1. O Sistema de Arrefecimento
NOTA: É muito difícil manter a solução salina a -18 ° C ou então quando a temperatura ambiente é aproximadamente à temperatura ambiente. É importante que os tanques de armazenamento do glicol de etileno e água salgada são bem isolado e de uma dimensão razoável para evitar o excesso de consumo de electricidade e para garantir o desempenho ideal do sistema. Recomenda-se que o tamanho do tanque não exceda 30 L.
- Prepara-se o fluido de arrefecimento secundário
- Pour 1 L de etileno glicol para dentro do tanque de refrigeração secundário, do tanque A (base: 400 mm x 200 mm, altura: 350 mm). Adicionar aproximadamente 0,6-,65 L (600-650 g) de água para Tanque A.
- Repita o passo 1.1.1 várias vezes até que haja bastante líquido no tanque A (25 L).
- Agita-se o fluido, de modo que o fluido é homogéneo.
- Ligue as duas bombas no tanque A para o ajuste de capacidade total (2,500 L / h). Certifique-se de que todas as bolhas presas nos trocadores de calor e tubos são liberados.
- Desligue a bomba para observar se todas as bolhas são liberadas. Se não, repita o passo 1.1.4.
- Preparação da solução salina
NOTA: neste exemplo, 22% em peso de solução salina é preparado. Se forem necessários outros concentrações, a massa de sal adicionada deve também ser alterado em conformidade. Os valores de concentração e densidade de salmoura de referência pode ser encontrada na página D-257 da 64 ª Edição (1983) do the CRC Handbook of Chemistry and Physics 46.- Adicionar 4 kg de água numa proveta de 5 L de plástico.
- Medida 1 kg de sal NaCl em balança eletrônica e despeje este sal no copo com água.
- Agita-se a mistura até a solução estar clara (isto é, não há partículas de sal ou bolhas de água visíveis na solução).
- Tomar uma amostra, ~ 10 mL, da solução, utilizando uma seringa de 10 ml.
- Injectar o fluido para dentro do medidor de densidade de tubo em U.
- Verifique se há bolhas de ar no tubo. Se houver algum, injetar mais fluido para empurrá-los para fora.
- Pressione o botão "Quick Settings" e selecione "Densidade de temperatura." Digite 20 ° C e pressione "OK". O medidor de densidade vai agora medir a densidade do fluido a essa temperatura.
- Carregue em START e aguarde o resultado.
- Compare a leitura da densidade com 1164,00 kg / m 3.
- Adicione mais sal se a leitura está abaixo do COMPARAÇÃOdensidade n. Adicione a água em caso contrário.
- Repita os passos 1.2.3-1.2.10 até que a densidade do fluido está correta (1164.00 kg / m 3).
- Coloque esta solução para um recipiente maior, Recipiente A.
- Use as etapas 1.2.1-1.2.12 para fazer 35-40 L de salmoura e colocar Container A em um freezer a -40 ° C. Mantenha a salmoura lá por 48-72 h, até a sua temperatura atingir -19,18 ° C (ponto deste salmoura 22% em peso de congelamento).
2. Preparação do gelo para a injecção e da água de lavagem
- Prepare gelo para a água injetando
- Pour 1 L de água num recipiente de pequenas dimensões (200 x 200 x 50 mm).
- Repita o passo 2.1.1 com outro recipiente e coloque os dois recipientes no congelador a -40 ° C.
- Mantê-los no congelador durante 10 horas ou mais para assegurar que toda a água é congelada.
- Prepare shell de gelo da água de lavagem
- Encher um copo de 5 L com 5 L de água.
- Encher um copo de 2 L com 2 L de água.
- Coloque as duas taças para o freezer a -40 ° C, durante 8-10 h para que haja uma espessa shell de acondicionamento de gelo em torno da água descongelada.
- Utilizar um jacto de água de alta velocidade a uma velocidade de 3-5 m / s a partir da torneira de abrir um buraco de 3 cm de diâmetro na parte superior do reservatório de gelo.
- Escorra a água no interior do reservatório de gelo.
- Coloque as duas taças de volta no congelador.
- Se a massa do gelo shell não chegar a 3 kg e 1 kg para as duas taças, respectivamente, repita os passos 2.2.1-2.2.5, mas manter os copos no congelador já na etapa 2.2.3. As duas provetas agora deve ser capaz de conter 2 L e 1 L de água, respectivamente.
3. Água Introdução posição ea experiência de controle de Reologia
- Introduzir água na superfície da solução salina
- Decantar 2 L de salmoura fria 22% em peso de Container A nobalde de alumínio da máquina de sorvete e interruptor na unidade de refrigeração.
- Medir a temperatura da solução salina com um termómetro / termopar (ou K-tipo ou tipo T são adequados). Continue a experiência se a salmoura é de -15 ° C ou inferior.
- Encha a seringa de vidro de 100 ml com água da torneira à temperatura ambiente. Anexar um diâmetro interno de 2 mm, 1 mm de espessura, e um tubo-m de comprimento de silicone para a ponta da seringa.
- Colocar a seringa numa posição específica de modo a que existe uma cabeça entre a água na seringa e a saída do tubo de silicone. A pressão hidrostática vai apertar a água para fora do tubo.
- Submerge um certo comprimento do tubo de silicone, tipicamente de 70 cm, para a salmoura.
- Ajustar a posição relativa entre a seringa e a saída do tubo de modo que a pressão hidrostática é grande o suficiente para permitir que a água a sair da seringa. Se o tubo for bloqueado, aumentar a cabeça, elevando a seringa para uma posição vertical mais elevada, until a pressão hidrostática pode ultrapassar a tensão de corte dentro do tubo.
- Manter a saída do tubo a cerca de 1 cm ou menos acima da superfície da solução salina.
- Ajuste o comprimento do tubo submerso e a altura da seringa para controlar a saída da água deixar temperatura e taxa de fluxo, a fim de determinar a quantidade de gelo pode ser feito ou quanto mistura ocorre na superfície da solução salina. O fenómeno de congelação deve agora ser observada na superfície da solução salina. Consulte a Referência 45 para um sentido mais adicional.
- Introduzir água através da salmoura
- Repita os passos 3.1.1-3.1.6.
- Manter a saída do tubo no interior da salmoura, de preferência na parte inferior do recipiente.
- Ajuste o comprimento do tubo submerso e a altura de uma seringa.
- Ajustar o ângulo de saída do tubo para controlar a reologia do fluxo.
- Repita os passos 3.2.3-3.2.4 para encontrar a reologia fluxo melhor acoplados e taxa que pode produzir a maior parte do gelo fluir.
4. Produção de gelo, Colecção, e Mensuração
- fazer gelo
- Se houver bolhas nos tubos, ligar as duas bombas no interior do tanque A para liberar as bolhas de fora do sistema de circulação de glicol, e depois desligar as bombas.
- Ligue as três unidades de refrigeração e deixá-los correr para 10-16 h para arrefecer as soluções de etilenoglicol.
- Meça a solução de etileno glicol com um termômetro / termopar. A temperatura de glicol deve ser de cerca de -25 ° C.
- Medir a temperatura da salmoura na Categoria A para se certificar de que está em -19 ° C antes de prosseguir para a etapa 4.1.5.
- Encha o tanque de água salgada, Tanque B, com cerca de 30 L de salmoura de Container A e ligue as duas bombas no tanque A.
- Medir a temperatura do glicol em tanque A. Se for mais fria do que -19 ° C, desligar um ou mais unidades de arrefecimento para evitar a precipitação de partículas de gelo dos permutadores de calor no exterior in Tanque B. Se a temperatura é mais quente do que a temperatura de salmoura esperado, ligar todas as três unidades de refrigeração. Efectua-se a experiência a -17 ° C a -19 ° C.
- Coloque os dois blocos premade de gelo a partir do passo 2.1 para o isolamento 5-L taça, Container B, e despeje cerca de 3 L de água no copo.
- Medir a temperatura da água e mantê-lo a 2 ° C por agitação da mistura entre os experimentos se a temperatura subir.
- Encher a seringa de vidro com 100 ml de água a 2 ° C.
- Aplicar 5-10 mL de metanol até a janela de vidro do tanque B para parar a condensação e a formação de gelo.
- Injectar a água na salmoura, ajustando a posição relativa entre a seringa e a saída do tubo de modo que há uma pressão hidrostática constante e, portanto, uma taxa de fluxo constante. Cerca de 70 cm do tubo de silicone deve ser submerso na salmoura. Ajustar o ângulo de injecção a 0 °, de modo que a velocidade inicial da água para cima na direcção é 0 m / s.
NOTA: A seringa pode ser fixada ou de um suporte de mão. -Mão é mais apropriado quando a temperatura salmoura é mais frio, porque leva mais tempo para ajustar uma posição, e gelo podem bloquear o tubo. Mantenha a reologia fluxo consistente durante todo o experimento, garantindo um ângulo de vazão e injeção constante (0 °) e, mantendo a fronteira congelamento cerca de 3 cm acima da saída do tubo. Não deixe que o fluxo de entrar na região onde ele começa a virar turbulenta 47. Consulte a Referência 45 para um sentido mais adicional. - Recolhe-se o gelo tal como descrito nas etapas 4.2 e 4.3. Repita os passos 4.1.8 - 4.1.11 a diferentes temperaturas salmoura.
- Recolher o gelo produzido e estimar a quantidade de gelo é produzido (recolha seco)
- Coloque um recipiente (200 × 200 × 50 mm) na escala e zero a leitura premindo o botão "Ativar" botão.
- Use a peneira para colher o gelo e sacudia salmoura.
- Coloque esse gelo no recipiente. Medir a massa de gelo por meio da escala.
- Depois de o gelo é derretido, utilizar a seringa de 10 mL para dar uma amostra. Injectar a amostra de líquido para dentro do medidor de densidade.
- Execute os passos 1.2.6-1.2.9.
- Registre a leitura densidade.
- Calcula-se a massa de água líquida a partir da sua densidade (isto é, a massa de água convertida em gelo) com a seguinte fórmula:
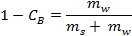
Onde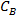 é a concentração de salmoura em peso e%
é a concentração de salmoura em peso e% 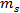 e
e 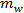 são as massas de sal e de água, respectivamente.
são as massas de sal e de água, respectivamente.
- Recolher o gelo produzido e estimar a quantidade de gelo é produzido (recolha molhada)
- Encha o copo 5-L com um shell de gelo (passo 2.2) e sala de temperatura da água da torneira. Coloque-o de volta para o congelador a -40 ° C.
- Decantar a água com o escudo de gelo a partir do 5-G numa proveta de 2-L proveta quando a sua temperatura é de 0 ° C. Encha o 5-L proveta. Mantenha as duas taças no congelador.
- Retire o gelo produzido nos passos 4.1.8 e 4.1.9 e despeje 200-500 mL de água a partir da proveta de 2 L para o gelo para lavá-lo. Não agite a peneira antes de aplicar a água de 0 ° C.
- Agitar o fluido na peneira.
- Repita os passos 4.2.2-4.2.7.
Access restricted. Please log in or start a trial to view this content.
Resultados
A Figura 1 compara os efeitos de água introduzido na superfície da solução salina a água injectada através da salmoura. No cenário "gelo-tampão", o gelo formado é sólida porque a água não se misturam muito com o fluido a granel. A diferença de temperatura e densidade entre os dois fluidos gera força de empuxo sobre a água e os impede de mistura. Ambos os fluidos são estáticas (por exemplo, a transferência de calor é muito maior do qu...
Access restricted. Please log in or start a trial to view this content.
Discussão
O processo de geração de gelo usando solução salina como um refrigerante secundário envolve a combinação de calor e transferência de massa. Se a transferência de calor é maior, então as formas de gelo antes que a água tem a chance de se misturar com o fluido a granel. Observou-se que, quando existe um movimento relativo entre a água introduzida e a salmoura grandes quantidades de repouso (isto é, injectando água dentro da solução salina), o fluxo ajuda a transferência de calor e encoraja a for...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Os autores não têm confirmações.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| DMA 4500 M | Anton Paar | 81546022 | Density Metre |
| GELATO Chef 2200 | magimix | 0036500504R13 | Ice Cream Maker |
| 280D | FREEZE MASTER | 241-1441 | Pipe Freezer |
| M17.5X2 | BLUE ICE MACHINES | GK924 | Slushy Puppy Machine |
| HH68K | OMEGA | 140045 | Thermometer |
| OHAUS | TS4KW | 1324 | Scale |
| ZFC321WA/BNI225 | ZANUSSI | 920672574-00 | Freezer |
| EIS Heater Matrix | Vauxhall | 214720041 | Heat Exchanger |
| 2500LPH | JBA | AP-2500 | Pump |
| Glass syringe | FORTUNA Optima | 100 mL | |
| OAT concentrated coolant | wilko | P30409014 | Ethylene Glycol |
| pure dried vacuum salt | INEOS Enterprise | 1433324 | NaCl Salt |
| Methylated Spirits | Barrettine | 1170 | Methanol |
Referências
- Cleaning and separation in conduits. UK patent. , GB2358229, WO0151224 (2001).
- Quarini, J. Ice-pigging to reduce and remove fouling and to achieve clean-in-place. Appl. Therm. Eng. 22, 747-753 (2002).
- Evans, T. S., Quarini, G. L., Shire, G. S. F. Investigation into the transportation and melting of thick ice slurries in pipes. Int. J. Refrig. 31, 145-151 (2008).
- Shire, G. S. F., Quarini, G. L., Rhys, T. D. L., Evans, T. S. The anomalous pressure drop behaviour of ice slurries flowing through constrictions. Int. J. Multiph. Flow. 34, 510-515 (2008).
- Shire, G. S. F., Quarini, G. L., Evans, T. S. Pressure drop of flowing ice slurries in industrial heat exchangers. Appl. Therm. Eng. 29, 1500-1506 (2009).
- Evans, T. S. Technical Aspects of Pipeline Pigging with Flowing Ice Slurries [dissertation]. , Department of Mechanical Engineering, University of Bristol. (2007).
- Shire, G. S. F. The behaviour of ice pigging slurries [dissertation]. , Department of Mechanical Engineering, University of Bristol. (2006).
- Hales, A., et al. Ice fraction measurement of ice slurries through electromagnetic attenuation. Int. J. Refrig. 47, 98-104 (2014).
- Hales, A., et al. The effect of salinity and temperature on electromagnetic wave attenuation in brine. Int. J. Refrig. 51, 161-168 (2015).
- Hales, A. Ice slurry diagnostics through electromagnetic wave attenuation and other techniques [dissertation]. , Department of Mechanical Engineering, University of Bristol. (2015).
- Lucas, E. J. K., Hales, A., McBryde, D., Yun, X., Quarini, G. L. Noninvasive Ultrasonic Monitoring of Ice Pigging in Pipes Containing Liquid Food Materials. J. Food Process. Eng. 40, e12306(2015).
- Carrasco, J., Hodgson, A., Michaelides, A. A molecular perspective of water at metal interfaces. Nat. Mater. 11, 667-674 (2012).
- Hu, X. L., Michaelides, A. Ice formation on kaolinite: Lattice match or amphoterism? Surf. Sci. 601, 5378-5381 (2007).
- Hu, X. L., Michaelides, A. The kaolinite (0 0 1) polar basal plane. Surf. Sci. 604, 111-117 (2010).
- Leiper, A. N., Ash, D. G., McBryde, D. J., Quarini, G. L. Improving the thermal efficiency of ice slurry production through comminution. Int. J. Refrig. 35, 1931-1939 (2012).
- Leiper, A. Carnot cycle optimisation of ice slurry production through comminution of bulk ice [dissertation]. , Department of Mechanical Engineering, University of Bristol. (2012).
- Leiper, A. N., Hammond, E. C., Ash, D. G., McBryde, D. J., Quarini, G. L. Energy conservation in ice slurry applications. Appl. Therm. Eng. 51, 1255-1262 (2013).
- Bédécarrats, J. -P., David, T., Castaing-Lasvignottes, J. Ice slurry production using supercooling phenomenon. Int. J. Refrig. 33, 196-204 (2010).
- Wijeysundera, N. E., Hawlader, M. N. A., Andy, C. W. B., Hossain, M. K. Ice-slurry production using direct contact heat transfer. Int. J. Refrig. 27, 511-519 (2004).
- Reynolds, O. On the extent and action of the heating surface of steam boilers. Proc. Lit. Philos. Soc. Manch. 14, 7-12 (1874).
- Reynolds, O. Papers on mechanical and physical subjects: reprinted from various transactions and journals. , Cambridge University Press. Vol. I, 1869-1882, Ch. 14. On the extent and action of the heating surface of steam boilers 81-85 (1900).
- Reynolds, O. Papers on mechanical and physical subjects. Int. J. Heat Mass Transfer. 12, 129-136 (1969).
- Prandtl, L. Eine Beziehung zwischen Wärmeaustausch und Strömungswiderstand der Flüssigkeiten (On the relation between heat exchange and stream resistance of fluid flow). Physik. Z. 11, 1072-1078 (1910).
- Prandtl, L. Bemerkung über den Wärmeübergang im Rohr (Note on heat transmission in pipes). Physik. Z. 29, 487-489 (1928).
- Taylor, G. I. Conditions at the surface of a hot body exposed to the wind. Rep. Memo. ACA. 272, (1916).
- Taylor, G. I. The Application of Osborne Reynolds' Theory of Heat Transfer to Flow through a Pipe. Proc. R. Soc. A. 129, 25-30 (1930).
- Kármán, T. v Proceedings of the Fourth International Congress for Applied Mechanics. , Cambridge, UK. 54-91 (1934).
- Kármán, T. v The analogy between fluid friction and heat transfer. Trans. Am. Soc. Mech. Eng. 61, 705-710 (1939).
- Martinelli, R. C. Heat transfer to molten metals. Trans. Am. Soc. Mech. Eng. 69, 947-959 (1947).
- Colburn, A. P. A method of correlating forced convection heat-transfer data and a comparison with fluid friction. Trans. Am. Inst. Chem. Eng. 29, 174-210 (1933).
- Colburn, A. P. A method of correlating forced convection heat-transfer data and a comparison with fluid friction. Int. J. Heat Mass Transfer. 7, 1359-1384 (1964).
- Chilton, T. H., Colburn, A. P. Mass Transfer (Absorption) Coefficients Prediction from Data on Heat Transfer and Fluid Friction. Ind. Eng. Chem. 26, 1183-1187 (1934).
- Friend, W. L., Metzner, A. B. Turbulent heat transfer inside tubes and the analogy among heat, mass, and momentum transfer. AIChE J. 4, 393-402 (1958).
- Bejan, A. Constructal-theory network of conducting paths for cooling a heat generating volume. Int. J. Heat Mass Transfer. 40, 799-816 (1997).
- Bejan, A., Lorente, S. Constructal theory of generation of configuration in nature and engineering. J. Appl. Phys. 100, 041301(2006).
- Bejan, A., Lorente, S., Yilbas, B. S., Sahin, A. Z. Why solidification has an S-shaped history. Sci. Rep. 3, 1711(2013).
- Lake, R. A., Lewis, E. L. Salt rejection by sea ice during growth. J. Geophys. Res. 75, 583-597 (1970).
- Wettlaufer, J. S., Worster, M. G., Huppert, H. E. Natural convection during solidification of an alloy from above with application to the evolution of sea ice. J. Fluid Mech. 344, 291-316 (1997).
- Paige, R. A. Stalactite Growth beneath Sea Ice. Science. 167, 171-172 (1970).
- Dayton, P. K., Martin, S. Observations of ice stalactites in McMurdo Sound, Antarctica. J. Geophys. Res. 76, 1595-1599 (1971).
- Eide, L. I., Martin, S. The formation of brine drainage features in young sea ice. J. Glaciol. 14, 137-154 (1975).
- Martin, S. Ice stalactites: comparison of a laminar flow theory with experiment. J. Fluid Mech. 63, 51-79 (1974).
- Jeffs, K., Attenborough, D. Frozen Planet: Episode 5 'Winter'. , BBC. (2011).
- Fothergill, A., Berlowitz, V., Attenborough, D. Ch. Winter: Life closes down. in Frozen Planet: A World Beyond Imagination. , BBC books. (2011).
- Yun, X., et al. Ice formation in the subcooled brine environment. Int. J. Heat Mass Transfer. 95, 198-205 (2016).
- Weast, R. C. CRC Handbook of Chemistry and Physics. 64, 64 edn, CRC Press. 257-258 (1983).
- Bejan, A., Lage, J. L. The Prandtl Number Effect on the Transition in Natural Convection Along a Vertical Surface. J. Heat Transfer. 112, 787-790 (1990).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados