Method Article
Wo schneiden Sie Angelegenheiten: Eine Dissektion und Analyse-Leitfaden für die räumliche Orientierung der Netzhaut Maus von okulären Sehenswürdigkeiten
In diesem Artikel
Zusammenfassung
Dieses Protokoll bietet einen umfassenden Präparation und Analyse-Leitfaden für die Verwendung von tief okuläre Sehenswürdigkeiten, s-Opsin Immunohistochemistry, Retistruct und benutzerdefinierten Code, präzise und zuverlässig isoliert Maus Netzhaut im anatomischen Raum zu orientieren.
Zusammenfassung
Präzise und zuverlässig identifizieren räumlichen Orientierung der isolierten Maus Netzhaut ist wichtig für viele Studien in den visuellen Neurowissenschaften, einschließlich der Analyse von Dichte und Größe Steigungen von retinalen Zelltypen, die Richtung Stimmung der Richtung-selektive Ganglienzellen, und die Prüfung der topographischen Degeneration Muster in einigen Netzhauterkrankungen. Allerdings gibt es viele verschiedene augenfällige Dissektion-Methoden in der Literatur beschrieben, die verwendet werden, zu identifizieren und kennzeichnen retinalen Orientierung in der Netzhaut Maus. Während die Methode der Ausrichtung verwendet in solchen Studien oft übersehen wird, kann keine Berichterstattung wie Netzhaut Ausrichtung bestimmt ist Abweichungen in der Literatur und Verwirrung verursachen beim Versuch, Daten zwischen den Studien zu vergleichen. Oberflächliche okuläre Sehenswürdigkeiten wie Hornhaut Verbrennungen werden häufig verwendet, aber haben vor kurzem gezeigt, dass weniger zuverlässig als tiefer Sehenswürdigkeiten wie die Rectus Muskeln, der Aderhaut Fissur oder der s-Opsin-Gradient. Hier bieten wir einen umfassenden Leitfaden für die Verwendung von tief okuläre Sehenswürdigkeiten genau untersuchen und dokumentieren die räumliche Orientierung der Netzhaut eine isolierte Maus. Wir haben auch verglichen die Wirksamkeit von zwei s-Opsin-Antikörpern und enthalten ein Protokoll für s-Opsin Immunohistochemistry. Da Orientierung der Netzhaut nach der s-Opsin-Gradient retinalen Rekonstruktion mit Retistruct Software und Rotation mit benutzerdefiniertem Code erforderlich ist, haben wir die wichtigen Schritte erforderlich, um beide Programme verwenden vorgestellt. Insgesamt ist das Ziel dieses Protokolls einen zuverlässigen und wiederholbaren Satz von Methoden für die präzise Ausrichtung der Netzhaut zu liefern, die an die experimentelle Protokolle anpassbar ist. Ein übergeordnetes Ziel dieser Arbeit ist es, retinale Ausrichtung Methoden für zukünftige Studien zu standardisieren.
Einleitung
Ein wichtiger und manchmal übersehener Aspekt der Netzhaut Neurowissenschaften ist die korrekte Ausrichtung und Analyse der isolierten ganze-Mount Netzhaut, sei es die Ausrichtung der Netzhaut in einer Elektrophysiologie Aufnahme Kammer oder auf einer histologischen Folie. Dies ist besonders wichtig für Studien mit der Maus Netzhaut, die derzeit das am weitesten verbreitete Modell für Untersuchungen des Säugetier-visuellen Systems. Die jüngsten Entdeckungen zeigen, dass die Maus Netzhaut nicht räumlich einheitlich ist sondern Dichte und Größe Gradienten der Netzhaut funktionell unterschiedliche Zelltypen, wie Ganglienzellen Melanopsin, transiente OFF-Alpha Ganglienzellen und Kegel Opsins1,2 hat ,3,4,5. Infolgedessen die Methode zur Ermittlung die Ausrichtung der Netzhaut beeinträchtigen die experimentellen Ergebnisse mit Zelle Typ oder Opsin Distributionen2,3,6, Richtung der Richtung-selektiven tuning Ganglion Zellen7,8,9und topografische Muster von Netzhautdegeneration10,11,12,13,14 . In der Tat kann nicht Berichterstattung wie Netzhaut Orientierung gemeldet wird Abweichungen in der Literatur und Verwirrung verursachen beim Versuch, Daten zwischen den Studien zu vergleichen. Es ist daher wichtig, dass Forscher berichten die Methode für die Ausrichtung der Netzhaut zu identifizieren, so dass die Ergebnisse solcher Studien genau interpretiert werden können.
Netzhaut Orientierung wird häufig durch scoring die dorsale, ventrale, nasale oder zeitliche Hornhaut vor dem Okular Enukleation1,3,12,15,16,17 identifiziert ,18,19 oder der Aderhaut Rissbildung durch Schneiden oder färben tief anatomische Auge Sehenswürdigkeiten wie die extraokularen Muskeln6,7,20,21, oder die s-Opsin gradient2,3. Rectus Muskeln können verwendet werden, um die dorsale, ventrale, Nasal und temporal Netzhaut indem man einem tief entspannenden Schnitt, der die Anlage die entweder halbiert überlegene Rectus, minderwertige Rectus, mediale Rectus oder seitlichen Rectus Muskeln, bzw. zu identifizieren. Jedoch ist für die meisten Experimente mit Rectus Muskeln ausreichend für die Orientierung der Netzhaut22. Die Aderhaut Fissur, die ein Überrest der Augenentwicklung ist, kann als eine schwache horizontale Linie auf der Rückseite des Auges betrachtet. Beiden Enden dieser Linie endet an der Nasal oder der zeitlichen Pole der Erde23. Zu guter Letzt s-Opsin Ausdruck ist asymmetrisch verteilt an der ventralen Netzhaut in Mäusen und s-Opsin Antikörper können verwendet werden, um die ventralen Netzhaut in immunhistochemischen Experimente1zeigen.
Neuere Arbeiten von Stabio, Et al. 22 gezeigt, dass oberflächliche okuläre Wahrzeichen wie Hornhaut Verbrennungen eine weniger zuverlässige Methode sind für die Orientierung der Netzhaut im anatomischen Raum, sehr wahrscheinlich durch menschliches Versagen und Variabilität bei der Herstellung der Hornhaut brennen bei der Verwendung der zeitlichen und medialen Augenwinkel als Referenzpunkte. Im Gegensatz dazu haben tiefe Sehenswürdigkeiten wie überlegener Rectus Muskeln, choroid Riss und dem s-Opsin-Gefälle erwiesen zuverlässig und präzise Wahrzeichen für die Orientierung der Netzhaut-22. Allerdings erfordert die Ermittlung von diesen anatomischen Landmarken einzigartige Dissektion Schritte, die nicht in der Literatur ausführlich beschrieben werden. Ziel dieses Protokolls ist es daher, eine umfassende Anleitung, wie die überlegene Rectus Muskeln, choroid Fissur und s-Opsin Farbverlauf verwenden, um die räumliche Orientierung der Netzhaut Maus genau zu identifizieren können. Darüber hinaus haben wir einen Vergleich der Wirksamkeit von zwei s-Opsin-Antikörper, sowie ein Protokoll für s-Opsin Immunohistochemistry aufgenommen.
Eine weitere Herausforderung Studien unter Berufung auf genaue Ausrichtung der Netzhaut ist die große Linderung Kürzungen erforderlich, um Wholemount Netzhaut auf einer Aufnahme Kammer, Schale oder Folie zu glätten. Dies kann führen, Herausforderungen für die Analyse dessen, was natürlich eine dreidimensionale Struktur ist, wenn es als eine flache zweidimensionale Struktur abgebildet wird. Ein Programm namens Retistruct24 lässt sich eine flache Wholemount Netzhaut seiner dreidimensionalen Struktur zurück, bevor die von ihm gesammelten Daten analysiert werden. So widmet ein Abschnitt dieses Protokolls Hervorhebung der Schritte, die notwendig sind für die Verwendung der Retistruct-Software s-Opsin Immunostained Maus Netzhaut zu rekonstruieren. Wir haben ebenfalls einen Abschnitt des Protokolls für die Verwendung unserer benutzerdefinierte MATLAB-Skript, das, um präzise drehen und orient Maus Netzhaut mit s-Opsin befleckt entwickelt wurde.
Protokoll
Alle hier beschriebene Methoden wurden von den institutionellen Animal Care und Nutzung Committee (IACUC) von der University of Akron genehmigt.
1. unter Verwendung überlegener Rectus Muskeln Wahrzeichen, retinale Orientierung zu identifizieren
Hinweis: Die überlegene Rectus Muskel ist ein Wahrzeichen für die dorsale Netzhaut (Tabelle 1). Wenn das Experiment nicht die Kennzeichnung der dorsalen Netzhaut erfordert, überspringen Sie Schritt 1 und Schritt 2 weiter.
- Folgen Sie Ihre zugelassenen institutionellen Animal Care und Use Committee Protokoll für Maus Euthanasie.
- Um die allgemeine Ausrichtung des Globus zu identifizieren, stellen Sie eine Brennen auf der dorsalen Hornhaut direkt zwischen den nasalen und temporalen Augenwinkel nahe der Hornhaut-Sklera Grenze unmittelbar nach Euthanasie (Abb. 1A) markieren. Machen Sie den Brennvorgang markieren, indem Sie einen Cautery Pen für zehn Sekunden Aufheizen und dann berührt die Spitze des Stiftes an der dorsalen Hornhaut für weniger als eine Sekunde.
Hinweis: Holding, die der Cautery Pen an der Hornhaut für den Globus zu durchstechen zu lange hervorrufen würde.
Hinweis: Während einige Cautery Pens Licht emittieren, strahlt der Cautery Pen aufgeführt in der Tabelle der Materialien kein Licht Wenn Sie erhitzt, so dass es eine sichere Option für dunkeladaptierten Experimente, kein. - Verwenden Sie für Enukleation gebogenen Pinzette, um sanft das Auge aus seiner Halterung schieben und greifen den Globus von unterhalb. Schneiden Sie nicht den Sehnerv um den Globus zu entfernen; Stattdessen heben Sie langsam den Globus aus seiner Halterung beim gleichzeitig bewegen sanft von links nach rechts bis die Kugel aus der Steckdose freigegeben wird.
Hinweis: Diese Bewegung ermöglicht die Rectus Muskeln zu bleiben mit der ganzen Welt verbunden, wenn die Kugel schließlich vollständig aus der Steckdose gezogen ist. Der Sehnerv wird auch oft an den Globus bleiben. - Den Globus mit den beigefügten Rectus Muskeln in einer Petrischale mit Dissektion Medium zu übertragen. Achten Sie darauf, welches Auge das linke Auge und das rechte Auge ist nachzuverfolgen.
Hinweis: Der Sezierer sollten eine entsprechende Dissektion Medium verwenden, die mit ihren experimentellen Protokoll richtet. - Im Rahmen der Dissektion, visuell suchen die dorsale Hornhaut brennen und identifizieren die überlegene Rectus Muskeln mit verbunden ist (Abb. 1A).
- Mit einer Schere Dissektion oder 20 G (0,9 x 25 mm) Nadel (siehe Tabelle der Materialien), Punktion die Hornhaut bei der Burn-Marke. Machen Sie einen tiefen Schnitt in den Globus auf den Sehnerv an den überlegenen Muskel bisect entlastet. Eine isolierte und rekonstruierte Netzhaut mit diesem Schnitt ist in den Figuren 1 b und 1 Cgezeigt.
- Fangen Sie an die Netzhaut zu isolieren, indem Sie mit zwei Sätzen von Zangen (siehe Tabelle der Materialien) sanft reißen das Loch mit der Punktion in Schritt 1.6 bis Teil der Netzhaut zu sehen ist.
Hinweis: Es ist wichtig, dass dies schonend zu kräftig reißen kann dazu führen, dass den Linderung Schnitt weiter reißen. - Verwenden Sie Zange um die Netzhaut von der Sklera auseinander zu necken, bis der Sklera vollständig entfernt wurde. Bis die Netzhaut vollständig isoliert ist entfernen Sie die Iris, Linse, Glaskörper und alle verbleibenden Strukturen mit Zange.
Hinweis: Das Protokoll kann hier angehalten werden. Wenn das Gewebe für s-Opsin Immunohistochemistry festgesetzt wird, fahren Sie mit Schritt 3.5.
2. mit Hilfe der Aderhaut Fissur Wahrzeichen, retinale Orientierung zu identifizieren
Hinweis: Die Aderhaut Spalt auf der Sklera auf der Rückseite des Auges vorhanden ist, und läuft vom zeitlichen Pol am nasalen Pol (Abbildungen 2 b und 2 C; Tabelle 1).
- Folgen Sie zugelassene institutionelle Animal Care und Use Committee Protokoll für Maus Euthanasie.
- Um die allgemeine Ausrichtung des Globus zu identifizieren, stellen Sie eine Brennen auf der dorsalen Hornhaut direkt zwischen den nasalen und temporalen Augenwinkel nahe der Hornhaut-Sklera Grenze unmittelbar nach Euthanasie (Abb. 2A) zu markieren. Machen Sie den Brennvorgang markieren, indem Sie einen Cautery Pen für zehn Sekunden Aufheizen und dann berührt die Spitze des Stiftes an der dorsalen Hornhaut für weniger als eine Sekunde.
Hinweis: Holding, die der Cautery Pen an der Hornhaut für den Globus zu durchstechen zu lange hervorrufen würde. - Enucleate das Auge und die ganzen Welt in einer Petrischale mit Dissektion Medium zu übertragen. Achten Sie darauf, welches Auge das linke Auge und das rechte Auge ist nachzuverfolgen.
Hinweis: Der Sezierer sollten eine entsprechende Dissektion Medium verwenden, die mit ihren experimentellen Protokoll richtet. - Visuell lokalisieren Sie und identifizieren Sie die Aderhaut Riss auf der Rückseite des Auges (Abbildung 2B, 2 C).
Hinweis: Die Aderhaut Fissur ist auch innerhalb der Augenmuschel unter Infrarot-Licht20sichtbar. - Ausrichten der Globus in der Petrischale, sodass der dorsale Brennen auf die überlegene Pole, liegt wie es wäre, wenn das Auge noch in der Maus.
Hinweis: Die Anwesenheit von dorsal brennen ermöglicht die Identifikation von den nasalen und temporalen Seite der Erde, als sei es eine Rechte oder linke Auge wurde dokumentiert: Wenn es ein rechtes Auge ist, werden die nasale choroide Riss auf der rechten Seite das Brennen und die Tempora l choroid Fissur werden auf der linken Seite der Verbrennung. Wenn es ein linkes Auge ist, die zeitliche choroide Fissur werden auf der rechten Seite der Verbrennung und die nasale choroide Fissur werden auf der linken Seite der Verbrennung.
Mit einer Schere Dissektion oder 20 G (0,9 x 25 mm) Nadel (siehe Tabelle der Materialien), machen eine Punktion in der ganzen Welt, wo die dorsale brennen befindet. - Machen Sie einen flachen Entlastung Schnitt in Richtung des Sehnervs die dorsale Hornhaut brennen befindet. Dieser Schnitt wird senkrecht zur Aderhaut Fissur, zur Identifizierung der dorsalen Netzhaut nach Isolierung (Abbildung 2D) ermöglicht werden.
- Die folgenden zwei tief befreiend Kürzungen gegenüber den Sehnerv: eins nach dem Futter der Klingen der Dissektion scheren sich mit der zeitlichen choroid Fissur-Linie auf der Rückseite des Auges, und eins nach dem Futter der Klingen der Dissektion Schere mit der nasalen Aderhaut Riss-Linie auf der Rückseite des Auges. Diese Kürzungen sind auf eine isolierte und rekonstruierte Netzhaut in Abbildung 2D und 2Edargestellt.
Hinweis: Alternativ ein tiefer Einschnitt in der zeitlichen choroid Fissur erfolgen kann und ein flacher Schnitt bei der nasalen choroid Fissur, machen die dorsale Hornhaut brennen unnötige schneiden erfolgen kann. Dies ermöglicht eine genaue Ausrichtung der Netzhaut mit weniger Linderung Schnitten. - Fangen Sie an die Netzhaut zu isolieren, indem Sie mit zwei Sätzen von Zangen (siehe Tabelle der Materialien) sanft reißen das Loch mit der Punktion in Schritten 2.7 und 2.8 bis Teil der Netzhaut zu sehen ist.
Hinweis: Es ist wichtig, dass dies schonend zu kräftig reißen kann dazu führen, dass die Linderung Cut(s) weiter reißen. - Verwenden Sie Zange um die Netzhaut von der Sklera auseinander zu necken, bis der Sklera vollständig entfernt wurde. Bis die Netzhaut vollständig isoliert ist entfernen Sie die Iris, Linse, Glaskörper und alle verbleibenden Strukturen mit Zange.
Hinweis: Das Protokoll kann hier angehalten werden. Wenn das Gewebe für s-Opsin Immunohistochemistry festgesetzt wird, fahren Sie mit Schritt 3.5.
3. Kennzeichnung der S-Opsin-Gradient in der Netzhaut Maus
Hinweis: Die s-Opsin fotopigment Ausdruck wird asymmetrisch an der ventralen Netzhaut1, so dass es einen ausgezeichnete Marker für die ventrale Hälfte der Netzhaut verteilt. Diese Methode ist nur sinnvoll für feste und Immunostained Gewebe (Tabelle 1). Die folgenden Schritte können auf Netzhaut angewendet werden, die mit einer der vorgenannten Methoden seziert worden.
- Folgen Sie zugelassene institutionelle Animal Care und Use Committee Protokoll für Maus Euthanasie.
- Unmittelbar nach der Euthanasie enucleate das Auge und die ganzen Welt in einer Petrischale mit Dissektion Medium zu platzieren. Achten Sie darauf, um nachzuverfolgen, welches Auge das linke Auge und das rechte Auge ist um Netzhaut Orientierung zu identifizieren, nachdem die Netzhaut zergliedert ist.
Hinweis: Der Sezierer sollten eine entsprechende Dissektion Medium verwenden, die mit ihren experimentellen Protokoll richtet. -
Fangen Sie an die Netzhaut zu isolieren, indem Sie mit zwei Sätzen von Zangen (Table of Materials) sanft reißen ein Loch in der Hornhaut bis Teil der Netzhaut zu sehen ist.
Hinweis: Es ist wichtig, dass dies schonend zu kräftig reißen kann dazu führen, dass die Netzhaut zu reißen. - Verwenden Sie Zange um die Netzhaut von der Sklera auseinander zu necken, bis der Sklera vollständig entfernt wurde. Bis die Netzhaut vollständig isoliert ist entfernen Sie die Iris, Linse, Glaskörper und alle verbleibenden Strukturen mit Zange.
Hinweis: Das Protokoll kann hier angehalten werden. Experimentieren mit der Netzhaut für eine ex Vivo , das Experiment vor Durchführung der folgenden Schritte durchführen. - Mit Dissektion Schere, machen Sie vier Linderung Schnitten in der Netzhaut, so dass es flach wird. Anbringen Sie die Netzhaut Ganglion Zelle-Seite oben auf Nitrozellulose-Membran (Table of Materials) durch leichtes Drücken jede Ecke der Netzhaut auf der Membran mit einer Pinzette.
Hinweis: Die Lage der Linderung Kürzungen kann beliebig sein, bei der Verwendung der s-Opsin-Gradient für Netzhaut Orientierung. - Mit Pinzette, Übertragung der montierten Netzhaut auf die erste Bohrung in einer 24-Well-Platte (Table of Materials) gefüllt mit 1 mL 4 % Paraformaldehyd (Table of Materials) zur Fixierung. Die 24-Well-Platte auf einem Orbitalschüttler bei Raumtemperatur (Table of Materials) und befestigen der Netzhaut genau 40 min.
Hinweis: Alle folgenden Schritte waschen und Inkubation sollte mit der 24-Well-Platte auf einem Orbitalschüttler abgeschlossen sein. - Waschen Sie die Netzhaut für 15 min bei Raumtemperatur durch Übertragung auf die zweite gut gefüllt mit 1 mL 0,1 M PBS. Wiederholen Sie diesen Schritt zweimal von der Netzhaut auf 0,1 M PBS gefüllten dritten und vierten Brunnen nacheinander übertragen.
- Transfer der montierten Netzhaut zum fünften gut mit 1 mL Lösung (1,7 % Triton x-100 und 5,2 % Esel normalen Serum in 0,1 M PBS; siehe Tabelle der Materialien) zu blockieren und über Nacht bei 4 ° c inkubieren
- Fügen Sie die Kaninchen Anti-s-Opsin Primärantikörper (siehe Tabelle der Materialien), die blockierende Lösung mit einer Konzentration von 1: 500 und drei Tage bei 4 ° c inkubieren
- Waschen Sie die überschüssige Primärantikörper aus der Netzhaut sechsmal indem man sie nacheinander in sechs Brunnen gefüllt mit 1 mL 0,1 M PBS für 10 Minuten bei Raumtemperatur.
- Die Netzhaut in einem Brunnen mit frischem blockierende Lösung (1,7 % Triton x-100 und 5,2 % Esel normalen Serum in 0,1 M PBS) und Esel-Anti-Kaninchen-Alexa-594 Sekundärantikörper (siehe Tabelle der Materialien). Inkubieren Sie die Netzhaut mit den sekundären Antikörper über Nacht bei 4 ° c
- Waschen Sie die überschüssige Sekundärantikörper von der Netzhaut sechsmal, indem man sie nacheinander in sechs Brunnen gefüllt mit 1 mL frisch 0,1 M PBS für 10 min bei Raumtemperatur.
- Mit Pinzette, die angebrachte Netzhaut auf einer Petrischale mit 0,1 M PBS übertragen. Freisetzung der Netzhaut aus Nitrozellulose-Membran durch sanft die Spitzen der Zange zwischen der Netzhaut und die Membran einsetzen, bis die Netzhaut nicht mehr angebracht ist.
- Montieren Sie die Netzhaut durch drängen es vorsichtig mit einer Pinzette bis die Netzhaut auf das Glas klebt auf einen Glas-Objektträger zu und entfernen Sie die Folie aus der Petrischale.
- Decken Sie die Netzhaut auf der Folie mit Aquamount und decken Sie es mit einem #1.5 deckgläschen. Legen Sie die Folie in einem einschubfachs (siehe Tabelle der Materialien) und lassen Sie es bei Raumtemperatur für eine Stunde sitzen.
- Rückkehr die Folie zum Kühlschrank und Shop in einem einschubfachs (siehe Tabelle der Materialien) bei 4 ° C bei Nichtgebrauch. Nachdem die Folie vorhanden für 24 Stunden aktiviert ist, verwenden Sie Nagellack versiegeln die Seiten der Folie um Austrocknung zu verhindern.
Hinweis: Das Protokoll kann hier angehalten werden.
4. mit rekonstruiert Netzhaut Immunostained mit S-Opsin, retinale Orientierung zu identifizieren
- Die s-Opsin Steigung mit einem confocal Mikroskop oder ein Epifluorescent Mikroskop mit einer Kamera-Anlage zu visualisieren (siehe Tabelle der Materialien) und Bild die Netzhaut, so dass die gesamte Netzhaut sichtbar in einem Bild (Zahlen 1 b, 2D, 3A, und 3D). Dies kann von der Netzhaut in Abschnitten bei kleiner Vergrößerung imaging und dann die Bilder zusammenfügen.
- Die Netzhaut zu nennen, so dass sie identifizierbar sind. Z. B. name die ersten Retina zu rekonstruieren "Retina1".
- Downloaden und Installieren von ImageJ am https://imagej.nih.gov/ij/download.html.
- Erstellen Sie einen einzelnen Ordner für jede Netzhaut, die muss rekonstruiert werden, aber die Ordner leer lassen. Beispielsweise erstellen Sie einen Ordner mit dem Titel "Retina1". Alle Dateien, die benötigt, um diese Netzhaut rekonstruieren werden in diesem Ordner in den nachfolgenden Schritten gelegt.
Hinweis: Die einzigen Dateien, die diese Ordner enthalten sollte sind die Dateien, die durch Retistruct analysiert werden. Alle Dateien außer den unten aufgeführten stellen die Netzhaut nicht von der Retistruct-Software geöffnet werden. - Öffnen Sie das Bild von der Netzhaut in ImageJ wählen Sie Datei → öffnen und wählen Sie dann "Retina1".
- Ohne Änderungen auf das Bild, speichern Sie es als "Bild.png" in den Ordner mit dem Titel "Retina 1" wählen Sie Datei → speichern unter → PNG.
Hinweis: Die Datei muss "Bild.png" in Reihenfolge für die Retistruct-Software, die Datei als eine Netzhaut für den Wiederaufbau zu erkennen benannt werden. - Verwenden Sie das segmentierte Linien-Werkzeug, um die Kanten der Netzhaut zu skizzieren. Klicken Sie auf zwei benachbarten Spots an der Grenze der Netzhaut, wird segmentierte Linien-Werkzeug im wesentlichen "die Punkte zwischen den zwei benachbarten Spots, erstellen eine Gliederung zu verbinden". Wiederholen Sie, bis die gesamte Netzhaut umrissen worden. Speichern der Netzhaut Gliederung als "outline.roi" in den Ordner mit dem Titel "Retina1" durch die Auswahl von Analyze hinzufügen → Werkzeuge → ROI Manager → [t] → mehr → speichern.
Hinweis: Der Rand der Netzhaut erkennbar dem s-Opsin Färbung übergeht in den Hintergrund. - Verwenden Sie das segmentierte Linien-Werkzeug wie in Schritt 4.7 angewiesen, um die Grenze von der Papille zu skizzieren. Speichern der Papille Gliederung als "od.roi" in den Ordner mit dem Titel "Retina1" durch die Auswahl von Analyze hinzufügen → Werkzeuge → ROI Manager → [t] → mehr → speichern.
Hinweis: Die Papille wird als das kleine Loch in der Mitte der Netzhaut identifiziert und variieren basierend auf die Qualität der Dissektion.
Hinweis: Alle Dateien benötigt für den Wiederaufbau der Retistruct ("Bild.png", "outline.roi" und "od.roi") sollten nun den Ordner "Retina1" gespeichert werden. - Um herunterladen, installieren und öffnen Sie das Retistruct-Programm, folgen Sie den Anweisungen in der Retistruct Bedienungsanleitung finden im Abschnitt ergänzende Materialien Sterratt, Et Al. beschrieben 24
- Sobald die Retistruct Fenster erschienen ist, klicken Sie auf das Symbol "Öffnen" oben links im Fenster und wählen Sie Verzeichnisordner aus dem "Retina1".
- Ein Bildfenster öffnet sich darauf hinweist, dass keine Maßstabsleiste vorhanden ist. Klicken Sie auf "Schließen" und ein Bild von der Netzhaut erscheint im Feld. Visualisieren Sie den Umriss der Netzhaut durch Klicken auf die Schaltfläche "Eigenschaften" in der oberen rechts vom Fenster und Änderung Umrissfarbe zu einer sichtbaren Farbe (Abb. 5A).
- WICHTIG: Geben Sie an, ob die Netzhaut aus einer rechten Auge oder linkes Auge in das Panel auf der linken Seite (Abb. 5A).
- Klicken Sie auf der linken Seite auf "Tear hinzufügen" und geben Sie an, wo ein Riss oder Schnitt in der Netzhaut ist, indem Sie auf die drei Scheitelpunkte des Risses (Abb. 5A). Dadurch wird Linien erstellt, die die drei Scheitelpunkte des Schnittes zu verbinden. Wiederholen Sie für alle Kürzungen in der Netzhaut.
- Geben Sie der dorsalen Netzhaut durch einen Klick auf einen beliebigen Punkt der Netzhaut Gliederung. Ein Großbuchstabe "D" erscheint zu diesem Zeitpunkt auf dem Umriss (Abb. 5B).
Hinweis: Die dorsale Netzhaut werden die dunklere Hälfte der Retina, gegenüber der s-Opsin-Gradient. Kennzeichnung der dorsalen Netzhaut in Retistruct ist jedoch keine zuverlässige Methode zur Identifizierung der dorsalen Hälfte der Netzhaut, so dass die Kennzeichnung von "dorsal" in diesem Schritt beliebig sein kann. - Zu rekonstruieren, die die Netzhaut durch Anklicken des Buttons "Rekonstruieren Retina" oben auf dem Bildschirm (Abb. 5B Links). Eine polare Handlung der rekonstruierten Netzhaut erscheint mit den Kürzungen in der gleichen Farbe wie die Gliederung (Abbildung 5C) sichtbar.
- Klicken Sie auf die Schaltfläche "Speichern" auf der rechten Seite des Bildschirms, so dass die rekonstruierten Netzhaut und alle damit verbundenen Daten im "Retina1" Ordnerverzeichnis (Abbildung 5D) gespeichert ist.
- Speichern Sie die rekonstruierte Netzhaut durch Anklicken der Schaltfläche "PDF" im rechten Fenster (Abbildung 5D). Eine Kiste erscheint und fordert für Größenangaben. Die Standardgröße ist akzeptabel für die folgenden Schritte. Diese Aktion wird die rekonstruierte Netzhaut als "image.polar.pdf" im Verzeichnis "Retina1" Ordner speichern.
- "Image.polar.pdf" in ein Malprogramm (oder anderen Bildbearbeitungsprogramm) öffnen und verwenden das "Füllwerkzeug" (oder ähnlich), den Hintergrund der rekonstruierten Netzhaut auf schwarz zu ändern. Speichern Sie die rekonstruierte Netzhaut als eine TIF-Datei, z. B. "Retina1_reconstructed.tif" im Verzeichnis "Retina1" Ordner.
Hinweis: Das Protokoll kann hier angehalten werden. - Download der MATLAB-Code für das Drehen der Netzhaut, genannt "Retina_Rotator.m" (siehe ergänzende Materialien). Legen Sie die Codedatei in einem eigenen Ordner mit keine anderen Dateien im Ordner "".
- Öffnen Sie MATLAB, Version 2007 b oder höher. Doppelklick auf die Codedatei in MATLAB öffnen. Geben Sie im Befehlsfenster "Retina_Rotator" und drücken Sie dann die EINGABETASTE. Es erscheint ein Suchfenster.
Hinweis: Der Code ist spezifisch für .tif-Dateien. Wenn die Datei gedreht werden nicht im richtigen Format ist, wird der Code die Netzhaut nicht richtig drehen. Finden Sie unter Schritte 4.17 und 4.18. zum Speichern der rekonstruierten Netzhaut im richtigen Format. - Öffnen Sie die Datei gedreht werden. Wählen Sie beispielsweise "Retina1_reconstructed.tif". Der Code wird dann die rekonstruierte Netzhaut analysieren und speichert automatisch die gedrehte Netzhaut als "Retina1_reconstructed_rotated.tif" in den Ordner, wo sich die Originaldatei befindet.
- Nachdem der Code Analyse der Netzhaut hat, erscheint ein Fenster auch mit Bildern der Netzhaut vor und nach der Drehung zum Vergleich (Zahlen 3 b und 3 C; 3E Zahlen und 3F).
Hinweis: Dieser Code dreht die rekonstruierte Netzhaut, so dass die ventrale (hellste) Hälfte auf der Unterseite ist und die dorsale (dunkelsten) Hälfte auf der Oberseite ist, so präzise ausrichten die Netzhaut nach der s-Opsin Steigung1. Wenn die Netzhaut von einem richtigen Auge ist ob linkes Auge dokumentiert worden ist, kann die Lage der nasalen und temporalen Pole auch von dieser Methode der Ausrichtung (Abbildung 3) extrapoliert werden.
Ergebnisse
Ein einziger Linderung Schnitt, der die überlegene Rectus Muskel genau und zuverlässig halbiert identifiziert die dorsale Netzhaut (Abbildung 1). Die Aderhaut Spalt identifiziert genau und zuverlässig die nasale und Temporale Retina mit Tiefe Linderung Einschnitte entlang der zeitliche und nasale choroid Fissur (Abbildung 2). In diesem Beispiel worden ein Linderung Schnitt auch in der dorsalen Netzhaut erzielt um die dorsale/ventrale Achse der Netzhaut (Abbildung 2D, vertikale Pfeil) zu erkennen. Die Schritte dieser Prozesse werden zum Zweck der Replikation durch zukünftige Dissectors gezeigt. Eine Kombination aus s-Opsin Immunohistochemistry (Abbildung 3A und 3D), Rekonstruktion mit Retistruct Software (3 b, 3E) und genaue Drehung mit einem benutzerdefinierten MATLAB-Code (3 C, 3F) ermöglicht die Kennung der ventralen und dorsalen Hälften der Netzhaut sowie die nasalen und temporalen Pole wenn es bekannt ist, ob die Netzhaut von einem rechten oder linken Auge (Abbildung 3 ist). Wir haben auch zwei häufig verwendete s-Opsin Primärantikörper für Effizienz in der Kennzeichnung s-Opsin Kegel (Abbildung 4A-D) verglichen: beide die Ziege Anti-s-Opsin Primärantikörper und die Kaninchen Anti-s-Opsin Primärantikörper effektiv zu beschriften s-Opsin Kegel (Abbildung 4E) in der gleichen Maus.
Linderung Kürzungen auf s-Opsin Immunostained rekonstruiert Netzhaut identifiziert wurden und ihre Standorte wurden im Vergleich zu der Orientierung durch die s-Opsin Steigung bestimmt. Mit unseren kundenspezifischen MATLAB-code (siehe Zusatzmaterialien), Netzhaut waren genau so gedreht, dass die höchste Konzentration von s-Opsin Färbung setzt damit wahre ventral, liegt dorsal bei 90° (für überlegene Rectus), wahre Nasal bei 0° (für Nasal Choroid Fissur) und bei 180 ° (für zeitliche choroid Fissur) zeitliche wahr. Der Wert jedes einzelnen Linderung Schnittwinkel war bestimmt mit dem Winkel-Tool in ImageJ, nachdem die Netzhaut nach der s-Opsin-Gradient gedreht wurden. Ein durchschnittlichen Winkel wurde für jede Linderung Schnitt Art berechnet und der Mittelwert der einzelnen Linderung einschnittart wurde dann auf einem polaren Grundstück (Abbildung 6) aufgetragen. Im Durchschnitt überlegener Rectus Muskeln Schnitten identifiziert den dorsalen Pol auf 96,3 ± 4,3 ° (n = 11) (Abbildung 6). Die nasale choroide Fissur die nasale Pol bei 6,7 ± 5,8 ° und zeitliche choroide Fissur gekennzeichnet der temporalen Pole bei 172.0 ± 4,4 ° (n = 9; ( Abbildung 6).
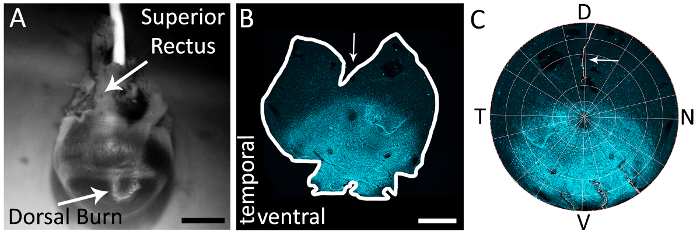
Abbildung 1: mit der überlegenen Rectus-Muskel, um die dorsale Netzhaut des rechten Auges genau zu identifizieren. (A) ein Beispiel für eine dorsale Hornhaut brennen nahe der Hornhaut skleralen Grenze mit einem Filzstift Cautery (weißer Pfeil) gemacht. Die überlegene Rectus Muskel ist auch in dieser Ansicht (weißer Pfeil) angezeigt. (B) ein Beispiel eines ganzen montierten Netzhaut mit einer Entlastung schneiden in der dorsalen Netzhaut durch halbiert überlegene Rectus Muskeln gemacht. Pfeil zeigt die tiefen Schnitt in der dorsalen Netzhaut durch halbiert überlegene Rectus Muskeln entlasten. Die Netzhaut ist gefärbt mit Primärantikörper Ziege Anti-s-Opsin (siehe Tabelle der Materialien) und Sekundärantikörper Esel anti-Ziege Alexa 594 (siehe Tabelle der Materialien; Erregung: 590 nm, Emission: 620 nm) (Cyan). Netzhaut wurde mit einem Epifluorescent-Mikroskop mit einem Texas Red Filter abgebildet (595 nm). (C) eine Netzhaut in Retistruct rekonstruiert und mit einem benutzerdefinierten MATLAB-Code gedreht (siehe Zusatzmaterialien) mit der überlegenen Rectus Muskel entlasten schneiden sichtbar (weißen Pfeils). D: dorsal, V: ventralen, T: temporal, N: Nasal. Skalieren von Balken = 1 mm. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2: Verwendung der Aderhaut Fissur, um die nasalen und temporalen Pole der Netzhaut des rechten Auges genau zu identifizieren. (A) ein Beispiel für eine dorsale Hornhaut brennen nahe der Hornhaut skleralen Grenze mit einem Filzstift Cautery gemacht. (B) der Aderhaut Spalt sichtbar auf der Rückseite des Auges auf der Sklera (weißer Pfeil). Die dorsale Hornhaut brennen ist auch in dieser Ansicht befindet sich etwa 90° aus der zeitlichen Aderhaut Spalt sichtbar. (C) der Aderhaut Spalt sichtbar auf der Rückseite des Auges auf die Lederhaut, von des Sehnervs bis zur Hornhaut skleralen Grenze Reisen. (D) eine Netzhaut gebeizt mit Ziege Anti-s-Opsin (siehe Tabelle der Materialien) und sekundäre Antikörper Esel anti-Ziege Alexa 594 (siehe Tabelle der Materialien; Erregung: 590 nm, Emission: 620 nm) (Cyan) mit choroid Fissur Schnitten (Horizontal Pfeile) und die dorsale Entlastung (vertikale Pfeil) schneiden. Netzhaut wurde mit einem Epifluorescent-Mikroskop mit einem Texas Red Filter abgebildet (595 nm). (E) die Netzhaut im Retistruct rekonstruiert und mit einem benutzerdefinierten MATLAB-Code (siehe Zusatzmaterialien) mit der dorsalen Linderung Schnitt und den nasalen und temporalen choroid Fissur Schnitten sichtbar (weisse Pfeile) gedreht. D: dorsal, V: ventralen, T: temporal, N: Nasal. Skalieren von Balken = 1 mm. Bitte klicken Sie hier für eine größere Version dieser Figur.
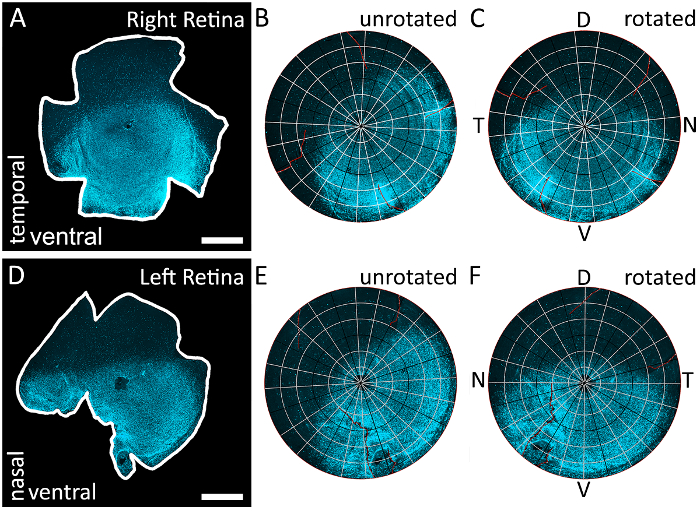
Abbildung 3: mit der s-Opsin-Farbverlauf, um alle vier Stangen der Netzhaut zu identifizieren. (A) ein Beispiel für eine Netzhaut seziert aus einer rechten Auge, die mit einem Epifluorescent-Mikroskop mit einem Texas Red Filter abgebildet und wurde Immunostained s-Opsin beschriften (595 nm). Die Kürzungen in diesem Netzhaut sind willkürlich, da die topographische Orientierung durch die s-Opsin-Verlauf bestimmt wird. (B) die Ergebnisse der Rekonstruktion der Netzhaut in A mit Retistruct. Beachten Sie, dass die s-Opsin-Gradienten nicht richtig ausgerichtet ist, weil die Netzhaut durch die benutzerdefinierte MATLAB-Code (siehe Zusatzmaterialien) nicht ausgeführt wurde. (C) die Ergebnisse der Drehung der Netzhaut in A mit den benutzerdefinierten Code. Die Netzhaut wurde gedreht, so dass die höchste Konzentration von s-Opsin Färbung an der Unterseite befindet und als die ventralen Retinal identifiziert. Weil die Netzhaut aus einer rechten Auge ist, der zeitliche Pol ist befindet sich 90° gegen den Uhrzeigersinn vom dorsalen Pol und der nasale Pol ist befindet sich 90° im Uhrzeigersinn von der dorsalen Pol. (D) ein Beispiel für eine Netzhaut seziert von einem linken Auge, die mit einem Texas Red Filter abgebildet und wurde Immunostained s-Opsin beschriften (595 nm). Die Kürzungen in diesem Netzhaut sind willkürlich, da die topographische Orientierung durch die s-Opsin-Verlauf bestimmt wird. (E) die Ergebnisse die Netzhaut in D mit Retistruct Digital zu rekonstruieren. Beachten Sie, dass die s-Opsin-Gradienten nicht richtig ausgerichtet ist, weil die Netzhaut nicht durch den benutzerdefinierten Code gedreht wurde. (F) die Ergebnisse der Drehung der Netzhaut in D mit den benutzerdefinierten Code. Die Netzhaut wurde gedreht, so dass die höchste Konzentration von s-Opsin Färbung an der Unterseite befindet und als die ventralen Retinal identifiziert. Da die Netzhaut von einem linken Auge ist, der nasale Pol ist befindet sich 90° gegen den Uhrzeigersinn vom dorsalen Pol und die Temporale Pole ist befindet sich 90° im Uhrzeigersinn von der dorsalen Pol. D: dorsal, V: ventralen, T: temporal, N: Nasal. Skalieren von Balken = 1 mm. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 4: Vergleich von zwei primäre s-Opsin-Antikörper in der Kennzeichnung s-Opsin Zapfen. (A) A Netzhaut mit der Ziege Anti-s-Opsin Primärantikörper befleckt (siehe Tabelle der Materialien). (B) die anderen Netzhaut der gleichen Maus gebeizt mit Kaninchen Anti-s-Opsin Primärantikörper (siehe Tabelle der Materialien). (C) eine repräsentative Region (0,1 x 0,1 mm2) von der Netzhaut mit der Ziege Anti-s-Opsin Primärantikörper befleckt. Aufnahme auf ein Epifluorescent Mikroskop bei 40 X Vergrößerung. (D) eine repräsentative Region (0,1 x 0,1 mm2) von der Netzhaut mit Kaninchen Anti-s-Opsin befleckt (siehe Tabelle der Materialien), eine Primärantikörper Alternative. Bild wurde auf ein Epifluorescent Mikroskop bei 40 X Vergrößerung aufgenommen. (E) beide Antikörper kennzeichnen die gleiche Anzahl von s-Kegel außensegmenten, da gibt es keinen signifikanten Unterschied in der Anzahl der Immunopositive s-Zapfen, die Ziege Anti-s-Opsin und Kaninchen Anti-s-Opsin jederzeit von den getesteten Retinal gefärbt sind Exzentrizitäten (n = 2; ANOVA mit post Hoc Bonferroni-Test; p > 0.05). Skalieren von Balken = 1 mm (A-B); 25 µm (C-D). Bitte klicken Sie hier für eine größere Version dieser Figur.
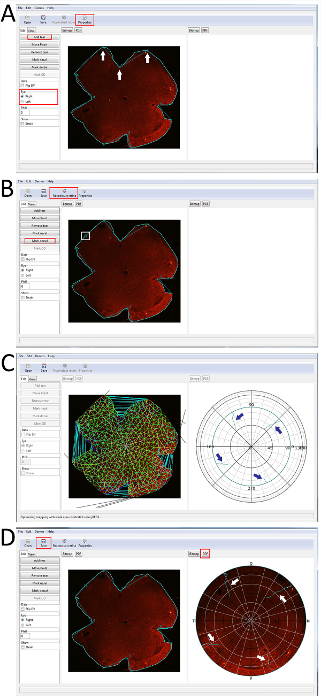
Abbildung 5: eine visuelle Anleitung zur Verwendung der Retistruct-Software, Netzhaut-Immunostained mit s-Opsin rekonstruieren. (A) A Netzhaut in Retistruct mit den Umriss sichtbar geöffnet und ein "reißen" hinzugefügt. Punkte von der "Träne" sind mit übereinander liegenden weißen Pfeile gekennzeichnet. Alle Kürzungen in diesem Netzhaut sind willkürlich, da kein besonderes Wahrzeichen verwendet wurde, um die Netzhaut Orientierung während der Präparation zu markieren. Wichtige Tasten sind rot hervorgehoben. (B) ein Netzhaut mit allen "Tears" hinzugefügt und der dorsalen Netzhaut identifizierte sich mit "D" am Rande der Netzhaut. Beachten Sie, dass die "Rekonstruieren Retina" Schaltfläche jetzt sichtbar ist. Wichtige Tasten sind rot hervorgehoben. (C) den Prozess des Wiederaufbaus der Netzhaut. Die polar Handlung der rekonstruierten Netzhaut erscheint auf der rechten Seite, zeigt, dass die Entlastung in Cyan (blaue Pfeile zur Klärung Schnitt Standorte überlagert) schneidet. (D) das endgültige Ergebnis der Netzhaut durch Retistruct laufen. Die ursprüngliche Wholemount Netzhaut bleibt auf der linken Seite und die rekonstruierte Netzhaut erscheint auf der rechten Seite. Die Linderung Kürzungen sind sichtbar in Cyan (weisse Pfeile zur Klärung Schnitt Standorte überlagert). Bitte klicken Sie hier für eine größere Version dieser Figur.
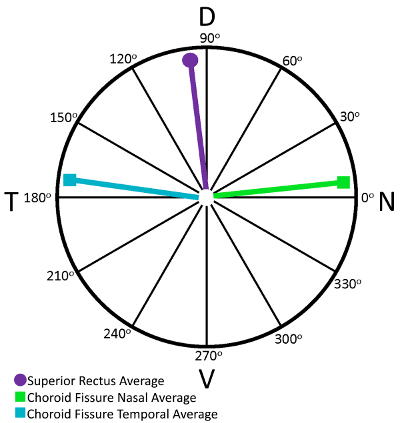
Abbildung 6: überlegener Rectus Muskeln und Aderhaut Fissur kann verwendet werden, um genau die Maus Netzhaut orientieren. Ein polar Plot der Winkel von entweder überlegener Rectus Muskeln entlasten Kürzungen oder Aderhaut Riss schneidet in der Netzhaut, die mit Retistruct rekonstruiert worden. Linderung Kürzungen auf s-Opsin Immunostained rekonstruiert Netzhaut identifiziert wurden und ihre Standorte wurden an die Stelle des s-Opsin Gradienten verglichen. Bei Verwendung des benutzerdefinierten MATLAB Codes genau die Netzhaut zu drehen, so dass die höchste Konzentration der s-Opsin Färbung ventral gelegen, wahre dorsal (90° für überlegene Rectus) ist true Nasal (0° für nasale choroid Fissur) und zeitliche (180° für zeitliche Aderhaut wahr Fissur) wurden für jede Netzhaut bestimmt. Der Wert jedes einzelnen entlasten Schnittwinkel ImageJ und einem durchschnittlichen Winkel festgestellt wurde war für jede Linderung Schnitt Art berechnet. Überlegener Rectus Muskeln Schnitten identifiziert den dorsalen Pol auf 96,3 ± 4,3 ° (n = 11). Die nasale choroide Fissur die nasale Pol bei 6,7 ± 5,8 ° und zeitliche choroide Fissur gekennzeichnet der temporalen Pole bei 172.0 ± 4,5 ° (n = 9). Bitte klicken Sie hier für eine größere Version dieser Figur.
| Tiefen Wahrzeichen | Hornhaut brennen Lage | Pol der Netzhaut identifizierte | Experimentelle Anwendung |
| Überlegener Rectus | Dorsal | Dorsal | Live- oder feste |
| Nasale Choroid Fissur | Dorsal | Nasal | Live- oder feste |
| Zeitliche Choroid Fissur | Dorsal | Zeitliche | Live- oder feste |
| S-Opsin Farbverlauf | Keine | Dorsal, Ventral, Nasal, zeitliche | Behoben |
Tabelle 1: Tiefe Wahrzeichen, die Pole der Netzhaut erkennen sie und ob sie für Live- oder festen Gewebe Anwendung verwendet werden können.
Diskussion
Keine umfassende, standardisierte Protokoll für die Bestimmung und Kennzeichnung der Ausrichtung der isolierten Maus Netzhaut im anatomischen Raum stattgefunden hat. Das Protokoll detailliert hier versucht, diese Lücke durch die Standardisierung und Detaillierung tief anatomische Landmarken Verwendung als Referenz verweist auf zuverlässig identifizieren retinalen Orientierung. Es hat sich gezeigt, dass die tief anatomischen Landmarken in diesem Protokoll eine genauere und zuverlässigere Methode für die Orientierung der Maus Netzhaut als oberflächliche Sehenswürdigkeiten wie Hornhaut Verbrennungen22bieten. So können Studien, die auf die Hornhaut Verbrennungen zur Netzhaut Orientierung verlassen haben größere Fehler in der Ausrichtung als Studien gehabt haben, die auf Sehenswürdigkeiten wie dem Rectus Muskeln und choroid Fissur verlassen haben. Diese Diskrepanz unterstreicht die Notwendigkeit und Bedeutung dieses standardisierten Protokolls in Bezug auf die Interpretation der Ergebnisse und Vergleiche zwischen den Studien, die von genau retinalen Orientierung abhängen. Insgesamt wird ein standardisiertes Protokoll eine gängige Methode zur Vision Forscher zu folgen, bieten wodurch das Vorhandensein einer konfundierenden Variablen in der Datenerfassung, die auftreten können mit der Verwendung von nicht-standardisierten Methoden zur Identifizierung von retinalen Orientierung.
Die hier vorgestellten Methoden sind leicht wiederholbar und für viele Arten von experimentelle Protokolle. In der Tat ist einer der größten Vorteile dieses Protokolls seine Anpassungsfähigkeit. Weil die Aderhaut Fissur, s-Opsin Ausdruck und Rectus Muskeln Sehenswürdigkeiten alle gefunden wurden, um retinale Orientierung22 zuverlässig zu identifizieren ist das Wahrzeichen, die am besten die Versuchsparameter wählbar, Datenerfassung (Tabelle zu optimieren 1). Darüber hinaus können Methoden der Dissektion kombiniert werden, um die Ausrichtung der Netzhaut weiter zu klären. Beispielsweise können choroid Fissur Schnitten mit s-Opsin Immunohistochemistry kombiniert werden, um alle vier Stangen der Netzhaut zu orientieren: nasale und Temporale Hemisphären durch die Aderhaut Fissur Kürzungen identifiziert werden können, und s-Opsin Immunohistochemistry erkennen Ventrale und dorsale Halbkugeln. Jedoch kann die Anpassungsfähigkeit dieses Protokolls durch den zeitkritischen Charakter der Physiologie Experimente abhängig gemacht werden. Da die Zeit, die es braucht, um ein Wahrzeichen zu identifizieren, machen eine Hornhaut brennen und ausführen einen Linderung Schnitt erhebliche Gewebe Tod in ex Vivo Experimenten führen könnten, möglicherweise einige dieser Methoden Dissektion suboptimal. Zum Glück, sobald ein Sezierer mit der Aderhaut Fissur oder überlegener Rectus Muskeln Dissektion Methode vertraut geworden ist, erkennen die tiefen Wahrzeichen und die Linderung von Kürzungen schnell werden Sie ein Teil der Dissektion Routine und nicht deutlich hinzufügen auf die Länge der Dissektion. Obwohl wir anerkennen, dass die hier beschriebenen Schritte auf Zeit extrem zeitkritische Experimente hinzufügen können, empfehlen wir die Verwendung der s-Opsin-Gradient für post-Hoc retinalen Ausrichtung wird die Lebensfähigkeit des Gewebes nicht mehr ein Problem (Abbildung 3 ). Färbung der Netzhaut für s-Opsin ist ein wirksames Mittel die Netzhaut zu orientieren, wie es alle vier Pole identifizieren kann: s-Opsin Färbung teilt die Netzhaut in dorsalen und ventralen Pole und ermöglicht eine Identifikation der nasalen und temporalen je nachdem, ob Pole die Netzhaut wird von einem rechten oder linken Auge (Abbildung 3). Daher glauben wir, dass dieses Protokoll liefert einen zuverlässigen und wiederholbaren Satz von Methoden für die präzise Ausrichtung der Netzhaut, die experimentellen Parameter erfüllen kann.
Als mit jedem veränderten retinalen Dissektion, die Gültigkeit der Dissektion Methode begrenzt durch die Genauigkeit der Sezierer und die Qualität des Gewebes, die isoliert wurde. Wenn jedes Gewebe verloren bei Dissektion oder die Netzhaut ist auch für genaue Rekonstruktion verstümmelt, werden Retistruct und das MATLAB-Programm nicht in der Lage, zuverlässig zu rekonstruieren oder die Netzhaut zu orientieren. Es ist daher wichtig, die Dissektion Methode üben, bevor zum Sammeln von Daten mittels Experimenten. Während die Arten von Dissektionen hier sind nicht schwer erklärt, müssen sie geübt werden, um die Wiederholbarkeit der Identifizierung von retinalen Orientierung ein besonderes Wahrzeichen zu gewährleisten. Darüber hinaus ist es wichtig, dass die Sezierer Praxis optisch identifizieren die anatomischen Landmarken vor Beginn der Datenerhebung zu sicher, dass das richtige Wahrzeichen verwendet wird. Eine Möglichkeit zur Überprüfung der Richtigkeit einer bestimmten Sezierer ist entweder choroid Fissur zu machen schneidet oder überlegener Rectus Muskel schneidet und dann den Speicherort der die Kürzungen bei den s-Opsin Farbverlauf zu vergleichen, da es eine feste Markierung und somit nicht abhängig von der Genauigkeit der Dissectio ist n. potenzielle Dissectors können auch vergleichen ihre rekonstruierten Netzhaut zu den Beispielen der rekonstruierten Netzhaut mit genauen Wahrzeichen Kürzungen sind in Abbildung 1 dargestellte und Abbildung 2. Im Wesentlichen eine potenzielle Sezierer sollten die Schritte in diesem Protokoll für einen bestimmten Dissektion Typ durchführen, sei es überlegener Rectus Muskeln oder Aderhaut Rissbildung Methode, und vergleichen Sie die Ergebnisse auf den s-Opsin Farbverlauf herzustellen die Gültigkeit einer bestimmten Sezierer. Denn wenn der Sezierer unsicher über den Standort des Wahrzeichens ist, es eine ungenaue Ausrichtung der Netzhaut führen kann, dass wird standardmäßig beeinflussen Datenerhebung und Auswertung.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Wir möchte Bretagne Tag und Jessica Onyak für ihre technische Unterstützung und Dr. Liu für bitte lassen Sie uns seine Epifluorescent Mikroskop benutzen. Danksagung des Supports: NIH-R15EY026255-01 und Karl Kirchgessner Stiftung.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.1 M Phosphate Buffered Saline | Sigma-Aldrich | P5244 | |
| Axioplan2 Epifluorescent Microscope | Zeiss | N/A | |
| Clear Nailpolish | N/A | N/A | |
| Corning LSE Low Speed Orbital Shaker | Sigma-Aldrich | CLS6780FP | |
| Costar TC-Treated 24-well Plates | Sigma-Aldrich | CLS3524 | |
| Dissection Microscope | Olympus | SZ51 | |
| Donkey anti-Goat Alexa 594 | Life Technologies | A11058 | |
| Donkey anti-Rabbit Alexa 594 | Life Technologies | A21207 | |
| Donkey Normal Serum | Millipore | 566460 | Use at 5.2% (52 μL with 86 μL of 20% Triton X-100 and 863 μL of 0.1M PBS for 1 mL of blocking solution) |
| Fisherbrand Superfrost Plus Microscope Slides | Fisher Scientific | 12-550-15 | |
| Goat anti-s-opsin | Santa Cruz Biotechnologies | sc-14363 | Not commerically available as of 2017 |
| Graefe Curved Forceps | Fine Science Tools | 11052-10 | |
| ImageJ or FIJI | National Institute of Health | N/A | Freely available software |
| Low Temperature Cautery Ophthalmic Fine Tip Cauterizer | Bovie Medical Corporation | AA00 | |
| MATLAB | MathWorks | N/A | At least version 2007b or later |
| Micro Cover Glasses | VWR International | 48393-241 | |
| Micro Slide Trays | VWR International | 82020-913 | |
| Moira Ultra Fine Forceps | Fine Science Tools | 11370-40 | |
| Nitrocellulose membrane | Millipore | HAWP04700 | |
| Paraformaldehyde | Electron Microscopy Sciences | 15714-S | Use at 4% (25 μL and 875 μL of 0.1 M PBS for 1 mL of fixative) |
| PrecisionGlide Needle 20G (0.90 mm x 25 mm) | BD PrecisionGlide | 305175 | |
| Pyrex Glass Petri Dish | Sigma-Aldrich | CLS3160152 | |
| R | The R Project for Statistical Computing | N/A | Freely available software; version 3.4.3 or later |
| Rabbit anti-s-opsin | Millipore | ABN1660 | |
| Retiga R3 Microscope Camera | Qimaging | 01-RET-R3-R-CLR-14-C | |
| Retistruct | N/A | N/A | Freely available software compatiable with Windows 7 or Windows 10 |
| Shandon Aqua-Mount Slide Mounting Media | Fisher Scientific | 14-390-5 | |
| Triton X-100 | Sigma-Aldrich | T8787 | Use 1.7% (86 μL of 20% Triton-X with 52 μL of Donkey Normal Serum and 863 μL of 0.1 M PBS for 1 mL of blocking solution) |
| Vannas Spring Dissection Scissors | Fine Science Tools | 15000-03 | |
| 5MP USB Microscope Digital Camera | AmScope | MU500 | To be used with the Olympus Dissection Microscope |
Referenzen
- Applebury, M. L., et al. The murine cone photoreceptor: A single cone type expresses both S and M opsins with retinal spatial patterning. Neuron. 27 (3), 513-523 (2000).
- Hughes, S., Watson, T. S., Foster, R. G., Peirson, S. N., Hankins, M. W. Nonuniform distribution and spectral tuning of photosensitive retinal ganglion cells of the mouse retina. Curr Biol. 23 (17), 1696-1701 (2013).
- Sondereker, K. B., Onyak, J. R., Islam, S. W., Ross, C. L., Renna, J. M. Melanopsin ganglion cell outer retinal dendrites: Morphologically distinct and asymmetrically distributed in the mouse retina. J Comp Neurol. 525 (17), 3653-3665 (2017).
- Bleckert, A., Schwartz, G. W., Turner, M. H., Rieke, F., Wong, R. O. L. Visual space is represented by nonmatching topographies of distinct mouse retinal ganglion cell types. Current Biology. 24 (3), 310-315 (2014).
- Warwick, R. A., Kaushansky, N., Sarid, N., Golan, A., Rivlin-Etzion, M. Inhomogeneous Encoding of the Visual Field in the Mouse Retina. Curr Biol. 28 (5), 655-665 (2018).
- Valiente-Soriano, F. J., et al. Distribution of melanopsin positive neurons in pigmented and albino mice: evidence for melanopsin interneurons in the mouse retina. Front Neuroanat. 8, 131(2014).
- Sabbah, S., et al. A retinal code for motion along the gravitational and body axes. Nature. 546 (7659), 492-497 (2017).
- Vaney, D. I., Sivyer, B., Taylor, W. R. Direction selectivity in the retina: Symmetry and asymmetry in structure and function. Nat Rev Neurosci. 13 (3), 194-208 (2012).
- Huberman, A. D., et al. Genetic identification of an On-Off direction-selective retinal ganglion cell subtype reveals a layer-specific subcortical map of posterior motion. Neuron. 62 (3), 327-334 (2009).
- Ueki, Y., Ramirez, G., Salcedo, E., Stabio, M. E., Lefcort, F. Loss of Ikbkap causes slow, progressive retinal degeneration in a mouse model of familial dysautonomia. eNeuro. 3 (5), (2016).
- Maiorano, N. A., Hindges, R. Restricted perinatal retinal degeneration induces retina reshaping and correlated structural rearrangement of the retinotopic map. Nat Commun. 4, 1938(2013).
- Hadj-Said, W., et al. Quantitative and topographical analysis of the losses of cone photoreceptors and retinal ganglion cells under taurine depletion. Invest Ophthalmol Vis Sci. 57 (11), 4692-4703 (2016).
- Tao, Y., et al. The temporal topography of the N-Methyl- N-nitrosourea induced photoreceptor degeneration in mouse retina. Sci Rep. 5, 18612(2015).
- Risner, M. L., Pasini, S., Cooper, M. L., Lambert, W. S., Calkins, D. J. Axogenic mechanism enhances retinal ganglion cell excitability during early progression in glaucoma. Proc Natl Acad Sci U S A. , (2018).
- Estevez, M. E., et al. Form and function of the M4 cell, an intrinsically photosensitive retinal ganglion cell type contributing to geniculocortical vision. J Neurosci. 32 (39), 13608-13620 (2012).
- Kolesnikov, A. V., Kefalov, V. J. Transretinal ERG recordings from mouse retina: Rod and cone photoresponses. J Vis Exp. (61), (2012).
- Lin, B., Wang, S. W., Masland, R. H. Retinal ganglion cell type, size, and spacing can be specified independent of homotypic dendritic contacts. Neuron. 43 (4), 475-485 (2004).
- Ortin-Martinez, A., et al. Number and distribution of mouse retinal cone photoreceptors: differences between an albino (Swiss) and a pigmented (C57/BL6) strain. PLoS One. 9 (7), 102392(2014).
- Zhang, H., et al. The degeneration and apoptosis patterns of cone photoreceptors in rd11 Mice. J Ophthalmol. 2017, 9721362(2017).
- Wei, W., Elstrott, J., Feller, M. B. Two-photon targeted recording of GFP-expressing neurons for light responses and live-cell imaging in the mouse retina. Nat Protoc. 5 (7), 1347-1352 (2010).
- Wang, J., et al. Anatomy and spatial organization of Muller glia in mouse retina. J Comp Neurol. 525 (8), 1759-1777 (2017).
- Stabio, M. E., et al. A novel map of the mouse eye for orienting retinal topography in anatomical space. J Comp Neurol. 526 (11), (2018).
- Lamb, T. D., Collin, S. P., Pugh, E. N. Evolution of the vertebrate eye: Opsins, photoreceptors, retina and eye cup. Nat Rev Neurosci. 8 (12), 960-976 (2007).
- Sterratt, D. C., Lyngholm, D., Willshaw, D. J., Thompson, I. D. Standard anatomical and visual space for the mouse retina: Computational reconstruction and transformation of flattened retinae with the Retistruct package. PLoS Comput Biol. 9 (2), 1002921(2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten