Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
One-Step Ansatz zur Herstellung von Polydimethylsiloxan mikrofluidische Kanäle von verschiedenen geometrischen Abschnitte durch sequentielle Nassätzen Prozesse
In diesem Artikel
Zusammenfassung
Für die Herstellung der Kanäle nicht-rechteckige Abschnitte eingebettet in Polydimethylsiloxan mikrofluidischen Geräte gibt es mehrere Methoden. Die meisten von ihnen beinhalten mehrstufige Fertigung und umfassende Ausrichtung. In diesem Papier ist ein ein-Schritt-Ansatz zur Herstellung von mikrofluidischen Kanäle von verschiedenen geometrischen Querschnitte von Polydimethylsiloxan sequentielle Nassätzen gemeldet.
Zusammenfassung
Polydimethylsiloxan (PDMS) Materialien sind wesentlich ausgenutzt, um mikrofluidischen Geräten mit weichen Lithographie Replik Formteil Techniken zu fabrizieren. Maßgeschneiderte Kanal-Layout-Designs sind für bestimmte Funktionen und integrierten Performance von mikrofluidischen Geräten in zahlreichen chemischen und biomedizinischen Anwendungen (z. B. Zellkultur, Biosensoren, chemische Synthese und Handhabung von Flüssigkeiten) notwendig. Aufgrund der Beschaffenheit der Guß Ansätze mit Silizium-Wafer mit Fotolack Schichten als Meister-Schimmel durch Photolithographie gemustert haben mikrofluidische Kanäle häufig regelmäßige Querschnitte von rechteckigen Formen mit identischen Höhen. In der Regel Kanäle mit mehreren Höhen oder verschiedene geometrische Abschnitte sollen dazu dienen, bestimmte Funktionen zu besitzen und in verschiedenen mikrofluidische Anwendungen auszuführen (z. B.Hydrophoresis wird verwendet für die Sortierung von Partikeln und in kontinuierlichen Bewegungen zum Trennung von Blutkörperchen6,7,8,9). Daher hat viel Aufwand Kanäle mit verschiedenen Abschnitten durch mehrstufige Ansätze zu konstruieren, wie Photolithographie mit mehreren Photoresist Schichten und Montage von verschiedenen PDMS Blätter dünne. Dennoch, solche mehrstufige Ansätze beinhalten in der Regel langwierige Verfahren und umfangreiche Instrumentierung. Darüber hinaus gefertigten Geräte können nicht konsequent durchführen und die entstandenen experimentellen Daten können unberechenbar sein. Hier wird ein ein-Schritt-Ansatz für die einfache Herstellung von mikrofluidischen Kanäle mit verschiedenen geometrischen Querschnitte durch PDMS sequentielle Nassätzen Prozesse, entwickelt das Ätzmittel in Kanäle der geplanten Einzellagen-Layouts einführt eingebettet in PDMS Materialien. Im Vergleich zu den vorhandenen Methoden zur Herstellung von PDMS mikrofluidische Kanäle mit unterschiedlichen Geometrien, kann die entwickelten ein-Schritt-Ansatz deutlich die um Kanäle mit nicht-rechteckige Abschnitte oder in verschiedenen Höhen zu fabrizieren vereinfachen. Infolgedessen ist die Technik einen Weg für den Bau von komplexen mikrofluidische Kanäle, die eine Fertigung Lösung zur Förderung der innovativen mikrofluidischen Systemen.
Einleitung
Mikrofluidischen Techniken haben in den letzten Jahrzehnten aufgrund ihrer inhärenten Vorteile für eine Vielzahl von chemischen und biomedizinischen Forschung und Anwendung. Es gibt verschiedene Materialeinsatz-Möglichkeiten für den Bau von mikrofluidischen Chips heute, wie Polymere, Keramiken und Silizium-Materialien. Nach bestem Wissen, unter den Materialien mikrofluidischen ist PDMS die häufigste aufgrund seiner entsprechenden Materialeigenschaften für verschiedene Mikrofluidik-Forschung und Anwendungen, einschließlich seiner optischen und biologischen Kompatibilitäten mit Partikeln, Flüssigkeiten und extrem kleine Lebewesen1,2,3,4,5. Darüber hinaus können die Chemie und Struktur mechanischen Oberflächeneigenschaften von PDMS Materialien angepasst werden, um mikroelektromechanische und Einhaltung Studien zu erleichtern, durch die Anwendung solcher Polymer-basierten mikrofluidischen Geräten10, 11,12. Bezüglich der Herstellung von mikrofluidischen Geräten mit gestalteten Kanal Muster gelten weiche Lithographie Replik Formgebungsverfahren in der Regel um die mikrofluidische Kanäle zu schaffen, durch den Einsatz ihrer entsprechenden Meister-Schimmel, bestehend aus sind Photolithographie-gemusterten Photoresist Schichten und Silizium Wafer Substrate12. Aufgrund der Beschaffenheit der Guß Ansätze mit Silizium-Wafer mit gemusterten Photoresist Schichten haben mikrofluidische Kanäle häufig regelmäßige Querschnitte von rechteckigen Formen mit identischen Höhen.
Vor kurzem haben Forscher erhebliche Fortschritte in biomedizinischen Studien, zum Beispiel behandeln, Sortierung Partikel und Zellen mit Hydrophoresis, Trennung von Blutplasma und Anreicherung von weißen Blutkörperchen durch die Anwendung von mikrofluidischen Chips mit Kanälen verschiedenen Höhen oder geometrische Abschnitte6,7,8,9. Diese Sortierung und Trennung der Funktionen der Mikrofluidik für biomedizinische Anwendungen werden realisiert durch Kanäle mit verschiedenen geometrischen Abschnitten anpassen. Mehrere Studien haben auf die Herstellung von mikrofluidischen Kanälen mit Querschnitten von verschiedenen Geometrieelemente gewidmet, durch die Herstellung von Meister-Schimmel mit bestimmten Oberflächenmuster verschiedener Höhen oder nicht-rechteckige Querschnitte. Diese Studien über Schimmel Fertigung gehören Techniken wie mehrstufige Photolithographie, Fotolack Reflow und Graustufen-Lithographie13,14,15. Die bestehenden Techniken zwangsläufig fein gearbeitete Photomasks oder eine präzise Ausrichtung in mehrstufigen Herstellungsverfahren, die die variationsebenen der entsprechenden Fabrikation von mikrofluidischen Kanälen erheblich verbessern kann. So weit, auf Einzelschritt Fertigungsprozesse für mikrofluidische Kanäle aus verschiedenen Bereichen wurden mehrere Versuche unternommen, aber die jeweiligen Techniken sind auf spezifische Querschnittsformen Kanäle16sehr beschränkt.
In den letzten zwei Jahrzehnten neben die Formteil-Ansätze für die Herstellung von PDMS mikrofluidische Kanäle mit verschiedenen Abschnitten, Radierung Techniken zur Musterung PDMS Kanäle mit geometrischen Merkmalen der Herstellung der Wahl in einer Vielzahl von geworden mikrofluidische Anwendungen. Zum Beispiel wird PDMS Nassätzen zusammen mit mehrschichtigen PDMS kleben für den Bau einer pneumatisch betätigten Zelle Kultur Gerät der Mikrofluidik mit rekonstituierten ORGANEBENE Lunge Funktionen17genutzt. Die PDMS nasse Ätzen Technik wird zusammen mit PDMS Casting am zylindrischen Mikrovertiefungen bearbeitet durch computergestützte Steuerungssysteme für die Herstellung von 3D PDMS Microneedle Arrays18eingesetzt. PDMS trockene Radierung dient zur PDMS Mikrostrukturen als Teile von Mikro-elektromechanischen Aktoren19,20. Poröse PDMS-Membranen mit gestalteten Pore Layouts werden auch durch trockene Radierung Prozesse21hergestellt. Die nasse und trockene Radierung Techniken können in PDMS Filme mit bestimmten geometrischen Formen22-Strukturierung integriert werden.
Jedoch Kanal die Radierung Techniken zur Bildung von PDMS Strukturen mit komplexen Abschnitt, die Formen durch ihre immanente Grenzen auf mikrofluidischen Herstellung häufig nicht angewendet wurden. Zuerst, während die Techniken des PDMS Nassätzen Nutzung laminare Strömungen von Chemikalien für die Erstellung von mikrofluidischen Kanäle aus verschiedenen Abschnitten hergestellt worden, ist die nachfolgende Kanal Abschnitt Bildung noch eingeschränkt, da die grundlegenden Merkmale isotrope chemische Ätzung Prozesse23. Darüber hinaus, obwohl es angemessenen Raum scheint für die Steuerung der Kanal Abschnitt Geometrien in einem Mikrofluidik-Herstellung mit PDMS trockenen Radierung Techniken20, soll die erforderliche Radierung Zeit in der Regel zu lang (in Stunden) praktisch für die Herstellung von mikrofluidischen Chips. Darüber hinaus ist die Radierung Selektivität zwischen PDMS Materialien und die entsprechenden Maskierung Photoresist Schichten könnte im Allgemeinen niedrig sein, und die entstandenen geätzten tiefen für die Kanäle sind so nicht akzeptabel20.
In diesem Papier entwickeln wir einen einstufigen Ansatz zur mikrofluidische Kanäle von verschiedenen geometrischen Querschnitte von PDMS sequentielle Nassätzen Prozesse (nachfolgend SWEP) herzustellen. Die SWEP beginnen mit einem PDMS mikrofluidischen Gerät mit Einzellagen-Kanäle. Mit verschiedenen Layout-Designs der Kanäle kann die Herstellung mikrofluidische Kanäle mit verschiedenen geometrischen Abschnitten verschiedener Art durch sequentielle Radierung Prozesse erreicht werden. Die sequentielle Radierung braucht nur ein Ätzmittel in bestimmte Kanäle der geplanten Einzellagen-Layouts eingebettet in PDMS Materialien eingebracht werden. Im Vergleich zu herkömmlichen PDMS Herstellungsprozesse, die SWEP benötigen nur ein weiterer Schritt, mikrofluidische Kanäle nicht-rechteckige Abschnitte zu fabrizieren oder in verschiedenen Höhen. Der vorgeschlagenen SWEP bieten eine unkomplizierte und einfache Herstellung mikrofluidische Kanäle mit verschiedenen Abschnitten entlang der Fließrichtung, die die Prozesse in den oben genannten Methoden erheblich vereinfachen können.
Protokoll
1. Herstellung von mikrofluidischen Geräte mit Single-Layer-Kanal Layouts
Hinweis: In diesem Papier, ist die weiche Lithographie Methode3 angenommen, für die Herstellung von mikrofluidischen Geräten aus PDMS Materialien hergestellt, um vorzuführen, wie Kanäle mit verschiedenen Abschnitten zu fertigen.
-
Erstellung von Meister-Schimmel für einen PDMS-Layer mit gestalteten Topologie Funktionen
- Kanal-Layouts auf einer PDMS-Schicht für eine einzelne Ätzprozess oder Ätzen nacheinander zu entwerfen.
- Skizzieren Sie die invertierten Topologie Features des gestalteten PDMS Layers mit einem CAD-Zeichenprogramm.
- Liefern Sie die Skizze-Datei in eine Photolithographie Einrichtung eine gemusterte Fotomaske mit den hochpräzisen invertierten Topologie Eigenschaften gedruckt auf einer Transparenz24Kanal-Layouts zu erhalten.
- Einsatz-Isopropyl-Alkohol (2-Propanol (IPA), ≥ 99.9 %), Aceton (Wasserrückstände-2-One, ≥ 99.5 %) und gepufferten oxid Ätzen (BOE, NH4F:HF (V/V) = 6:1) auf der Oberfläche von einem 4-Zoll-Silizium-Wafer, entfernen Staub oder Rückstände und Verunreinigungen zu vermeiden.
- Benutzen Sie rund 500 mL entionisiertem Wasser, um die Silizium-Wafer für einen letzten Schliff zu waschen, und wenden Sie dann Stickstoff gespülten Wafer zu trocknen.
- Legen Sie einen negativen Ton Fotolack von etwa 20 g auf dem Wafer. Dann drehen die Wafer auf 500 u/min für 15 s und 2.000 u/min für 30 s, eine Photoresist Schicht von rund 75 µm Dicke zu produzieren.
Hinweis: Verschiedene Photoresist dicken können erreicht werden mit negativen Ton Photoresists mit unterschiedlichen Produktnummern und mit unterschiedlichen Spin-Coating, Back- und Entwicklungsbedingungen, nach der Benutzer-Handbücher25,26. - Weiche Backen des Wafers durch Erhitzen auf einer Herdplatte bei 65 ° C für 3 min. und dann bei 95 ° C für 9 min.
- Genommen Sie die Wafer in einer Fotomaske Aligner Maschine zusammen mit gemusterten Transparenz aus Schritt 1.1.3 als Maske.
- Gelten Sie in der Maschine Aligner ultraviolettes (UV) Licht bei 300 mJ/cm2 , die Wafer abgedeckt durch die Transparenz verfügbar zu machen.
- Nach Exposition gegenüber UV-Licht Platz des Wafers auf einer Herdplatte bei 65 ° C für 2 min und dann bei 95 ° C für 7 min als Post Exposure Bake (PEB).
- Nach der PEB stark Regen Sie den Wafer inmitten einer negativen Ton Photoresist Entwickler oder platzieren Sie eingetauchten Wafer in einem Ultraschallbad (37 kHz, Wirkleistung von 180 W) für 7 min zu.
- Reinigen Sie den gesamten Wafer wieder mit Isopropyl-Alkohol, jeder Entwickler noch auf den Wafer-Oberfläche zu beseitigen.
- Um zu verhindern, dass unerwünschte bonding, Silanize die Oberfläche des Wafers durch die Einführung des Wafers mit 100 µL 97 % Silan (1H, 1H, 2H, 2H- Perfluorooctyl-Trichlorsilan) einer 6 cm Petrischale in den Exsikkator gestellt.
- Verbindung der Exsikkator mit einer Vakuumpumpe und der Unterdruck 760 MmHg.
- Als nächstes schalten Sie die Pumpe für 15 min. Schalter es ab, und lassen Sie die Wafer zur Ruhe in einem Vakuum in den Exsikkator für 30 min.
Achtung: Das verdampfte Silan ist extrem schädlich für den Menschen; Daher muss die ganze Wafer-Oberflächen-Passivierung in einem Abzug durchgeführt werden. - Holen Sie den silanisiert Wafer, der Oberfläche Passivierung unterzogen wurde. Den Wafer in einem 15 cm Petrischale zur weiteren Verwendung zu beheben.
Hinweis: Die gemusterte Wafer ist bereit, als Form von verwendet werden, um die gestalteten Kanal-Layouts zu replizieren umgekehrt PDMS Materialien.
-
Herstellung von PDMS Kanal Layouts durch die Replikation der invertierten Topologie auf die Formen
- Setzen Sie die base PDMS (Monomer) zusammen mit der entsprechenden Katalysator (härter) in einem Volumenverhältnis von 10:1 in einem sauberen und Einweg-Plastikbecher.
- Mischen Sie die PDMS-prepolymer-Mischung (aus Schritt 1.2.1) durch ein macht-Rührer mit homogen.
- Setzen Sie den Becher in den Exsikkator verbunden mit der Vakuumpumpe für 60 min, eventuell eingeschlossenen Luftblasen in der PDMS-Mischung zu entfernen.
- Gießen Sie 20 g (Abschnitt 2) oder 8 g (Abschnitt 3) der PDMS prepolymer Mischung auf der master-Form (hergestellt in Schritt 1.1) mit den invertierten Topologie Eigenschaften der gestalteten Kanal Layouts, und beseitigen Sie alle möglichen Bläschen eingebettet in der PDMS-Materialien mithilfe von t He Exsikkator (für 60 min).
- Legen Sie die Form tragen die PDMS-Mischung in einem Ofen bei 60 ° C für 4 h, die Silikon-basierte flüssigen prepolymer Materialien zu heilen.
- Nach dem Abkühlen des Wafers mit PDMS auf Raumtemperatur für ca. 20 min, lösen Sie die ausgehärtete PDMS aus der Form mit einem Skalpell und Pinzette.
- Passen Sie die freistehende PDMS-Schicht auf eine Fläche (ca. 6 x 6 cm2 für Abschnitt 2 oder 2 x 7,5 cm2 für Abschnitt 3) Abdeckung den gesamten Kanal-Layouts mit einem Skalpell.
- Erstellen Sie Kanal-Access-Ports (ein- und Ausläufe) mithilfe einer Biopsie-Punch von 1,5 mm Durchmesser.
Hinweis: Die Zahlen und die Positionen der ein- und Ausläufe sind basierend auf der Radierung-Prozesse für die Herstellung von spezifischen mikrofluidische Kanäle ausgelegt. - 30 g der PDMS-prepolymer-Mischung in eine Petrischale Gießen, und dann eventuell möglichen Luftblasen eingebettet in der PDMS-Materialien mithilfe der Exsikkator (für 60 min) zu beseitigen.
- Setzen Sie die Petrischale mit PDMS-Mischung in einem Ofen bei 60 ° C für mehr als 4 h, die flüssigen prepolymer Materialien zu heilen.
- Nach dem Abkühlen der Petrischale zusammen mit PDMS auf Raumtemperatur für ca. 20 min, lösen Sie die ausgehärtete PDMS aus der Schale mit einem Skalpell und Pinzette.
- Mit einem Skalpell, passen Sie die freistehende PDMS-Schicht ohne Merkmale Abmessungen identisch mit denen der oben genannten PDMS-Schicht (ca. 6 x 6 cm2 für Abschnitt 2 oder 2 x 7,5 cm2 für Abschnitt 3).
- Aktivieren Sie die Oberflächen der beiden PDMS-Schichten (hergestellt in den Schritten 1.2.7 und 1.2.12) mit den gestalteten Kanal-Layouts und ohne Merkmale durch die Aufdeckung der Top PDMS-Materialien zu Sauerstoffplasma in einer Oberflächenbehandlung-Maschine bei 90 W für 40 s.
- Bond 2 PDMS "layers" indem man Kontakt zwischen ihren behandelten Oberflächen direkt nach der Sauerstoff-Plasma-Oberflächenaktivierung. Dann verlassen Sie die verklebten PDMS-Schichten in einem Ofen bei 60 ° C für mehr als 30 min.
Hinweis: Es gibt keine Obergrenze der Zeit für das Verlassen der verklebten PDMS-Schichten in den Ofen. - Nachdem die 2 verklebt PDMS Schichten haben gekühlt, PDMS-Überbestände vom gefertigte Gerät für eine später Versuchsaufbau zu trimmen.
(2) die einstufige Ansatz zur Herstellung von PDMS mikrofluidische Kanäle von verschiedenen Abschnitten
Hinweis: Zur Charakterisierung der PDMS Ätzrate nass, wird eine mikrofluidischen Gerät mit einem einlagigen und geraden Kanal rechteckige Formen vorgeschlagen, zur Identifizierung von spezifischen Radierung Preise entsprechend bestimmten experimentellen Einstellungen ausgebeutet werden.
-
Experimentelle Charakterisierung von PDMS nass Radierung
- Bereiten Sie eine Ätzmittel Lösung durch Mischen von Tetra-n-Butylammonium Fluorid (TBAF, eine 1 M Lösung in Tetrahydrofuran (THF)) mit 1-Methyl-2-Pyrrolidinone (NMP) mit einer Rate von V: V = 01:10.
Hinweis: NMP ist in der Lage, effizient lösen chemische Rückstände durch das Ätzmittel induziert. Im allgemeinen PDMS Materialien sind geringfügig von der NMP geschwollen, und die PDMS mikrofluidischen Geräte sind noch in der Lage, ihre Formen, Volumen, bewahren und Bedingungen zu versiegeln. - Zeichnen Sie die gemischten TBAF/NMP Ätzmittel in eine 10 mL Spritze mit einer rostfreien stumpfen Nadel (16 G) verbunden.
- Richten Sie eine Spritzenpumpe als Controller der Druck angetrieben Flüssigkeiten in den Kanälen.
- Schließen Sie die stumpfen Nadeln von Spritzen mit der Ätzmittel Lösung zum Kanal Hafen des oben genannten einfachen Gerätes gefüllt und führen Sie den entsprechenden Port aus der Steckdose zu einem Abfallbehälter Schläuche, wie in Abbildung 1dargestellt.
- Führen Sie die Spritzenpumpe tragen die Spritzen mit der gemischten TBAF/NMP Ätzmittel Lösung bei 150 µL/min Durchfluss zur Charakterisierung der PDMS Radierung nass.
- Verwenden Sie Hellfeld mikroskopische Ansichten und sicherstellen Sie, dass die geätzte Kanal entlang der Fließrichtung eine einheitliche Breite hat, somit bestätigen, dass das Mischungsverhältnis von das Ätzmittel Volumen und die Durchflussmenge Ätzmittel sind ausreichend.
- Die Zeitreihen Aufnahmen des Kanals Querschnitt unter einem inversen Mikroskop mit 4 X Vergrößerung während der Ätzprozess PDMS.
- Analysieren Sie die gespeicherten Bilder, durch die Anwendung der grundlegenden Messfunktion in einer 2D Analyse des Programms bildgebenden Verarbeitung eine zeitlichen Abfolge der Zahlen für die Kanalbreite während der nassen Ätzprozess PDMS Materialien zu sammeln.
- Bewerten die Zeitreihen Ätzen-Preise durch die Gleichung dargestellt in Abbildung 2, die 50 % der Breite Kanalwechsel spaltet (ΔW / 2) um die Dauer der PDMS-Radierung (t).
- Führen Sie eine lineare Regression der gesammelten Datenpunkte, um eine allgemeine Schätzung Ätzrate von gemischten TBAF/NMP-Ätzmittel mit dem spezifischen Volumen Mischungsverhältnis von 01:10 für die PDMS-Materialien, wie in Abbildung 2dargestellt.
- Bereiten Sie eine Ätzmittel Lösung durch Mischen von Tetra-n-Butylammonium Fluorid (TBAF, eine 1 M Lösung in Tetrahydrofuran (THF)) mit 1-Methyl-2-Pyrrolidinone (NMP) mit einer Rate von V: V = 01:10.
-
PDMS sequentielle nass für die Herstellung von mikrofluidischen Kanäle von verschiedenen geometrischen Abschnitte Ätzen
- Entwerfen Sie eine Anordnung von Ätzmittel Buchten für die einschichtige PDMS Kanallayout dienen die entsprechenden ätzprozesse nacheinander, so dass einem bestimmten Kanaltyp der verschiedenen Querschnittsformen wie in Abbildung 3 dargestellt gefertigt werden kann.
- Folgen Sie die nachfolgend beschriebenen Schritte 2.1.1 - 2.1.7 für PDMS nassen Ätzen Ansatz.
Hinweis: Die Durchflussmenge wird als 50 μL/min eingestellt. - Während die TBAF/NMP Ätzmittel fließen, inspizieren Sie die geätzten Kanäle unter dem Mikroskop zu sehen, ob es erhebliche Probleme wie eine merkliche Menge Blasen gibt, eine verbleibende mehrere chemische Rückstände durch das Ätzmittel, ein Austreten von das Ätzmittel induziert, oder einen Fluss von Ätzmittel auf einer schiefen Ebene.
- Beobachten der mikrofluidischen Kanal wanddickenschwankung invertierte Mikroskopie und Zeit den nassen Ätzverfahren um sicherzustellen, dass die richtigen Kanal Geometrien erreicht werden.
3. das Design eines mikrofluidischen Mixer
Hinweis: Eine Design von mikrofluidischen Mischer der effizient 2 unterschiedliche Flüssigkeiten mischen kann zeigt hier um eine vorteilhafte Anwendung mikrofluidische Kanäle mit verschiedenen Abschnitten zu zeigen.
-
Herstellung von einem mikrofluidischen Mischer mit verschiedenen u-profile
- Machen Sie eine PDMS-Gerät mit einem einlagigen mikrofluidischen Kanal des Entwurfs durch das weiche Lithographie Replikat molding Technik (Abschnitt 2) in Abbildung 4 dargestellt.
- Die einschichtige mikrofluidischen Kanallayout führen Sie die TBAF/NMP Ätzmittel Lösung gemäß die Verfahren in Schritt 2.1.1 vom Hafen gekennzeichnet als "Outlet" bei 20 µL/min Durchfluss in Abbildung 4beschrieben vorbereitet ein.
- Die mikrofluidischen Kanal wanddickenschwankung unter dem Mikroskop zu beobachten, und Zeit nassen Ätzverfahren um sicherzustellen, dass die richtigen Kanal-Geometrien, wie Sie in Abbildung 5 dargestellt erreicht werden.
-
Experimentelle Charakterisierung von mikrofluidischen mixer
- Nachdem der mikrofluidischen Kanal mit Abschnitten in verschiedenen Formen in einem alternativen Muster realisiert wird, Pumpe 2 unterschiedliche Flüssigkeiten einschließlich einer Lösung von Fluorescein Natrium Salz mit einer Konzentration von 50 µg/mL und destilliertes Wasser in 2 separate Kanäle mit 20 µL/min Durchfluss.
- Nehmen Sie Fluoreszenz Mikroskopbilder des Kanals in der Draufsicht an den Positionen gekennzeichnet als A, B, C und D unter einem inversen Mikroskop (4 X Vergrößerung) für die 2 Mischer mit einheitlichen (vor der Ätzung) und verschiedene geometrische Abschnitte (nach 2 h von SWEP), bzw.) ( Abbildung 6).
Hinweis: Die Fluoreszenz-Mikroskop-Bilder stammen, während die stabile Ströme auftreten, zum Zeitpunkt der 5 min, gerechnet ab Beginn Momente durch den Mixer-Kanäle zu mischen. - Analysieren die fluoreszierenden Aufnahmen mithilfe eines bildgebenden Verarbeitung-Programms um zu schätzen, die entsprechenden mischen Effizienz-Nummern, die durch Mischen Residual definiert sind (MR, 0,5 = unvermischt, 0 = vollständig gemischt) in der folgenden Gleichung27, 28:
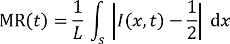
Hier,
t ist die Zeit, Radierung,
L ist die Kanalbreite an einer bestimmten Position von Interesse,
S ist ein Liniensegment über den Kanal an der Position, und
I ist die Fluoreszenz Intensitätsverteilung über S t. - Plot der Fluoreszenz Intensitätsverteilung über S über den Kanal an den Positionen gekennzeichnet als A, B, C und D für die 2 Mischer mit einheitlichen (vor der Ätzung) und verschiedene geometrische Abschnitte (nach 2 h von SWEP), beziehungsweise. Schätzen Sie die entsprechenden Herr, wie in Abbildung 6dargestellt.
Ergebnisse
Vor kurzem wurden eine große Anzahl von Studien auf die Herstellung von mikrofluidischen Geräten mit Kanälen von verschiedenen Abschnitten von Lithographie Replik Formen von13,14,15 und PDMS Radierung Techniken17 gemacht , 18 , 19 , 20 , ...
Diskussion
In den letzten Jahrzehnten hat die Mikrofluidik angeboten viel versprechende Mittel durch den experimentellen Plattformen für chemischen und biomedizinischen Forschung sein können systematisch1,2,3,4gebaut, 5. Die Plattformen haben auch ihre Fähigkeiten zu untersuchen verschiedene Zellfunktionen in Vivo unter physiologischen Mikroumgebung Bedingun...
Offenlegungen
Die Autoren haben nichts zu verzollen.
Danksagungen
Die Autoren dankbar anerkennen, die Unterstützung von National Health Research Institute (NMRI) in Taiwan unter der innovativen Research Grant (IRG) (EX106-10523EI), die Taiwan Ministerium für Wissenschaft und Technologie (die meisten 104-2218-E-032-004, 104 - 2221 - E-001-015-MY3, 105-2221-E-001-002-MY2, 105-2221-E-032-006, 106-2221-E-032-018-MY2), und der Academia Sinica Career Development Award. Die Autoren möchten Heng-Hua Hsu danken für das Korrekturlesen der Handschrift.
Materialien
| Name | Company | Catalog Number | Comments |
| 1-Methyl-2-Pyrrolidinone | Tedia, Fairfield, OH | ME-1962 | NMP |
| 10 ml Syringe | Becton-Dickinson, Franklin Lakes, NJ | 302151 | |
| 150 mm Petri dish | Dogger Science | DP-43151 | |
| 1H,1H,2H,2H- Perfluorooctyltrichlorosilane | Alfa Aesar, Ward Hill, MA | L16606 | 97 % silane |
| 4'' Silicon Dummy Wafer | Wollemi Technical, Taoyuan, Taiwan | - | |
| Acetone | ECHO Chemical, Miaoli, Taiwan | AH3102-000000-72EC | |
| AG Double Expose Mask Aligner | M&R Nano Technology, Taoyuan, Taiwan | AG500-4D-D-V-S-H | |
| Biopsy Punch | Miltex, Plainsboro, NJ | 33-31 | |
| Blunt Needle | Jensen Global, Santa Barbara, CA | Gauge 16 | |
| Buffered Oxide Etch | ECHO Chemical, Miaoli, Taiwan | PH3101-000000-72EC | |
| Desicattor | A-VAC Industries, Anaheim, CA | 35.10001.01 | |
| Fluorescein Sodium Salt Water | Sigma-Aldrich Co., St Louis, MO | F6300 | |
| ImageJ | National Institutes of Health, Bethesda, MD | Ver. 1.51 | Imaging Processing Program |
| Inverted Fluorescence Microscope | Leica Microsystems, Wetzlar, Germany | DMI 6000 B | |
| Isopropyl Alcohol (IPA) | ECHO Chemical, Miaoli, Taiwan | CMOS112-00000-72EC | |
| Leica Application Suite | Leica Microsystems GmbH | LAS X | |
| MATLAB | MathWorks, Natick, MA | R2015b | Programming for MR evaluation |
| Mechanical Convention Oven | ThermoFisher Scientific,Waltham, MA | Lindberg Blue M MO1450C | |
| Plasma Tretment System | Nordson MARCH, Concord CA | PX-250 | Oxygen plasma surface treatment |
| Polydimehtylsiloxane (PDMS) | Dow Corning, Midland, MI | SYLGARD 184 | |
| Polyethylene Tubing | Becton-Dickinson and Company, Sparks, MD | 427446 | PE 205, 10' |
| Spin Coater | ELS Technology, Hsinchu, Taiwan | ELS 306MA | |
| Negative Tone Photoresist | MicroChem, Westborough, MA | SU-8 2050 | |
| Negative Tone Photoresist Developer | MicroChem, Westborough, MA | Y020100 | SU-8 Developer |
| Surgical Blade | Feather, Osaka, Japan | 5005093 | PDMS cutting |
| Syringe Pump | Chemyx, Houston, TX | Fusion 400 | |
| Tetra-n-butylammonium Fluoride (TBAF) | Alfa Aesar, Ward Hill, MA | A10588 |
Referenzen
- Tung, Y. -. C., et al. Optofluidic Detection for Cellular Phenotyping. Lab on a Chip. 12, 3552-3565 (2012).
- Lu, Y., Yang, L., Wei, W., Shi, Q. Microchip-based Single-cell Functional Proteomics for Biomedical Applications. Lab on a Chip. 17, 1250-1263 (2017).
- Jensen, K. F., Reizman, B. J., Newman, S. G. Tools for Chemical Synthesis in Microsystems. Lab on a Chip. 14, 3206-3212 (2014).
- Chang, C. -. W., et al. A Polydimethylsiloxane-polycarbonate Hybrid Microfluidic Device Capable of Generating Perpendicular Chemical and Oxygen Gradients for Cell Culture Studies. Lab on a Chip. 14, 3762-3772 (2014).
- Mosadegh, B., et al. Integrated Elastomeric Components for Autonomous Regulation of Sequential and Oscillatory Flow Switching in Microfluidic Devices. Nature Physics. 6, 433-437 (2010).
- Choi, S., Park, J. -. K. Tuneable Hydrophoretic Separation Using Elastic Deformation of Poly(Dimethylsiloxane). Lab on a Chip. 9, 1962-1965 (2009).
- Choi, S., Song, S., Choi, C., Park, J. -. K. Microfluidic Self-Sorting of Mammalian Cells to Achieve Cell Cycle Synchrony by Hydrophoresis. Analytical Chemistry. 81, 1964-1968 (2009).
- VanDelinder, V., Groisman, A. Separation of Plasma from Whole Human Blood in a Continuous Cross-Flow in a Molded Microfluidic Device. Analytical Chemistry. 78, 3765-3771 (2006).
- VanDelinder, V., Groisman, A. Perfusion in Microfluidic Cross-Flow: Separation of White Blood Cells from Whole Blood and Exchange of Medium in a Continuous Flow. Analytical Chemistry. 79, 2023-2030 (2007).
- Duffy, D. C., McDonald, J. C., Schueller, O. J., Whitesides, G. M. Rapid Prototyping of Microfluidic Systems in Poly(dimethylsiloxane). Analytical Chemistry. 70 (23), 4974-4984 (1998).
- Xia, Y., Whitesides, G. M. Soft Lithography. Annual Review of Material Science. 28, 153-184 (1998).
- Mello, A. Plastic Fantastic?. Lab on a Chip. 2, 31N-36N (2002).
- Choi, S., Park, J. -. K. Two-step Photolithography to Fabricate Multilevel Microchannels. Biomicrofluidics. 4, 046503 (2010).
- Zhong, K., Gao, Y., Li, F., Zhang, Z., Luo, N. Fabrication of PDMS Microlens Array by Digital Maskless Grayscale Lithography and Replica Molding Technique. Optik. 125, 2413-2416 (2013).
- Brower, K., White, A. K., Fordyce, P. M. Multi-step Variable Height Photolithography for Valved Multilayer Microfluidic Devices. Journal of Visualized Experiments. (119), e55276 (2017).
- Lai, D., et al. Simple Multi-level Microchannel Fabrication by Pseudo-grayscale Backside Diffused Light Lithography. RSC Advances. 3, 19467-19473 (2013).
- Huh, D., et al. Reconstituting Organ-Level Lung Functions on a Chip. Science. 328, 1662-1668 (2010).
- Deng, Y. -. L., Juang, Y. -. J. Polydimethyl Siloxane Wet Etching for Three-Dimensional Fabrication of Microneedle Array and High-Aspect-Ratio Micropillars. Biomicrofluidics. 8, 026502 (2014).
- Tung, Y. -. C., Kurabayashi, K. Nanoimprinted Strain-controlled Elastomeric Gratings for Optical Wavelength Tuning. Applied Physics Letters. 86, 161113 (2005).
- Tung, Y. -. C., Kurabayashi, K. A Single-Layer PDMS-On-Silicon Hybrid Microactuator with Multi-Axis Out-Of-Plane Motion Capabilities-Part II: Fabrication and Characterization. Journal of Microelectromechanical Systems. 14, 558-566 (2005).
- Chen, W., Lam, R. H. W., Fu, J. Photolithographic Surface Micromachining of Polydimethylsiloxane (PDMS). Lab on a Chip. 12, 391-395 (2012).
- Balakrisnan, B., Patil, S., Smela, E. Patterning PDMS Using a Combination of Wet and Dry Etching. Journal of Micromechanics and Microengineering. 19, 047002 (2009).
- Takayama, S., et al. Topographical Micropatterning of Poly(dimethylsiloxane) Using Laminar Flows of Liquids in Capillaries. Advanced Materials. 13, 570-574 (2001).
- Friend, J., Yeo, L. Fabrication of Microfluidic Devices Using Polydimethylsiloxane. Biomicrofluidics. 4, 026502 (2010).
- . NANO SU-8 2000 Negative Tone Photoresist formulations 2002-2025 Available from: https://www.seas.upenn.edu/~nanosop/documents/SU8_2002-2025.pdf (2000)
- . NANO SU-8 2000 Negative Tone Photoresist formulations 2035-2100 Available from: https://www.seas.upenn.edu/~nanosop/documents/SU8_2035-2100.pdf (2000)
- Hardt, S., Schönfeld, F. Laminar Mixing in Different Interdigital Micromixers: II. Numerical Simulations. AIChE Journal. 49, 578-584 (2003).
- Hessel, V., Löwe, H., Schönfeld, F. Micromixers-A Review on Passive and Active Mixing Principles. Chemical Engineering Science. 60, 2479-2501 (2005).
- Damiati, S., Kompella, U., Damiati, S., Kodzius, R. Microfluidic Devices for Drug Delivery Systems and Drug Screening. Genes. 9, 103 (2018).
- Wang, C. -. K., et al. Single Step Sequential Polydimethylsiloxane Wet Etching to Fabricate a Microfluidic Channel with Various Cross-Sectional Geometries. Journal of Micromechanics and Microengineering. 27, 115003 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten