È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
One-Step approccio a fabbricare canali microfluidici Polydimethylsiloxane di diverse sezioni geometriche da processi sequenziali acquaforte bagnata
In questo articolo
Riepilogo
Diversi metodi sono disponibili per la realizzazione di canali di sezioni non rettangolari incorporati in dispositivi microfluidici polidimetilsilossano. La maggior parte di essi coinvolgono produzione multistep e vasto allineamento. In questa carta, un approccio One-Step è segnalato per la realizzazione di canali microfluidici di diverse sezioni trasversali geometriche di polidimetilsilossano sequenziale acquaforte bagnata.
Abstract
Materiali di polidimetilsilossano (PDMS) sostanzialmente vengono sfruttate per fabbricare dispositivi microfluidici mediante tecniche di stampaggio di litografia soft replica. Progettazione di layout di canale personalizzati sono necessari per determinate funzioni e prestazioni integrato di dispositivi microfluidici nelle numerose applicazioni biomediche e chimiche (per esempio, la coltura cellulare, biosensori, sintesi chimica e dei liquidi). A causa della natura di approcci utilizzando wafer di silicio con strati di photoresist modellati di fotolitografia come master stampi di stampaggio, i canali microfluidici comunemente hanno sezioni trasversali regolari di forme rettangolari con altezze identiche. In genere, canali con più altezze o sezioni geometriche differenti sono progettati per possedere particolari funzioni e ad esibirsi in varie applicazioni di microfluidica (ad esempio, hydrophoresis viene utilizzato per l'ordinamento di particelle e in flussi continui per che separa le cellule del sangue6,7,8,9). Pertanto, una grande quantità di sforzo è stata fatta nella costruzione di canali con varie sezioni attraverso approcci più-passaggio come fotolitografia utilizzando diversi strati di photoresist e l'assemblaggio di diversi PDMS sottili fogli. Tuttavia, tali approcci più-passaggio di solito comportano procedure noiose e ampia strumentazione. Inoltre, i dispositivi fabbricati non possono eseguire in modo coerente e ha portati dati sperimentali potrebbero essere imprevedibili. Qui, un approccio One-Step è sviluppato per la semplice realizzazione di canali microfluidici con diverse sezioni trasversali geometriche attraverso processi sequenziali acquaforte bagnata di PDMS, che introduce il mordenzante in canali di pianificato monostrato layout incorporato in materiali PDMS. Rispetto ai metodi esistenti per la produzione di canali microfluidici PDMS con diverse geometrie, l'approccio sviluppato uno stadio è in grado di semplificare notevolmente il processo per fabbricare canali con sezioni non rettangolari o di varie altezze. Di conseguenza, la tecnica è un modo di costruire canali microfluidici complessi, che fornisce una soluzione di montaggio per l'avanzamento di sistemi microfluidici innovativi.
Introduzione
Tecniche di microfluidica hanno attirato l'attenzione negli ultimi decenni a causa della loro vantaggi intrinseci per una varietà di applicazioni e ricerca biomedica e chimica. Diverse opzioni di utilizzo del materiale per la costruzione di chip microfluidici sono disponibili al giorno d'oggi, come polimeri, ceramica e materiali di silicio. Al meglio della nostra conoscenza, tra i materiali di microfluidica, PDMS è quella più comune grazie alle sue proprietà di materiale appropriato per vari microfluidica ricerca e applicazioni, comprese le sue compatibilità ottiche e biologici con particelle, fluidi e gli organismi viventi estremamente piccoli di1,2,3,4,5. Inoltre, le proprietà meccaniche chimica e struttura superficiale dei materiali PDMS possono essere regolate per facilitare studi microelettromeccanici e mechanobiological applicando tali dispositivi microfluidici basati su polimeri10, 11,12. Per quanto riguarda la produzione di dispositivi microfluidici con modelli di canale progettato, litografia soft replica stampaggio metodi sono applicati solitamente per creare i canali microfluidici utilizzando loro stampi master corrispondenti che sono composti da strati di photoresist fotolitografia-fantasia e silicon wafer substrati12. A causa della natura di approcci utilizzando wafer di silicio con strati di photoresist modellati del modanatura, i canali microfluidici comunemente hanno sezioni trasversali regolari di forme rettangolari con altezze identiche.
Recentemente, i ricercatori hanno compiuto progressi significativi in studi biomedici che si occupano, per esempio, particelle ordinamento e celle utilizzando hydrophoresis, che separa il plasma sanguigno e arricchendo le cellule bianche del sangue applicando chip microfluidici con canali di diverse altezze o sezioni geometriche6,7,8,9. Tale selezione e separazione funzioni della microfluidica per applicazioni biomediche sono realizzati mediante la personalizzazione dei canali con diverse sezioni geometriche. Parecchi studi sono stati dedicati alla fabbricazione di canali microfluidici con sezioni trasversali delle caratteristiche di geometria diversa da fabbricare stampi master con specifici modelli di superficie di varie altezze o sezioni trasversali non rettangolare. Questi studi sulla fabbricazione della muffa includono tali tecniche come multi-step fotolitografia, riflusso di photoresist e scala di grigi Litografia13,14,15. Le tecniche esistenti comportano inevitabilmente, delle maschere finemente lavorate e un allineamento preciso nei processi di produzione multi-step, che sostanzialmente può migliorare i livelli di complessità di fabbricazione corrispondente dei canali microfluidici. Finora, parecchi tentativi sono stati fatti sui processi di fabbricazione unico passaggio per canali microfluidici di varie sezioni, ma le rispettive tecniche sono altamente limitate a forme specifiche della sezione trasversale di canali16.
Durante le due decadi scorse, oltre gli approcci di stampaggio per la realizzazione di PDMS canali microfluidici con varie sezioni, acquaforte tecniche per patterning canali PDMS con caratteristiche geometriche sono diventati la fabbricazione di scelta in una varietà di applicazioni di microfluidica. Per esempio, acquaforte bagnata PDMS è sfruttato con PDMS multi-strato di legame per la costruzione di un dispositivo di cultura cellulare ad azionamento pneumatico della microfluidica con ricostituito livello di organo polmone funzioni17. Sul bagnato PDMS incisione tecnica è impiegato insieme al casting di PDMS su cilindrici micropozzetti lavorati dai sistemi di controllo computerizzato per fabbricare 3D PDMS microneedle matrici18. Incisione a secco PDMS è usato per fare le microstrutture PDMS come parti di micro-elettromeccanici attuatori19,20. Membrane porose PDMS con poro progettato layout sono realizzate anche attraverso processi di incisione a secco21. Sia sul bagnato e le tecniche di incisione a secco possono essere integrate in patterning film PDMS con forme geometriche designato22.
Tuttavia, le tecniche di incisione per la formazione di PDMS canale strutture con sezione complesse forme comunemente non sono state applicate a causa delle loro intrinseche limitazioni sulla fabbricazione di microfluidica. In primo luogo, mentre le tecniche di attacco a umido PDMS utilizzando flussi laminari di sostanze chimiche per la creazione di canali microfluidici di varie sezioni sono state stabilite, la formazione di sezione canale successivo è ancora limitata a causa delle caratteristiche di base di incisione chimica isotropo elabora23. Inoltre, anche se sembra esserci abbastanza spazio per controllare le geometrie di sezione del canale in una montatura di microfluidica utilizzando l'asciutto PDMS acquaforte tecniche20, il tempo richiesto acquaforte è solitamente troppo lungo (in termini di ore) per essere pratico per la produzione di chip microfluidici. In aggiunta, la selettività di incisione tra materiali PDMS e il mascheramento corrispondente photoresist strati potrebbero essere bassi in generale, e le profondità acidate ha portate per i canali sono, quindi, non accettabile20.
In questa carta, sviluppiamo un approccio One-Step per fabbricare canali microfluidici di diverse sezioni trasversali geometriche di processi sequenziali acquaforte bagnata PDMS (in appresso denominato SWEP). La SWEP iniziano con un dispositivo microfluidico PDMS con canali mono-strato. Con disegni assortiti layout dei canali, fabbricando canali microfluidici con diverse sezioni geometriche di vario genere può essere raggiunto attraverso processi acquaforte sequenziale. L'acquaforte sequenza deve solo un mordenzante ad essere introdotti in canali specifici dei layout pianificato monostrato incorporato in materiali PDMS. Rispetto ai processi convenzionali di fabbricazione PDMS, la SWEP richiedono solo un passo avanti per fabbricare canali microfluidici delle sezioni non rettangolari o varie altezze. La SWEP proposte consentono di fabbricare canali microfluidici con varie sezioni lungo la direzione del flusso, che può semplificare notevolmente i processi in metodi di cui sopra in modo diretto e semplice.
Protocollo
1. fabbricazione di dispositivi microfluidici con strato singolo canale layout
Nota: In questa carta, la litografia soft metodo3 è adottata per la realizzazione di dispositivi microfluidici costituiti da materiali PDMS, per dimostrare come per la fabbricazione di canali con varie sezioni.
-
Creazione di stampi master per un livello PDMS con caratteristiche di topologia progettata
- Progettazione layout di canale su un livello PDMS per un singolo processo di incisione o acquaforte in sequenza.
- Disegnare le caratteristiche di topologia invertito dello strato PDMS progettato utilizzando un programma di disegno CAD.
- Consegnare il file schizzo a un centro di fotolitografia per ottenere un photomask modellato con le caratteristiche di alta precisione invertito topologia dei layout canale stampato su una trasparenza24.
- Utilizzare alcool isopropilico (2-propanolo (IPA), ≥ 99.9%), acetone (Propan-2-one, ≥ 99.5%) e ossido tamponata etch (BOE, NH4F:HF (v/v) = 6:1) sulla superficie di un wafer di silicio da 4 pollici per rimuovere polvere e residui ed evitare contaminazioni.
- Utilizzare circa 500 mL di acqua deionizzata per lavare la lastra di silicio per una lucidatura finale e quindi applicare il gas di azoto per asciugare la cialda risciacquata.
- Posizionare un photoresist tono negativo di circa 20 g sul wafer. Poi giro cappotto la cialda a 500 giri/min per 15 s e 2.000 rpm per 30 s a produrre uno strato di photoresist di circa 75 µm di spessore.
Nota: Photoresist diversi spessori possono essere ottenuti utilizzando i photoresists tono negativo con numeri di prodotti diversi e con diversi spin-coating, cottura e condizioni di sviluppo, secondo l'utente manuali25,26. - Morbido e cuocere la cialda riscaldandolo su una piastra riscaldante a 65 ° C per 3 min e poi a 95 ° C per 9 min.
- Messo la cialda in una macchina di aligner photomask insieme con la trasparenza modellata dal punto 1.1.3 come una maschera.
- Nella macchina aligner, applicare la luce ultravioletta (UV) a 300 mJ/cm2 per esporre la cialda coperta dalla trasparenza.
- Dopo l'esposizione alla luce UV, posizionare la cialda su una piastra riscaldante a 65 ° C per 2 min e poi a 95 ° C per 7 min come cuocere la post-esposizione (PEB).
- In seguito la crepa, fortemente agitare il wafer immerso in uno sviluppatore di photoresist tono negativo, o mettere il wafer immerso in un bagno ad ultrasuoni (37 kHz, efficace potenza di 180 W) per 7 min.
- Pulire la cialda intera nuovo con alcool isopropilico per eliminare qualsiasi sviluppatore rimanendo sulla superficie del wafer.
- Per evitare indesiderate incollaggio, silanizzare la superficie del wafer mettendo la cialda con 100 µ l di 97% Silano (1H, 1H, 2H, 2H- perfluottani-triclorosilano) in una capsula di Petri in un essiccatore di 6 cm.
- Collegare un essiccatore a una pompa a vuoto e regolare la pressione di vuoto a 760 mmHg.
- Successivamente, accendere la pompa per 15 min. Switch off e poi lasciare la cialda per riposare in un vuoto in un essiccatore per 30 min.
Attenzione: Il silano evaporato è estremamente dannoso per gli esseri umani; così, la passivazione superficiale intero wafer deve essere svolta in una cappa aspirante. - Recuperare la cialda silanizzata, che era in fase di passivazione superficiale. Difficoltà la cialda in un 15cm di Petri per ulteriore uso.
Nota: La cialda di fantasia è pronta per essere utilizzato come uno stampo per replicare i layout progettato canale inversamente da materiali PDMS.
-
Realizzazione di layout canale PDMS replicando la topologia invertita sugli stampi
- Mettere la base PDMS (monomero) insieme con il corrispondente catalizzatore (catalizzatore) a un rapporto volumetrico di 10:1 in una tazza di plastica pulita e monouso.
- Mescolare la miscela prepolimero PDMS (dal punto 1.2.1) in modo omogeneo utilizzando un agitatore di potenza.
- Metti la tazza in un essiccatore collegato alla pompa del vuoto per 60 min per rimuovere eventuali bolle intrappolate nella miscela PDMS.
- Versare 20 g (per la sezione 2) o 8 g (per la sezione 3) della miscela prepolimero PDMS in cima al forgi master (effettuata nel passaggio 1.1) con le caratteristiche di topologia invertito dei layout progettato canale e quindi eliminare tutte le bolle possibili incorporate nei materiali PDMS utilizzando t essiccatore di lui (per 60 min).
- Mettere lo stampo portando la miscela PDMS in forno a 60 ° C per 4 h curare i materiali prepolimero liquidi a base di silicone.
- Dopo il raffreddamento la cialda con il PDMS a temperatura ambiente per circa 20 min, staccare il PDMS curata dallo stampo con un bisturi e pinzette.
- Adattare il livello PDMS indipendente ad un covering di zona (circa 6 x 6 cm2 per sezione 2 o 2 x 7,5 cm2 per sezione 3) i layout di intero canale usando un bisturi.
- Creare porte di accesso del canale (ingressi e uscite) utilizzando un pugno di biopsia di 1,5 mm di diametro.
Nota: I numeri e le posizioni degli ingressi e delle uscite sono progettate basata sui processi di incisione per la realizzazione di canali microfluidici specifici. - Versare 30 g della miscela prepolimero PDMS in una capsula Petri e quindi eliminare tutte le bolle possibili incorporate nei materiali PDMS utilizzando un essiccatore (per 60 min).
- Mettere la capsula di Petri portando la miscela PDMS in forno a 60 ° C per più di 4 h curare i materiali liquidi prepolimero.
- Dopo il raffreddamento di Petri insieme il PDMS a temperatura ambiente per circa 20 min, staccare il PDMS curata dal piatto con un bisturi e pinzette.
- Usando un bisturi, adattare il livello PDMS indipendente senza alcune caratteristiche di dimensioni uguali a quelli del suddetto livello PDMS (circa 6 x 6 cm2 per sezione 2 o 2 x 7,5 cm2 per sezione 3).
- Attivare le superfici di entrambi gli strati PDMS (fatti in passaggi 1.2.7 e 1.2.12) con il layout del canale progettato e senza funzionalità esponendo i materiali PDMS superiori al plasma di ossigeno in una macchina di trattamento di superficie a 90 W per 40 s.
- Bond il 2 PDMS strati facendo contatto tra le superfici trattate subito dopo l'attivazione superficiale al plasma di ossigeno. Quindi, lasciare gli strati PDMS in forno a 60 ° C per più di 30 min.
Nota: Non c'è nessun limite di tempo per lasciare gli strati PDMS in forno. - Dopo il 2 legato PDMS strati si sono raffreddate, tagliare i materiali in eccesso PDMS dal dispositivo fabbricato per una struttura sperimentale più tardi.
2. l'approccio di uno stadio a fabbricare canali microfluidici PDMS delle diverse sezioni
Nota: Un dispositivo microfluidico con un canale singolo strato e diritto di forme rettangolari per caratterizzare il PDMS bagnato tasso acquaforte, è suggerito per essere sfruttata per l'identificazione di specifici acquaforte tariffe corrispondenti a determinate impostazioni sperimentali.
-
Caratterizzazione sperimentale di PDMS attacco a umido
- Preparare una soluzione mordenzante con fluoruro di tetra-n-butylammonium (TBAF, una soluzione 1 M in tetraidrofurano (THF)) con 1-metil-2-pirrolidinone (NMP) ad un tasso di v: v = 01:10.
Nota: NMP è in grado di sciogliere efficacemente residui chimici indotti dai mordenzanti. In generale, materiali PDMS sono gonfie marginalmente dal NMP, e i dispositivi microfluidici PDMS sono ancora in grado di preservare le loro forme, volumi e le condizioni della guarnizione. - Disegnare il etchants TBAF/NMP misto in una siringa da 10 mL collegata ad un ago smussato inox (16 G).
- Installare una pompa a siringa come un controller dei fluidi basati su pressione nei canali.
- Collegare gli smussato aghi delle siringhe riempite con la soluzione mordenzante al porto canale del suddetto dispositivo semplice e guida la porta interessata dalla presa di tubatura a un contenitore per rifiuti, come mostrato nella Figura 1.
- Eseguire la pompa a siringa che trasportano le siringhe contenenti la soluzione mordenzante TBAF/NMP mista ad una 150 µ l/min di portata per caratterizzare il PDMS attacco a umido.
- Utilizzare viste al microscopio luminoso-campo e assicurarsi che il canale inciso lungo la direzione di flusso ha una larghezza uniforme, per confermare di conseguenza che il volume della miscela dei mordenzanti e la portata di mordenzante sono adeguate.
- Catturare le immagini di serie temporali del canale sezione trasversale sotto un microscopio invertito con un ingrandimento 4x durante il processo di incisione di PDMS.
- Analizzare le immagini memorizzate applicando la funzione di misura di base in un'analisi 2D del programma di elaborazione immagini per raccogliere una sequenza temporale di numeri per la larghezza del canale durante il bagnato mordenzatura dei materiali PDMS.
- Valutare i tassi di acquaforte di serie temporali attraverso l'equazione mostrata nella Figura 2, che sta dividendo il 50% della variazione di larghezza di canale (ΔW / 2) per la durata dell'acquaforte PDMS (t).
- Eseguire una regressione lineare dei punti dati raccolti per stimare un complessivo pari acquaforte il etchants TBAF/NMP misto con il volume specifico della miscela di 01:10 per i materiali PDMS come mostrato nella Figura 2.
- Preparare una soluzione mordenzante con fluoruro di tetra-n-butylammonium (TBAF, una soluzione 1 M in tetraidrofurano (THF)) con 1-metil-2-pirrolidinone (NMP) ad un tasso di v: v = 01:10.
-
PDMS sequenziale bagnato acquaforte per la realizzazione di canali microfluidici di diverse sezioni geometriche
- Progettare un arrangiamento di mordenzante insenature per il layout di canale PDMS monostrato che serve il corrispondente acquaforte processi in sequenza, così che può essere fabbricato un tipo di canale specifico delle diverse forme della sezione trasversale come mostrato nella Figura 3 .
- Seguire le procedure descritte nei passaggi 2.1.1 - 2.1.7 per il bagnato PDMS acquaforte approccio.
Nota: La portata viene impostata come 50 μL/min. - Mentre il TBAF/NMP etchants stanno fluendo, ispezionare i canali incisi sotto il microscopio per vedere se esistono problemi significativi come una notevole quantità di bolle, un residuo di diversi residui chimici indotti da mordenzanti, una perdita di mordenzanti, o un flusso di etchants su un piano inclinato.
- Osservare la variazione di spessore parete canale microfluidico microscopio invertito e tempo sul bagnato mordenzatura per garantire il che raggiungono le geometrie di canale corretto.
3. la progettazione di un Mixer di microfluidica
Nota: Un design del miscelatore microfluidici che possa efficacemente mescolare 2 fluidi dissimili è dimostrato qui per mostrare un'applicazione vantaggiosa di canali microfluidici con diverse sezioni.
-
Fabbricazione di un mixer di microfluidica con sezioni di canale diverso
- Fare un dispositivo PDMS con un canale singolo strato microfluidic del progetto illustrato nella Figura 4 dalla replica di litografia soft stampaggio tecnica (sezione 2).
- Nel layout di canale singolo strato microfluidica, introdurre la soluzione mordenzante TBAF/NMP preparata seguendo le procedure descritte al punto 2.1.1 dal porto contrassegnato come "presa" con una portata di 20 µ l/min in Figura 4.
- Osservare la variazione di spessore parete canale microfluidico sotto il microscopio e tempo sul bagnato mordenzatura per garantire il raggiungono le geometrie di canale corretto come rappresentato in Figura 5 .
-
Caratterizzazione sperimentale del mixer microfluidica
- Dopo il canale microfluidico con sezioni di forma diversa in modo alternato è realizzato, fluidi dissimili pompa 2, incluso una soluzione di fluoresceina sodica avendo una concentrazione di 50 µ g/mL di sale e acqua distillata in 2 canali separati a un 20 µ l/min tasso di flusso.
- Prendere la fluorescenza immagini al microscopio del canale nella vista superiore alle posizioni contrassegnate come A, B, C e D sotto un microscopio invertito (ingrandimento 4x) per i 2 miscelatori con uniforme (prima acquaforte) e diversi geometrico sezioni (dopo 2 h di SWEP), rispettivamente ( Figura 6).
Nota: Le immagini del microscopio di fluorescenza sono presi mentre i flussi stabili verificano, nel punto di tempo di 5 min, contato dai momenti di inizio della miscelazione attraverso i canali del mixer. - Analizzare le immagini fluorescenti catturate utilizzando un programma di elaborazione grafica per stimare i corrispondenti numeri di efficienza che sono definiti dalla miscelazione residuo di miscelazione (MR, 0,5 = non miscelati, 0 = completamente misto) nell' equazione seguente27, 28:
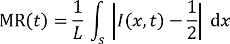
Qui,
t è il tempo di incisione,
L è la larghezza del canale in una certa posizione di interesse,
S è un segmento di linea attraverso il canale nella posizione, e
I è la distribuzione di intensità di fluorescenza oltre S a t. - Tracciare la distribuzione dell'intensità di fluorescenza nel S attraverso il canale alle posizioni contrassegnate come A, B, C e D per i 2 miscelatori con uniforme (prima acquaforte) e diversi geometrico sezioni (dopo 2 h di SWEP), rispettivamente. Stimare il signor corrispondenti come illustrato nella Figura 6.
Risultati
Recentemente, un gran numero di studi è stato apportato sulla fabbricazione di dispositivi microfluidici con canali di diverse sezioni dalla replica di Litografia stampaggio13,14,15 e PDMS acquaforte tecniche17 , 18 , 19 , 20 , 21
Discussione
Negli ultimi decenni, microfluidica ha offerto mezzo promettente che piattaforme sperimentali per la ricerca biomedica e chimica possono essere costruito sistematicamente1,2,3,4, 5. Le piattaforme hanno presentato le loro capacità di indagare diverse funzioni cellulari in vivo in condizioni fisiologiche microambiente via in vitro delle cell...
Divulgazioni
Gli autori non hanno nulla da dichiarare.
Riconoscimenti
Gli autori riconoscono con gratitudine il sostegno fornito da istituti nazionali per la ricerca salute (vi) in Taiwan sotto l'innovativa ricerca Grant (IRG) (EX106-10523EI), Taiwan Ministero di scienza e tecnologia (più 104-2218-E-032-004, 104 - 2221 - E-001-015-MY3, 105-2221-E-001-002-MY2, 105-2221-E-032-006, 106-2221-E-032-018-MY2) e l'Academia Sinica Career Development Award. Gli autori vorrei ringraziare Heng-Hua Hsu per la correzione del manoscritto.
Materiali
| Name | Company | Catalog Number | Comments |
| 1-Methyl-2-Pyrrolidinone | Tedia, Fairfield, OH | ME-1962 | NMP |
| 10 ml Syringe | Becton-Dickinson, Franklin Lakes, NJ | 302151 | |
| 150 mm Petri dish | Dogger Science | DP-43151 | |
| 1H,1H,2H,2H- Perfluorooctyltrichlorosilane | Alfa Aesar, Ward Hill, MA | L16606 | 97 % silane |
| 4'' Silicon Dummy Wafer | Wollemi Technical, Taoyuan, Taiwan | - | |
| Acetone | ECHO Chemical, Miaoli, Taiwan | AH3102-000000-72EC | |
| AG Double Expose Mask Aligner | M&R Nano Technology, Taoyuan, Taiwan | AG500-4D-D-V-S-H | |
| Biopsy Punch | Miltex, Plainsboro, NJ | 33-31 | |
| Blunt Needle | Jensen Global, Santa Barbara, CA | Gauge 16 | |
| Buffered Oxide Etch | ECHO Chemical, Miaoli, Taiwan | PH3101-000000-72EC | |
| Desicattor | A-VAC Industries, Anaheim, CA | 35.10001.01 | |
| Fluorescein Sodium Salt Water | Sigma-Aldrich Co., St Louis, MO | F6300 | |
| ImageJ | National Institutes of Health, Bethesda, MD | Ver. 1.51 | Imaging Processing Program |
| Inverted Fluorescence Microscope | Leica Microsystems, Wetzlar, Germany | DMI 6000 B | |
| Isopropyl Alcohol (IPA) | ECHO Chemical, Miaoli, Taiwan | CMOS112-00000-72EC | |
| Leica Application Suite | Leica Microsystems GmbH | LAS X | |
| MATLAB | MathWorks, Natick, MA | R2015b | Programming for MR evaluation |
| Mechanical Convention Oven | ThermoFisher Scientific,Waltham, MA | Lindberg Blue M MO1450C | |
| Plasma Tretment System | Nordson MARCH, Concord CA | PX-250 | Oxygen plasma surface treatment |
| Polydimehtylsiloxane (PDMS) | Dow Corning, Midland, MI | SYLGARD 184 | |
| Polyethylene Tubing | Becton-Dickinson and Company, Sparks, MD | 427446 | PE 205, 10' |
| Spin Coater | ELS Technology, Hsinchu, Taiwan | ELS 306MA | |
| Negative Tone Photoresist | MicroChem, Westborough, MA | SU-8 2050 | |
| Negative Tone Photoresist Developer | MicroChem, Westborough, MA | Y020100 | SU-8 Developer |
| Surgical Blade | Feather, Osaka, Japan | 5005093 | PDMS cutting |
| Syringe Pump | Chemyx, Houston, TX | Fusion 400 | |
| Tetra-n-butylammonium Fluoride (TBAF) | Alfa Aesar, Ward Hill, MA | A10588 |
Riferimenti
- Tung, Y. -. C., et al. Optofluidic Detection for Cellular Phenotyping. Lab on a Chip. 12, 3552-3565 (2012).
- Lu, Y., Yang, L., Wei, W., Shi, Q. Microchip-based Single-cell Functional Proteomics for Biomedical Applications. Lab on a Chip. 17, 1250-1263 (2017).
- Jensen, K. F., Reizman, B. J., Newman, S. G. Tools for Chemical Synthesis in Microsystems. Lab on a Chip. 14, 3206-3212 (2014).
- Chang, C. -. W., et al. A Polydimethylsiloxane-polycarbonate Hybrid Microfluidic Device Capable of Generating Perpendicular Chemical and Oxygen Gradients for Cell Culture Studies. Lab on a Chip. 14, 3762-3772 (2014).
- Mosadegh, B., et al. Integrated Elastomeric Components for Autonomous Regulation of Sequential and Oscillatory Flow Switching in Microfluidic Devices. Nature Physics. 6, 433-437 (2010).
- Choi, S., Park, J. -. K. Tuneable Hydrophoretic Separation Using Elastic Deformation of Poly(Dimethylsiloxane). Lab on a Chip. 9, 1962-1965 (2009).
- Choi, S., Song, S., Choi, C., Park, J. -. K. Microfluidic Self-Sorting of Mammalian Cells to Achieve Cell Cycle Synchrony by Hydrophoresis. Analytical Chemistry. 81, 1964-1968 (2009).
- VanDelinder, V., Groisman, A. Separation of Plasma from Whole Human Blood in a Continuous Cross-Flow in a Molded Microfluidic Device. Analytical Chemistry. 78, 3765-3771 (2006).
- VanDelinder, V., Groisman, A. Perfusion in Microfluidic Cross-Flow: Separation of White Blood Cells from Whole Blood and Exchange of Medium in a Continuous Flow. Analytical Chemistry. 79, 2023-2030 (2007).
- Duffy, D. C., McDonald, J. C., Schueller, O. J., Whitesides, G. M. Rapid Prototyping of Microfluidic Systems in Poly(dimethylsiloxane). Analytical Chemistry. 70 (23), 4974-4984 (1998).
- Xia, Y., Whitesides, G. M. Soft Lithography. Annual Review of Material Science. 28, 153-184 (1998).
- Mello, A. Plastic Fantastic?. Lab on a Chip. 2, 31N-36N (2002).
- Choi, S., Park, J. -. K. Two-step Photolithography to Fabricate Multilevel Microchannels. Biomicrofluidics. 4, 046503 (2010).
- Zhong, K., Gao, Y., Li, F., Zhang, Z., Luo, N. Fabrication of PDMS Microlens Array by Digital Maskless Grayscale Lithography and Replica Molding Technique. Optik. 125, 2413-2416 (2013).
- Brower, K., White, A. K., Fordyce, P. M. Multi-step Variable Height Photolithography for Valved Multilayer Microfluidic Devices. Journal of Visualized Experiments. (119), e55276 (2017).
- Lai, D., et al. Simple Multi-level Microchannel Fabrication by Pseudo-grayscale Backside Diffused Light Lithography. RSC Advances. 3, 19467-19473 (2013).
- Huh, D., et al. Reconstituting Organ-Level Lung Functions on a Chip. Science. 328, 1662-1668 (2010).
- Deng, Y. -. L., Juang, Y. -. J. Polydimethyl Siloxane Wet Etching for Three-Dimensional Fabrication of Microneedle Array and High-Aspect-Ratio Micropillars. Biomicrofluidics. 8, 026502 (2014).
- Tung, Y. -. C., Kurabayashi, K. Nanoimprinted Strain-controlled Elastomeric Gratings for Optical Wavelength Tuning. Applied Physics Letters. 86, 161113 (2005).
- Tung, Y. -. C., Kurabayashi, K. A Single-Layer PDMS-On-Silicon Hybrid Microactuator with Multi-Axis Out-Of-Plane Motion Capabilities-Part II: Fabrication and Characterization. Journal of Microelectromechanical Systems. 14, 558-566 (2005).
- Chen, W., Lam, R. H. W., Fu, J. Photolithographic Surface Micromachining of Polydimethylsiloxane (PDMS). Lab on a Chip. 12, 391-395 (2012).
- Balakrisnan, B., Patil, S., Smela, E. Patterning PDMS Using a Combination of Wet and Dry Etching. Journal of Micromechanics and Microengineering. 19, 047002 (2009).
- Takayama, S., et al. Topographical Micropatterning of Poly(dimethylsiloxane) Using Laminar Flows of Liquids in Capillaries. Advanced Materials. 13, 570-574 (2001).
- Friend, J., Yeo, L. Fabrication of Microfluidic Devices Using Polydimethylsiloxane. Biomicrofluidics. 4, 026502 (2010).
- . NANO SU-8 2000 Negative Tone Photoresist formulations 2002-2025 Available from: https://www.seas.upenn.edu/~nanosop/documents/SU8_2002-2025.pdf (2000)
- . NANO SU-8 2000 Negative Tone Photoresist formulations 2035-2100 Available from: https://www.seas.upenn.edu/~nanosop/documents/SU8_2035-2100.pdf (2000)
- Hardt, S., Schönfeld, F. Laminar Mixing in Different Interdigital Micromixers: II. Numerical Simulations. AIChE Journal. 49, 578-584 (2003).
- Hessel, V., Löwe, H., Schönfeld, F. Micromixers-A Review on Passive and Active Mixing Principles. Chemical Engineering Science. 60, 2479-2501 (2005).
- Damiati, S., Kompella, U., Damiati, S., Kodzius, R. Microfluidic Devices for Drug Delivery Systems and Drug Screening. Genes. 9, 103 (2018).
- Wang, C. -. K., et al. Single Step Sequential Polydimethylsiloxane Wet Etching to Fabricate a Microfluidic Channel with Various Cross-Sectional Geometries. Journal of Micromechanics and Microengineering. 27, 115003 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon