É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Abordagem de uma etapa para fabricar polidimetilsiloxano Microfluidic canais de diferentes seções geométricas por processos sequenciais gravura molhado
Neste Artigo
Resumo
Vários métodos estão disponíveis para a fabricação de canais das seções não-retangulares incorporadas em dispositivos microfluídicos de polidimetilsiloxano. A maioria deles envolve várias etapas fabricação e extenso alinhamento. Neste trabalho, uma abordagem de uma etapa é relatada para fabricar microfluidic canais de diferentes geométrica das secções transversais pelo polidimetilsiloxano sequencial gravura molhado.
Resumo
Materiais de polidimetilsiloxano (PDMS) substancialmente são exploradas para fabricar dispositivos microfluídicos usando técnicas de moldagem de réplica de litografia macia. Canal personalizado topografias são necessárias para o desempenho integrado de dispositivos microfluídicos em numerosas aplicações biomédicas e químicas (por exemplo, cultura de células, biosensing, síntese química e manipulação de líquidos) e funções específicas. Devido à natureza da moldagem abordagens usando wafers de silício com camadas de fotorresiste modeladas por fotolitografia como mestre moldes, os canais microfluídicos comumente têm regulares seções transversais de formas retangulares com alturas idênticas. Normalmente, canais com várias alturas ou diferentes seções geométricas são projetados para possuir funções específicas e realizar em várias aplicações de microfluidic (por exemplo, hydrophoresis é usado para classificar as partículas e em fluxos contínuos para separando as células do sangue6,7,8,9). Portanto, foi feita uma grande quantidade de esforço na construção de canais com várias seções, através de abordagens de várias etapas como fotolitografia usando várias camadas de fotorresiste e montagem de PDMS diferentes finas folhas. No entanto, tais abordagens várias etapas geralmente envolvem procedimentos tediosos e instrumentação extensa. Além disso, os dispositivos fabricados não podem executar consistentemente e os dados experimentais de resultado podem ser imprevisíveis. Aqui, é desenvolvida uma abordagem de uma etapa para a fabricação direta de canais microfluídicos com as diferentes seções transversais geométricas através de processos de gravura molhado sequencial de PDMS, que introduz o condicionador em canais de layouts de camada única planejadas incorporado em materiais PDMS. Em comparação com os métodos existentes para a fabricação de canais microfluídicos PDMS com diferentes geometrias, a abordagem de uma etapa desenvolvido significativamente pode simplificar o processo para fabricar canais com seções não-retangulares ou várias alturas. Consequentemente, a técnica é uma forma de construir canais microfluídicos complexo, que fornece uma solução de fabricação para o avanço dos sistemas microfluídicos inovadoras.
Introdução
Microfluidic técnicas já chamou a atenção nas últimas décadas por causa de suas vantagens intrínsecas para uma variedade de aplicações e pesquisa biomédica e química. Várias opções de uso de material para a construção de chips microfluídicos estão disponíveis hoje em dia, tais como polímeros, cerâmicas e materiais do silicone. O melhor de nosso conhecimento, entre os materiais microfluídicos, PDMS é o mais comum devido a suas propriedades de material apropriadas para vários microfluídica pesquisa e aplicações, incluindo suas compatibilidades ópticas e biológicas com partículas, fluidos e organismos vivos extremamente pequeno1,2,3,4,5. Além disso, as superfície química e estrutura propriedades mecânicas de materiais PDMS podem ser ajustadas para facilitar estudos Microeletromecânicos e mechanobiological através da aplicação de tais dispositivos microfluídicos baseado em polímero10, 11,12. No que diz respeito ao fabrico de dispositivos microfluídicos com padrões de canal projetado, métodos de moldagem de réplica de litografia macia são geralmente aplicados para criar os canais microfluídicos, utilizando seus moldes mestre correspondentes, que são compostos de fotolitografia-modelados fotorresiste camadas e silicone bolacha substratos12. Devido à natureza da moldagem abordagens usando wafers de silício com camadas de fotorresiste estampados, os canais microfluídicos comumente têm regulares seções transversais de formas retangulares com alturas idênticas.
Recentemente, pesquisadores fizeram progressos significativos em estudos biomédicos que lidar, por exemplo, classificação de partículas e células usando hydrophoresis, separando o plasma sanguíneo e enriquecendo glóbulos brancos aplicando microfluidic chips com canais de alturas diferentes ou seções geométricas6,7,8,9. Tal classificação e separação de funções de microfluídica para aplicações biomédicas são realizadas Personalizando canais com diferentes seções geométricas. Vários estudos têm se dedicado ao fabrico de canais microfluídicos com seções transversais das características de geometria diferente por fabricando moldes mestre com testes padrões de superfície específicos de várias alturas ou não-retangulares de seções transversais. Estes estudos na fabricação do molde incluem técnicas como multi-passo fotolitografia, fotorresiste refluxo e litografia de escala de cinza de14,13,15. Inevitavelmente, as técnicas existentes envolvem máscaras finamente trabalhadas ou um alinhamento preciso em processos de produção de várias etapas, que substancialmente pode aumentar os níveis de complexidade de fabricação dos canais microfluídicos correspondente. Até agora, várias tentativas foram feitas em processos de fabricação de etapa única para os canais microfluídicos de várias seções, mas as respectivas técnicas são altamente restritas a formas específicas de seção transversais de canais16.
Nas últimas duas décadas, além das abordagens de molde para a fabricação de PDMS microfluidic canais com várias seções, gravura técnicas para padronização canais PDMS com características geométricas tornaram-se a fabricação de escolha em uma variedade de microfluidic aplicações. Por exemplo, gravura molhada PDMS é explorada juntamente com PDMS multi-camada de ligação para a construção de um dispositivo de cultura celular atuada pneumática de microfluídica com funções de pulmão reconstituído de órgãos-nível17. PDMS molhado técnica de gravura é empregado em conjunto com a fundição de PDMS na cilíndricas micropoços usinados por sistemas de controle por computador para a fabricação de matrizes de microneedle PDMS 3D18. Gravura de seca de PDMS é usada para fazer microestruturas PDMS como partes de atuadores eletromecânicos-micro19,20. Membranas PDMS porosas com layouts de poro projetado também são fabricadas através de de processos de gravura seca21. O molhou- e as técnicas de gravura seca podem ser integradas padronização filmes PDMS com formas geométricas designadas22.
No entanto, as técnicas de gravura para formar PDMS canal estruturas com seção complexa formas não tiverem sido aplicadas comumente por causa de suas limitações intrínsecas na fabricação microfluidic. Em primeiro lugar, enquanto as técnicas de gravura molhada de PDMS utilizando fluxos laminar de produtos químicos para a criação de canais microfluídicos de várias seções foram estabelecidas, a formação de seção do canal posterior é ainda restrita devido às características básicas de decapagem química isotrópica processos23. Além disso, mesmo que parece haver um espaço razoável para controlar as geometrias de seção do canal em uma fabricação de microfluídica usando o seco PDMS gravura técnicas20, o tempo de condicionamento necessário é geralmente muito longo (em termos de horas) para ser práticas para a fabricação de chips microfluídicos. Além disso, a seletividade de gravura entre materiais PDMS e o mascaramento correspondente fotorresiste camadas podem ser baixas, em geral, e das profundezas gravadas resultou para os canais, assim, não são aceitáveis20.
Neste trabalho, desenvolvemos uma abordagem de uma etapa para fabricar microfluidic canais de diferentes geométrica das secções transversais por processos de gravura molhado sequencial de PDMS (doravante referidos como SWEP). O SWEP começam com um dispositivo de microfluidic PDMS com canais de camada única. Com variadas topografias dos canais, canais microfluídicos com diferentes seções geométricas de vários tipos de fabricação pode ser conseguido através de processos de gravura sequencial. A gravura sequencial só precisa de um ácido para ser introduzido em canais específicos dos layouts planejados monocamada incorporados em materiais PDMS. O SWEP comparado aos processos convencionais de fabricação de PDMS, exigem apenas um passo adicional para fabricar canais microfluídicos das seções não-retangulares ou várias alturas. O SWEP proposto fornecem uma maneira fácil e simples de fabricar microfluidic canais com várias seções ao longo da direção de fluxo, que pode simplificar significativamente os processos nos métodos acima mencionados.
Protocolo
1. fabricação de dispositivos microfluídicos com camada única canal Layouts
Nota: Neste trabalho, o método de litografia macia3 é adotado para fabricar dispositivos microfluídicos feitos de materiais PDMS, para demonstrar como produzir canais com várias seções.
-
Criação de moldes mestre para uma camada PDMS com características de topologia projetada
- Projetar layouts de canal em uma camada PDMS para um único processo de decapagem ou gravura em sequência.
- Esboçar as características invertido de topologia de camada de PDMS projetada usando um programa de desenho assistido por computador.
- Entrega o arquivo de desenho para uma instalação de fotolitos para obter uma Fotomáscara estampada com as características de alta precisão invertido topologia dos layouts canal imprimidos em uma transparência24.
- Uso com álcool isopropílico (2-Propanol (IPA), ≥ 99,9%), acetona (Propan-2-ona, ≥ 99.5%) e óxido de buffer etch (BOE, NH4F:HF (v/v) = 6:1) na superfície de um wafer de silício de 4 polegadas para remover qualquer poeira ou resíduos e evitar contaminações.
- Use cerca de 500 mL de água desionizada para lavar o wafer de silício para um polimento final e aplique gás nitrogênio para secar a bolacha enxaguada.
- Coloque um tom negativo fotorresiste de cerca de 20 g a bolacha. Em seguida, girar revestir a bolacha a 500 rpm por 15 s e 2.000 rpm para 30 s para produzir uma camada de fotorresiste de cerca de 75 µm de espessura.
Nota: Fotorresiste diferentes espessuras podem ser conseguidas usando tom negativo photoresists com números diferentes de produto e com revestimento de rotação diferente, cozimento e condições de desenvolvimento, de acordo com os manuais de usuário25,26. - Macio, asse a bolacha aquecendo em uma placa de aquecimento a 65 ° C por 3 min e em seguida a 95 ° C por 9 min.
- Coloque a bolacha numa máquina de alinhador Fotomáscara juntamente com a transparência padronizada da etapa 1.1.3 como uma máscara.
- Na máquina de alinhador, aplica os luz ultravioleta (UV) a 300 mJ/cm2 para expor o wafer coberto pela transparência.
- Após a exposição à luz UV, coloque a bolacha sobre uma placa de aquecimento a 65 ° C por 2 min e, em seguida, a 95 ° C por 7 min como os bolos de pós-exposição (PEB).
- Na sequência do PEB, fortemente agitar a bolacha imergida em um desenvolvedor de fotorresiste Tom negativo, ou coloque a bolacha imersa em um banho ultra-sônico (37 kHz, potência efetiva de 180 W) por 7 min.
- Limpe a hóstia inteira novamente com álcool isopropílico para eliminar qualquer desenvolvedor permanecendo na superfície da bolacha.
- Para evitar a indesejada de ligação, silanize a superfície do wafer, colocando a bolacha juntamente com 100 µ l de 97% de silano (1H, 1H, 2H, 2H- perfluorooctyl-triclorosilano) em uma placa de Petri num exsicador de 6cm.
- Estabelecer conexão exsicador para uma bomba de vácuo e a pressão do vácuo no 760 mmHg.
- Em seguida, liga a bomba durante 15 min. Switch-la e então deixar a bolacha para descansar em um vácuo no exsicador por 30 min.
Atenção: O silano evaporado é extremamente prejudicial aos seres humanos; assim, a passivação de bolacha toda superfície deve ser efectuada em uma coifa. - Buscar a bolacha silanizadas, que estava passando por superfície passivação. Corrigi a bolacha em um prato de Petri para utilização posterior de 15 cm.
Nota: A bolacha padronizada está pronta para ser usada como um molde para replicar os layouts do canal projetado inversamente por materiais PDMS.
-
Fabricação de layouts de canal PDMS, replicando a topologia invertida sobre os moldes
- Colocar a base PDMS (monômero) juntamente com o catalisador correspondente (agente de cura) em uma relação de volume de 10:1 em um copo de plástico limpo e de uso único.
- Misture a mistura prepolymer PDMS (da etapa 1.2.1) homogênea, utilizando um agitador de poder.
- Coloque o copo no exsicador conectado à bomba de vácuo para 60 min para remover quaisquer bolhas presas na mistura de PDMS.
- Despeje a 20 g (para seção 2) ou 8 g (para a secção 3) da mistura prepolymer PDMS em cima o molde mestre (feito na etapa 1.1) com as características da topologia invertido dos layouts do canal projetado e então eliminar qualquer possíveis bolhas incorporadas nos materiais PDMS usando t Exsicador, (para 60 min).
- Coloque o molde com a mistura PDMS em estufa a 60 ° C por 4 h curar os materiais prepolymer líquidos à base de silicone.
- Após arrefecimento a bolacha juntamente com o PDMS à temperatura ambiente por aproximadamente 20 min, desanexe o PDMS curado do molde com um bisturi e uma pinça.
- Adaptar a camada PDMS destacada para uma cobertura de área (aproximadamente 6 x 6 cm2 a secção 2 ou 2 x 7,5 cm2 para a secção 3) os layouts de todo canal usando um bisturi.
- Crie portas de acesso do canal (entradas e saídas) usando um soco biópsia de 1,5 mm de diâmetro.
Nota: Os números e as posições das entradas e saídas são projetadas com base em processos de gravura para canais microfluídicos específicos de fabricação. - Despeje 30 g da mistura prepolymer PDMS em uma placa de Petri e em seguida, eliminar qualquer possíveis bolhas incorporadas nos materiais PDMS usando o dessecador (para 60 min).
- Coloque o prato de Petri carregando a mistura PDMS em estufa a 60 ° C, durante mais de 4 h curar os materiais líquidos prepolymer.
- Após refrigerar a placa de Petri em conjunto com o PDMS à temperatura ambiente por aproximadamente 20 min, desanexe o PDMS curado do prato com um bisturi e uma pinça.
- Usando um bisturi, adaptar a camada PDMS isolada sem quaisquer características de dimensões iguais da camada acima de PDMS (aproximadamente 6 x 6 cm2 a secção 2 ou 2 x 7,5 cm2 para a secção 3).
- Ativar as superfícies de ambas as camadas PDMS (feitas em etapas 1.2.7 e 1.2.12) com os layouts do canal projetado e sem quaisquer recursos, expondo os materiais top de PDMS para plasma de oxigênio em uma máquina de tratamento de superfície em 90 W para 40 s.
- Bond os 2 PDMS camadas, fazendo contato entre as superfícies tratadas logo após a ativação de superfície de plasma de oxigênio. Em seguida, deixe as camadas coladas de PDMS em estufa a 60 ° C por mais de 30 min.
Nota: Não há nenhum limite superior de tempo para deixando as camadas PDMS ligadas no forno. - Depois de ligado o 2 camadas PDMS esfriaram, apare os excesso materiais PDMS longe o dispositivo fabricado para uma montagem experimental mais tarde.
2. a abordagem de uma etapa para fabricar PDMS Microfluidic canais de diferentes seções
Nota: Para caracterizar o PDMS molhado taxa de gravura, um dispositivo microfluidic com um canal de camada única e em linha reto de formas retangulares é sugerido para ser explorada para identificar taxas de condicionamento específicos correspondentes a determinadas configurações experimentais.
-
Caracterização experimental de PDMS molhado gravura
- Prepare uma solução de ácido pela mistura de fluoreto de tetra-n-butilamônio (TBAF, solução em tetrahidrofurano (THF) 1M) com 1-metil-2-pirrolidona (NMP) a uma taxa de v: v = 01:10.
Nota: NMP é capaz de dissolver eficientemente resíduos químicos induzidos pelos ácidos. Em geral, materiais PDMS estão inchados marginalmente pelo NMP, e os dispositivos microfluídicos PDMS ainda são capazes de preservar suas formas, volumes e as condições do selo. - Desenhe os ácidos TBAF/NMP misturados em uma seringa de 10 mL, conectada a uma agulha inoxidável (16G).
- Configure uma bomba de seringa como um controlador dos fluidos controlado por pressão nos canais.
- Conectar as agulhas sem corte das seringas preenchidas com a solução de ácido para o porto canal do supracitado dispositivo simples e orientar a respectiva porta de saída do tubo para um contentor de resíduos, conforme mostrado na Figura 1.
- Execute a bomba de seringa, carregando as seringas que contém a solução de ácido mista TBAF/NMP caudal 150 µ l/min para caracterizar o PDMS molhado gravura.
- Use brilhante-campo microscópicas exibições e certifique-se que o canal gravado ao longo da direção de fluxo tem uma largura uniforme, consequentemente, confirmar que o volume de mistura a relação entre os ácidos e a taxa de fluxo do condicionador são adequados.
- Capturar as imagens de séries temporais do canal de seção transversal sob um microscópio invertido com uma ampliação de 4x durante o PDMS processo de gravura.
- Analise as imagens armazenadas, aplicando a função básica de medição em uma análise 2D do programa de processamento de imagem para coletar uma sequência de tempo dos números para a largura do canal durante o molhado gravura processo de PDMS materiais.
- Avaliar as taxas de gravura de séries temporais através da equação mostrada na Figura 2, que está a dividir 50% da alteração da largura do canal (ΔW / 2) pela duração do condicionamento PDMS (t).
- Realizar uma regressão linear dos pontos de dados coletados para estimar um total taxa de gravura dos ácidos TBAF/NMP misturados com o volume específico a relação de 01:10 para os materiais PDMS de mistura, como mostrado na Figura 2.
- Prepare uma solução de ácido pela mistura de fluoreto de tetra-n-butilamônio (TBAF, solução em tetrahidrofurano (THF) 1M) com 1-metil-2-pirrolidona (NMP) a uma taxa de v: v = 01:10.
-
PDMS sequencial molhado gravura para fabricar microfluidic canais de diferentes seções geométricas
- Projete um arranjo de etchant entradas para o layout de canal PDMS de camada única servindo o correspondente gravura processos em sequência, para que um tipo específico de canal de diferentes formas de seção transversais como mostrado na Figura 3 pode ser fabricado.
- Siga os procedimentos descritos nas etapas 2.1.1 - 2.1.7 para PDMS molhado gravura abordagem.
Nota: A taxa de fluxo é definida como 50 µ l/min. - Enquanto os ácidos TBAF/NMP estão fluindo, inspecionar os canais gravados sob o microscópio para ver se existem problemas significativos como uma notável quantidade de bolhas, um remanescente de vários resíduos químicos induzidos pelos ácidos, um escapamento dos ácidos, ou um fluxo de ácidos sobre um plano inclinado.
- Observar a variação de espessura de parede de canal microfluidic por microscópio invertido e tempo molhado gravura processo para garantir que as geometrias de canal adequado são alcançadas.
3. o projeto de um misturador de Microfluidic
Nota: Um projeto do mixer microfluidic que eficientemente pode misturar 2 fluidos dissemelhantes é demonstrado aqui para mostrar uma aplicação vantajosa de canais microfluídicos com seções diferentes.
-
Fabricação de um misturador de microfluidic com seções diferentes do canal
- Fazer um dispositivo PDMS com um canal de camada única microfluidic do desenho mostrado na Figura 4 pela réplica de litografia macia moldagem técnica (secção 2).
- No layout de canal de camada única microfluídicos, introduza a solução de ácido TBAF/NMP preparada, seguindo os procedimentos descritos na etapa 2.1.1 da porta marcada como "saída", com um caudal de 20 µ l/min na Figura 4.
- Observar a variação de espessura de parede de canal microfluidic sob o microscópio e tempo molhado gravura processo para garantir que as geometrias de canal adequado, conforme representado na Figura 5 são alcançadas.
-
Caracterização experimental do mixer microfluídicos
- Depois que o canal microfluidic com seções de diferentes formas em um padrão alternativo é realizado, fluidos dissemelhantes bomba 2, incluindo uma solução de sódio fluoresceína sal com uma concentração de 50 µ g/mL e água destilada em 2 canais separados em um 20 µ l/min taxa de fluxo.
- Fluorescência imagens de microscópio do canal no vista superior nas posições marcadas como A, B, C e D num microscópio invertido (ampliação de 4x) para os 2 misturadores com uniforme (antes gravura) e diferentes geométricas das seções (após 2h de SWEP), respectivamente ( A Figura 6).
Nota: As imagens de microscópio de fluorescência são tomadas enquanto os fluxos estáveis ocorrem, no ponto de tempo de 5 min, contado desde o momento do início da mistura através dos canais do mixer. - Analisar as imagens capturadas fluorescentes usando um programa de processamento de imagens para estimar a correspondente mistura números de eficiência que são definidos pela mistura residual (MR, 0.5 = misturadas, 0 = totalmente misto) na seguinte equação27, 28:
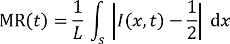
Aqui,
t é o tempo de decapagem,
L é a largura do canal em uma certa posição de interesse,
S é um segmento de linha através do canal na posição, e
A distribuição de intensidade de fluorescência acabou S em t. - Traçar a distribuição de intensidade de fluorescência mais S através do canal nas posições marcadas como A, B, C e D para os 2 misturadores com uniforme (antes gravura) e diferentes geométricas das seções (após 2h de SWEP), respectivamente. Estime o senhor correspondente, conforme representado na Figura 6.
Resultados
Recentemente, um grande número de estudos foram feito na fabricação de dispositivos microfluídicos com canais de diferentes seções pela réplica de litografia, moldagem de14,13,15 e PDMS gravura técnicas17 , 18 , 19 , 20 , 21
Discussão
Nas últimas décadas, microfluídica ofereceu promissores meios pelos quais plataformas experimentais para a investigação biomédica e química podem ser construídos, sistematicamente,1,2,3,4, 5. As plataformas também apresentaram suas capacidades de investigar várias funções celulares vivo em condições fisiológicas microambiente através ...
Divulgações
Os autores não têm nada a declarar.
Agradecimentos
Os autores reconhecem com gratidão o suporte fornecido pela institutos de pesquisa nacional de saúde (INDH) em Taiwan sob o inovador Research Grant (IRG) (EX106-10523EI), o Taiwan Ministério da ciência e tecnologia (mais 104-2218-E-032-004, 104 - 2221 - E-001-015-MY3, 105-2221-E-001-002-MY2, 105-2221-E-032-006, 106-2221-E-032-018-MY2) e o prêmio de desenvolvimento de carreira Sinica de Academia. Os autores gostaria agradecer Heng-Hua Hsu para revisão do manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| 1-Methyl-2-Pyrrolidinone | Tedia, Fairfield, OH | ME-1962 | NMP |
| 10 ml Syringe | Becton-Dickinson, Franklin Lakes, NJ | 302151 | |
| 150 mm Petri dish | Dogger Science | DP-43151 | |
| 1H,1H,2H,2H- Perfluorooctyltrichlorosilane | Alfa Aesar, Ward Hill, MA | L16606 | 97 % silane |
| 4'' Silicon Dummy Wafer | Wollemi Technical, Taoyuan, Taiwan | - | |
| Acetone | ECHO Chemical, Miaoli, Taiwan | AH3102-000000-72EC | |
| AG Double Expose Mask Aligner | M&R Nano Technology, Taoyuan, Taiwan | AG500-4D-D-V-S-H | |
| Biopsy Punch | Miltex, Plainsboro, NJ | 33-31 | |
| Blunt Needle | Jensen Global, Santa Barbara, CA | Gauge 16 | |
| Buffered Oxide Etch | ECHO Chemical, Miaoli, Taiwan | PH3101-000000-72EC | |
| Desicattor | A-VAC Industries, Anaheim, CA | 35.10001.01 | |
| Fluorescein Sodium Salt Water | Sigma-Aldrich Co., St Louis, MO | F6300 | |
| ImageJ | National Institutes of Health, Bethesda, MD | Ver. 1.51 | Imaging Processing Program |
| Inverted Fluorescence Microscope | Leica Microsystems, Wetzlar, Germany | DMI 6000 B | |
| Isopropyl Alcohol (IPA) | ECHO Chemical, Miaoli, Taiwan | CMOS112-00000-72EC | |
| Leica Application Suite | Leica Microsystems GmbH | LAS X | |
| MATLAB | MathWorks, Natick, MA | R2015b | Programming for MR evaluation |
| Mechanical Convention Oven | ThermoFisher Scientific,Waltham, MA | Lindberg Blue M MO1450C | |
| Plasma Tretment System | Nordson MARCH, Concord CA | PX-250 | Oxygen plasma surface treatment |
| Polydimehtylsiloxane (PDMS) | Dow Corning, Midland, MI | SYLGARD 184 | |
| Polyethylene Tubing | Becton-Dickinson and Company, Sparks, MD | 427446 | PE 205, 10' |
| Spin Coater | ELS Technology, Hsinchu, Taiwan | ELS 306MA | |
| Negative Tone Photoresist | MicroChem, Westborough, MA | SU-8 2050 | |
| Negative Tone Photoresist Developer | MicroChem, Westborough, MA | Y020100 | SU-8 Developer |
| Surgical Blade | Feather, Osaka, Japan | 5005093 | PDMS cutting |
| Syringe Pump | Chemyx, Houston, TX | Fusion 400 | |
| Tetra-n-butylammonium Fluoride (TBAF) | Alfa Aesar, Ward Hill, MA | A10588 |
Referências
- Tung, Y. -. C., et al. Optofluidic Detection for Cellular Phenotyping. Lab on a Chip. 12, 3552-3565 (2012).
- Lu, Y., Yang, L., Wei, W., Shi, Q. Microchip-based Single-cell Functional Proteomics for Biomedical Applications. Lab on a Chip. 17, 1250-1263 (2017).
- Jensen, K. F., Reizman, B. J., Newman, S. G. Tools for Chemical Synthesis in Microsystems. Lab on a Chip. 14, 3206-3212 (2014).
- Chang, C. -. W., et al. A Polydimethylsiloxane-polycarbonate Hybrid Microfluidic Device Capable of Generating Perpendicular Chemical and Oxygen Gradients for Cell Culture Studies. Lab on a Chip. 14, 3762-3772 (2014).
- Mosadegh, B., et al. Integrated Elastomeric Components for Autonomous Regulation of Sequential and Oscillatory Flow Switching in Microfluidic Devices. Nature Physics. 6, 433-437 (2010).
- Choi, S., Park, J. -. K. Tuneable Hydrophoretic Separation Using Elastic Deformation of Poly(Dimethylsiloxane). Lab on a Chip. 9, 1962-1965 (2009).
- Choi, S., Song, S., Choi, C., Park, J. -. K. Microfluidic Self-Sorting of Mammalian Cells to Achieve Cell Cycle Synchrony by Hydrophoresis. Analytical Chemistry. 81, 1964-1968 (2009).
- VanDelinder, V., Groisman, A. Separation of Plasma from Whole Human Blood in a Continuous Cross-Flow in a Molded Microfluidic Device. Analytical Chemistry. 78, 3765-3771 (2006).
- VanDelinder, V., Groisman, A. Perfusion in Microfluidic Cross-Flow: Separation of White Blood Cells from Whole Blood and Exchange of Medium in a Continuous Flow. Analytical Chemistry. 79, 2023-2030 (2007).
- Duffy, D. C., McDonald, J. C., Schueller, O. J., Whitesides, G. M. Rapid Prototyping of Microfluidic Systems in Poly(dimethylsiloxane). Analytical Chemistry. 70 (23), 4974-4984 (1998).
- Xia, Y., Whitesides, G. M. Soft Lithography. Annual Review of Material Science. 28, 153-184 (1998).
- Mello, A. Plastic Fantastic?. Lab on a Chip. 2, 31N-36N (2002).
- Choi, S., Park, J. -. K. Two-step Photolithography to Fabricate Multilevel Microchannels. Biomicrofluidics. 4, 046503 (2010).
- Zhong, K., Gao, Y., Li, F., Zhang, Z., Luo, N. Fabrication of PDMS Microlens Array by Digital Maskless Grayscale Lithography and Replica Molding Technique. Optik. 125, 2413-2416 (2013).
- Brower, K., White, A. K., Fordyce, P. M. Multi-step Variable Height Photolithography for Valved Multilayer Microfluidic Devices. Journal of Visualized Experiments. (119), e55276 (2017).
- Lai, D., et al. Simple Multi-level Microchannel Fabrication by Pseudo-grayscale Backside Diffused Light Lithography. RSC Advances. 3, 19467-19473 (2013).
- Huh, D., et al. Reconstituting Organ-Level Lung Functions on a Chip. Science. 328, 1662-1668 (2010).
- Deng, Y. -. L., Juang, Y. -. J. Polydimethyl Siloxane Wet Etching for Three-Dimensional Fabrication of Microneedle Array and High-Aspect-Ratio Micropillars. Biomicrofluidics. 8, 026502 (2014).
- Tung, Y. -. C., Kurabayashi, K. Nanoimprinted Strain-controlled Elastomeric Gratings for Optical Wavelength Tuning. Applied Physics Letters. 86, 161113 (2005).
- Tung, Y. -. C., Kurabayashi, K. A Single-Layer PDMS-On-Silicon Hybrid Microactuator with Multi-Axis Out-Of-Plane Motion Capabilities-Part II: Fabrication and Characterization. Journal of Microelectromechanical Systems. 14, 558-566 (2005).
- Chen, W., Lam, R. H. W., Fu, J. Photolithographic Surface Micromachining of Polydimethylsiloxane (PDMS). Lab on a Chip. 12, 391-395 (2012).
- Balakrisnan, B., Patil, S., Smela, E. Patterning PDMS Using a Combination of Wet and Dry Etching. Journal of Micromechanics and Microengineering. 19, 047002 (2009).
- Takayama, S., et al. Topographical Micropatterning of Poly(dimethylsiloxane) Using Laminar Flows of Liquids in Capillaries. Advanced Materials. 13, 570-574 (2001).
- Friend, J., Yeo, L. Fabrication of Microfluidic Devices Using Polydimethylsiloxane. Biomicrofluidics. 4, 026502 (2010).
- . NANO SU-8 2000 Negative Tone Photoresist formulations 2002-2025 Available from: https://www.seas.upenn.edu/~nanosop/documents/SU8_2002-2025.pdf (2000)
- . NANO SU-8 2000 Negative Tone Photoresist formulations 2035-2100 Available from: https://www.seas.upenn.edu/~nanosop/documents/SU8_2035-2100.pdf (2000)
- Hardt, S., Schönfeld, F. Laminar Mixing in Different Interdigital Micromixers: II. Numerical Simulations. AIChE Journal. 49, 578-584 (2003).
- Hessel, V., Löwe, H., Schönfeld, F. Micromixers-A Review on Passive and Active Mixing Principles. Chemical Engineering Science. 60, 2479-2501 (2005).
- Damiati, S., Kompella, U., Damiati, S., Kodzius, R. Microfluidic Devices for Drug Delivery Systems and Drug Screening. Genes. 9, 103 (2018).
- Wang, C. -. K., et al. Single Step Sequential Polydimethylsiloxane Wet Etching to Fabricate a Microfluidic Channel with Various Cross-Sectional Geometries. Journal of Micromechanics and Microengineering. 27, 115003 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados