Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Одноэтапный подход к фабрикации полидиметилсилоксан Microfluidic каналы различных геометрических секций путем последовательных мокрой офорт процессов
В этой статье
Резюме
Для изготовления каналов не прямоугольного сечения, встроенных в полидиметилсилоксан microfluidic приборы доступны несколько методов. Большинство из них связаны с многоступенчатым производства и обширные выравнивание. В этом документе одноэтапный подход сообщается для изготовления microfluidic каналы различных геометрических сечений полидиметилсилоксан последовательных мокрой травления.
Аннотация
Полидиметилсилоксан (PDMS) материалы существенно используются для изготовления microfluidic приборы с помощью методов формования мягких литографии реплики. Индивидуальная настройка каналов макет дизайна являются необходимыми для конкретных функций и комплексной производительности microfluidic приборы в многочисленных приложениях биомедицинских и химического (например, культуры клеток, biosensing, химического синтеза и обработки жидких). Ввиду характера литья подходы с использованием кремниевых пластин с слоёв фоторезиста узорной фотолитографии как мастер форм microfluidic каналы обычно имеют регулярные сечений прямоугольной формы с идентичными высот. Как правило, каналы с нескольких высот или различные геометрические разделы предназначены для обладают определенной функции и выполнять в различных приложениях microfluidic (например, hydrophoresis используется для сортировки частиц и непрерывного притока для разделение клетки крови6,,78,9). Таким образом много усилий был достигнут в создании каналов с различными секциями через несколько шагов подходов как фотолитографии, используя несколько слоёв фоторезиста и монтаж различных PDMS тонкие листы. Тем не менее такие подходы многошаговая обычно включают утомительных процедур и обширный инструментарий. Кроме того сфабрикованные устройства не могут выполнять последовательно и приведенные экспериментальные данные могут быть непредсказуемыми. Здесь одноэтапный подход разработан для простой изготовления microfluidic каналов с различных геометрических сечений через PDMS последовательных мокрой офорт процессов, что вводит etchant в каналы запланированных однослойной макетов Встроенный в материалах PDMS. По сравнению с существующими методами для изготовления PDMS microfluidic каналов с различными геометриями, развитые одноэтапный подход может значительно упростить процесс для изготовления каналы с-прямоугольные или различных высот. Следовательно метод является способ построения сложных microfluidic каналов, которое обеспечивает изготовление решение для продвижения инновационных microfluidic систем.
Введение
Microfluidic методы имеют обращается внимание в последние десятилетия из-за их внутренние преимущества для целого ряда медико-биологических и химических исследований и приложений. В настоящее время, таких как полимеры, керамики и материалы кремния доступны несколько вариантов использования материалов для строительства microfluidic фишки. В меру наших знаний, среди материалов microfluidic PDMS является наиболее распространенным из-за своих соответствующих свойств материала для различных микрофлюидика исследований и приложений, включая его оптических и биологическая совместимость с частицами, жидкости и чрезвычайно малые живые организмы1,-2,-3,-4,-5. Кроме того, химических и структура механических свойств поверхности PDMS материалов могут корректироваться для облегчения микроэлектромеханические и mechanobiological исследований, применяя такие на полимерной основе microfluidic приборы10, 11,12. Относительно изготовления microfluidic приборы с дизайном канала шаблоны, мягкие литографии реплики литья методы обычно применяются для создания microfluidic каналов, используя их соответствующие главной формы, которые состоят из Фотолитография узорные фоторезиста слои и кремниевых пластин субстратов12. Ввиду характера литья подходы с использованием кремниевых пластин с узорными фоторезиста слои каналы microfluidic обычно имеют регулярные сечений прямоугольной формы с идентичными высот.
Недавно исследователи добились значительного прогресса в биомедицинских исследований, которые касаются, например, сортировки частиц и клеток с помощью hydrophoresis, отделяя плазмы крови и обогащая белые кровяные клетки, применяя microfluidic фишки с каналами различной высоты или геометрические разделы6,,78,9. Такая сортировка и разделение функций микрофлюидика для биомедицинских приложений реализуются путем настройки каналов с различных геометрических секций. Несколько исследований были посвящены изготовления microfluidic каналов с сечений различной геометрии функций путем изготовления мастер формы конкретных фактурная различных высот или непрямоугольной сечений. Эти исследования на изготовление формы включают в себя такие методы, как многошаговый фотолитографии, фоторезист оплавления и серо масштаб литографией13,14,15. Неизбежно существующие методы связаны с мелко созданного фотошаблонов или точное выравнивание в многоэтапный производственные процессы, которые могут существенно повысить уровень сложности соответствующего изготовления microfluidic каналов. До настоящего времени было предпринято несколько попыток на единый этапа производственных процессов для microfluidic каналов различных секций, но соответствующие методы весьма ограничены конкретным поперечного сечения формы каналов16.
За последние два десятилетия помимо подходы литья под давлением для изготовления PDMS microfluidic каналов с различными секциями, травления методы структурирования PDMS каналы с геометрическими характеристиками стали изготовление выбора в различных microfluidic приложений. Например наряду с PDMS многослойного склеивания для построения пневматический сработанный клетки культуры устройство микрофлюидика с восстановленного орган уровня легких функции17эксплуатируется PDMS мокрой травления. PDMS мокрой травления техника используется вместе с PDMS литья на цилиндрические microwells станке, систем автоматизированного управления для изготовления 3D PDMS микроиглы массивы18. PDMS сухого травления используется чтобы PDMS микроструктур как части микро электромеханические приводы19,20. Пористые PDMS мембраны с дизайном поры макеты также изготавливаются путем сухого травления процессы21. Мокрого и сухого травления методы могут быть интегрированы кучность PDMS фильмов с назначенным геометрические фигуры22.
Однако методы травления для формирования PDMS канал структур с сложных раздел формы обычно не применяется из-за их внутренние ограничения на изготовление microfluidic. Во-первых хотя были созданы методы PDMS мокрой травления, используя ламинарного потоков химических веществ для создания каналов microfluidic различных секций, формирование секции последующих канала по-прежнему ограничен из-за основные характеристики изотропного травления химических процессов23. Кроме того даже несмотря на то, что там, кажется, разумно пространства для управления раздел геометрии канала в микрофлюидика изготовления с использованием PDMS сухого травления методы20, время необходимые вытравливания обычно слишком долго (в плане часов) быть практические для изготовления microfluidic фишек. Кроме того, травления селективности между PDMS материалов и соответствующей маски слоёв фоторезиста может быть низкой в целом, и результате травления глубины для каналов, таким образом, не являются приемлемыми20.
В этой статье мы разрабатываем одноэтапный подход к изготовить microfluidic каналы различных геометрических сечений PDMS последовательных мокрой офорт процессов (в дальнейшем именуемый SWEP). SWEP начинаются с устройством microfluidic PDMS с однослойной каналами. С ассорти из макета дизайна каналов фабрикуют microfluidic каналов с различных геометрических разделы различных видов может быть достигнуто путем последовательного офорт процессов. Последовательные травления необходимо только etchant быть введены специфические каналы запланированных однослойной макетов, встроенные в материалах PDMS. По сравнению с обычными процессами изготовления PDMS, SWEP просто требуют еще один шаг для изготовления microfluidic каналы прямоугольные или различных высот. Предлагаемый SWEP обеспечивают простой способ изготовления microfluidic каналов с различными секциями вдоль направления потока, которые могут значительно упростить процессы в вышеупомянутых методов.
протокол
1. Изготовление Microfluidic приборы с канал однослойной макетов
Примечание: В настоящем документе, метод мягкой литографии3 принят для изготовления microfluidic приборы изготовлены из материалов PDMS, чтобы продемонстрировать, как производить каналы с различными секциями.
-
Создание главной формы для PDMS слоя с дизайном топологии функции
- Дизайн макетов канала на слое PDMS для одного процесс травления или травления в последовательности.
- Эскиз Перевернутый топологии функции разработан PDMS слоя с помощью компьютерного программу для рисования.
- Доставить эскиз файла в объекте фотолитографии для получения узорной photomask с высокой точности Перевернутый топологии функции канала макетов, напечатанные на прозрачности24.
- Использование изопропилового спирта (2-пропанол (IPA), ≥ 99,9%), ацетон (пропан-2-1, ≥ 99,5%) и буферизации оксида etch (BOE, NH4F:HF (v/v) = 6:1) на поверхности 4-дюймовый кремниевой пластины, чтобы удалить пыль или остатки и избегать загрязнений.
- Используйте около 500 мл обессоленной воды для мытья кремниевой пластины для окончательной полировки, а затем применить газ азот, сухой промытый пластин.
- Место фоторезист негативный тон около 20 g на пластины. Затем счетчик слой пластины на 500 rpm для 15 s и 2000 об/мин за 30 s производить фоторезиста слой около 75 микрон в толщину.
Примечание: Различные фоторезиста толщины можно добиться, используя фоторезистов негативный тон с номера различных продуктов и разные закрутка покрытие, выпечки и условий развития, согласно25,руководства пользователя26. - Мягкие выпекать пластины путем нагревать его на конфорку при 65 ° C для 3 мин, а затем на 95 ° C за 9 мин.
- Положите Вафля photomask выравниватель машину вместе с узорными прозрачности от шага 1.1.3 как маска.
- В выравниватель машины применяются ультрафиолетового (УФ) свет в 300 МДж/см2 подвергать вафельке, покрытые прозрачности.
- После воздействия ультрафиолета место пластины на конфорку при 65 ° C для 2 мин, а затем на 95 ° C 7 мин как постконтактная выпекать (Трещины).
- После Трещины сильно агитировать пластин, погруженный в разработчик фоторезист негативный тон, или место погружены пластин в ультразвуковой ванне (37 кГц, эффективную мощность 180 Вт) за 7 мин.
- Очистите вся вафля снова с изопропиловый спирт для устранения любой разработчик, оставшиеся на поверхности пластин.
- Чтобы предотвратить нежелательные, склеивание, silanize поверхности пластины, поставив вафельные вместе с 100 мкл 97% силана (1H, 1H, 2Ч, 2H- perfluorooctyl-трихлорсилана) в 6 см Петри в эксикатор.
- Подключите эксикатор для вакуумного насоса и установка вакуумного давления на мм рт.ст.
- Затем включите насос для 15 мин выключайте его и затем оставить пластин на отдых в вакууме в эксикатор для 30 мин.
Предупреждение: Выварочная силана чрезвычайно вредными для человека; Таким образом пассивирование поверхности всей пластин должны осуществляться в зонта. - Получить silanized пластины, которая переживает пассивирование поверхности. Исправьте вафля в 15 см Петри для дальнейшего использования.
Примечание: Узорные вафельные готов для использования в качестве формы для репликации разработан канал макеты обратно PDMS материалами.
-
Изготовление макетов канал PDMS Реплицируя Перевернутый топологии на формы
- Положите базовый PDMS (мономер) вместе с соответствующей катализатора (Вулканизирующий агент) в соотношении 10:1 тома в чистой и одноразовых пластиковых стаканчиков.
- Смешайте PDMS предполимер смесь (от шаг 1.2.1) однородно, используя власть мешалкой.
- Поместите чашку в эксикатор, подключенных к вакуумный насос для 60 мин для удаления любых захваченные пузыри в смеси PDMS.
- Залить 20 г (для раздела 2) или 8 g (раздел 3) PDMS предполимер смеси на вершине мастер плесень (сделано на этапе 1.1) с функциями Перевернутый топологии разработан канал макетов и затем устранить любые возможные пузыри, встроенных в PDMS материалов с помощью t Он Эксикатор (за 60 мин).
- Положите плесень, перевозящих PDMS смесь в духовке при 60 ° C для 4 h для лечения жидким предполимер материалы на основе силикона.
- После охлаждения вафельных вместе с PDMS к комнатной температуре примерно 20 мин, отсоедините вылечить PDMS от плесени с скальпель и пинцет.
- Портной отдельный слой PDMS для покрытия области (примерно 6 x 6 см2 для2 раздела 2 или 2 x 7,5 см для раздела 3) весь канал макеты с помощью скальпеля.
- Создайте канал доступа порты (впуски и выпуски) с помощью биопсии удар 1,5 мм в диаметре.
Примечание: Цифры и позиции впуски и выпуски предназначены основе процессов травления для изготовления конкретных microfluidic каналы. - Налить в чашку Петри 30 g PDMS предполимер смеси, а затем устранить любые возможные пузыри, встроенных в PDMS материалов с помощью Эксикатор (60 мин).
- Положите Петри, перевозящих PDMS смесь в духовке при 60 ° C для более чем 4 h вылечить жидкого предполимер материалы.
- После охлаждения Петри блюдо вместе с PDMS к комнатной температуре примерно 20 мин, отсоедините вылечить PDMS от блюдо с скальпель и пинцет.
- С помощью скальпеля, портной отдельный слой PDMS без каких-либо функций для измерения равным те вышеупомянутые PDMS слоя (примерно 6 x 6 см2 для2 раздела 2 или 2 x 7,5 см для раздела 3).
- Активировать поверхности обоих слоёв PDMS (сделанные в шаги 1.2.7 и 1.2.12) с дизайном канал макетов и без каких-либо функций, подвергая Топ PDMS материалы в плазме кислород обработка поверхности машины на 90 Вт для 40 s.
- Бонд 2 PDMS слои, делая контакты между их обрабатываемой поверхности сразу после активации поверхности плазмы кислорода. Затем оставьте кабального PDMS слоями в духовке при 60 ° C для более чем 30 мин.
Примечание: Существует не верхний предел времени для оставляя кабального PDMS слоями в духовке. - После того, как 2 тычковой PDMS слои остыли, обрезать излишки материалов PDMS от сфабрикованные устройство для позднее экспериментальной установки.
2. одноэтапный подход к фабрикации PDMS Microfluidic каналов из различных разделов
Примечание: Характеризовать PDMS мокрой скорость травления, microfluidic устройство с однослойной и прямой канал прямоугольной формы предложил, чтобы быть использованы для выявления конкретных травления ставок соответствующих некоторых экспериментальных настройки.
-
Экспериментальная характеристика PDMS мокрые травления
- Подготовка протравливающего решение путем смешивания фторид тетра n-butylammonium (TBAF, 1 М раствора в тетрагидрофуран (THF)) с 1-метил-2-pyrrolidinone (NMP) со скоростью v: v = 1:10.
Примечание: NMP способен эффективно растворять химических остатков, вызванных реактивов. В общем PDMS материалы незначительно опухли, NMP и PDMS microfluidic приборы все еще в состоянии сохранить их формы, объемы, и печатью условий. - Нарисуйте смешанных травители TBAF/NMP в 10 мл шприц, подключенных к нержавеющей тупой иглой (16 G).
- Настройка шприцевый насос как контроллер инициативе давление жидкости в каналах.
- Подключите тупым иглы шприцы, наполненный протравливающего решение порт канала вышеназванных простые устройства и направлять соответствующие порт от розетки, трубки для отходов контейнер, как показано на рисунке 1.
- Запуск насоса шприца, перевозящих шприцы, содержащие смешанные TBAF/NMP протравливающего решение со скоростью 150 мкл/мин потока характеризующих PDMS мокрой травления.
- Используйте микроскопические видом ярко поле и убедитесь, что травления каналов вдоль направления потока одинаковой ширины, поэтому подтвердить, что пропорции травители объем и скорость потока etchant являются адекватными.
- Захват изображения время серии канала поперечное сечение под инвертированным микроскопом с 4 X увеличением во время PDMS процесс травления.
- Анализировать сохраненные изображения, применив функцию основные измерения в 2D анализ изображений программы обработки для сбора времени последовательность чисел для ширины канала во время мокрый процесс PDMS материалов травления.
- Оценивать время серии травления ставки через уравнения показано на рисунке 2, который деления 50% изменение ширины канала (ΔW / 2) на продолжительность травления PDMS (t).
- Линейной регрессии точек собранных данных оценить общую скорость травления смешанной травители TBAF/NMP с конкретным объемом пропорции 1:10 для PDMS материалов, как показано на рисунке 2.
- Подготовка протравливающего решение путем смешивания фторид тетра n-butylammonium (TBAF, 1 М раствора в тетрагидрофуран (THF)) с 1-метил-2-pyrrolidinone (NMP) со скоростью v: v = 1:10.
-
PDMS последовательных мокрой травления для изготовления microfluidic каналы различных геометрических секций
- Дизайн расположения etchant отверстия для макета канал PDMS однослойные, обслуживающих соответствующие офорт процессов в последовательности, так что тип конкретного канала различной формы поперечного сечения, как показано на рисунке 3 могут быть изготовлены.
- Выполните процедуры, описанные в шагах 2.1.1 - 2.1.7 для мокрой PDMS травления подход.
Примечание: Скорость потока задается как 50 мкл/мин. - В то время как TBAF/NMP травители текут, осмотрите травления каналов под микроскопом, чтобы увидеть, если существуют серьезные проблемы, такие как заметное количество пузырьков, оставшиеся несколько химических остатков, вызванных реактивов, утечки реактивов, или поток реактивов на наклонной плоскости.
- Наблюдать изменения толщины стенки канала microfluidic, Перевернутый микроскопии и время мокрый процесс для обеспечения правильного канала геометрии достигаются травления.
3. дизайн Microfluidic микшер
Примечание: Дизайн microfluidic смеситель, который может эффективно смешать 2 разнородных жидкостей показана здесь чтобы показать выгодное применение microfluidic каналов с различными разделами.
-
Изготовление microfluidic микшер с различными канала секций
- Делать PDMS устройство с однослойной microfluidic канал дизайн, показанный на рисунке 4 репликой мягкой литографии, литьевой метод (раздел 2).
- В структуре канала-однослойная microfluidic ввести TBAF/NMP протравливающего решение, подготовленный после процедур, описанных в шаге 2.1.1 от порта помечены как «выходе» на 20 мкл/мин скорость потока на рисунке 4.
- Наблюдать изменения толщины стенки канала microfluidic под микроскопом и время мокрый процесс для обеспечения правильного канала геометрии, как представлено на рисунке 5 травления.
-
Экспериментальная характеристика microfluidic смеситель
- После того, как реализуется microfluidic канал с разделами различной формы в альтернативный шаблон, насос 2 разнородных жидкостей, включая решение флуоресцеин натрия соль, имея 50 мкг/мл, концентрация и дистиллированной воды в 2 отдельные каналы в 20 мкл/мин скорость потока.
- Возьмите флуоресценции изображения микроскопа канала в вид сверху на позиции, отмеченные как A, B, C и D под инвертированным микроскопом (увеличение Х 4) для 2 Смесители с единой (перед травлением) и различные геометрические (после 2 ч SWEP), соответственно разделами ( Рисунок 6).
Примечание: Изображения микроскопа флуоресценции принимаются в то время как стабильные потоки возникают, в момент времени 5 мин, отсчитывается от начала моменты смешивания через микшер каналов. - Анализировать захваченные флуоресцентного изображения, используя программу обработки изображений для оценки соответствующих смешивание эффективность чисел, которые определяются путем смешивания остаточной (MR, 0,5 = несмешанные, 0 = полностью смешанных) в следующем уравнении27, 28:
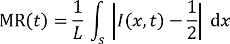
Здесь,
t -время травления,
L -ширина канала в определенном положении интерес,
S является сегмент линии через Ла-Манш на позиции, и
Я это распределение интенсивности флуоресценции над S в t. - Участок распределение интенсивности флуоресценции над S через Ла-Манш на позиции, отмеченные как A, B, C и D для 2 Смесители с единой (перед травлением) и различных геометрических разделы (после 2 ч SWEP), соответственно. Оцените соответствующие MR, как показано на рисунке 6.
Результаты
Недавно большое количество исследований были сделаны на изготовление microfluidic приборы с каналами различных секций литографии реплики, литье13,,1415 и PDMS травления методы17 , 18 ,
Обсуждение
За последние десятилетия микрофлюидика предложило перспективные средства, в которой может быть экспериментальной платформы для химических и биомедицинских исследований построены систематически,1,2,3,4
Раскрытие информации
Авторы не имеют ничего объявить.
Благодарности
Авторы с благодарностью признаем поддержку национальных институтов здравоохранения исследований (НПЗУ) в Тайване под инновационный исследовательский грант (IRG) (EX106-10523EI), Тайвань министерства науки и технологии (наиболее 104-2218-E-032-004, 104 - 2221 - E-001-015-MY3, 105-2221-E-001-002-MY2, 105-2221-E-032-006, 106-2221-E-032-018-MY2) и развитию премии Академии Синика карьеры. Авторы хотели бы поблагодарить Хен-Хуа Hsu для корректуры рукопись.
Материалы
| Name | Company | Catalog Number | Comments |
| 1-Methyl-2-Pyrrolidinone | Tedia, Fairfield, OH | ME-1962 | NMP |
| 10 ml Syringe | Becton-Dickinson, Franklin Lakes, NJ | 302151 | |
| 150 mm Petri dish | Dogger Science | DP-43151 | |
| 1H,1H,2H,2H- Perfluorooctyltrichlorosilane | Alfa Aesar, Ward Hill, MA | L16606 | 97 % silane |
| 4'' Silicon Dummy Wafer | Wollemi Technical, Taoyuan, Taiwan | - | |
| Acetone | ECHO Chemical, Miaoli, Taiwan | AH3102-000000-72EC | |
| AG Double Expose Mask Aligner | M&R Nano Technology, Taoyuan, Taiwan | AG500-4D-D-V-S-H | |
| Biopsy Punch | Miltex, Plainsboro, NJ | 33-31 | |
| Blunt Needle | Jensen Global, Santa Barbara, CA | Gauge 16 | |
| Buffered Oxide Etch | ECHO Chemical, Miaoli, Taiwan | PH3101-000000-72EC | |
| Desicattor | A-VAC Industries, Anaheim, CA | 35.10001.01 | |
| Fluorescein Sodium Salt Water | Sigma-Aldrich Co., St Louis, MO | F6300 | |
| ImageJ | National Institutes of Health, Bethesda, MD | Ver. 1.51 | Imaging Processing Program |
| Inverted Fluorescence Microscope | Leica Microsystems, Wetzlar, Germany | DMI 6000 B | |
| Isopropyl Alcohol (IPA) | ECHO Chemical, Miaoli, Taiwan | CMOS112-00000-72EC | |
| Leica Application Suite | Leica Microsystems GmbH | LAS X | |
| MATLAB | MathWorks, Natick, MA | R2015b | Programming for MR evaluation |
| Mechanical Convention Oven | ThermoFisher Scientific,Waltham, MA | Lindberg Blue M MO1450C | |
| Plasma Tretment System | Nordson MARCH, Concord CA | PX-250 | Oxygen plasma surface treatment |
| Polydimehtylsiloxane (PDMS) | Dow Corning, Midland, MI | SYLGARD 184 | |
| Polyethylene Tubing | Becton-Dickinson and Company, Sparks, MD | 427446 | PE 205, 10' |
| Spin Coater | ELS Technology, Hsinchu, Taiwan | ELS 306MA | |
| Negative Tone Photoresist | MicroChem, Westborough, MA | SU-8 2050 | |
| Negative Tone Photoresist Developer | MicroChem, Westborough, MA | Y020100 | SU-8 Developer |
| Surgical Blade | Feather, Osaka, Japan | 5005093 | PDMS cutting |
| Syringe Pump | Chemyx, Houston, TX | Fusion 400 | |
| Tetra-n-butylammonium Fluoride (TBAF) | Alfa Aesar, Ward Hill, MA | A10588 |
Ссылки
- Tung, Y. -. C., et al. Optofluidic Detection for Cellular Phenotyping. Lab on a Chip. 12, 3552-3565 (2012).
- Lu, Y., Yang, L., Wei, W., Shi, Q. Microchip-based Single-cell Functional Proteomics for Biomedical Applications. Lab on a Chip. 17, 1250-1263 (2017).
- Jensen, K. F., Reizman, B. J., Newman, S. G. Tools for Chemical Synthesis in Microsystems. Lab on a Chip. 14, 3206-3212 (2014).
- Chang, C. -. W., et al. A Polydimethylsiloxane-polycarbonate Hybrid Microfluidic Device Capable of Generating Perpendicular Chemical and Oxygen Gradients for Cell Culture Studies. Lab on a Chip. 14, 3762-3772 (2014).
- Mosadegh, B., et al. Integrated Elastomeric Components for Autonomous Regulation of Sequential and Oscillatory Flow Switching in Microfluidic Devices. Nature Physics. 6, 433-437 (2010).
- Choi, S., Park, J. -. K. Tuneable Hydrophoretic Separation Using Elastic Deformation of Poly(Dimethylsiloxane). Lab on a Chip. 9, 1962-1965 (2009).
- Choi, S., Song, S., Choi, C., Park, J. -. K. Microfluidic Self-Sorting of Mammalian Cells to Achieve Cell Cycle Synchrony by Hydrophoresis. Analytical Chemistry. 81, 1964-1968 (2009).
- VanDelinder, V., Groisman, A. Separation of Plasma from Whole Human Blood in a Continuous Cross-Flow in a Molded Microfluidic Device. Analytical Chemistry. 78, 3765-3771 (2006).
- VanDelinder, V., Groisman, A. Perfusion in Microfluidic Cross-Flow: Separation of White Blood Cells from Whole Blood and Exchange of Medium in a Continuous Flow. Analytical Chemistry. 79, 2023-2030 (2007).
- Duffy, D. C., McDonald, J. C., Schueller, O. J., Whitesides, G. M. Rapid Prototyping of Microfluidic Systems in Poly(dimethylsiloxane). Analytical Chemistry. 70 (23), 4974-4984 (1998).
- Xia, Y., Whitesides, G. M. Soft Lithography. Annual Review of Material Science. 28, 153-184 (1998).
- Mello, A. Plastic Fantastic?. Lab on a Chip. 2, 31N-36N (2002).
- Choi, S., Park, J. -. K. Two-step Photolithography to Fabricate Multilevel Microchannels. Biomicrofluidics. 4, 046503 (2010).
- Zhong, K., Gao, Y., Li, F., Zhang, Z., Luo, N. Fabrication of PDMS Microlens Array by Digital Maskless Grayscale Lithography and Replica Molding Technique. Optik. 125, 2413-2416 (2013).
- Brower, K., White, A. K., Fordyce, P. M. Multi-step Variable Height Photolithography for Valved Multilayer Microfluidic Devices. Journal of Visualized Experiments. (119), e55276 (2017).
- Lai, D., et al. Simple Multi-level Microchannel Fabrication by Pseudo-grayscale Backside Diffused Light Lithography. RSC Advances. 3, 19467-19473 (2013).
- Huh, D., et al. Reconstituting Organ-Level Lung Functions on a Chip. Science. 328, 1662-1668 (2010).
- Deng, Y. -. L., Juang, Y. -. J. Polydimethyl Siloxane Wet Etching for Three-Dimensional Fabrication of Microneedle Array and High-Aspect-Ratio Micropillars. Biomicrofluidics. 8, 026502 (2014).
- Tung, Y. -. C., Kurabayashi, K. Nanoimprinted Strain-controlled Elastomeric Gratings for Optical Wavelength Tuning. Applied Physics Letters. 86, 161113 (2005).
- Tung, Y. -. C., Kurabayashi, K. A Single-Layer PDMS-On-Silicon Hybrid Microactuator with Multi-Axis Out-Of-Plane Motion Capabilities-Part II: Fabrication and Characterization. Journal of Microelectromechanical Systems. 14, 558-566 (2005).
- Chen, W., Lam, R. H. W., Fu, J. Photolithographic Surface Micromachining of Polydimethylsiloxane (PDMS). Lab on a Chip. 12, 391-395 (2012).
- Balakrisnan, B., Patil, S., Smela, E. Patterning PDMS Using a Combination of Wet and Dry Etching. Journal of Micromechanics and Microengineering. 19, 047002 (2009).
- Takayama, S., et al. Topographical Micropatterning of Poly(dimethylsiloxane) Using Laminar Flows of Liquids in Capillaries. Advanced Materials. 13, 570-574 (2001).
- Friend, J., Yeo, L. Fabrication of Microfluidic Devices Using Polydimethylsiloxane. Biomicrofluidics. 4, 026502 (2010).
- . NANO SU-8 2000 Negative Tone Photoresist formulations 2002-2025 Available from: https://www.seas.upenn.edu/~nanosop/documents/SU8_2002-2025.pdf (2000)
- . NANO SU-8 2000 Negative Tone Photoresist formulations 2035-2100 Available from: https://www.seas.upenn.edu/~nanosop/documents/SU8_2035-2100.pdf (2000)
- Hardt, S., Schönfeld, F. Laminar Mixing in Different Interdigital Micromixers: II. Numerical Simulations. AIChE Journal. 49, 578-584 (2003).
- Hessel, V., Löwe, H., Schönfeld, F. Micromixers-A Review on Passive and Active Mixing Principles. Chemical Engineering Science. 60, 2479-2501 (2005).
- Damiati, S., Kompella, U., Damiati, S., Kodzius, R. Microfluidic Devices for Drug Delivery Systems and Drug Screening. Genes. 9, 103 (2018).
- Wang, C. -. K., et al. Single Step Sequential Polydimethylsiloxane Wet Etching to Fabricate a Microfluidic Channel with Various Cross-Sectional Geometries. Journal of Micromechanics and Microengineering. 27, 115003 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены