Method Article
Isolierung und Analyse der mikrobiellen Lebensgemeinschaften im Boden, Rhizosphäre und Wurzeln in mehrjährige Grass Experimente
In diesem Artikel
Zusammenfassung
Ausgrabung der Pflanzenwurzeln aus dem Bereich sowie Verarbeitung von Proben in Endosphere, Rhizosphäre und Boden sind im Detail beschrieben, einschließlich DNA-Extraktion und Analyse-Methoden. Dieses Papier soll anderen Labors, diese Techniken für die Untersuchung von Böden, Endosphere und Rhizosphäre mikrobiome zu ermöglichen.
Zusammenfassung
Pflanzen- und Bodenproben Microbiome Studien werden immer wichtiger für das Verständnis spielen die Rollen Mikroorganismen in der landwirtschaftlichen Produktivität. Dieses Manuskript soll geben Sie Details wie schnell Boden, Rhizosphäre und Endosphere von replizierten Feldversuche und analysieren Sie Veränderungen, die bei der mikrobiellen Gemeinschaften aufgrund Probenart, Behandlung und Pflanze Genotyp auftreten. Das Experiment verwendet, um diese Methoden zu veranschaulichen besteht aus replizierten Feld-Handlungen mit zwei reinen, warmen Jahreszeit Gräser (Panicum Virgatum und Andropogon Gerardii) und eine niedrig-Vielfalt Grasmischung (A. Gerardii, Sorghastrum Nutans, und Bouteloua Curtipendula). Kurz, Pflanzen ausgegraben, eine Vielzahl von Wurzeln schneiden in Phosphatpuffer gelegt und dann geschüttelt, um die Rhizosphäre sammeln. Wurzeln werden im Labor auf Eis und Oberfläche mit Bleichmittel und Ethanol (EtOH) sterilisiert gebracht. Die Rhizosphäre ist gefiltert und durch Zentrifugation konzentriert. Bodenaushub aus um den Wurzelballen ist platziert in Plastiktüten und brachte in das Labor, wo eine kleine Menge des Bodens für DNA Extraktionen genommen wird. DNA wird aus Wurzeln, Boden- und Rhizosphäre extrahiert und dann verstärkt mit Primer für die V4-Region von der 16 s rRNA-gen. Amplifikate sequenziert, dann mit open-Access-Bioinformatik analysiert. Diese Methoden erlauben Forschern, wie die mikrobiellen Gemeinschaft Vielfalt und Zusammensetzung variiert aufgrund der Probentyp, Behandlung, zu testen und Genotyp zu Pflanzen. Mit diesen Methoden zusammen mit statistischen Modellen, zeigen die repräsentativen Ergebnisse, gibt es erhebliche Unterschiede bei mikrobieller Gemeinschaften von Wurzeln, Rhizosphäre und Boden. Hier vorgestellte Methoden bieten eine komplette Reihe von Schritten wie Feldproben zu sammeln, zu isolieren, zu extrahieren, zu quantifizieren, verstärken und DNA-Sequenz und mikrobiellen Gemeinschaft Vielfalt und Komposition in replizierten Feldversuche zu analysieren.
Einleitung
Microbiome Forschung hat wichtige Implikationen für verstehen und Bearbeiten von Ökosystemprozessen wie Nährstoff Radfahren, organischer Umsatz, und die Entwicklung oder Hemmung der Boden Krankheitserreger1,2. Dieser Bereich der Forschung birgt auch ein großes Potenzial für das Verständnis der Auswirkungen von Bodenmikroben auf die Produktivität der natürlichen Pflanzengesellschaften und Agrarökosystemen. Zwar gibt es viele Studien, die auf dem Boden Microbiome in natürlichen Ökosystemen konzentriert haben, haben weniger auf Pflanze Rhizosphäre und Endosphere Mikroben in Agrarökosystemen3konzentriert. In Nebraska dominiert Landwirtschaft die Landschaft in weiten Teilen des Staates, so dass die Studien dieser Böden landwirtschaftlich wichtige Nutzpflanzen angebaut wo ein wichtiges Thema für die Forschung. Diese Methodenpapiers soll Forscher bieten eine Reihe von Protokollen, die Mikroben in Agrarökosystemen, präsent zu beschreiben, um festzustellen, wie die Pflanzenwurzeln mikrobiellen Gemeinschaften in der Rhizosphäre und Endosphere und schließlich ändern verstehen Sie die Funktionen, die diese Mikroben in gesundheitspolizeilicher und pflanzenschutzrechtlicher Bodenproduktivität zu spielen.
Die hier vorgestellte Methode unterscheidet sich geringfügig von den Methoden, die von anderen Benutzern4,5 , dass dieses Papier gerichtet ist, zu lernen, welche Mikroben sind ausschließlich im Inneren der Wurzel und wie sie sich unterscheiden von den Mikroben sofort außerhalb der Wurzel in der Rhizosphäre. Die Amplifikate Sequenzierung in dieser Studie verwendeten weist die mikrobielle Taxa in die DNA-Probe gefunden und ermöglicht die Ermittler zu bestimmen, wie die Gemeinden je nach Probentyp oder Behandlung ändern. Einer der Hauptunterschiede zwischen dieses Protokoll und ein sehr ähnliches Protokoll von Lundberg Et Al. verwendet 6 ist, dass anstelle von Beschallung, dieses Protokoll Oberfläche Sterilisation mit Bleichmittel und Ethanol verwendet, um die Rhizosphäre von den Wurzeln zu entfernen. Andere haben auch effektiv Oberfläche Sterilisation verwendet7,8,9,10. Diese Methoden sind nicht günstiger als andere Methoden, aber etwas anders. Diese Methoden eignen sich besonders gut für große Feldversuche, denn mit genügend Leute es möglich ist, über 150 Feld-Handlungen pro Tag, bis zu ca. 450 Proben, wenn in Endosphere, Rhizosphäre und Boden partitioniert fügt zu verarbeiten. Dieses Manuskript beschreibt im Detail die Methoden zur Probe im Feld, verarbeiten das Material im Labor, zu extrahieren und die DNA-Sequenz, und bietet eine kurze Übersicht über die Schritte, die Sequenzierungsdaten zu analysieren.
Protokoll
1. Website Feldbeschreibung
- Beschreiben Sie Experimentierfeld Seiten Sammlung Zeiten. Bestimmen Sie den Speicherort des Feldes (Breite, Länge und Höhe) mit einem GPS.
- Beschreiben Sie die Sampling-Tiefe, Abtastzeit und Erde-Textur.
- Umweltfaktoren spielen eine wichtige Rolle bei der Gestaltung von mikrobieller Gemeinschaften. Notieren Sie Klimainformationen wie Jahresmitteltemperatur, die jährliche Niederschlagsmenge, vorherige Jahre Fruchtfolge, Bodenbearbeitung Praktiken, Methode der Befruchtung und die Geschichte von der Wiese. Automatische Wetterstationen oder andere Geräte sind nützlich, um den täglichen Niederschlag und Temperatur über eine Vegetationsperiode aufnehmen.
2. Erhebung und Verarbeitung von Boden, Rhizosphäre und Wurzelproben Feld
- Ausgrabung der Pflanzen.
- Beschriften Sie eine Pfanne waschen und Eimer mit einer Notiz, die Informationen über das Pflanzenmaterial zu untersuchenden. Enthalten Sie Informationen wie Nummer der Beobachtungsfläche, Pflanzen Sie Genotyp zu und Pflanzenarten. Die beschrifteten Eimer für die Handlung zu tragen und waschen Pfanne am etablierten Arbeitsplatz im Bereich hinterlassen.
- Durchstoßen Sie Boden mit einer Schaufel bis zu einer Tiefe von 30 cm zum Schneiden Sie die seitlichen Wurzeln hält die Pflanze in den Boden. Das ungefähre Volumen beträgt 18 cm3. Nach dem Zufallsprinzip wählen Sie aus und sammeln Sie zwei Pflanzen pro Parzelle aus verschiedenen Bereichen innerhalb der Handlung.
- Graben Sie die Wurzeln der Pflanzen durch die Nutzung der Schaufel aus und den Wurzelballen in den beschrifteten Eimer. Bringen Sie den beschrifteten Eimer mit den ausgegrabenen Wurzelballen zurück an der Arbeitsstation im Feld. Abgeschnitten und die oberirdischen pflanzlichen Biomasse zu verwerfen.
- Entfernung der Erde von Wurzeln und Ansammlung von Bulk-Boden.
- Schütteln Sie Wurzeln um manuell entfernen, Boden oder verwenden Sie einen Spaten oder einer handgeführten Pinne, um Erde von den Wurzeln zu entfernen. Schütteln die Wurzeln ist ausreichend, um die Erde in sehr sandigen Böden zu entfernen. Tragen Sie Handschuhe und platzieren Sie Wurzeln in der Nähe der Bearbeitungsstation zu.
- Nach dem Schütteln der Wurzeln, wird der Großteil des Bodens in der Pfanne waschen sein. Mischen Sie den Boden in der Pfanne waschen und Boden-Schollen mit einer handgeführten Pinne aufbrechen. Legen Sie eine Probe des Bodens, die frei von Schutt in einer beschrifteten, 17,7 x 19,5 cm Reißverschluss Aufbewahrungstasche und an einem kühlen Ort oder auf Eis.
- Sammlung von Wurzeln und Rhizosphäre.
- Mit beschneiden Schere sterilisiert in 70 % EtOH, Verbrauchsteuer eine Vielzahl von Wurzeln, etwa 4 bis 6 Wurzeln pro Pflanze und jede Wurzel ca. 9-12 cm lang. Legen Sie die ausgeschnittenen Wurzeln (Schneiden Bedarf passen) in eine beschriftete 50 mL-Tube mit 35 mL autoklaviert, Phosphatpuffer (6,33 g/L NaH2PO4, 8,5 g/L Na2HPO4 wasserfrei, pH = 6,5, 200 µl/L Tensid).
Hinweis: Das Tensid (siehe Tabelle der Materialien) wurde nach dem Autoklavieren der Phosphatpuffer hinzugefügt. Das Volumen der Wurzelballen und Wurzel Längen variieren je nach Alter der Pflanze und Pflanzenarten. - Schütteln Sie Rohre für 2 min in der Rhizosphäre von der Oberfläche der Wurzeln zu lösen. Mit der Pinzette sterilisiert in 70 % EtOH, entfernen Sie die Wurzeln aus der Tube, Blot kurz auf Papierhandtücher und legen Sie in eine neue, mit der Aufschrift 50 mL-Tube. Legen Sie beide das Röhrchen mit der Rhizosphäre und mit Wurzeln auf dem Eis.
- Mit beschneiden Schere sterilisiert in 70 % EtOH, Verbrauchsteuer eine Vielzahl von Wurzeln, etwa 4 bis 6 Wurzeln pro Pflanze und jede Wurzel ca. 9-12 cm lang. Legen Sie die ausgeschnittenen Wurzeln (Schneiden Bedarf passen) in eine beschriftete 50 mL-Tube mit 35 mL autoklaviert, Phosphatpuffer (6,33 g/L NaH2PO4, 8,5 g/L Na2HPO4 wasserfrei, pH = 6,5, 200 µl/L Tensid).
3. Bearbeitung des Feldes Proben im Labor
- Oberfläche Sterilisation von Wurzeln nach Auflistung dar.
Hinweis: Führen Sie Oberfläche Sterilisation so bald wie möglich nach der Rückkehr aus dem Feld. Wenn es nicht möglich, die Oberfläche ist die Wurzeln am selben Tag zu sterilisieren, Wurzeln bei 4 ° C bis verarbeitet zu speichern.- Fügen Sie ca. 35 mL 50 % Bleichmittel + 0,01 % Tween 20 bis 50 mL Wurzel Rohre im Bereich gesammelt. Schütteln Sie 50 mL Röhrchen 30 bis 60 Sekunden lang. 50 % Bleichmittel abgießen und 35 mL 70 % EtOH. Eine weitere 30 bis 60 Sekunden lang schütteln.
- Gießen Sie 70 % EtOH und 35 mL steril, hochreines Wasser. 1 Minute schütteln. Wiederholen Sie das Waschen mit Wasser zwei weitere Male.
Hinweis: Um sicherzustellen, dass unsere Oberfläche Sterilisation Behandlung ausreicht, wir Proben des Wassers aus der letzten Spülung vernickelt und kein Wachstum von Bakterien (P. Wang, unveröffentlichte Daten, 2014) beobachtet. Andere Forscher haben für Wurzel Sterilisation Effizienz mit ähnlichen Methoden9,10getestet. - Tupfen Sie Wurzeln Trocknen auf saubere Papiertücher. Verwenden Sie ein sauberes Papiertuch für jede Probe.
Hinweis: Papierhandtücher können vor der Verwendung sterilisiert werden. Wir sterilisieren nicht unsere Papierhandtücher. Aber wir verwenden 1 Handtuch pro Probe und halten Handtücher gewickelt bis verwendet. - Schneiden Sie Wurzeln mit sterilen Pinzette und Beschneidung Scheren, die Wurzeln in ca. 5 mm Stücke schneiden und Ort in einem sauberen, beschriftete 15 mL konische Röhrchen. Speichern Sie die Proben bei-80 ° C bis weiterverarbeitet.
- Verarbeitung von Rhizosphäre Proben.
- Schütteln Sie 50 mL Röhrchen mit Rhizosphäre Proben vom Feld bis auf die gesamte Stichprobe aufzuwirbeln. Mit einem Sieb steril, 100-µm-Mesh-Zelle (siehe Tabelle der Materialien), Filter der resuspendierte Probe in eine neue 50 mL Tube.
- Zentrifugieren Sie die Rohre bei 3000 X g für 5 min bei Raumtemperatur. Sofort abgießen und den überstand verwerfen.
- Legen Sie Rhizosphäre Pellets in der 50 mL-Tuben auf Eis. Fügen Sie 1,5 mL steriler Phosphatpuffer (ohne Tensid hinzu) Rhizosphäre Pellets und Wirbel, auszusetzen.
- Pipettieren der suspendierten Flüssigkeit in ein sauberes, beschriftet, 2 mL Microfuge Rohr. Spin-Röhren 15.871 x g für 2 min bei Raumtemperatur. Sofort der Überstand abgießen und die Rohre auf sauberen Küchenpapier abtropfen lassen.
- Speichern Sie die Pellets bei-20 ° C bis weiterverarbeitet.
Hinweis: Schritte 3.2.2 - 3.2.4 erfolgen um die Stichprobengröße Rohr für die Lagerung zu reduzieren. Es ist mehr platzsparend, die kleineren 2 mL Röhrchen im Vergleich zu den 50 mL-Tuben zu speichern.
- Verarbeitung von Bodenproben zur Analyse der DNA-Extraktion und Boden.
- Mit einem sterilen Metallspatel, füllen Sie eine sauberes, beschriftete 2 mL-Tube mit ca. 3 g des Bodens für DNA-Extraktion. Vermeiden Sie jede kleine Wurzel-Stücke und Schutt. Speichern Sie diese Bodenprobe bei-20 ° C. Metallspatel spülen in 70 % EtOH zwischen jeder Probe.
- In einer Pfanne sauber waschen, leeren Sie den Beutel mit Erde in gestapelten Siebe (siehe Tabelle der Materialien), größere Sieb oben auf das kleinere Sieb, und manuell Sieb des Bodens durch beide Siebe. Verwenden Sie einen Pinsel, um sorgfältig reinigen Sie die Siebe zwischen Proben.
- 100 bis 125 g gesiebten Boden in einer 17,7 x 19,5 cm mit Reißverschluss-Tasche für zukünftige Boden physikalisch-chemischen und Texturanalyse beiseite. Legen Sie die Taschen des Bodens bei 4 ° C für eine kurzfristige Speicherung.
- Verarbeitung von Bodenproben für Bodenfeuchte.
- Tara eine beschriftete braune Papiertüte auf einer Skala. 40 bis 45 g gesiebten Boden in die braune Papiertüte zu messen. Nehmen das Gewicht der braune Papiertüte und Boden auf ein Datenblatt und Ort Taschen in einem Trockenofen auf 55-60 ° C.
- Entfernen Sie nach 72 Stunden die Taschen aus der Trockenofen. Lassen Sie die Boden-Taschen für mindestens 30 Minuten abkühlen lassen und dann abwägen.
- Um das Gewicht zu erfassen, Tarieren Sie die Waage auf NULL zu und legen Sie die braunen Papiertüten auf die Waage. Berechnung des Prozentsatzes der Bodenfeuchte für jede Probe mit Hilfe der Formel:
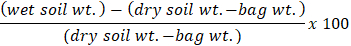
Hinweis: Die Boden Feuchtigkeit Methode stammt von Kellogg biologische Station lange Begriff ökologische Forschung (KBS LTER). KBS LTER bietet eine breite Palette von etablierten Protokollen für Forscher auf ihrer Website (https://Lter.kbs.msu.edu/).
4. Vorbereitung der verarbeiteten Wurzel Proben für DNA Extraktionen.
- Grind wurzelmaterial eingefroren, so dass die Probe homogen ist.
- Gießen von flüssigem Stickstoff in einem Kunststoffbecher mit sauber Spachteln und in einem sauberen Mörser und Stößel, Proben eingefroren während des Schleifens zu halten.
- Legen Sie gefrorene Gewebe im Mörser zerstoßen und mit dem Stößel zu einem feinen Pulver zermahlen. Ständig fügen Sie Flüssigstickstoff in Schleifen um Proben eingefroren zu halten.
- Einem Spatel um Boden Gewebe in einem sauberen, beschriftete 2 mL Röhrchen zu legen. Shop bei-80 ° C.
(5) Extraktion von DNA aus dem Boden und Rhizosphäre Proben in 96-Well-Format
- Laden von Bodenproben in 96-Well Platten.
- Wischen Sie den Arbeitsbereich mit 70 % EtOH und 1 % Bleichmittel. Während diese Schritte tragen Sie Labor Handschuhe. -20 ° C Lagerung der Bodenproben entnehmen und in einem Eiskübel auftauen lassen.
- Entfernen Sie die Abdichtung Matte Abdeckung aus einer 96-Well-Extraktion-Platte, die mit der DNA-Extraktion Kit bereitgestellt wird. Legen Sie die Matte dichtungsklappe zwischen 2 Papier-Tücher, während nicht in Gebrauch sauber zu halten. Kontamination zu vermeiden, verwenden Sie Kleber 8-Well-PCR-Streifen um die 12 Spalten der Extraktion 96-Well-Platte abdecken.
- Tarieren Sie einen sterilen wiegen-Trichter (Größe SM) auf einer Skala zu und wiegen Sie 200 bis 250 mg des Bodens.
Hinweis: Diese sterile Trichter sind auf der einen Seite abgeflacht, so dass der Trichter auf einer Skala flach aufliegt. Der Trichter ist mit Erde gefüllt und direkt in einen Brunnen platziert. Diese Technik vermeidet den Verlust von Proben, Verschütten minimiert und verhindert Kreuzkontamination. - Entdecken Sie die erste Bohrung der Extraktion Platte, heben Sie vorsichtig den Klebestreifen, gefüllte wiegen-Trichter in den passenden Platz gut und sanft ans der Bodenprobe in den entsprechenden Brunnen. Ersetzen Sie den Klebestreifen um den Brunnen zu decken.
- Wiederholen Sie diesen Vorgang für jeden gut der Platte, mit einem neuen, sterilen Trichter für jede Probe, bis die Platte gefüllt ist. Lassen eines gut leer wie eine leere Extraktionskontrolle.
Hinweis: Eine gut auf jede Extraktion Teller dienen als Negativkontrolle (leer) bleibt leer. Dies steuert für Verunreinigungen, die im Kit Reagenzien11vorhanden sein dürfen. - Mat dichtungsklappe auf der Extraktion-Platte zu ersetzen und die Platte bei-20 ° C bis bereit für DNA-Extraktion zu speichern.
- Rhizosphäre Proben in 96-Well Platten geladen.
- -20 ° C Lagerung der Rhizosphäre Proben entnehmen und in einem Eiskübel auftauen lassen.
- Folgen Sie den Schritten 5.1.2 oben, um die DNA-Extraktion-Platte vorbereiten.
- Legen Sie ein sauberes Papier abwischen auf eine Waage, dann Tarieren Sie einem sterilen Spatel auf die Waage zu. Der Spatel einige der Rhizosphäre Pellet aus ein Probenröhrchen vorsichtig aushöhlen. Die Skala der Spatel wieder und wiegen Sie zwischen 200 und 250 mg der Rhizosphäre Probe.
- Heben Sie vorsichtig den Klebestreifen, die erste Bohrung der Extraktion Platte aufzudecken, Winkel der gefüllten Spachtel in den Brunnen, und abkratzen der Rhizosphäre Material in den entsprechenden Brunnen mit einem sterilen Zahnstocher.
- Spülen Sie die Spachtel aus Metall im Wasser, gefolgt von 70 % EtOH zwischen Proben. Wiederholen Sie diesen Vorgang für jeden gut der Platte, bis die Platte gefüllt ist, so dass man gut leer wie eine leere Extraktionskontrolle.
- Extraktion von DNA aus Rhizosphäre und Boden Proben in 96-Well-Format.
- Extrakt-Boden und Rhizosphäre DNA mit eine Kit für optimiert Böden (siehe Tabelle der Materialien), nach Hersteller Protokoll.
Hinweis: Wir verwenden dieses spezielle Kit zum Isolieren von Boden und Rhizosphäre DNA wegen der Möglichkeit der proprietären Reagenzien, Huminsäure und andere mächtigeren PCR-Inhibitoren gefunden im Boden zu entfernen.
- Extrakt-Boden und Rhizosphäre DNA mit eine Kit für optimiert Böden (siehe Tabelle der Materialien), nach Hersteller Protokoll.
- DNA-Quantifizierung.
- Quantifizierung von 92 Proben und 4 Konzentrationen von Standards mit einem Kit (siehe Tabelle der Materialien; Standards sind im Preis inbegriffen), laut Protokoll des Herstellers.
- Quantifizieren Sie die restlichen 4 Proben, die von der Platte, Brunnen für die vier Standards mit einem Kit unterzubringen entfernt wurden (siehe Tabelle der Materialien), laut Protokoll des Herstellers.
(6) Extraktion von DNA aus Wurzel Proben in 96-Well-Format.
- Laden von Wurzelproben in 96-Well Platten.
- Wischen Sie den Arbeitsbereich mit 70 % EtOH und 1 % Bleichmittel. Tragen Sie Handschuhe während dieser Schritte.
- Halten Sie Boden Wurzelproben zu allen Zeiten indem man Proben in einen Eimer mit Trockeneis eingefroren.
- Füllen Sie einen Kunststoffbecher mit flüssigem Stickstoff und antistatische Microspatulas und sterile wiegen-Trichter (Größe XSM) in die Kunststoffbecher abkühlen lassen.
- Entfernen Sie die Abdichtung Matte Abdeckung aus der 96-Well-Extraktion-Perle-Platte, die mit Kit bereitgestellt wird und legen Sie es zwischen 2 Papier-Tücher, während nicht in Gebrauch sauber zu halten.
Hinweis: Die neuere Version dieses Kits, veröffentlicht im Anschluss an die Zeit, die wir diese DNA Extraktionen durchgeführt muss der Benutzer die Extraktion Wulst Platten liefern. In der Tabelle der Materialienhaben wir die Herstellerinformationen Katalog benötigt, um diesen Artikel zu bestellen aufgeführt. - Kontamination zu vermeiden, verwenden Sie Kleber 8-Well-PCR-Streifen um die 12 Spalten der Extraktion 96-Well-Platte abdecken.
- Platzieren Sie die Extraktion Perle Platte auf Trockeneis, Proben in die Brunnen gefroren zu halten.
- Heben Sie die Klebestreifen vorsichtig die erste Bohrung der Extraktion Platte zu entdecken, legen Sie die gefüllten wiegen-Trichter in den entsprechenden Brunnen und hinzufügen 3 Spatel Kugeln Boden Wurzel Gewebe. Ersetzen Sie den Klebestreifen um den Brunnen zu decken.
Hinweis: Die Boden- und Rhizosphäre sind aufgetaut auf dem Eis vor dem wiegen, während Pflanzenmaterial aus gefrorenen gewogen wird. Gefrorene Pflanzengewebe, vor allem kleine Mengen, ist schwierig, auf einer Skala ohne Auftauen zu wiegen. Wiegen Tests wurden durchgeführt, auf Boden Wurzel Gewebe zu bestimmen, wie viele Kugeln Spachtel ausreichend waren. Beachten Sie, dass der Hersteller des Bausatzes keine exakte Menge des Gewebes erfordert aber rund 50 mg. empfiehlt verschiedene Pflanzenarten Probentypen variiert und der Benutzer muss den entsprechenden Betrag zu bestimmen. - Wiederholen Sie diesen Vorgang für jeden gut der Platte, bis die Platte gefüllt ist.
- Platte bei-20 ° C bis bereit für DNA-Extraktion zu speichern.
- DNA-Extraktion der Wurzel Gewebe.
- Mit einem Kit optimiert für Pflanzen (siehe Tabelle der Materialien) DNA Extrahieren nach Protokoll des Herstellers.
Hinweis: Wir verwenden dieses Kit, das speziell für Pflanzengewebe maximale Erträge aus der Wurzelproben vorgesehen ist. Im Gegensatz zu Boden und Rhizosphäre sind die Huminsäure und andere Verunreinigungen weniger ein Problem für das Wurzel-Gewebe.
- Mit einem Kit optimiert für Pflanzen (siehe Tabelle der Materialien) DNA Extrahieren nach Protokoll des Herstellers.
- Die DNA wie in Schritt 5.4 zu quantifizieren.
(7) Verstärkung und die isolierte DNA-Sequenzierung.
- Die V4-Region des Gens 16 s mit ein Korrekturlesen Polymerase zu verstärken (siehe Tabelle der Materialien), wie in Gohl Et Al. beschrieben 12 Barcode Beispiele mit verschiedenen Indizierung Grundierungen und Pool vor der Sequenzierung. Sequenz mit den Methoden von Gohl Et Al12 mit zwei Schritten PCR mit V4-Primer (ergänzende Datei 1) beschrieben.
Hinweis: Einige der Methoden für diese Schritte beschrieben werden ausführlich an anderer Stelle12,13,14 und daher wird hier nicht beschrieben. Für die Wurzelproben wurden PNA-Blocker reduzieren die Menge der Plastiden-DNA aus dem Pflanzengewebe, das zuvor ausführlich15wurde verstärkt. Sequenzierung, eine Negativkontrolle beinhaltete die Extraktion Teller leer Steuerelemente (siehe Hinweis nach Schritt 5.1.5), zwei Steuerelemente verwendet wurden und eine mock Gemeinschaft von einer bekannten Bevölkerung von bakterieller DNA (siehe Tabelle der Materialien) dienten als positiv Kontrolle.
Hinweis: In den meisten Fällen die MiSeq Reagenz Kits v3 dienen im Modus 2 X 300 Basis gekoppelten Ende. Für die Beispiele in diesem Manuskript diente die Illumina Leseweite 2500 im schnellen Modus mit 250 Paired-End (2 x 250)-Modus. Die Stichprobe wurden sequenziert, in der gleichen Spur. - Prozess der Sequenzierungsdaten durch eine Pipeline für mikrobielle Gemeinschaft Analysen (USEARCH v9.2.64, QIIME v1.9.1 und RStudio v3.4.3 16).
- Bereiten Sie die Sequenzierungsdaten mithilfe von USEARCH17.
Hinweis: USEARCH ist online verfügbar mit voller Anweisungen (https://www.drive5.com/usearch/). - Demultiplex die Sequenzierungsdaten mit Index liest oder Barcodes zuweisen Illumina liest zu Proben.
- Zusammenführen der gepaart Ende liest um Konsensus-Sequenzen zu erhalten. Verwenden Sie den Befehl: Usearch-Fastq_mergepairs * R1*.fastq-Relabel @ - Fastq_maxdiffs 10 - Fastq_minmergelen 230 - Fastq_maxmergelen 320 - Fastq_pctid 80 - Fastqout merged.fq.
Hinweis: Die Parameter werden durch Referenzierung der USEARCH Bedienungsanleitung eingestellt. - Entfernen Sie die Primer aus Sequenzierungsdaten Substitutionen in den Primer-Sequenzen zu vermeiden, die durch die PCR-Reaktion verursacht werden können. Verwenden Sie den Befehl: Usearch-Fastx_truncate merge.fq - Stripleft 19 - Stripright 20 - Fastqout stripped.fq.
- Filtern Sie Sequenzierungsdaten, um minderwertige liest und halten hochwertige operative taxonomischen Einheit (OTU) Sequenzen. Verwenden Sie den Befehl: Usearch-Fastq_filter stripped.fq-Fastq_maxee 1.0 - Fastaout filtered.fa.
- Bereiten Sie die Sequenzierungsdaten mithilfe von USEARCH17.
- OTUs USEARCH generieren.
- Führen Sie die Dereplication um den Satz der einzigartige OTU Sequenzen zu identifizieren. Verwenden Sie den Befehl: Usearch-Fastx_uniques filtered.fa - Fastaout uniques.fa - Sizeout-Befehl Uniq.
- Cluster OTUs mit 97 – 100 % Sequenzähnlichkeit, die einzigartige OTUs zu benennen. Verwenden Sie den Befehl: Usearch-Cluster_otus uniques.fa - Minsize 2 - Otus otus.fa-Befehl Otu.
Hinweis: Dieser Schritt umfasst auch die Entfernung von Singles aus den gruppierten OTUs und Entfernung von Chimären von Sequenzierungsdaten. - Erstellen Sie eine OTU-Tabelle in USEARCH. Verwenden Sie den Befehl: Usearch-Usearch_global stripped.fq - Db otus.fa-Strang plus - Id 0,97 - Otutabout otutable.txt.
Hinweis: Dieser Befehl erzeugt eine Tabelle mit der Anzahl der Lesevorgänge (Grafen) von allen OTUs für jede Probe. Die OTU-Tabelle wird für nachgelagerte Schritte einschließlich differential Fülle Analysen und mikrobiellen Diversität verwendet. Beispiel für OTU-Tabelle ist in ergänzenden Abbildung 2 dargestellt. - Führen Sie eine Verdünnung Analyse in QIIME v1.9.1 18.
Hinweis: Die Verdünnung Kurve wird berechnet anhand der OTU-Tabelle, um festzustellen, ob die Tiefe der Sequenzierung die mikrobielle Gemeinschaft richtig Proben. Beispiel für Verdünnung Kurven sind ergänzende Abbildung3. - Führen Sie eine alpha-Diversität Analyse18. Verwenden Sie alpha_rarefaction.py in QIIME v1.9.1, um die Vielfalt der mikrobiellen Gemeinschaft innerhalb jeder Probe zu berechnen.
Hinweis: Diese Analyse berechnet Vielfalt Indizes wie Shannon19, Simpson20und Chao121. - Führen Sie eine Beta-Vielfalt Analyse18,22. Verwenden Sie das Python-Skript: beta_diversity_through_plots.py in QIIME v1.9.1 Bray-Curtis Unähnlichkeit Matrix.
Hinweis: Diese Analyse vergleicht die Zusammensetzung der mikrobiellen Gemeinschaft zwischen Proben. - Führen Sie statistische Analysen zwischen Gruppen. Verwenden Sie die Distanz-Matrizen für PERMONOVA mit der Adonis und Anova Funktion in die vegane Paket23 v2.4.5 in RStudio16berechnet. Durchführen Sie kanonische Analyse der wichtigsten Koordinaten (CAP) Analyse über die Capscale-Funktion in das Vegan-Paket. Visualisierung von Daten mit ggplot2 Paket24 v2.2.1 in RStudio.
Ergebnisse
Die repräsentativen Ergebnisse präsentiert in dieser Handschrift stammen aus der Wiese, gegründet im Jahr 2012 an der University of Nebraska-Lincoln Landwirtschaft Research Division Farm in der Nähe von Mead, ne vor dem Versuch, die Website hatte es geschafft worden, als eine Mais-Soja-rotation . Das Untersuchungsgebiet befand sich auf drei verschiedene Arten von Böden, aber die Daten wurden analysiert, als wären alle Änderungen in gemessene Bodeneigenschaften durch die Behandlungen verhängt.
Die Wiese enthielt zwei reine, steht der Rutenhirse (p. Virgatum cv Liberty) und große Bluestem (A. Gerardii) sowie eine Low-Vielfalt Grasmischung mit großen Bluestem, Indiangrass (S. Nutans) und "Butte" Sideoats Grama ( B. Curtipendula). Die drei warmen Jahreszeit Rasen Grundstücke wurden in einem randomisierten komplette Blockdesign, die drei mal repliziert wurde. In drei verschiedenen Rasen Grundstücke verschachtelt wurden zwei Stickstoff (N) Befruchtung Behandlungen, die waren 56 (N1) und 112 (N2) kg N ha-1 angewandte Harnstoff. Zum Zeitpunkt des Mikrobiom Probenahme am Ende der Vegetationsperiode Boden enthaltenen 8.0 ± 1,1 (Mittelwert ± SD) ppm Nitrat in den Parzellen befruchtet mit 112 kg N ha-1 und 6,8 ± 0,7 (Mittel + SD) ppm Nitrat in den Parzellen befruchtet mit 56 kg N ha-1. Die Parzellen hatten jährlich befruchtet worden. Der warmen Jahreszeit Rasen, die Grundstücke als Haupt Handlungen (8000 m2) und N-Behandlungen ausgewiesen waren waren die geteilten Parzellen (4000 m2). Große Bluestem wurde als eine 50: 50 Mischung aus "Bonanza" und "Goldmine" ausgesät und Indiangrass wurde als eine 50: 50 Mischung von "Scout" und "Krieger" ausgesät. Die Grundstücke wurden im Jahr 2012 gepflanzt, und die erste N-Anwendung ereignete sich im Frühjahr 2013.
Der Boden und die Wurzel Probenahme wurde am 15. September 2014 durchgeführt. Die unten beschriebene Arbeiten wurde auf einem Feld durchgeführt, die als Split-Plot-randomisierten Design mit drei Wiederholungen (Abbildung 1) eingerichtet wurde. Die durchschnittliche Sequenzierung Tiefe aller Proben für Endosphere wie folgt waren: 4871 ± 5711 (Mittelwert ± SD), Rhizosphäre: 40726 ± 14684, Boden: 38184 ± 9043. Eine der größten Quellen der Variation in diesen Experimenten, die mit den Methoden beschrieben, ist der Unterschied in der mikrobiellen Lebensgemeinschaften zwischen Probentypen (Abbildung 2). In dieser repräsentativen Datensatz erscheinen die Rhizosphäre und Boden ähnlicher Zusammensetzung zueinander als die Endosphere (Abbildung 2A). Allerdings gab es auch hoch signifikant (p = 0,001) Unterschiede in der Zusammensetzung der mikrobiellen Gemeinschaft zwischen Rhizosphäre und Boden (Abb. 2 b). Die totale Variation entfielen in diesen Experimenten von Probentyp analysiert waren 26 %.
Alpha-Diversität Analyse zeigte, dass die mikrobielle Gemeinschaften in der Endosphere in der Probe Vielfalt im Vergleich zu Boden und Rhizosphäre (Abbildung 3) niedriger waren. Nur signifikante Unterschiede in der Vielfalt zwischen der Grasarten in jedem Fach wurden zwischen den Endosphere Proben von großen Bluestem und Rutenhirse mit Rutenhirse mit deutlich höheren mikrobielle Artenvielfalt (Abbildung 3). Die relative Häufigkeit Analyse (Abbildung 4) zeigt die Dominanz der Proteobakterien gefolgt von Actinobacteria in alle Probentypen. Boden und Rhizosphäre sind auch Acidobacteria Chloroflexi dominieren und während der Endosphere eine größere relative Häufigkeit von Bacteroiditenhatte.
In diesem Experiment Pflanzen wurden mit zwei verschiedenen Mengen von N-Dünger angebaut und daher analysieren wir die Daten, um festzustellen, ob es behandlungseffekte gab. Behandlungseffekte entfielen 12 % der gesamten Variation aber waren nicht signifikant unterschiedlich, obwohl die beiden Behandlungen in der Ordination verschiedene (Abbildung 5) aussehen. Dies unterstreicht die Bedeutung von statistischen Analysen für diese Datensätze statt Sichtprüfung oder qualitative Urteile.
Pflanze beeinflusst Unterschiede in das Mikrobiom von Pflanzengewebe und Boden wurden mit einer eingeschränkten Methode der Ordination visualisiert. Statistische Unterschiede waren bestimmt mit einer PERMANOVA Analyse um zu testen, ob bestimmte Variablen, wie zum Beispiel Arten, deutlich verschiedene mikrobielle Gemeinschaft Zusammensetzung zwischen Proben führen. Als alle Probentypen zusammen analysiert wurden, fand man ein hoch signifikanten Unterschied in der Zusammensetzung der mikrobiellen Gemeinschaft aufgrund von Pflanzenarten (Abbildung 6). In diesem Experiment wurde der Betrag der Streuung von Pflanzenarten entfielen 6,7 %. Schließlich war jeder Probentyp einzeln analysiert, um festzustellen, welche der Probe die bedeutende Anlage Arten Wirkung fahren könnte. Nur in der Endosphere war es ein sehr signifikanter Unterschied (p = 0,001) zwischen der mikrobiellen Gemeinschaft Kompositionen der verschiedenen Pflanzenarten (Abbildung 7). In den anderen Probentypen war der Arten-Effekt nicht signifikant wenn einzeln analysiert. In der Endosphere war die prozentuale Variation durch Arten 27 %, während es in der Rhizosphäre (18 %) und Erde (15 %) geringer war. Dies unterstreicht weiter die Bedeutung jeder Gewebetyp einzeln zu analysieren.
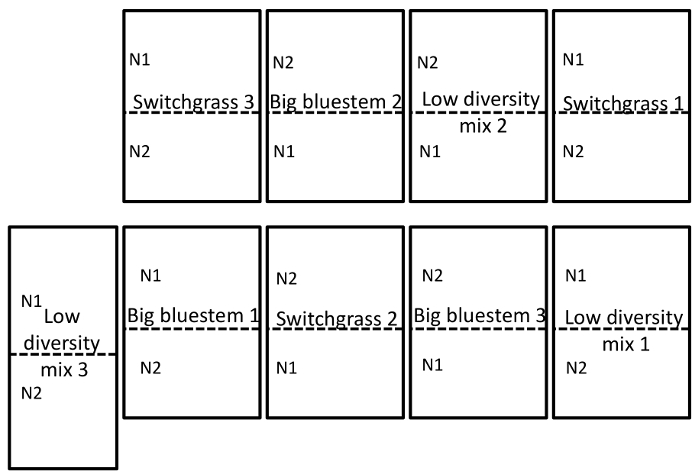
Abbildung 1: Beispiel für die experimentelle feldmuster. Experimentelle feldmuster illustriert eine randomisierte komplette Block-Design in dreifacher Ausfertigung der Wiese befindet sich an der University of Nebraska-Lincoln Eastern Nebraska Forschung und Extension Center in der Nähe von Mead, NE. Vollständige Website Beschreibung finden Sie unter dem Abschnitt "Ergebnisse". N1 ist die geringe (56 kg N ha-1 Harnstoff) und N2 (112 kg N ha-1 Harnstoff) ist die höhere Stickstoff-Rate, die angewendet wurde. Bitte klicken Sie hier für eine größere Version dieser Figur.
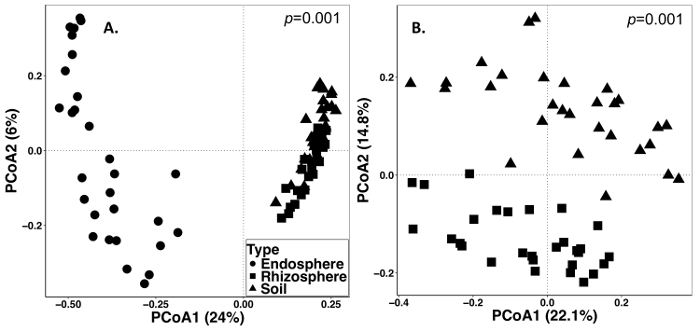
Abbildung 2: Beta-Vielfalt Analyse die mikrobiellen Zusammensetzung in den verschiedenen Probenarten einschließlich Endosphere, Rhizosphäre und des Bodens von der ewigen Grass Probenahme im Jahr 2014 zu vergleichen. Die Auswertung erfolgte mit einem Python-Skript in QIIME1.9.1, um Bray-Curtis Unähnlichkeit Matrix zu produzieren. Wichtigsten Koordinaten Analyse (HKoA) auf der Grundlage der Bray-Curtis Unähnlichkeit Matrix wurde in RStudio visualisiert. PCoA1 und PCoA2 zeigen die erste und zweite größte Varianz erklärt sich durch die HKoA-Analyse. PERMANOVA statistische Analyse wurde durchgeführt, um die Bedeutung zwischen Probentypen zu bestimmen, und der p -Wert wird auf der rechten oberen Ecke angezeigt. Jedes Symbol in den Figuren repräsentieren die gesamte mikrobiellen Gemeinschaft für jede Probe. (A) Endosphere, Rhizosphäre und Boden Probentypen wurden gemeinsam analysiert. Alle 87 Proben wurden 486 Sequenzen pro Probe verdünnt. (B) die Rhizosphäre und Bodenproben wurden gemeinsam analysiert. Alle 59 Proben wurden mit 8231 Sequenzen verfeinert. Bitte klicken Sie hier für eine größere Version dieser Figur.
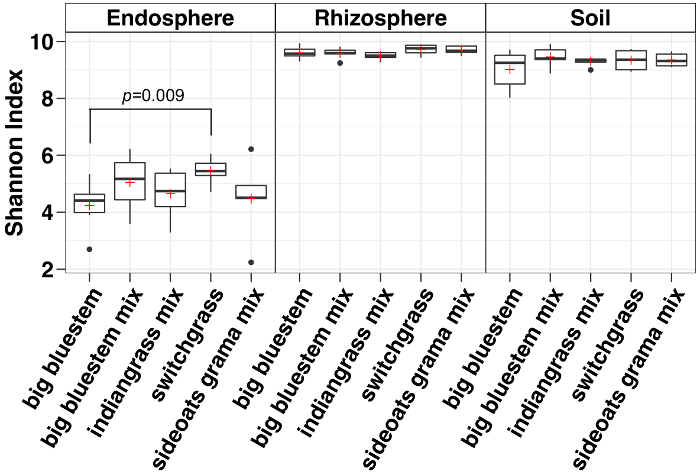
Abbildung 3: Alpha-Vielfalt-Analyse mit Shannon-Index für die einzelnen Arten in der Endosphere, Rhizosphäre und Boden. Die Auswertung erfolgte mit einem Python-Skript in der QIIME1.9.1. Verdünnung wurde für die Endosphere, Rhizosphäre und Bodenarten Probe bzw. mit 486, 17154 und 8231 Sequenzen pro Probe gemacht. Kästchen zeigen an den 25. und 75. Perzentile (erster und Dritter Quartile). Die horizontale Linie innerhalb der Box bezeichnet den Median und den roten plus zeigt den Mittelwert. Schnurrhaare zeigen die Bandbreite der die Daten ohne Ausreißer (die als schwarze Punkte dargestellt sind), die mehr als das 1,5-fache der interquartilbereich fiel (n = 6 für jede Probe außer mix für Sideoats Grama wo n = 5). Der Shannon-Index aller fünf Arten in der Endosphere waren niedriger als Rhizosphäre und Boden. Nicht-parametrische Wilcoxon Rang Summe Test wurde verwendet, um die Bedeutung zwischen den Arten zu bestimmen und nur signifikante Unterschiede zwischen den Arten wurden auf den Feldern. Bitte klicken Sie hier für eine größere Version dieser Figur.
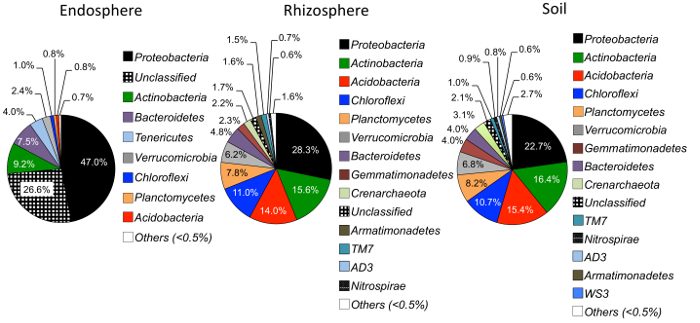
Abbildung 4: Relative Häufigkeit auf der Ebene der Phylum in der Endosphere, der Rhizosphäre und Boden. Proben wurden analysiert, um die Fülle der mikrobielle Stämme unter verschiedenen Proben Arten vergleichen (n = 29 für jede Probe). Die Auswertung erfolgte mit einem Python-Skript in QIIME1.9.1 aus der OTU-Tabelle. Die verschiedenen Farben im Inneren des Kreisdiagramms bezeichnen die Stämme. Der Prozentsatz gibt die relative Häufigkeit der einzelnen Phylum in den jeweiligen Probe. Die Phylum Informationen wurde kommentiert mit der ribosomalen Datenbankprojekt Klassifikator (RDP)25. Bitte klicken Sie hier für eine größere Version dieser Figur.
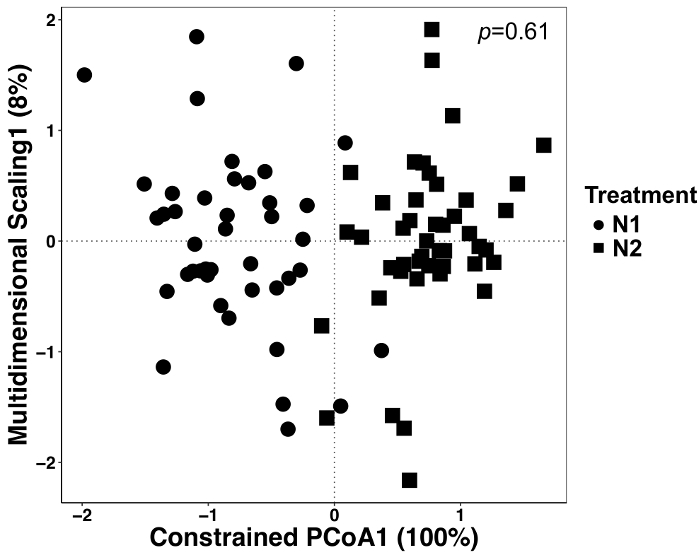
Abbildung 5: Analyse mit Behandlung als einschränkende Faktor zwischen alle Probentypen. Kanonische Analyse der wichtigsten Koordinaten (CAP) Analyse wurde durchgeführt, um festzustellen, ob gab es Unterschiede in der Zusammensetzung der mikrobiellen Gemeinschaft zwischen den Behandlungen. Für jede Behandlung von N, n = 42 für N1 (56 kg N ha-1) und n = 45 für N2 (112 kg N ha-1). Bray-Curtis Unähnlichkeit Matrix wurde mit einem Python-Skript in der QIIME1.9.1 erstellt. Gap Analyse anhand der Bray-Curtis Unähnlichkeit Matrix erfolgte durch die Behandlung als Faktor der RStudio einschränken. PERMANOVA-Analyse wurde durchgeführt, um festzustellen, ob Behandlung Unterschiede signifikant waren, und der p -Wert wird auf der rechten oberen Ecke angezeigt. Bitte klicken Sie hier für eine größere Version dieser Figur.
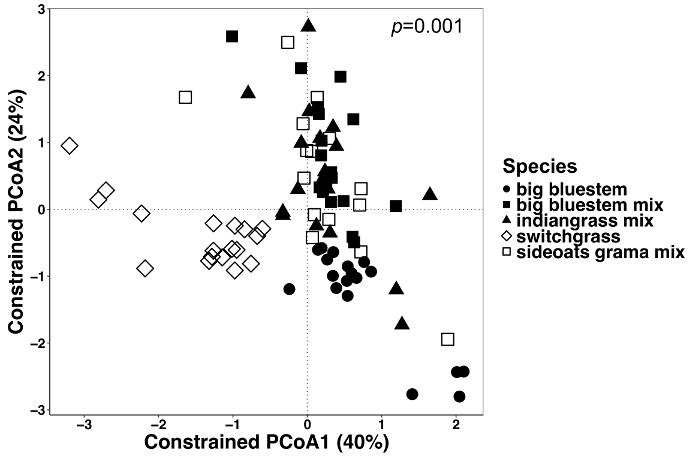
Abbildung 6: Analyse mit Pflanzenarten als einschränkende Faktor zwischen alle Probentypen. Analyse wurde durchgeführt, um festzustellen, ob es Unterschiede in der Zusammensetzung der mikrobiellen Gemeinschaft zwischen Pflanzenarten in alle Probentypen. Wichtigsten Koordinaten Ordination und Gap-Analyse der alle Probentypen (Endosphere, Rhizosphäre und Boden) erfolgten mit einer Bray-Curtis Unähnlichkeit Matrix. Bray-Curtis Unähnlichkeit Matrix wurde mit der Python-Skript in QIIME1.9.1 erstellt. Gap-Analyse anhand der Bray-Curtis Unähnlichkeit Matrix erfolgte durch Einschränken der Pflanzenarten als Faktor der RStudio. PERMANOVA statistische Analyse wurde durchgeführt, um die Bedeutung zwischen Pflanzenarten zu ermitteln, und der P-Wert wird auf der rechten oberen Ecke angezeigt. Jedes Symbol in den Abbildungen stellt die gesamte mikrobiellen Gemeinschaft für diese Probe. n = 18 für die einzelnen Arten in alle Probentypen außer n = 15 für den Sideoats Grama Mix. Bitte klicken Sie hier für eine größere Version dieser Figur.
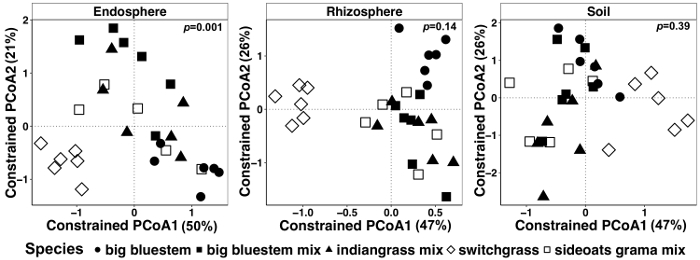
Abbildung 7: Beispiel für die GAP-Analyse mit Arten als einschränkende Faktor für jede Probe individuell. Wichtigsten koordinieren Ordination und CAP Analyse jeder Probenart (Endosphere, Rhizosphäre und Boden) mit Bray-Curtis Unähnlichkeit Matrix. Jede Probentyp wurde 486, 17154 und 8231 Lesevorgänge pro Probe bzw. in Endosphere, Rhizosphäre und Boden verfeinert. Arten wurde als der Faktor verwendet, um die Ordination zu beschränken. PERMANOVA statistische Analyse wurde durchgeführt, um die Bedeutung von Pflanzenarten in den jeweiligen Probe bestimmen, und der p -Wert wird auf der rechten oberen Ecke angezeigt. Jedes Symbol in der Abbildung stellt die gesamte mikrobielle Gemeinschaft für jede Probe. Stichprobengröße ist n = 29 für jede Probe, n = 6 für jede Pflanzenart in den jeweiligen Probe mit Ausnahme der Sideoats Grama Mix (n = 5). Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
In diesem Manuskript beschriebenen Methoden sollten Wissenschaftler gelangen Sie bequem das Feld von Boden und Pflanze Metagenomik aktivieren. Im Laufe der Jahre haben wir unsere Methoden verfeinert, seit Durchführung des Experiments in diesem Manuskript beschrieben. Eine Änderung ist, dass wir nun Röhren Pre-label vor dem ausgehen zu Feld zu probieren. Unser Labor verwendet ein Barcode-System und einem Etikettendrucker. Der Etikettendrucker spart nicht nur Zeit, Kennzeichnung Röhren, aber auch macht alles leichter zu verfolgen und zu Proben ohne den Launen der menschlichen Hand schreiben korrekt zu identifizieren. Ein weiterer kritischer Punkt ist, dass wir versuchen, das Material nach bringt es wieder aus dem Feld so schnell wie möglich bearbeiten. Unser Ziel ist es Gefrieren des Bodens für die DNA-Analyse, sterilisieren und frieren die Wurzeln und Filtern und Einfrieren der Rhizosphäre innerhalb von 12 bis 36 Stunden nach der Rückkehr aus dem Feld. Die DNA-Extraktionsverfahren sind langwierig mit vielen Schritten, vor allem für Boden und Rhizosphäre, also kauften wir einen Roboter (Kingfisher Flex, ThermoFisher), das minimiert die Hände auf Zeit für die DNA-Extraktion-Protokolle, reduziert menschliches Versagen, das eingeführt werden kann, Verbesserung der Konsistenz in der Art und Weise verschiedene Chargen von Erde, Wurzeln oder Rhizosphäre werden verarbeitet. Beim Arbeiten mit Pflanzenmaterial ist es wichtig zu entscheiden, der Stammtyp untersucht werden oder eine Vielzahl von Wurzel-Typen zu einer "repräsentativen" zu nehmen. Wurzeln und Blätter in gefrorenem Zustand bei der Durchführung der DNA Extraktionen ist wichtig, da sichergestellt ist, dass es keine Kreuzkontamination zwischen Proben beim 96-Well DNA Extraktion Platten zu füllen. Ein weiterer wichtiger Faktor ist die Anzahl der Wiederholungen beim Feld Versuchsplanung und mit einer kompletten Design randomisiert soweit möglich zu verwendende26. Aufgrund der hohen Feld Variabilität kann es notwendig, eine große Anzahl von Wiederholungen, kleine Unterschiede zu erkennen sein. Schließlich aus unserer Erfahrung ist es wichtig, sicherzustellen, dass die Böden nicht zu nass sind, wenn die Wurzeln ausgraben. Wenn die Boden wassergesättigt ist nicht nur chaotisch, mit zu arbeiten, aber es ist auch sehr schwierig, die Rhizosphäre zu definieren und die Erde von den Wurzeln zu entfernen.
Eine Änderung, die früh während der Entwicklung dieser Methoden gemacht wurde wurde in Bezug auf statt schütteln die Röhren von hand um die Rhizosphäre zu lösen, die wir ein zu Vortexers angetrieben von einem Gasgenerator Upgrade, der Arbeit in Feld und vieles mehr erleichtern standardisiert. die Zeit und die Art und Weise, dass jedes Rohr aufgeregt war. Eine Einschränkung des Amplikons Sequenzierung Ansatzes ist, dass die taxonomische Auflösung der Ergebnisse oft begrenzt ist und viele OTUs unbekannt oder nur bekannte Ebene der Familie oder Gattung sind. Dieser Bereich der Forschung ist rasant, so ist es wichtig, sich bewusst neue und sich entwickelnde Ansätze, vor allem für die Datenanalyse, die die Auflösung der Ergebnisse verbessern können.
Diese Protokolle sind nur für das Studium nicht Pilze, Bakterien und Archaeen. Die Verwendung von verschiedenen Grundierungen für Verstärkung ermöglicht die Untersuchung von pilzgemeinschaften mit der gleichen DNA-Proben27,28. Diese Methoden erfordern nicht den Kauf von großen Mengen von Ausrüstung, da die Verfahren vereinfacht werden können. Die Methoden, die wir beschreiben hier sind vor allem für die Bestimmung, "Wer ist da", aber das Feld ist schnell weiterentwickelt, in wichtigen Fragen zu Funktion, die angegangen werden kann, mit Schrotflinte sequenziermethoden, Isolierung und testen die Funktionalität der Mikroben, oder ganze mikrobielle Genome Sequencing.
Die repräsentativen Ergebnisse unterstreichen die Unterschiede in der mikrobiellen Gemeinschaften, die mit den beschriebenen Methoden identifiziert werden können. Mit einem Beta-Diversität Ansatz um die Daten-Analyse-22, wurden kompositorischen Unterschiede zwischen Probentypen gezeigt. Dieser Unterschied in den meisten anderen Studien, wo Endosphere, Rhizosphäre und des Bodens enthalten einzigartige mikrobieller Gemeinschaften3,deutlich beobachtet worden. Die Shannon-Vielfalt-Index wurde berechnet, um die Fülle und Gleichmäßigkeit der mikrobielle Artenvielfalt innerhalb jedes Pflanzenarten in der Endosphere, der Rhizosphäre und Boden bestimmen. In dieser Studie und in vielen anderen gezeigt, dass alpha-Diversität in den Boden, in der Rhizosphäre leicht rückläufig und verringert dann deutlich in der Endosphere3,5,29am höchsten. Diese Ergebnisse deuten darauf hin, dass die hier beschriebenen Methoden zur Identifizierung von kompositorischer Änderungen in der Endosphere, der Rhizosphäre und Boden geeignet sind.
Die Dominanz der Proteobakterien ist ein häufiger Befund in Studien über Endosphere und Boden30,31,32. Endosphere hat im Allgemeinen eine geringere Vielfalt an mikrobielle Spezies mit einem höheren relativen Reichtum an der Proteobakterien. Dies zeigt erneut, dass die Ergebnisse repräsentativ für andere Befunde in der Literatur sind. Die behandlungseffekte in dieser Studie waren nicht signifikant unterschiedlich und zwei Hauptgründe dafür können sein, dass die Unterschiede auferlegt durch die Behandlungen nicht groß genug, um ausreichend Variation erkennen zu generieren und diese Auswahl geschah, am Ende der Vegetationsperiode, wenn die Felder gehabt haben ausreichend Zeit, ziehen Sie den Stickstoff auf das Niveau, das ist, was am Ende der Saison gemessen wurde. In einer weiteren Studie mit ähnlichen Befruchtung Raten über einen längeren Zeitraum hinweg waren nur relativ kleine Änderungen in der Zusammensetzung der das Mikrobiom gemessenen33. Andere Studien haben Änderungen in Pilz- und bakteriellen Gemeinschaften durch Stickstoff-Dünger-34,-35gezeigt.
Pflanzenarten sind bekannt, eine Rolle bei der Bestimmung ihrer mikrobiome3,32,36 spielen und auch kleine Unterschiede in der mikrobiellen Gemeinschaft Variation zwischen verschiedenen Genotypen innerhalb nachgewiesen haben eine einzelne Arten37. In dieser Studie wurde ein signifikanter Unterschied in der Zusammensetzung der mikrobiellen Gemeinschaft zwischen Pflanzenarten gefunden. In alle Probentypen schien es, dass Rutenhirse die markanteste mikrobiellen Zusammensetzung hatten, aber Unterschiede zwischen den Arten nur statistisch signifikant in der Endosphere waren. Rhizosphäre Zusammensetzung kann geworden sind, von Bedeutung, wenn mehr Wiederholungen für Analysen zur Verfügung standen.
Die kombinierten Feld, Labor und analytische Protokolle hier beschriebenen bieten einer leistungsfähigen Methode für das Studium wie verschiedene Faktoren Einfluss die Zusammensetzung der mikrobiellen Gemeinschaften in Böden, Rhizosphäre und die Endosphere der Wurzeln36. Es gibt viel Arbeit im Bereich der mikrobiome, insbesondere in landwirtschaftlich genutzten Feldern zu studieren. Wichtige Fragen wie Erträge durch den Boden Microbiome verändert werden sind noch nicht vollständig aufgeklärt werden. Selbst die grundlegendsten Fragen wie Fruchtfolgen beeinflussen den Boden Mikrobiom, wie Timing das Mikrobiom verändert, wie abiotischem Stress verändert das Mikrobiom wie Bodenart interagiert mit diesen Faktoren, das Mikrobiom zu ändern, und ob es gibt universelle Mikroben in bestimmten Kulturen und Regionen der USA sind alle offenen Fragen. Diese Methoden werden auch nützlich für epidemiologische Studien, die Präsenz und die Persistenz von pathogenen und nützlichen Bakterien zu identifizieren. Eine weitere zukünftige Horizont für diese Methoden werden zu starten, die mit Pflanzen und Mikroben RNA und Metabolit Daten hier beschriebenen DNA-Methoden zu integrieren. Zusätzliche Verbesserung und Erprobung von mehr Variablen werden wichtig für die weitere Optimierung dieser Protokolle.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Die Entwicklung dieser Handschrift wird von der National Science Foundation EPSCoR Center für Root und Rhizobiome Innovation Award OIA-1557417 unterstützt. Die Datenerhebung wurde mit Mitteln von der University of Nebraska-Lincoln, landwirtschaftliche Forschung und Entwicklung und durch einen Zuschuss von Hatch USDA unterstützt. Wir anerkennen auch Unterstützung von der USDA-ARS und wurde unterstützt vom Agriculture and Food Research Initiative wettbewerbsfähige Grant Nr. 2011-68005-30411 vom USDA nationalen Institut für Lebensmittelwissenschaften und Landwirtschaft zu etablieren und diese Felder zu verwalten.
Materialien
| Name | Company | Catalog Number | Comments |
| Dneasy PowerSoil HTP 96 Kit | Qiagen/MoBio | 12955-4 | Extraction kit for soil and rhizosphere |
| Dneasy PowerPlant HTP 96 Kit | Qiagen/MoBio | 13496-4 | Extraction kit for roots |
| D-Handle Digging shovel, 101 cm L | Fiskars | 9669 | |
| Rapid Tiller, 40 cm L | Truper | 34316 | |
| Ziploc Bags, 17.7 cm x 19.5 cm | Ziploc | NA | |
| Cooler | Any | NA | |
| Wash pan | Any | NA | |
| Plastic bucket | Any | NA | |
| Gloves (work and lab) | Any | NA | |
| 20 cm diameter Soil sieve #8, 2360 μm mesh size | Dual Manufacturing Co., Chicago IL | US8-8FS | |
| 20 cm diameter Soil Sieve #4, 4750 μm mesh size | Dual Manufacturing Co., Chicago IL | US8-4FS | |
| portable generator | Honda brand works well | NA | |
| Sterile cell strainers 100 μm mesh size | Fisher Scientific | 22-363-549 | |
| NaH2PO4·H2O | VWR | 0823 | |
| Na2HPO4 | VWR | 0404 | |
| Silwet L-77 | Lehman Seeds | VIS-30 | Surfactant |
| Autoclaves | Any | NA | |
| Drying Oven | Any | NA | |
| Scale | Any | Any | |
| Bleach | CLOROX - household strength | NA | |
| Tween 20 | Any | NA | |
| Liquid Nitrogen | Any | NA | |
| Dry Ice pellets | Any | NA | |
| Ethanol | Any | NA | |
| 11 cm precision fine point tweezers | Fisher | 17456209 | |
| 18 cm Straight point specimen forceps | VWR | 82027-436 | |
| 13.5 cm Pruning Scissors | Fiskars | 9921 | |
| 2 mL tube | Any | NA | |
| 15 mL PP conical tube | MIDSCI | C15B | |
| 50 mL PP conical tube | MIDSCI | C50B | |
| Ultrapure water | Millipore-sigma | Milli-Q Integral, Q-POD | |
| Qubit 2.0 fluorometer | Invitrogen | Q32866 | |
| Qubit dsDNA HS Assay Kit | Invitrogen | Q32854 | For DNA quantification of removed samples |
| QuantiFluor dsDNA System | Promega | E2670 | For DNA quantification |
| 96-Well Black with Clear Flat Bottom Plates | Corning | 3631 | |
| pPNA PCR Blocker | PNA Bio | PP01-50 | |
| mPNA PCR Blocker | PNA Bio | MP01-50 | |
| Genomic DNA from Microbial Mock Community B (Even Low Concentration) v5.1L, for 16s rRNA Gene sequencing | BEI Resources | HM782D | |
| Adhesive 8 well-strips for plates | VWR | 89134-434 | |
| Stainless steel beads, 3.2 mm dia | Next Advance | SSB32 | |
| 1 ml Assay block (DNA extraction plate for the Qiagen/MoBio Dneasy PowerPlant HTP Kit) | CoStar | 3959 | |
| antistatic PP weighing funnel, size small for soil/rhizosphere | TWD Tradewinds, INC | ASWF1SPK | |
| antistatic PP weighing funnel, size x-small for root/leaf | TWD Tradewinds, INC | ASWFXSCS | |
| Genie 2 Digital Vortex | Scientific Industries | SI-0236 | |
| Vortex adapter for 50 mL tubes | Scientific Industries | SI-H506 | |
| Mortar (100 mL) and pestle | Any | NA | |
| Metal micro-spatula | VWR | 80071-672 | |
| Disposable antistatic microspatulas | VWR | 231-0106 | |
| Brown Paper bag 2# (10.95 cm x 6.19 cm x 20 cm) | Duro | 18402 | |
| 5424 Centrifuge for 2 mL tube | Eppendorf | 22620461 | |
| Centrifuge for 96-well plate | Sigma4-16S | 81510 | |
| Centrifuge rotor for 50 mL tubes | Sigma4-16S | 12269 - Biosafe | |
| KAPA HiFi DNA polymerase | Kapa Biosystems |
Referenzen
- Philippot, L., Raaijmakers, J. M., Lemanceau, P., vander Putten, W. H. Going back to the roots: the microbial ecology of the rhizosphere. Nature Reviews Microbiology. 11, 789-799 (2013).
- Fierer, N. Embracing the unknown: disentangling the complexities of the soil microbiome. Nature Review Microbiology. 15 (10), 579-590 (2017).
- Wang, P., et al. Shifts in microbial communities in soil, rhizosphere and roots of two major crop systems under elevated CO2 and O3. Scientific Reports. 7 (1), 15019(2017).
- White, L. J., Jothibasu, K., Reese, R. N., Brözel, V. S., Subramanian, S. Spatio Temporal influence of isoflavonoids on bacterial diversity in the soybean Rhizosphere. Molecular Plant-Microbe Interactions. 28 (1), 22-29 (2015).
- Edwards, J., et al. Structure, variation, and assembly of the root-associated microbiomes of rice. Proceedings of the National Academy of Science of the United States of America. 112 (8), E911-E920 (2015).
- Lundberg, D. S., et al. Defining the core Arabidopsis thaliana root microbiome. Nature. 488, 86-90 (2012).
- Bougoure, D. S., Cairney, J. W. Assemblages of ericoid mycorrhizal and other root-associated fungi from Epacris pulchella (Ericaceae) as determined by culturing and direct DNA extraction from roots. Environmental Microbiology. 7 (6), 819-827 (2005).
- Doty, S. L., et al. Diazotrophic endophytes of native black cottonwood and willow. Symbiosis. 47 (1), 23-33 (2009).
- Gottel, N. R., et al. Distinct microbial communities within the endosphere and rhizosphere of populus deltoides roots across contrasting soil types. Applied and Environmental Microbiology. 77 (17), 5934-5944 (2011).
- Xin, G., Glawe, D., Doty, S. L. Characterization of three endophytic, indole-3-acetic acid-producing yeasts occurring in Populus trees. Mycological Research. 113, 973-980 (2009).
- Salter, S. J., et al. Reagent and laboratory contamination can critically impact sequence-based microbiome analyses. BMC Biolology. 12, 87(2014).
- Gohl, D. M., et al. Systematic improvement of amplicon marker gene methods for increased accuracy in microbiome studies. Nature Biotechnology. 34 (9), 942-949 (2016).
- Kozich, J. J., Westcott, S. L., Baxter, N. T., Highlander, S. K., Schloss, P. D. Development of a dual-index sequencing strategy and curation pipeline for analyzing amplicon sequence data on the MiSeq Illumina sequencing platform. Applied Environmental Microbiology. 79 (17), 5112-5120 (2013).
- Caporaso, J. G., et al. Ultra-high-throughput microbial community analysis on the Illumina HiSeq and MiSeq platforms. ISME Journal. 6 (8), 1621-1624 (2012).
- Lundberg, D. S., Yourstone, S., Mieczkowski, P., Jones, C. D., Dangl, J. L. Practical innovations for high-throughput amplicon sequencing. Nature Methods. 10 (10), 999-1002 (2013).
- RStudio, T. RStudio: Integrated Development for R. RStudio, Inc. , Available from: http://www.rstudio.com/ (2015).
- Edgar, R. C. UPARSE: highly accurate OTU sequences from microbial amplicon reads. Nature Methods. 10 (10), 996-998 (2013).
- Caporaso, J. G., et al. QIIME allows analysis of high-throughput community sequencing data. Nature Methods. 7 (5), 335-336 (2010).
- Shannon, C. A mathematical theory of communication. Bell System Technical Journal. 27, 379-423 (1948).
- Simpson, E. H. Measurement of diversity. Nature. 163, 688(1949).
- Chao, A. Non-parametric estimation of the number of classes in a population. Scandanavian Journal of Statistics. 11, 265-270 (1984).
- Legendre, P. Studying beta diversity: Ecological variation partitioning by multiple regression and canonical analysis. Journal of Plant Ecology. 1 (1), 3-8 (2008).
- Oksanen, J., et al. The vegan package. Community Ecology Package. 10, 631-637 (2007).
- Wickham, H. ggplot2: Elegant graphics for data analysis. Ggplot2: Elegant Graphics for Data Analysis. , Springer Nature. Switzerland. 1-212 (2009).
- Cole, J. R., et al. The Ribosomal Database Project (RDP-II): sequences and tools for high-throughput rRNA analysis. Nucleic Acids Research. 33, D294-D296 (2006).
- Wagner, M. R., et al. Host genotype and age shape the leaf and root microbiomes of a wild perennial plant. Nature Communications. 7, 12151(2016).
- O'Brien, H. E., Parrent, J. L., Jackson, J. A., Moncalvo, J. M., Vilgalys, R. Fungal community analysis by large-scale sequencing of environmental samples. Applied and Environmental Microbiology. 71 (9), 5544-5550 (2005).
- Taylor, D. L., et al. A first comprehensive census of fungi in soil reveals both hyperdiversity and fine-scale niche partitioning. Ecological Monographs. 84 (1), 3-20 (2014).
- Lebeis, S. L., et al. Salicylic acid modulates colonization of the root microbiome by specific bacterial taxa. Science. 349 (6250), 860-864 (2015).
- Ofek-Lalzar, M., et al. Niche and host-associated functional signatures of the root surface microbiome. Nature Commununications. 5, 4950(2014).
- Niu, B., Paulson, J. N., Zheng, X., Kolter, R. Simplified and representative bacterial community of maize roots. Proceedings of the National Academy of Science of the United States of America. 114 (12), E2450-E2459 (2017).
- Fitzpatrick, C. R., et al. Assembly and ecological function of the root microbiome across angiosperm plant species. Proceedings of the National Academy of Science of the United States of America. 115 (6), E1157-E1165 (2018).
- Ramirez, K. S., Lauber, C. L., Knight, R., Bradford, M. A., Fierer, N. Consistent effects of nitrogen fertilization on soil bacterial communities in contrasting systems. Ecology. 91 (12), 3463-3470 (2010).
- Paungfoo-Lonhienne, C., et al. Turning the table: Plants consume microbes as a source of nutrients. PLoS One. 5 (7), e11915(2010).
- Yeoh, Y. K., et al. The core root microbiome of sugarcanes cultivated under varying nitrogen fertilizer application. Environmental Microbiology. 18 (5), 1338-1351 (2016).
- Bulgarelli, D., Schlaeppi, K., Spaepen, S., Ver Loren van Themaat, E., Schulze-Lefert, P. Structure and functions of the bacterial microbiota of plants. Annual Review of Plant Biology. 64, 807-838 (2013).
- Peiffer, J. A., et al. Diversity and heritability of the maize rhizosphere microbiome under field conditions. Proceedings of the National Academy of Science of the United States of America. 110 (16), 6548-6553 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten