Method Article
Dissipative Microgravimetry die Bindung Dynamik der Phospholipid-bindende Protein Annexin A2, solide unterstützt Lipid Bilayer mit einem Quarz-Resonator zu studieren
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Hier präsentieren wir ein experimentelles Protokoll, die eingesetzt werden kann, um die verbindliche Affinitäten und Art der Interaktion von markierungsfreie Phospholipid-bindendes Protein annexin A2 mit immobilisierten Solid unterstützt Bilayer (SLB) durch gleichzeitige Messung bestimmen die Mass Aufnahme und die viskoelastischen Eigenschaften des Proteins annexin A2.
Zusammenfassung
Die dissipative Quarzkristall Mikrowaage Technik ist eine einfache und markierungsfreie Herangehensweise an die simultane Messung von Aufnahme und viskoelastische Masseneigenschaften der absorbiert/immobilisiert Masse auf Sensorflächen, so dass die Messungen der Interaktion von Proteinen mit Solid-unterstützte Oberflächen wie Lipid Bilayer, in Echtzeit und mit hoher Empfindlichkeit. Polymerasen sind eine hoch konservierte Gruppe von Phospholipid-bindende Proteine, die reversibel mit der negativ geladenen Headgroups über die Koordinierung von Calcium-Ionen zu interagieren. Hier beschreiben wir eine Protokoll, das eingesetzt wurde, um quantitativ zu analysieren, die Bindung von annexin A2 (AnxA2), planar Lipid Bilayer vorbereitet auf der Oberfläche eines Quarz-Sensors. Dieses Protokoll ist optimiert, um stabile und reproduzierbare Daten zu erhalten und enthält eine ausführliche Schritt für Schritt Beschreibung. Die Methode kann zu anderen Membran-bindende Proteine und Bilayer Kompositionen angewendet werden.
Einleitung
Zellmembranen sind äußerst dynamischen und komplexen Strukturen. Die zusammengesetzte Mischung der Membranlipide, zusammen mit peripher und/oder stoffschlüssig verbunden Membranproteine, montieren, Form Microdomains. Die koordinierte Tempo-räumliche Organisation der diese Membrane Microdomains ist wichtige physiologische Prozesse1beteiligt. Membran Microdomain Dynamik werden angetrieben durch das Zusammenspiel der Membranlipide sowie durch die Fähigkeit der peripheren Membranproteinen zu erkennen und interagieren mit Lipiden angereichert in die Microdomains. Die Rekrutierung der Proteine, die bestimmte Lipide ist oft erreicht über Lipid-Anerkennung-Module wie Pleckstrin Homologie (PH) oder C2 Domänen2,3. Biophysikalische Analysemethoden mit Modell-Membranen sind Schlüssel zum Verständnis der Grundsätze, die für diese Prozesse auf molekularer Ebene.
Polymerasen, eine Multigene-Großfamilie, sind bekannt für ihre Fähigkeit zur Bindung an negativ geladenen Membranlipide, überwiegend Phosphatidylserin (PS), Ca2 +-Weise2gesteuert. Das zweite Kennzeichen der annexin-Familie ist das Vorhandensein eines konservierten strukturelle Segments der Knochenoder wiederholen, d. h. vier oder acht Mal und birgt die Ca2 +- und Phospholipid-Bindung Seiten4. Die Ca2 +-abhängigen Lipid Interaktion stellt die Polymerasen in einer perfekten Lage, Sinn und vermitteln Ca2 +-vermittelte Signalisierung zu Ziel Membranen. Konsequent, können sich Polymerasen induzieren die Bildung von Microdomains Cholesterin, Phosphatidylinositol-4,5-Bisphosphate (PI (4,5) P2) und PS, beide in zellulären und/oder künstliche Membran Systeme5bereichert. Dieses Protokoll beschreibt einen Ansatz zur Analyse der annexin-Membran-Interaktion mit einem Quarzkristall Mikrowaage Dissipation (QCM-D)6,7,8.
Die grundlegende Komponente in diesem Mikrowaage ist ein oszillierenden Kristall, der als die Sensoroberfläche dient. Die Adsorption bzw. Bindung von Molekülen auf der Sensoroberfläche verringert die Resonanzfrequenz (f) proportional zur Zunahme der Masse. Wenn die Oberfläche gleichmäßig mit einer Folie beschichtet ist, die Bindung von weiteren Substanzen beeinträchtigen die strukturelle Integrität dieser Schicht, und solche Änderungen in Viskoelastizität (der Energie Verlustfaktor D) zusätzlich überwacht werden können. Dies ist eine weit verbreitete Technik, die Interaktion von Proteinen mit Lipid Bilayer zu studieren. Bei diesem Ansatz werden Lipid Vesicles auf die entsprechend beschichteten Sensoroberfläche aufgenommen. Lipid Bilayer Bildung ist günstig auf Silizium basierende Materialien9,10, wie Bläschen oft nicht auf anderen hydrophilen Oberflächen brechen wie gold11 nach UV-Ozon-Exposition, TiO212oder Al oxidiert 2O313. Der Bruch der Koaleszenz Vesikel löst die wässrige Phase, führt zu charakteristischen Veränderungen in Masse und Wärmeableitung. Die Generation von Solid-gestützte Bilayer (SLB) durch Fusion der Vesikel ist einfach und robust und kann verwendet werden, um komplexe Modelle zu generieren, die Zellmembranen zu imitieren.
Dissipative Quarz Kristall Mikrowaage ist eine markierungsfreie und sensible Technik. Ein großer Vorteil ist die Möglichkeit, jegliches Material zu beschichten, die ausreichend Dünnschicht auf der Oberfläche, wodurch ein breites Anwendungsspektrum in verschiedenen Forschungsbereichen generiert. Die Membran-Protein-Interaktion beobachtet in Echtzeit, und die Ergebnisse können direkt analysiert werden. Die gleichen Sensorfläche einsetzbar in nachfolgenden Messungen (nach der Durchführung eine minimale Reinigung wie in diesem Protokoll beschrieben), wodurch für genaue interne Kontrollen und eine Vergleichbarkeit zwischen den Analyten.
Protokoll
Hinweis: Puffer sollte gefiltert werden, mithilfe eines Filters 0,22 µm und durch ein Vakuum für 1 h entgast.
(1) Lipid Vesikel Vorbereitung
- 2-mL Glasröhren zu verwenden. Lösen jedes Lipid, 1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC), 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphocholine (POPC), 1-palmitoyl-2-oleoyl-sn-glycero-3-phospho-L-serine (Pop) und Cholesterin (Chol), in einer Mischung aus Chloroform / Methanol (50: 50 V/V), eine klare 5 mM Lipid Lösung vorzubereiten. 1,2-dioleoyl-sn-glycero-3-phospho-(1'-myo-inositol-4',5'-bisphosphate) (PI (4,5) P2) in einer Mischung aus Chloroform/Methanol/Wasser (20:9:1 V/V) auflösen.
- Kombinieren Sie die gelösten Lipide in der gewünschten Molverhältnis von POPC/POPS (80/20), POPC/PI (4,5) P2 (95/5), POPC/POPS/Chol (60/20/20), POPC/POPS/PI (4,5) P2/Chol (60/17/3/20) und POPC/DOPC/POPS/PI (4,5) P2/Chol (37/20/20/3/20) () Tabelle 1) in 10-mL Glasröhren.
Hinweis: Die endgültige Höhe der gesamten Lipid ist 500 µg. - Die organischen Lösungsmittel mit einem trockenen Strom von Stickstoff verdampft. Lassen Sie die Lipid-Mischung auf einem Hochvakuum (Lyophilisation) System für 3 h, Restspuren der Lösungsmittel zu entfernen.
Hinweis: Dies führt zu einer trockenen Klarsichtfolie. - Aufschwemmen der Lipid-Film in 1 mL Citrat-Puffer (10 mM Trinatrium-Citrat, 150 mM NaCl, pH 4,6). Die Lipid-Aufhängung bei 60 ° C (diese Temperatur ist etwa 10 ° C oberhalb der Übergangstemperatur Phase der höchsten Schmelzpunkt Lipid in der Mischung) für 30 min in ein Wasserbad und Vortex inkubieren es energisch alle 5 Minuten.
Hinweis: Dadurch wird die Bildung von großen, multilamellar Vesikeln (MLV). Halten Sie die Suspension über die Übergangstemperatur. - Heizen Sie den Extruder (bei 60 ° C in diesem Fall), ausgestattet mit einer 50-nm Durchmesser Porengröße Polycarbonat Membran über die Übergangstemperatur (die 40-50 ° C hier) für 30 min vor.
- Laden der MLV-Suspension in den vorgeheizten Extruder und sanft übergeben die Mischung 31 X durch die Polycarbonat-Membran bilden kleine Unilamellar Vesikeln (SUV)14. Halten Sie die Temperatur oberhalb der Übergangstemperatur.
- Die SUV-Aussetzung zu einem 2 mL Kunststoff Reaktionsgefäß übertragen und fügen Sie den Citrat-Puffer (siehe Punkt 1.4) bringen das Endvolumen von 2 mL.
Hinweis: Dies wird eine abschließende Lipidkonzentration von 250 µg/mL erreichen.
2. Umgang mit Quarz-Sensoren
Hinweis: Behandeln Sie stets die Quarz-Sensoren mit einer Pinzette.
- Inkubieren Sie vier Sensoren in einem Polytetrafluorethylen-Halter in ein 2 % SDS-Lösung für ≥ 30 min. Waschen sie ausgiebig mit eingefügt ultrareines Wasser ganz herauszudrehen SDS und lassen sie trocknen, mit einem Strom von trockenen Argon oder Stickstoff.
- Verwenden Sie ein Plasma-cleaning-System, um alle Verunreinigungen vollständig zu entfernen. Legen Sie die trockenen Sensoren in der Plasmareinigung Kammer, die Kammer zu evakuieren und spülen Sie es 3 X mit Sauerstoff. Drehen Sie das Plasma Reiniger auf. Verwenden Sie die folgenden Prozessparameter: 1 x 10-4 Torr Druck, hohe Radiofrequenz (RF) macht und 10 Minuten Bearbeitungszeit. Schalten Sie das Gerät und die Sensoren herausnehmen.
(3) Mikrowaage Betrieb
Hinweis: Ein Mikrowaage System mit vier temperaturgeführte Fluss Kammern in einer parallelen Konfiguration zu einer peristaltischen Pumpe angeschlossen und eingestellt, einen Durchfluss von 80 µL/min, wurde verwendet. In der offenen Flow-Modus wurde der Puffer aus dem Feeder-Reservoir in der empfangenden Tank gepumpt. Im Loop-Modus war der empfangende Tank mit Zuführung eines Behälters, erzeugen eine geschlossene Schleife verbunden. Die Temperatur wurde auf 20 ° c eingestellt.
- Sorgfältig dock Plasma gereinigt Sensoren in die Kammern 4 Fluss mit einer Pinzette. Vermeiden Sie Druck auf oder Torsion der Kammern und die Rohre, die undichte verursachen könnten.
- Spülen Sie das System mit Citrat-Puffer (10 mM Trinatrium-Citrat, 150 mM NaCl, pH 4.6) in der offenen-Flow-Modus für 10 min..
Hinweis: Hierzu muss genau 3,2 mL Puffer, aber es ist ratsam, ein Übermaß an Puffer (10 mL) zu verwenden. - Starten Sie das Programm. Starten Sie die Aufnahme von Änderungen in der Häufigkeit und Ableitung der ersten Grundton (n = 1) und Obertönen (n = 3.-13.) mit Hilfe der Software, bis die Frequenz und Verlustleistung Basislinien stabil sind (Dies dauert etwa 40-60 min).
Hinweis: Frequenz Geräuschpegel (Peak to Peak) sollte weniger als 0,5 Hz und für die Dissipation niedriger als 0.1·10-6, mit einer maximalen Drift (in wässriger Lösung) 1 Hz/h in Frequenz und 0.3·10-6/h in Wärmeableitung. - Wenn die Basislinien stabil sind, gelten Sie die SUV-Suspension in Citrat-Puffer (2 mL in ein Röhrchen). Entfernen Sie mit einem Reaktionsgefäß 1,5 mL das Totvolumen. Schließen Sie dann das System in der Schleife-Flow-Modus. Die Frequenz/Verlustleistung Verschiebung für weitere 10 Minuten aufzeichnen.
Hinweis: Während dieser Zeit werden die Vesikel auf der SiO2 Oberfläche verteilt und verschmelzen zu einem kontinuierlichen Bilayer15,16 (Schritt 2 in Abbildung 1, Abbildung 2und Abbildung 3) bilden. Die SUVs Adsorption an der Oberfläche des Sensors ist zwei-phasisch und hat eine typische Frequenz minimal- und Maximalwerte in der Verlustleistung. Eine stabile neue Frequenz/Verlustleistung Baseline mit einer charakteristischen Frequenzverschiebung (abhängig von der Lipidzusammensetzung) von 26-29 Hz zeigt (siehe Tabelle 1) eine kontinuierliche Bilayer auf der Oberfläche. - Wenn die SLB ist stabil (siehe Punkt 3.4), das System mit dem laufenden Puffer (10 mM HEPES, 150 mM NaCl, pH 7,4) in den erforderlichen Ca2 + Konzentrationen (im Bereich von 50 µM bis 1 mM CaCl2, je nach dem Experiment) in einem offenen Flow-Modus für equilibrate 40 min.
- Fügen Sie das Protein (hier AnxA2) Puffer für den Betrieb mit Ca2 + (siehe Punkt 3.5). Führen Sie die Anwendung des Proteins in einer Schleife-Flow-Modus, bis ein Gleichgewicht der Steady-State (Schritt 3 in Abbildung 1, Abbildung 2und Abbildung 3) erreicht ist.
Hinweis: Die Proteinkonzentration kann reichen von 1 bis 400 nM. Protein-Adsorption ergibt sich eine Konzentration abhängig Frequenzverschiebung reflektieren die Masse (Protein) Adsorption. - Trennen des gebundenen Proteins durch chelatisierenden Ca2 + -Ionen mit 5 mM EGTA im laufenden Puffer in offenen Flow-Modus (Schritt 4 in Abbildung 1 und Abbildung 2).
Hinweis: Eine Wiederherstellung der Frequenz und Ableitung der SLB-Baseline zeigt eine vollständige Reversibilität der Proteinbindung. Verein-Dissoziation Zyklen können wiederholt werden, um unterschiedliche Konzentrationen oder Proteine zu vergleichen.
4. Reinigung Mikrowaage
Hinweis: Führen Sie eine minimale Reinigung nach jeder Messung.
- Die Mikrowaage System mit 50 mL DdH2O in einem offenen kontinuierlichen Modus zu regenerieren, die Rohre aus den Wasserbehälter entfernen und das System trocken laufen lassen.
- Nehmen Sie den Kristall-Sensor vorsichtig und reinigen Sie ihn mit den 2 % SDS-Lösung mit dem Polytetrafluorethylen-Halter (siehe Punkt 2.1).
- Trocken Sie die sichtbaren Teile des Flow Modul Innenraum wo der Sensor war.
Hinweis: Führen Sie eine Intensive Reinigung nach einer Reihe von 10 Messungen. - Reinigen Sie das System mit einer 2 % igen SDS-Lösung (50 mL) bei 40 ° C (Einstellung in der Software) in einem kontinuierlichen offenen Fluss (Rohr)-Modus, mit einer Flussrate von 20 µL/min für längeren Kontakt mit dem Reinigungsmittel.
- Mit 250 mL DdH2O in offenen kontinuierlichen Modus mit einer Durchflussrate von 160 µL/min reinigen.
Hinweis: Nach 4 Monaten, führen Sie eine umfassende Reinigung laut Handbuch des Herstellers.
Ergebnisse
Der Rückgang der Resonanzfrequenz (Δf) korreliert in einer linearen Weise mit der adsorbierten Masse (Δm), definiert durch die Gleichung Sauerbrey. 17
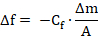
Hier f ist die Resonanzfrequenz, Cf ist eine konstante, die von den geometrischen und physikalischen Eigenschaften von bestimmten Quarz und die Resonanzfrequenz abhängig ist, und A ist die Sensor-Oberfläche.
In den meisten Anwendungen ist die adsorbierten Schicht nicht völlig starr aber viskoelastische. Die daraus resultierende Dämpfung der Quarz Sensor Oszillation bezeichnet man als Ableitung (D). Die überwachten Verlustleistung Änderungen (ΔD) korrelieren mit der viskoelastischen Eigenschaften des gebundenen Masse18 und sind definiert wie folgt8.
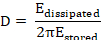
Hier Eabgeführt wird der Energieverlust während einer Schwingungsperiode und Egespeichert ist die Gesamtenergie des frei schwingenden Sensors.
Um zu analysieren und die Bindungsparameter zu quantifizieren, werden Frequenz isothermen durch Plotten Gleichgewicht Frequenz Verschiebungen (ΔΔfe) gegen die Proteinkonzentrationen abgeleitet. ΔΔfe ist definiert als

Δft1 stellt hier den Beginn des Protein Adsorption und Δft2 den Gleichgewichtszustand. Nichtlineare Kurvenanpassung kann mit einen Hügel Ausbau der Langmuir Gleichung folgendermaßen6,8durchgeführt werden.
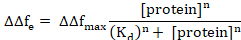
Hier ΔΔfmax ist die ΔΔfe der Konzentration des Proteins, wodurch maximale (Sättigung) Bindung, Kd ist die scheinbare Dissoziationskonstante für die Protein/Membran-Komplex, und n ist der Hill-Koeffizient.
Der Hill-Koeffizient (n) beschreibt die Kooperativität der Bindung. Für n = 1, das Hill-Adsorption-Modell ist eine einfache Langmuir-Isotherme (die gleichen Bindungsstellen und alle Moleküle binden unabhängig voneinander an der Lipid-Bilayer). Wenn n ≠ 1, eine gebundene Liganden die Membran verbindliche Affinität für andere Liganden ändert, entweder (n > 1, positive Kooperativität) erhöhen oder verringern (n < 1, negative Kooperativität) die Affinität.
Abbildung 1 zeigt eine schematische Darstellung der experimentellen Workflow in unserem Labor zur Messung der Veränderungen in Resonanz und Frequenz während Ca2 +-abhängige Bindung und die Freigabe des AnxA2 an die Lipid-Bilayer in der flüssigen Phase. Eine beispielhafte Aufnahme ist in Abbildung 2dargestellt. Abbildung 2 A zeigt die Aufzeichnung der die Frequenzkurve und Abbildung 2B zeigt die Wärmeableitung Verschiebungen. Der prominente Rückgang der Häufigkeit nach der Zugabe von Liposomen (Abbildung 2A [Schritt 1]) zeigt ihre Adsorption. Da die Puffer gefüllt Vesikel nicht starr sind, sondern viskoelastische, die Verlustleistung erhöht (Abbildung 2B [Schritt 1]). Anschließend die Koaleszenz Vesikel Bruch. Die gleichzeitige Freigabe des Puffers in den Vesikeln sinkt die adsorbierten Masse, bis ein stabiles Plateau (Abbildung 2A [Schritt 2]) erreicht ist. Der Hinweis führt die Zugabe von Vesikeln eine hohe Verlustleistung Verschiebung, während die Verschiebung als Reaktion auf die Bilayer aufgrund der starren homogene Art der SLB (Abbildung 2B [Schritt 2]) viel kleiner ist. Schritt 3 in Abbildung 2A und 2 b Aufzeichnungen die Bindung des AnxA2 auf die Lipide, die Masse, fügt, wie durch das klare Frequenzverschiebung gesehen, aber die Bilayer Struktur nicht stört, wie durch die einzige kleine Veränderung der Verlustleistung angegeben. Wenn Ca2 + durch Chelatbildner EGTA (Abbildung 1 und Abbildung 2 [Schritt 4]) entfernt wird, distanziert sich AnxA2 von der Lipid-Film. Die Frequenz als auch die Verlustleistung Aufnahmen zu verschieben, auf dem Niveau mit der Bilayer nur (vgl. Schritt 2 und 4 in Abbildung 2A und 2 b), darauf hinweist, dass AnxA2 Bindung völlig abhängig von Ca ist2 + und dass die Lipid-Film bleibt intakt.
AnxA2, wie die meisten von den Polymerasen hängt von negativ geladenen Lipide wie PS. Dies ist deutlich zu erkennen, wenn POPS nicht vorhanden ist in der Lipid-Bilayer (Abbildung 3). Abbildung 3 A zeigt die Aufzeichnung der die Frequenzkurve und Abbildung 3B zeigt die Wärmeableitung Verschiebungen. Beachten Sie, dass die Frequenz verschiebt sich zu einer stabilen Basislinie bei-25 Hz, aber die Verlustleistung nicht ist verändert (Abbildung 3B [Schritt 2]), bezeichnend für eine ordnungsgemäße Bilayer-Formation. Jedoch werden keine Änderungen in der Frequenz (Abb. 3A) oder Dissipation (Abbildung 3B) nach der Zugabe von AnxA2 in Anwesenheit von Ca2 + (Abb. 3A und 3 b [Schritt 3]) oder EGTA (Abbildung beobachtet. 3a und 3 b [Schritt 4]), da AnxA2 nicht mit der Lipid-Film interagieren kann.

Abbildung 1 : Grafische Modell des experimentellen Arbeitsablaufs. Dieser Workflow zeigt die Vesikel-Absorption, die hydrophilen Sensorfläche (Schritt 1), der Vesicle Fusion/Bruch führte zu die SLB-Bildung (Schritt 2) und die Ca2 +-abhängigen Adsorption (Schritt 3) und EGTA-abhängige Desorption des AnxA2 (Schritt 4). Bitte klicken Sie hier für eine größere Version dieser Figur.
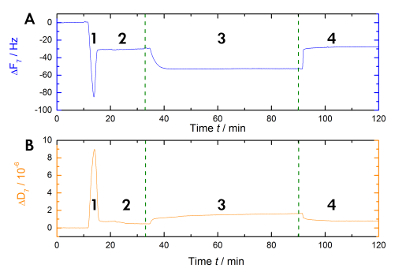
Abbildung 2 : Vorbildliche Aufnahme. Diese Tafeln zeigen (A) die zeitabhängige Überwachung der 7. Oberton Resonanzfrequenz und (B) die Ableitung verschiebt sich der Quarz Sensoren während der Messung. Die Anwendung von Liposomen verursacht einen schnellen Rückgang in der Frequenz-Baseline während die Ableitung Grundlinie (Schritt 1) erhöht. Die Stabilisierung der Baselines zeigt die Bildung von Bilayer (Schritt 2). Die AnxA2 (200 nM) Adsorption (in Anwesenheit von Ca2 +) auf die POPS-haltigen Lipid Bilayer fügt Masse ohne erheblich die Verlustleistung, darauf hinweist, dass die Lipid-Film nicht gestört ist (Schritt 3). Die Erholung der Frequenz Baseline auf Ca2 + Chelat mit EGTA zeigt die gesamte Desorption des Proteins (Schritt 4). Bitte klicken Sie hier für eine größere Version dieser Figur.
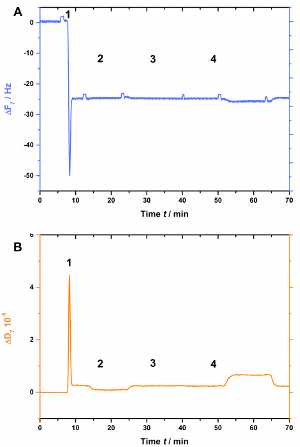
Abbildung 3 : Negative Kontrollexperiment, was zeigt, dass AnxA2 nicht in der Abwesenheit des POPS SLBs bindet. Diese Tafeln zeigen die Zugabe von Liposomen und die SLB-Bildung (Schritte 1 und 2). Keine Änderungen in der Frequenz (A) oder (B) Ableitung sind offensichtlich nach der Zugabe von AnxA2 (Schritt 3; 200 nM, im Beisein von Ca2 +) oder EGTA (Schritt 4). Bitte klicken Sie hier für eine größere Version dieser Figur.
| Zusammensetzung | ΔΔF/Hz nach Bildung der SLBs | ΔΔD * 10-6 nach Bildung der SLB |
| POPC/POPS (80: 20) | 26,3 ± 0,2 | 0,26 ± 0,03 |
| POPC/PI (4,5) P2 (95: 5) | 26,5 ± 0,5 | 0,31 ± 0,02 |
| POPC/POPS/Chol (60: 20: 20) | 29.2 ± 0,2 | 0,45 ± 0,09 |
| POPC/POPS/PI (4,5) P2/Chol (60: 17: 03:20) | 29,6 ± 0,6 | 0,43 ± 0,10 |
| POPC/DOPC/POPS/PI (4,5) P2/Chol (37: 20: 20: 03:20) | 29,4 ± 0,4 | 0,39 ± 0,14 |
Tabelle 1: Zusammensetzung und Bildung der SLB Daten Lipid 7 .
Diskussion
Zur Beantwortung von Fragen rund um die Struktur-Funktions-Beziehung von Zellmembranen sowohl in quantitativer und qualitativer Weise Zelle Biologie Gewinne immens durch die Verwendung von biophysikalischen Methoden basierend auf etablierten und Techniken weit verbreitet , einschließlich der atomaren force Microscopy (AFM), Oberflächenplasmonenresonanz (SPR), und die QCM-D-Technik hier beschäftigt. Wir zeigten in früheren Studien, die annexin Proteine in Ca2 binden +-abhängigen Weise an die immobilisierten Membran mit hoher Affinität. Wir verwenden Frequenz und Wärmeableitung Verschiebungen von der 7. Oberton (Δf7), da dies den besten Kompromiss Erkennung Empfindlichkeit und Oszillation Stabilität darstellt.
Diese Technik ermöglicht auch eine quantitative Beschreibung der Membran-Protein-Interaktion. AnxA2 Bindung an die Membran zeichnet sich durch positive Kooperativität, die wird durch die erhaltenen annexin zentrale Domäne vermittelt und hängt von der Anwesenheit von Cholesterin. Die quantitativen Daten, die für AnxA2 und AnxA8 in gemeldet werden ausführlich an anderer Stelle6,8.
Es gibt viele wichtige Schritte in diesem Protokoll. Verwenden Sie die Liposomen sofort; Andernfalls könnte kleine Bläschen zu größeren Bläschen mit weniger Oberflächenspannung, führt die Hemmung der Lipid Bilayer Bildung zu verschmelzen. Pflegen Sie eine konstante Temperatur während der Messungen. Jede kleine Abweichung der Temperatur führt zu einer nicht unbedeutenden Frequenz und Verlustleistung Verschiebung. Vermeiden Sie Luftblasen; Andernfalls das System ist instabil und wird keine Basislinie einzurichten.
Die Sauerbrey-Gleichung ermöglicht die direkte Umwandlung der beobachteten Frequenz verwandelt sich in Veränderungen in der Masse und ist daher weit verbreitet. Die Annahme einer linearen Zusammenhang zwischen der Änderung der Resonanzfrequenz und die added Mass gilt jedoch nur für Komponenten bilden eine starre und einheitliche Film auf der Sensorfläche. Die Sauerbrey Gleichung nicht für viskoelastische Adsorbentien wie wasserreiche Protein Filme, Lipid-Schichten mit eingearbeiteten Wasser verwendet werden oder sogar adsorbiert Zellen. Komplexere mathematische Modelle sind hier erforderlich. Daher ist es äußerst wichtig, gleichzeitig die Veränderungen in Frequenz und Verlustleistung zu beobachten. Um strukturelle Veränderungen während der Messung zu erkennen, können die ΔD im Vergleich zu Δf Verhältnisse mit einer geraden Linie zeigt keine Konformationsänderungen geplottet werden.
Ein großer Vorteil dieser Technik ist die Möglichkeit, ein sehr breites Spektrum von Materialien als Substrate zu nutzen. Darüber hinaus ist es eine sichere und direkte Methode, verschiedenste makromolekulare Interaktionen zu studieren, wie die richtige Bildung der Oberflächenbeschichtung Filme (z. B. SLB), sowie weitere Protein-Lipid Interaktionen online überwacht werden kann.
Dieses Protokoll kann sein angewandt zu anderen Membran-wechselwirkenden Proteinen, z. B. BAR Domäne Proteine19, die ERM (Ezrin, Radixin und Moesin) Protein-Familie, die eine wichtige Rolle in Membran-Cytoskelett Gestänge20,21 ,22oder Proteine, die C2 oder PH-Domänen enthalten. Darüber hinaus wurde eine Vielzahl von Anwendungen dieser Technik, biologische Materialien zu studieren erfolgreich veröffentlicht damit QCM als gut geeignet experimentelle Plattform, um die Wechselwirkungen von komplexeren makromolekularen Versammlungen oder sogar studieren zu etablieren, 23,24Zellen.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Diese Arbeit wurde von der Deutschen Forschungsgemeinschaft unter Stipendien SFB 858/B04, EXC 1003, SFB 1348/A04 und SFB 1348/A11 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Calciumchloride | Merck | 017-013-00-2 | 99% |
| Chloroform | Roth | 4432.1 | 99% |
| DOPC | Avanti | 850375P | |
| EGTA | PanReac AppliChem | A0878 | 99% |
| HEPES | PanReac AppliChem | A1069 | |
| Methanol | PanReac AppliChem | A3493 | |
| PiP2 | Avanti | 850155P | |
| POPC | Avanti | 850457P | |
| POPS | Avanti | 840034P | |
| Sodiumchloride | PanReac AppliChem | A1149 | |
| SDS | Roth | 183 | |
| Trisodium citrate | PanReac AppliChem | A3901 | |
| Equipment | |||
| Extruder Liposofast | Avestin | ||
| Qsense E4 Analyzer | Qsense | ||
| QSense Dfind | Qsense | ||
| Pump IPC 4 | Ismatec | ISM 930 | |
| QSX 303 SiO2 Silicon dioxide 50nm | Qsense | QSX 303 | |
| PC Membranes 0.05μm | Avanti polar lipids | 610003 | |
| OriginPro | OriginLab Corporation | Version 8 and 9 |
Referenzen
- Simons, K., Toomre, D. Lipid rafts and signal transduction. Nature Reviews Molecular Cell Biology. 1 (1), 31-41 (2000).
- Gerke, V., Creutz, C. E., Moss, S. E. Annexins: linking Ca2+ signalling to membrane dynamics. Nature Reviews Molecular Cell Biology. 6, 449-461 (2005).
- Mim, C., Unger, V. M. Membrane curvature and its generation by BAR proteins. Trends in Biochemical Science. 37, 526-533 (2012).
- Rescher, U., Ruhe, D., Ludwig, C., Zobiack, N., Gerke, V. Annexin 2 is a phosphatidylinositol (4,5)-bisphosphate binding protein recruited to actin assembly sites at cellular membranes. Journal of Cell Science. 117, 3473-3480 (2004).
- Gerke, V., Moss, S. E. Annexins: from structure to function. Physiological Reviews. 82, 331-371 (2002).
- Heitzig, N., et al. Cooperative binding promotes demand-driven recruitment of AnxA8 to cholesterol-containing membranes. Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids. 1863 (4), 349-358 (2018).
- Drücker, P., Grill, D., Gerke, V., Galla, H. J. Formation and characterization of supported lipid bilayers containing phosphatidylinositol-4,5-biphosphate and cholesterol as functional surfaces. Langmuir. 30, 14877-14886 (2014).
- McConnell, H. M., Watts, T. H., Weis, M. R., Brian, A. A. Supported planar membranes in studies of cell-cell recognition in the immune system. Biochimica et Biophysica Acta - Reviews on Biomembranes. 864, 95-106 (1986).
- Anderson, T. H., et al. Formation of supported bilayers on silica substrates. Langmuir. 25, 6997-7005 (2009).
- Pfeiffer, L., Petronis, S., Koper, I., Kasemo, B., Zach, M. Vesicle adsorption and phospholipid bilayer formation on topographically and chemically nanostructured surfaces. Journal of Physical Chemistry B. 114, 4623-4631 (2010).
- Cho, N. J., Jackman, J. A., Liu, M., Frank, C. W. pH-Driven assembly of various supported lipid platforms: a comparative study on silicon oxide and titanium oxide. Langmuir. 27, 3739-3748 (2011).
- Jackman, J. A., Tabaei, S. R., Zhao, Z., Yorulmaz, S., Cho, N. J. Self-Assembly formation of lipid bilayer coatings on bare aluminium oxide: overcoming the force of interfacial water. ACS Applied Materials & Interfaces. 7, 959-968 (2015).
- Olson, F., Hunt, C. A., Szoka, F. C., Vail, W. J., Papahadjopoulos, D. Preparation of liposomes of defined size distribution by extrusion through polycarbonate membranes. Biochimica et Biophysica Acta(BBA) - Biomembranes. 557 (1), 9-23 (1979).
- Richter, R., Mukhopadhyay, A., Brisson, A. Pathways of lipid vesicle deposition on solid surfaces: a combined QCM-D and AFM study. Biophysical Journal. 85 (5), 3035-3047 (2003).
- Richter, R. P., Bérat, R., Brisson, A. R. Formation of solid-supported lipid bilayers: an integrated view. Langmuir. 22 (8), 3497-3505 (2006).
- Sauerbrey, G. Verwendung von Schwingquarzen zur Wägung dünner Schichten und zur Mikrowägung. Zeitschrift für Physik A Hadrons and Nuclei. 155 (2), 206-222 (1959).
- Rodahl, M., Höök, F., Krozer, A., Brzezinski, P., Kasemo, B. Quartz crystal microbalance setup for frequency and Q-factor measurements in gaseous and liquid environments. Review of Scientific Instruments. 66 (7), 3924-3930 (1995).
- Drücker, P., Pejic, M., Grill, D., Galla, H. J., Gerke, V. Cooperative binding of annexin A2 to cholesterol-and phosphatidylinositol-4, 5-bisphosphate-containing bilayers. Biophysical Journal. 107 (9), 2070-2081 (2014).
- Galic, M., et al. External push and internal pull forces recruit curvature-sensing N-BAR domain proteins to the plasma membrane. Nature Cell Biology. 14 (8), 874-881 (2012).
- Fehon, R. G., McClatchey, A. I., Bretscher, A. Organizing the cell cortex: the role of ERM proteins. Nature Reviews Molecular Cell Biology. 11 (4), 276-287 (2010).
- Braunger, J. A., Kramer, C., Morick, D., Steinem, C. Solid supported membranes doped with PIP2: influence of ionic strength and pH on bilayer formation and membrane organization. Langmuir. 29 (46), 14204-14213 (2013).
- Bianco, M., et al. Quartz crystal microbalance as cell-based biosensor to detect and study cytoskeletal alterations and dynamics. Biotechnology Journal. , 1700699(2018).
- Chen, J. Y., Penn, L. S., Xi, J. Quartz crystal microbalance: Sensing cell-substrate adhesion and beyond. Biosensors and Bioelectronics. 99, 593-602 (2018).
- Bragazzi, N. L., et al. Quartz-Crystal Microbalance (QCM) for Public Health: An Overview of Its Applications. Advances in Protein Chemistry and Structural Biology. Donev, R., et al. 101, Academic Press. 149-211 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten