Method Article
Microgravimetry dissipativo para estudar a dinâmica da vinculação do fosfolipídeo proteína anexina A2 para Bilayers do Lipid com suporte sólido usando um ressonador de quartzo
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Aqui, apresentamos um protocolo experimental que pode ser empregado para determinar a afinidades de ligação e o modo de interação da etiqueta livre fosfolipídeo-proteína anexina A2 com imobilizado com suporte sólido bilayers (SLB), medindo-se simultaneamente a absorção de massa e as propriedades viscoelásticas da proteína anexina A2.
Resumo
A técnica de micro-balança dissipativas de cristal de quartzo é uma abordagem simples e livre de rótulo para medir simultaneamente as propriedades de absorção e viscoelástico em massa da massa absorvida/imobilizada em superfícies de sensor, permitindo que as medições da interação de proteínas com superfícies com suporte sólido, tais como bilayers do lipid, em tempo real e com alta sensibilidade. Anexinas são um grupo altamente conservado de fosfolipídeo-proteínas que interagem reversivelmente com o headgroups carregado negativamente através da coordenação de íons cálcio. Aqui, descrevemos um protocolo que foi contratado para analisar quantitativamente a ligação da anexina A2 (AnxA2) para bilayers do lipid planar preparados na superfície de um sensor de quartzo. Este protocolo é otimizado para obter dados robustos e reprodutíveis e inclui uma descrição detalhada passo a passo. O método pode ser aplicado a outras proteínas com ligação a membrana e composições de BICAMADA.
Introdução
Membranas celulares são estruturas altamente dinâmicas e complexas. Mistura de compostos de lipídios de membrana, juntamente com proteínas de membrana perifericamente e/ou integralmente associado, montar a forma microdomains. A organização tempo-espacial coordenada destas microdomains membrana está envolvida em processos fisiológicos importantes1. Dinâmica de microdomain de membrana é conduzida pela interação de lipídios de membrana, assim como pela capacidade das proteínas de membrana periférica de reconhecer e interagir com lipídios enriquecidos no microdomains. O recrutamento das proteínas para os lipídios específicos frequentemente é conseguida através de lipídios-reconhecimento módulos, como a homologia de plecstrina (PH) ou o C2 domínios2,3. Biofísicos métodos analíticos usando membranas modelo são a chave para a compreensão dos princípios fundamentais que regem esses processos a nível molecular.
Anexinas, uma grande família de multigene, são bem conhecidas por sua capacidade de se ligar a lipídios de membrana carregada negativamente, predominantemente fosfatidilserina (PS), em uma Ca2 +-controlado de forma2. A segunda marca da família annexin é a presença de um segmento estrutural conservada, a anexina repetir, ou seja presentes quatro ou oito vezes e abriga o Ca2 +- e de sites de fosfolipídeo-ligação4. O Ca2 +-interação dependente lipídico coloca as anexinas na posição perfeita para sentir e transmitir Ca2 +-mediada por sinalização nas membranas do alvo. Consistentemente, anexinas são capazes de induzir a formação de microdomains enriquecidos em colesterol, fosfatidilinositol-4,5-bisfosfato (PI (4,5) P.2) e PS, tanto na membrana celular e/ou artificial sistemas5. Este protocolo descreve uma abordagem para analisar a interação de anexina-membrana usando um cristal de quartzo micro-balança dissipação (QCM-D)6,7,8.
O componente básico neste micro-balança é um cristal oscilante que serve como superfície do sensor. A adsorção e/ou ligação de moléculas de superfície do sensor diminui a frequência de ressonância (f) proporcional ao aumento da massa. Se a superfície é revestida uniformemente com um filme, a ligação de substâncias adicionais pode interferir com a integridade estrutural desta camada, e tais alterações na viscoelasticidade (a energia fator de dissipação D) podem ser adicionalmente monitoradas. Esta é uma técnica generalizada para estudar a interação das proteínas com bilayers do lipid. Nesta abordagem, vesículas lipídicas são absorvidas para a superfície do sensor adequadamente revestida. Formação de bicamada lipídica é favorável em materiais à base de sílica9,10, como vesículas frequentemente não romper-se em outras superfícies hidrofílicas, tais como ouro11 oxidado após exposição UV-ozônio, TiO212ou Al 2O313. A ruptura das vesículas unindo libera a fase aquosa, levando a mudanças características em massa e dissipação. A geração de suporte sólido bilayers (SLB) pela fusão de vesículas é simples e robusto e pode ser usada para gerar modelos complexos que imitam as membranas celulares.
Micro-balança dissipativas de cristal de quartzo é uma técnica livre de rótulo e sensível. Uma grande vantagem é a possibilidade de revestir qualquer material que gera um filme suficientemente fino para a superfície, proporcionando uma ampla gama de aplicações em pesquisa de diversas áreas. A interação da proteína-membrana é observada em tempo real, e os resultados podem ser analisados diretamente. A mesma superfície do sensor pode ser usada em medições posteriores (após a realização de um mínimo de limpeza conforme descrito neste protocolo), permitindo assim para controles internos precisos e uma comparabilidade entre analitos.
Protocolo
Nota: Buffers devem ser filtrados, usando um filtro de 0,22 µm e desgaseificado por um vácuo por 1h.
1. preparação de vesículas lipídicas
- Use tubos de vidro de 2 mL. Dissolver cada lipídico, 1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC), 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphocholine (POPC), 1-palmitoyl-2-oleoyl-sn-glycero-3-phospho-L-serine (pop) e colesterol (Chol), em uma mistura de clorofórmio / metanol (50: 50 v/v) para preparar uma solução de lipídios clara 5 mM. 1,2-dioleoyl-sn-glycero-3-phospho-(1'-myo-inositol-4',5'-bisphosphate) (PI (4,5) P.2), dissolva em uma mistura de clorofórmio/metanol/água (20:9:1 v/v).
- Combinar os lipídios dissolvidos na proporção molar desejado de POPC/POPS (80/20), POPC/PI (4,5) P2 (95/5), POPC/POPS/Chol (60/20/20), POPC/POPS/PI (4,5) P2/Chol (60/17/3/20) e POPC/DOPC/POPS/PI (4,5) P2/Chol (37/20/20/3/20) ( A tabela 1) em tubos de vidro de 10 mL.
Nota: O montante final de lipídio total é de 500 µ g. - Evapore os solventes orgânicos usando um córrego seco de nitrogênio. Deixe a mistura de lipídios em um sistema de alto vácuo (liofilização) para 3h remover quaisquer traços residuais de solventes.
Nota: Isto resulta em uma película seca. - Resuspenda o filme lipídico em 1 mL de tampão citrato (10mm-citrato trissódico, 150 mM de NaCl, pH 4,6). Incube a suspensão lipídico a 60 ° C (esta temperatura é em torno de 10 ° C acima da temperatura de transição de fase do maior derretimento lipídico na mistura) por 30 min em um banho de água e o vórtice vigorosamente cada 5 min.
Nota: Isto resulta na formação de vesículas grandes, multilamellar (MLVs). Manter a suspensão acima da temperatura de transição. - Pré-aqueça a extrusora (a 60 ° C, neste caso), equipada com uma membrana de policarbonato de tamanho de poro de 50 nm de diâmetro acima da temperatura de transição (que chegou a 40-50 ° C) por 30 min.
- Carregar a suspensão MLV em extrusora pré-aquecido e passar suavemente a mistura 31 x através da membrana de policarbonato para formar unilamellar de pequenas vesículas (SUVs)14. Manter a temperatura acima da temperatura de transição.
- Transferir a suspensão SUV para um recipiente de plástico reação de 2 mL e adicionar o tampão citrato (consulte a etapa 1.4) para trazer o volume final de 2ml.
Nota: Isto irá produzir uma concentração final de lipídios de 250 µ g/mL.
2. manipulando os sensores de quartzo
Nota: Sempre lidar com os sensores de quartzo com uma pinça.
- Incube quatro sensores inserido em um suporte de politetrafluoretileno em uma solução de SDS 2% ≥ 30 min. lavagem-los extensivamente com água ultra-pura completamente remover o SDS e deixe-os secar usando um fluxo de argônio seco ou nitrogênio.
- Use um sistema de limpeza de plasma para remover completamente todos os contaminadores. Inserir os sensores secos na câmara de plasma-limpeza, evacuar a câmara e nivelá-lo 3x com oxigênio. Vire o plasma líquido de limpeza na. Use os seguintes parâmetros de processo: 1 x 10-4 Torr pressão, poder de alta frequência de rádio (RF) e 10 min de tempo de processo. Desligar a máquina e retire os sensores.
3. micro-balança operação
Nota: Um sistema micro-balança com quatro câmaras de temperatura controlada de fluxo em uma configuração paralela, ligado a uma bomba peristáltica e definido como um caudal de 80 µ l/min, foi usado. No modo de fluxo aberto, o buffer foi bombeado do reservatório alimentador para o tanque. No modo de loop, o tanque estava conectado com o reservatório alimentador para gerar um ciclo fechado. A temperatura foi definida a 20 ° C.
- Doca cuidadosamente os sensores limpos de plasma em câmaras de 4 fluxo, usando uma pinça. Evite qualquer pressão sobre ou torção das câmaras e os tubos que podem causar vazamento.
- Irrigue o sistema com tampão citrato (10mm-citrato trissódico, 150 mM NaCl, pH 4,6) no modo de fluxo aberto por 10 min.
Nota: Isto requer exatamente 3,2 mL de tampão, mas é aconselhável usar um excesso de buffer (10 mL). - Lançamento do programa. Começar a gravar as alterações na frequência e dissipação do primeiro Tom fundamental (n = 1) e overtones (n = 3-13) usando o software, até que a frequência e dissipação das linhas de base são estáveis (isto levará em torno de 40-60 min).
Nota: Os níveis de ruído de frequência (pico-a-pico) devem ser menores do que 0,5 Hz e, para a dissipação, inferior 0.1·10-6, com uma tração máxima (em solução aquosa) de 1Hz/h em frequência e 0.3·10/h-6em dissipação. - Quando as linhas de base são estáveis, aplica a suspensão SUV em tampão citrato (2 mL em um tubo pequeno). Usando um recipiente de reação, remova 1,5 mL do volume morto. Em seguida, feche o sistema no modo de laço-fluxo. Registro da mudança de frequência/dissipação por mais 10 minutos.
Nota: Durante este tempo, as vesículas irão espalhar sobre a superfície de2 SiO e se fundem para formar uma BICAMADA contínua15,16 (passo 2 nas figuras 1e Figura 2, Figura 3). A adsorção de SUVs na superfície do sensor é dois-fásicos e tem uma frequência típica mínima e máxima na dissipação. Uma base estável de frequência/dissipação nova com um deslocamento de frequência característica (dependendo da composição lipídica) entre 26 e 29 Hz (ver tabela 1) indica uma BICAMADA contínua na superfície. - Quando o SLB é estável (ver passo 3.4), equilibrar o sistema com o buffer de execução (10 mM HEPES, 150 mM NaCl, pH 7,4) a necessária Ca2 + concentrações (variando de 50 µM até a 1 mM CaCl2, dependendo da experiência) em um modo de fluxo aberto para 40 min.
- Adicionar a proteína (aqui, AnxA2) para a execução de buffer que contém Ca2 + (ver passo 3.5). Execute a aplicação da proteína em um modo de laço-fluxo até um estado de constante de equilíbrio é atingido (etapa 3 na Figura 3, Figura 1e Figura 2).
Nota: A concentração de proteína pode variar de 1 a 400 nM. Adsorção de proteínas resulta em um deslocamento de frequência de concentração-dependente, refletindo a adsorção de massa (proteína). - Dissocia a proteína ligada por quelantes de íons de Ca2 + com 5mm EGTA no buffer de execução no modo de fluxo aberto (etapa 4 nas figuras 1 e Figura 2).
Nota: A recuperação da frequência e dissipação da linha de base do SLB indica uma total Reversibilidade da ligação às proteínas. Ciclos de associação-dissociação podem ser repetidos para comparar diferentes concentrações ou proteínas.
4. micro-balança limpeza
Nota: Execute um procedimento de limpeza mínimo após cada medição.
- Regenerar o sistema micro-balança com 50 mL de DDQ2O em um modo de fluxo contínuo aberto, retirar os tubos do recipiente de água e deixe o sistema funcionar a seco.
- Cuidadosamente remova o sensor de cristal e limpe-o com a solução de SDS 2% usando o titular de politetrafluoroetileno (consulte a etapa 2.1).
- Seque as partes visíveis do interior módulo fluxo onde o sensor foi colocado.
Nota: Execute um procedimento de limpeza após uma série de 10 medidas de intensivo. - Limpe o sistema com uma solução de SDS 2% (50 mL) a 40 ° C (instalação do software) em um modo de fluxo contínuo aberto (tubo), usando uma taxa de fluxo de 20 µ l/min para contacto prolongado com o detergente.
- Limpe com 250 mL de DDQ2O no modo contínuo fluxo aberto com um caudal de 160 µ l/min.
Nota: Depois de 4 meses, efectuar um procedimento de limpeza extensivo, de acordo com o manual do fabricante.
Resultados
A diminuição na frequência ressonante (Δf) correlaciona-se de forma linear com a massa adsorvida (Δm), conforme definido pela equação de Sauerbrey. 17
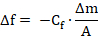
Aqui, f é a frequência de ressonância, Cf é uma constante que depende das características físicas e geométricas de quartzo determinado e a frequência de ressonância, e A é a área de superfície do sensor.
Na maioria das aplicações, a camada adsorvida não é completamente rígida mas viscoelástico. O amortecimento resultante da oscilação do sensor de quartzo é referido como dissipação (D). A dissipação monitorada alterações (ΔD) se correlacionam com as propriedades viscoelásticas da massa limite18 e são definidos como segue8.
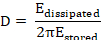
Aqui, Edissipou-se é a energia perdida durante o período de uma oscilação e Earmazenados é a energia total do sensor livremente oscilante.
Para analisar e quantificar os parâmetros de ligação, isotermas de frequência são derivadas plotando os turnos de frequência de equilíbrio (ΔΔfe) contra as concentrações de proteína. ΔΔfe é definido como

Aqui, Δft1 representa o início da proteína adsorção e Δft2 o estado de equilíbrio. Encaixe de curva não linear pode ser realizada por meio de uma expansão de Hill da equação de Langmuir conforme segue6,8.
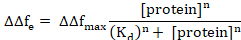
Aqui, ΔΔfmáximo é o de ΔΔfe da concentração de proteína, resultando em encadernação máxima (saturação), Kd é a constante de dissociação aparente para a complexo de proteína/membrana e n é o coeficiente de Hill.
O coeficiente de Hill (n) descreve a cooperatividade de vinculação. Para n = 1, o modelo de adsorção de Hill é uma simples isoterma de Langmuir (os sites de ligação igual e todas as moléculas ligam independentemente uns dos outros para a bicamada lipídica). Se n ≠ 1, um limite ligante altera a membrana vinculação afinidade para outros ligantes, aumentando (n > 1, cooperatividade positiva) ou diminuir (n < 1, cooperatividade negativa) a afinidade.
A Figura 1 mostra um diagrama de fluxo de trabalho experimental utilizado em nosso laboratório para medir as mudanças na ressonância e frequência durante Ca2 +-dependente ligação e a liberação de AnxA2 para a bicamada lipídica na fase líquida. Uma gravação de exemplar é mostrada na Figura 2. Figura 2 A mostra a gravação da curva de frequência e Figura 2B mostra as mudanças de dissipação. A queda proeminente na frequência sobre a adição das lipossomas (Figura 2A [Passo 1]) indica sua adsorção. Porque as vesículas buffer preenchido não são rígidas, mas viscoelástico, a dissipação aumenta (Figura 2B [Passo 1]). Posteriormente, a ruptura de vesículas coalescentes. A liberação concomitante de buffer dentro as vesículas diminui a massa adsorvida até um platô estável é atingido (Figura 2A [passo 2]). Digno de nota, a adição de vesículas resulta em uma mudança de elevada dissipação, enquanto a mudança em resposta à BICAMADA é muito menor, devido à natureza homogénea rígida do SLB (Figura 2B [passo 2]). Etapa 3 na Figura 2A e 2B registros a ligação do AnxA2 para os lipídios, que adiciona a massa, como visto pelo deslocamento de frequência clara, mas não interfere com a estrutura de BICAMADA, conforme indicado pela única pequena alteração em dissipação. Quando Ca2 + é removido pelo agente quelante EGTA (Figura 1 e Figura 2 [passo 4]), AnxA2 se dissocia do filme lipídico. A frequência, bem como as gravações de dissipação, deslocar-se para os níveis vistos com a BICAMADA apenas (comparar as etapas 2 e 4 na Figura 2A e 2B), indicando que a ligação de AnxA2 é totalmente dependente de Ca2 + e que o filme lipídico mantém-se intacto.
AnxA2, quanto mais das anexinas, depende de lipídios negativamente carregados, tais como PS Isto é claramente visto quando o pai está ausente na bicamada lipídica (Figura 3). Figura 3 A mostra a gravação da curva de frequência e Figura 3B mostra as mudanças de dissipação. Nota que a frequência desloca-se para uma linha de base estável a-25 Hz, no entanto, a dissipação não é alterado (Figura 3B [passo 2]), indicativo de uma formação adequada da bicamada. No entanto, nenhuma mudança na frequência (Figura 3A) ou dissipação (Figura 3B) é observada após a adição de AnxA2 na presença de Ca2 + (Figura 3A e 3B [passo 3]) ou EGTA (Figura 3a e 3B [passo 4]), como AnxA2 não pode interagir com o filme de lipídios.

Figura 1 : Gráfico modelo de fluxo de trabalho experimental. Este fluxo de trabalho ilustra a absorção de vesículas na superfície do sensor hidrófila (etapa 1), a fusão de vesículas/ruptura levando para a formação do SLB (etapa 2) e o Ca2 +-dependente adsorção (etapa 3) e dessorção de EGTA-dependente do AnxA2 (passo 4). Clique aqui para ver uma versão maior desta figura.
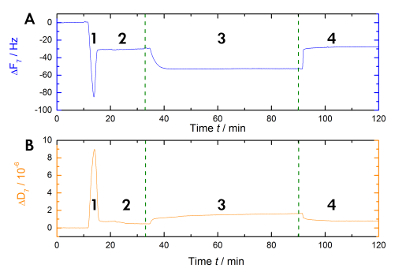
Figura 2 : Gravação exemplar. Estes painéis mostram (A) o monitoramento de tempo-dependente da frequência de ressonância da 7ª harmônica e (B) a dissipação de turnos dos sensores quartzo durante a medição. A aplicação de lipossomas a causa uma rápida queda na linha de base a frequência, Considerando que a base de dissipação aumenta (etapa 1). A estabilização das linhas da base indica a formação da bicamada (etapa 2). O AnxA2 (200 nM) adsorção (na presença de Ca2 +) para a POPS contendo lipídica adiciona massa sem alterar significativamente a dissipação, indicando que o filme lipídico não é perturbado (etapa 3). A recuperação de linha de base frequência em cima de Ca2 + quelação com EGTA indica a dessorção total da proteína (passo 4). Clique aqui para ver uma versão maior desta figura.
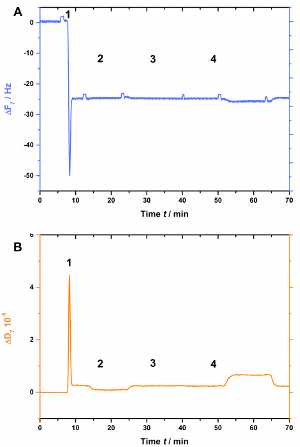
Figura 3 : Experimento de controle negativo, demonstrando que AnxA2 não se vincula ao SLBs na ausência de POPS. Estes painéis mostram a adição de lipossomas e a formação do SLB (etapas 1 e 2). Nenhuma mudança na frequência do (A) ou (B) dissipação é aparente após a adição de AnxA2 (etapa 3; 200 nM, na presença de Ca2 +) ou EGTA (passo 4). Clique aqui para ver uma versão maior desta figura.
| Composição | ΔΔF/Hz após formação de SLBs | ΔΔD * 10-6 após a formação do SLB |
| POPC/POPS (80: 20) | 26,3 ± 0.2 | 0,26 ± 0,03 |
| POPC/PI (4,5) P2 (95: 5) | 26,5 ± 0,5 | 0,31 ± 0,02 |
| POPC/POPS/Chol (60: 20: 20) | 29,2 ± 0.2 | 0,45 ± 0,09 |
| POPC/POPS/PI (4,5) P2/Chol (60: 17: 03:20) | 29,6 ± 0,6 | 0,43 ± 0,10 |
| POPC/DOPC/POPS/PI (4,5) P2/Chol (20: 37: 20: 03:20) | 29,4 ± 0,4 | 0,39 ± 0,14 |
Tabela 1: dados de formação e composição lipídica do SLB 7 .
Discussão
Para responder a perguntas relativas a relação estrutura-função das membranas celulares de forma quantitativa e qualitativa, biologia celular lucros imensamente a utilização de abordagens biofísicas baseiam no bem conhecidos e amplamente utilizado técnicas , incluindo atômica força (AFM), microscopia de ressonância de plasmon de superfície (SPR), e utilizada a técnica de QCM-D aqui. Mostramos em estudos anteriores que anexina proteínas ligam-se em uma Ca2 +-dependente forma à membrana imobilizada com alta afinidade. Nós usamos a frequência e dissipação turnos do subtexto 7 (Δf7), porque isso representa o melhor compromisso de estabilidade de sensibilidade e oscilação de deteção.
Esta técnica também permite uma descrição quantitativa da interação da membrana-proteína. AnxA2 ligação à membrana é caracterizada por cooperatividade positiva que é mediada pelo domínio do núcleo annexin conservado e depende da presença de colesterol. Os dados quantitativos obtidos para AnxA2 e AnxA8 são relatados em detalham em outro lugar6,8.
Existem muitos passos críticos no presente protocolo. Use os lipossomas imediatamente; caso contrário, pequenas vesículas podem fundir-se em vesículas maiores com menos tensão de superfície, levando à inibição da formação de bicamada lipídica. Manter uma temperatura constante durante as medições. Cada pequeno desvio na temperatura resulta em uma mudança de frequência e dissipação não negligenciável. Evitar bolhas de ar; caso contrário, o sistema é instável e não irá estabelecer uma linha de base.
A equação de Sauerbrey permite a conversão direta da frequência observada, muda de alterações em massa e é, portanto, amplamente utilizado. No entanto, a suposição de uma correlação linear entre a mudança na frequência de ressonância e a massa adicionada só vale para componentes que formam uma película rígida e uniforme sobre a superfície do sensor. A equação de Sauerbrey não pode ser usada para viscoelástico adsorventes tais como filmes de proteína rica em água, camadas de lipídios com água incorporada, ou mesmo adsorvido células. Aqui, os modelos matemáticos mais complexos são necessários. Portanto, é extremamente importante monitorar simultaneamente as alterações na frequência e dissipação. Para detectar mudanças estruturais durante a medição, ΔD contra Δf rácios podem ser plotados, com uma linha reta, não indicando nenhuma alteração conformacional.
Uma grande vantagem desta técnica é a possibilidade de utilizar uma gama muito ampla de materiais como substratos. Além disso, é um método confiável e direto para estudar uma ampla gama de interações macromoleculares, como a formação adequada dos filmes de revestimento de superfície (tais como SLB), bem como interações proteína-lipídio mais, pode ser monitorado on-line.
Este protocolo pode ser aplicado a outras proteínas de membrana-interagindo, por exemplo, barra de proteínas do domínio19, a família de proteínas com ERM (ezrin, radixin e moesin) que tem um papel importante na ligação de membrana-citoesqueleto20,21 ,22, ou proteínas contendo domínios C2 ou PH. Além disso, uma ampla gama de aplicações desta técnica para o estudo de materiais biológicos com êxito publicou, estabelecendo assim o QCM como uma plataforma experimental adequada para estudar as interações dos conjuntos macromoleculares mais complexos ou até mesmo células de23,24.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Este trabalho foi apoiado pela Deutsche Forschungsgemeinschaft sob concessões SFB 858/B04, EXC 1003, SFB 1348/A04 e SFB 1348/A11.
Materiais
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Calciumchloride | Merck | 017-013-00-2 | 99% |
| Chloroform | Roth | 4432.1 | 99% |
| DOPC | Avanti | 850375P | |
| EGTA | PanReac AppliChem | A0878 | 99% |
| HEPES | PanReac AppliChem | A1069 | |
| Methanol | PanReac AppliChem | A3493 | |
| PiP2 | Avanti | 850155P | |
| POPC | Avanti | 850457P | |
| POPS | Avanti | 840034P | |
| Sodiumchloride | PanReac AppliChem | A1149 | |
| SDS | Roth | 183 | |
| Trisodium citrate | PanReac AppliChem | A3901 | |
| Equipment | |||
| Extruder Liposofast | Avestin | ||
| Qsense E4 Analyzer | Qsense | ||
| QSense Dfind | Qsense | ||
| Pump IPC 4 | Ismatec | ISM 930 | |
| QSX 303 SiO2 Silicon dioxide 50nm | Qsense | QSX 303 | |
| PC Membranes 0.05μm | Avanti polar lipids | 610003 | |
| OriginPro | OriginLab Corporation | Version 8 and 9 |
Referências
- Simons, K., Toomre, D. Lipid rafts and signal transduction. Nature Reviews Molecular Cell Biology. 1 (1), 31-41 (2000).
- Gerke, V., Creutz, C. E., Moss, S. E. Annexins: linking Ca2+ signalling to membrane dynamics. Nature Reviews Molecular Cell Biology. 6, 449-461 (2005).
- Mim, C., Unger, V. M. Membrane curvature and its generation by BAR proteins. Trends in Biochemical Science. 37, 526-533 (2012).
- Rescher, U., Ruhe, D., Ludwig, C., Zobiack, N., Gerke, V. Annexin 2 is a phosphatidylinositol (4,5)-bisphosphate binding protein recruited to actin assembly sites at cellular membranes. Journal of Cell Science. 117, 3473-3480 (2004).
- Gerke, V., Moss, S. E. Annexins: from structure to function. Physiological Reviews. 82, 331-371 (2002).
- Heitzig, N., et al. Cooperative binding promotes demand-driven recruitment of AnxA8 to cholesterol-containing membranes. Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids. 1863 (4), 349-358 (2018).
- Drücker, P., Grill, D., Gerke, V., Galla, H. J. Formation and characterization of supported lipid bilayers containing phosphatidylinositol-4,5-biphosphate and cholesterol as functional surfaces. Langmuir. 30, 14877-14886 (2014).
- McConnell, H. M., Watts, T. H., Weis, M. R., Brian, A. A. Supported planar membranes in studies of cell-cell recognition in the immune system. Biochimica et Biophysica Acta - Reviews on Biomembranes. 864, 95-106 (1986).
- Anderson, T. H., et al. Formation of supported bilayers on silica substrates. Langmuir. 25, 6997-7005 (2009).
- Pfeiffer, L., Petronis, S., Koper, I., Kasemo, B., Zach, M. Vesicle adsorption and phospholipid bilayer formation on topographically and chemically nanostructured surfaces. Journal of Physical Chemistry B. 114, 4623-4631 (2010).
- Cho, N. J., Jackman, J. A., Liu, M., Frank, C. W. pH-Driven assembly of various supported lipid platforms: a comparative study on silicon oxide and titanium oxide. Langmuir. 27, 3739-3748 (2011).
- Jackman, J. A., Tabaei, S. R., Zhao, Z., Yorulmaz, S., Cho, N. J. Self-Assembly formation of lipid bilayer coatings on bare aluminium oxide: overcoming the force of interfacial water. ACS Applied Materials & Interfaces. 7, 959-968 (2015).
- Olson, F., Hunt, C. A., Szoka, F. C., Vail, W. J., Papahadjopoulos, D. Preparation of liposomes of defined size distribution by extrusion through polycarbonate membranes. Biochimica et Biophysica Acta(BBA) - Biomembranes. 557 (1), 9-23 (1979).
- Richter, R., Mukhopadhyay, A., Brisson, A. Pathways of lipid vesicle deposition on solid surfaces: a combined QCM-D and AFM study. Biophysical Journal. 85 (5), 3035-3047 (2003).
- Richter, R. P., Bérat, R., Brisson, A. R. Formation of solid-supported lipid bilayers: an integrated view. Langmuir. 22 (8), 3497-3505 (2006).
- Sauerbrey, G. Verwendung von Schwingquarzen zur Wägung dünner Schichten und zur Mikrowägung. Zeitschrift für Physik A Hadrons and Nuclei. 155 (2), 206-222 (1959).
- Rodahl, M., Höök, F., Krozer, A., Brzezinski, P., Kasemo, B. Quartz crystal microbalance setup for frequency and Q-factor measurements in gaseous and liquid environments. Review of Scientific Instruments. 66 (7), 3924-3930 (1995).
- Drücker, P., Pejic, M., Grill, D., Galla, H. J., Gerke, V. Cooperative binding of annexin A2 to cholesterol-and phosphatidylinositol-4, 5-bisphosphate-containing bilayers. Biophysical Journal. 107 (9), 2070-2081 (2014).
- Galic, M., et al. External push and internal pull forces recruit curvature-sensing N-BAR domain proteins to the plasma membrane. Nature Cell Biology. 14 (8), 874-881 (2012).
- Fehon, R. G., McClatchey, A. I., Bretscher, A. Organizing the cell cortex: the role of ERM proteins. Nature Reviews Molecular Cell Biology. 11 (4), 276-287 (2010).
- Braunger, J. A., Kramer, C., Morick, D., Steinem, C. Solid supported membranes doped with PIP2: influence of ionic strength and pH on bilayer formation and membrane organization. Langmuir. 29 (46), 14204-14213 (2013).
- Bianco, M., et al. Quartz crystal microbalance as cell-based biosensor to detect and study cytoskeletal alterations and dynamics. Biotechnology Journal. , 1700699(2018).
- Chen, J. Y., Penn, L. S., Xi, J. Quartz crystal microbalance: Sensing cell-substrate adhesion and beyond. Biosensors and Bioelectronics. 99, 593-602 (2018).
- Bragazzi, N. L., et al. Quartz-Crystal Microbalance (QCM) for Public Health: An Overview of Its Applications. Advances in Protein Chemistry and Structural Biology. Donev, R., et al. 101, Academic Press. 149-211 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados