Method Article
Eine neuartige In-vitro- Modell von traumatischen Hirnverletzungen Blast
In diesem Artikel
Zusammenfassung
Dieser Artikel beschreibt eine neuartige Modell der primären Explosion traumatische Hirnverletzungen. Eine Druckluft angetriebene Schock Röhre dient zur in-vitro- Maus hippocampal Slice Kulturen zu einer einzigen Schockwelle aussetzen. Dies ist ein einfaches und schnelles Protokoll generiert eine reproduzierbare Gehirnverletzung Gewebe mit einem hohen Durchsatz.
Zusammenfassung
Schädel-Hirn-Verletzungen ist eine führende Ursache von Tod und Invalidität in militärische und zivile Bevölkerung. Blast Schädel-Hirn Verletzungen ergibt sich aus der Detonation von Sprengkörpern, jedoch die Mechanismen, die das Gehirn Schäden durch Explosion Überdruck Exposition zugrunde liegen sind nicht völlig verstanden und werden geglaubt, um eindeutig sein, um diese Art von Hirn-Trauma. Präklinische Modellen sind wichtige Werkzeuge, die dazu beitragen, um besser zu verstehen, Blast-induzierten-Hirn-Trauma. Eine neuartige in-vitro- Explosion TBI Modell wurde entwickelt mit einer offene Schock Tube, um Real-Life Open-Feld Druckwellen durch die Wellenform Friedlander modelliert zu simulieren. C57BL/6N Maus organotypischen hippocampal Slice Kulturen wurden einzelne Stosswellen ausgesetzt und die Entwicklung der Verletzung war bis zu 72 h mit Propidium Jodid, eine gut etablierte fluoreszierenden Marker von Zellschäden, die nur Zellen mit dringt gekennzeichnet Zellmembranen in Frage gestellt. Propidium Jodid Fluoreszenz war signifikant höher in den Scheiben eine Druckwelle im Vergleich mit Sham Scheiben während der gesamten Dauer des Protokolls ausgesetzt. Die Hirnverletzung Gewebe ist sehr reproduzierbar und proportional zu den Gipfel Überdruck der Stoßwelle angewandt.
Einleitung
Blast Schädelhirntrauma (SHT) ist ein komplexer Typ von Hirn-Trauma, das ergibt sich aus der Detonation von Sprengkörpern1,2. Blast TBI entstanden als Major gesundheitliches Problem in den letzten 15 Jahren mit der jüngsten militärischen Auseinandersetzungen im Irak und in Afghanistan2,3. Insgesamt wird es geschätzt, dass zwischen 4,4 % und 22,8 % der Soldaten aus dem Irak und Afghanistan mild TBI, ein Großteil davon Blast-bezogene, mit einer höheren gemeldeten Rate von Blast TBI in der US-Streitkräfte im Vergleich mit der britischen Streitkräfte4 erlitten haben ,5.
Die Verwendung von improvisierten Sprengkörpern ist verantwortlich für den Großteil der Explosion-assoziierten Trauma, einschließlich Explosion TBI, durch die militärischen Kräfte6ausgehalten. Die Detonation einer Treibladung ergibt sich eine sehr schnelle — aber vorübergehend — Druckanstieg, Auftritt in Millisekunden. Die entstehende Überdruck Welle von einer realen Freifeld-Explosion wird durch die Funktion Friedlander, mit einem plötzlichen Anstieg auf den Gipfel Überdruck, gefolgt von einer exponentiellen Zerfall7,8modelliert. Das Spektrum der extremen Kräfte und ihre schnellen zeitlichen Verlauf in einer Explosion Event gesehen sind in der Regel nicht in nicht-Blast Traumata1,9erlebt. Der Peak-Überdruck, ist der maximale Druck der Wellenform und die Dauer der positiven Welle gelten als wichtige Mitwirkende zur Explosion-Hirn-Trauma und diese hängen die explosive Aufladung und die Entfernung von der Detonation10, 11.
Das Trauma, dass Ergebnisse aus eine explosive Blast ist als vier diskreten Bauteilen, als primären, sekundären, tertiären und quartären Blast Verletzungen10,12,13,14eingestuft. Jede dieser Komponenten ist verbunden mit spezifischen Mechanismen der Schädigung. Primäre Blast Verletzungen ergibt sich aus der direkten Aktion der Überdruck Welle von Organen und Geweben2,13. Sekundäre Explosion Verletzungen Ergebnisse vor den Auswirkungen von Projektil Fragmente, durchdringend und ohne Dachdurchdringungen verursacht Wunden2,15. Tertiäre Explosion Verletzung tritt auf, wenn den Körper des Opfers gegen den Boden oder die umgebenden Objekte verschoben und Beschleunigung/Verzögerung Kräfte1,10,13zugeordnet ist. Quartäre Blast Verletzungen beschreibt eine heterogene Gruppe von Verletzungen unmittelbar im Zusammenhang mit der Explosion nicht abgedeckt durch die ersten drei Verletzungen Mechanismen beschrieben12,13. Es beinhaltet (ist aber nicht beschränkt auf) thermische Schädigung, Rauchvergiftung, Strahlung, elektromagnetische Wellen und psychische Nebenwirkungen13,15. Die meisten Blast-assoziierten TBI ergibt sich unmittelbar aus der ersten drei Mechanismen der Verletzungen, während der quartären Mechanismen der Explosion Verletzungen in der Regel mit systemischen Verletzung13verbunden sind. Die Auswirkungen der Beschleunigung/Verzögerung Kräfte (z.B. Schleudertrauma), stumpf und Eindringen von Schädel-Hirn-Verletzungen wurden ausgiebig untersucht in Bezug auf andere Arten von TBI (z.B., Kraftfahrzeug-Abstürze, fällt, ballistische Verletzungen). Jedoch die primäre Druckwelle Überdruck ist einzigartig für Blast Verletzungen und deren Auswirkungen auf das Hirngewebe sind viel weniger gut verstanden16. Die primäre Blast Verletzungen Mechanismen, verbunden mit einem Überdruck-Welle, sind die ersten die mechanischen Kräfte, mit dem Gehirn zu interagieren.
Zahlreiche präklinische TBI-Modelle wurden in den letzten Jahrzehnten entwickelt, die von unschätzbarem Wert für Blast TBI Mechanismen der Schädigung und Pathophysiologie verstehen und untersuchen mögliche neue Behandlungsmethoden, die sonst unmöglich, ausschließlich zu tun in der klinischen Einstellung17,18,19. Obwohl kein einziges präklinisches Modell die Komplexität der klinischen Blast-Hirn-Trauma reproduzieren kann, in der Regel replizieren verschiedene präklinische TBI Modelle unterschiedliche Aspekte der menschlichen TBI. Die schädigende Wirkung der Kräfte verbunden mit einer Explosion Explosion kann isoliert oder in Kombination in in Vitro und in Vivo Explosion TBI Modellen untersucht werden. In-vitro- Modelle haben den Vorteil, dass eine strikte Kontrolle der experimentellen Umgebung (Gewebe physiologischen Bedingungen und Verletzungen Biomechanik), die biologischen Variabilität reduziert und verbessert die Reproduzierbarkeit, erlaubt die Untersuchung von spezifischen molekularen Kaskaden, ohne die Confounder in Tier-Modelle20. Unser Ziel war es, ein in-vitro- Modell untersuchen die Auswirkungen der primären Explosion auf Hirngewebe zu entwickeln. Wir wollten ein Modell mit einem Überschall Shockwave mit einem Friedlander Wellenform Vertreter einer Freifeld-Explosion wie durch eine improvisierte Sprengkörper (IED) zu entwickeln.
Protokoll
In diesem Manuskript beschriebenen Experimente wurden in Übereinstimmung mit dem Vereinigten Königreich Tiere (wissenschaftliche Verfahren) Act von 1986 und von Animal Welfare & Ethical Review Körper des Imperial College London genehmigt worden. Tierbetreuung wurde in Übereinstimmung mit den institutionellen Richtlinien des Imperial College London.
(1) hippocampal organotypischen Slice Vorbereitung und Kultur
Hinweis: Dieses Protokoll ermöglicht die Herstellung von organotypischen hippocampal Scheiben entsprechend die Interface-Methode von Stoppini und Kollegen mit geringfügigen Änderungen21,22,23beschrieben. Im Idealfall sollte nicht mehr als drei Tiere eingeschläfert und seziert in einer Sitzung, um sicherzustellen, dass jeder Schritt rasch erfolgt und Kompromisse bei der Qualität der Scheiben zu vermeiden. Verwenden Sie aseptische Technik im gesamten.
- Stellen Sie sicher, dass die folgenden Schritte unternommen werden, vor Beginn der Dissektion Protokoll.
- Bereiten und Filter sterilisieren alle Lösungen, die im Voraus mit einem 0,22 µm-Filter.
- Halten Sie die Lösungen bei 4 ° C während der Lagerung und im gesamten Gehirn sezieren und hippocampal Slice Vorbereitung indem die Lagerbehälter und Petrischalen auf metallische Kühlkörper sitzen auf nassem Eis zu jeder Zeit.
- Autoklav alle Metall-Instrumente, Ringe und Papiertaschentücher.
- Sicherzustellen, dass alle Instrumente und Material für jeden Schritt des Protokolls verwendet werden sind gebrauchsfertig, im Voraus angelegt und mit 70 % igem Ethanol besprüht. Stellen Sie sicher, dass sie berechtigt sind, abkühlen und trocknen.
- Täglich 5 – 7 einschläfern-alte C57BL/6N Maus Welpe durch zervikale Dislokation und wischen Sie kurz die gesamte Hautoberfläche mit sterilen Papiertaschentuch getränkt in 70 % igem Ethanol. Tupfen Sie die Haut trocken und Enthaupten Sie der Welpe mit Mayo Schere zu.
- Schneiden Sie die Kopfhaut mit Iris-Schere entlang der Mittellinie des Kopfes im okzipitalen Bereich beginnt und endet in der Nähe von der Schnauze und seitlich einfahren.
- Legen Sie die Spitze des Vannas Schere in das Foramen Magnum und machen Sie zwei kleine seitliche Einschnitte am Knochen entlang den transversalen Nebenhöhlen, dann schneiden Sie den Schädel entlang der Mittellinie bis zu den Riechkolben und machen Sie zwei kleine Einschnitte senkrecht auf der Mittellinie in dieser Region.
- Mit feinen Punkt gebogene Pinzetten, Einfahren der Klappen des Knochens seitlich von der Mittellinie entfernt, sorgfältig entfernen Sie das Gehirn mit einem kleinen Spatel und überträgt es auf eine 90 mm Silikon-Elastomer beschichtet Petrischale mit "Dissektion Medium".
Hinweis: Dissektion Medium ist Gey Salzlösung (5 mg/mL D-Glucose, 1 % Antibiotikum antimykotische Lösung, mit 10.000 Einheiten/mL Penicillin, 10 mg/mL Streptomycin und 25 µg/mL Amphotericin B) ausgeglichen. - Entfernen Sie das Kleinhirn und trennen Sie der zerebralen Hemisphären entlang der Mittellinie mit einer Rasierklinge zu. Übertragen der zerebralen Hemisphären auf eine neue 90 mm Silikon Elastomer beschichteten Petrischale mit frischen eiskalte Dissektion Medium gefüllt mit einem Spatel. Wenn mehr als ein Tier in einer Sitzung verwendet werden soll, wiederholen Sie die Schritte 1,2 – 1,6.
- Schneiden Sie unter einem Stereomikroskop den Riechkolben und die Spitze des frontalen Kortex mit einer Rasierklinge und trennen Sie der Großhirnrinde vom Rest des zerebralen Gewebe mit feiner Spitze Pinzette. Dieser Schritt lässt den Hippocampus auf der medialen Fläche der kortikalen Gewebe ausgesetzt. Verwenden Sie von diesem Schritt vorwärts eine laminare Strömung Gewebekultur Haube (Ultraviolett sterilisiert und gereinigt mit 70 % igem Ethanol-Lösung).
- Wenden Sie eiskalte Dissektion Medium auf eine flache Kunststoffscheibe hacken an und mit einem Spatel, das Hirngewebe auf dem Datenträger so positionieren Sie, dass die mediale Fläche des Kortex nach oben zeigt und die Achse des Hippocampus senkrecht zur Achse der Häckselmesser ist.
- Entfernen Sie so viel wie möglich des Mediums Dissektion vom hacken Datenträger mit einer feinen Spitze Pasteurpipette.
- Schneiden Sie das Gehirn in 400 µm-Scheiben mit einem Gewebe-Chopper mit einer 50 %-hacken-Geschwindigkeit und Kraft.
Hinweis: Es ist sehr wichtig, dass dieser Schritt erfolgt so schnell wie möglich da das Gehirngewebe nicht in Dissektion Medium eingetaucht ist. - Ersetzen Sie die Dissektion Medium in der Petrischale Silikon-Elastomer beschichtet mit frisches eiskaltes Medium.
- Nach Abschluss die Gewebe-Chopper sorgfältig Tauchen Sie das Hirngewebe in frischen Dissektion Medium, und zurück auf 90 mm Silikon-Elastomer beschichtet Petrischale mit einer geraden Klinge Skalpell übertragen Sie geschnittene Gewebe.
- Trennen Sie unter einem Stereomikroskop vorsichtig die kortikalen Scheiben mit feiner Spitze Pinzette. Für jede Scheibe überprüfen des Hippocampus für Morphologie und Potenzial Gewebeschäden infolge der Dissektion oder schneiden.
- Trennen Sie die Hippocampi aus dem entorhinalen Kortex und die Fimbrien mit feiner Spitze Pinzetten und kleine Vannas Schere. In der Regel sind etwa 6 bis 8 hippocampale Scheiben pro Hemisphäre erzeugt.
- Übertragen Sie bis zu 6 hippocampale Scheiben auf einer Gewebekultur-Einlage mit einem Schnitt Pasteurpipette und Stelle es innen ein 35 mm Petri dish. Stellen Sie sicher, dass die Scheiben ein paar Millimeter auseinander gestreut werden (Dadurch wird sichergestellt, dass jede Scheibe einzeln abgebildet werden kann).
- Fügen Sie sofort eiskalte "Wachstumsmedium" am unteren Rand jeder Petrischale unter der Gewebekultur einfügen, knapp unterhalb der Spitze der Gewebekultur einfügen Felge.
Hinweis: Wachstumsmedium enthält 50 % Minimum wesentliche Medium Adler, 25 % Hanks ausgewogenen Salzlösung, 25 % Pferd Serum 5 mg/mL D-Glucose, 2 Mmol/L L-Glutamin, Antibiotikum antimykotische Lösung 1 % und 10 Mmol/L HEPES, pH 7,2 mit Natronlauge titriert. - Ändern Sie das Wachstumsmedium am Tag nach der Präparation und dann alle 2 bis 3 Tage danach (Verwendung Nährmedium bei 37 ° C). Stellen Sie sicher, dass das Wachstumsmedium hinzugefügt wird in ausreichender Menge, aber nicht so sehr, dass es überläuft über Gewebekultur einfügen Membran, die die Lebensfähigkeit des Gewebes Scheiben beeinträchtigen könnten.
- Halten Sie die Gewebe-Scheiben in einem befeuchteten Inkubator bei 37 ° C mit 5 % Kohlendioxid in der Luft für 12 bis 14 Tage vor in Experimenten verwendet wird.
2. Vorbereitung der hippocampalen organotypischen Scheiben für das experimentelle Blast-TBI-Protokoll
Hinweis: Die Schritte dieses Abschnitts, mit Ausnahme von Bildgebung, statt in eine laminare Strömung Gewebekultur Kapuze.
- Legen Sie nach Maß Edelstahl-Ringe in eine 6-well-Platte (eine pro Well).
Hinweise: Die Ringe haben eine Felge mit einer Kerbe (die in der 12:00 Position sitzen soll) und passen behaglich in die Brunnen, während der Gewebekultur fügt einfach in dieser Felge passen. Sicherstellen Sie, dass die Ringe sind mit einem bakterizide Desinfektionsmittel gewaschen, gründlich mit gereinigtem Wasser, autoklaviert gespült und vorab abgekühlt. - Füllen Sie den Brunnen von den 6-Well-Platte mit vorgewärmten (37 ° C) serumfreien "experimentelle Medium" mit Propidium Jodid.
Hinweis: Experimentelle Medium mit Propidium Jodid ist: 75 % Minimum wesentliche Medium Adler, 25 % Hanks ausgewogene Salzlösung, 5 mg/mL D-Glucose, 2 Mmol/L L-Glutamin, 1 % Antibiotikum antimykotische Lösung, 10 Mmol/L HEPES, 4,5 µmol/L Propidium Jodid, betitelten pH 7.2 mit Natriumhydroxid. - Stellen Sie sicher, dass das Niveau des Mediums nicht über die Kerbe des Ringes zu erreichen. Übertragen Sie die 6-Well-Platte mit den Ringen wieder in den Inkubator für 1 h um sicherzustellen, dass das Medium bei 37 ° C ist, unmittelbar vor der Gewebekultur Einsätze übertragen werden.
- Übertragen der Gewebekultur-Einsätze mit dem organotypischen Scheiben aus dem 35 mm Petrischalen in 6-Well-Platte mit den Ringen und dem experimentellen Medium mit der Pinzette.
- Machen Sie einen Punkt auf der einfügen-Felge in der 03:00-Position mit einem permanent Marker.
Hinweis: Die Einsätze werden während des Experiments aus dem 6-Well-Platte entfernt werden und dieser Schritt erleichtert den Einsatz in seine ursprüngliche Position zurück, nach der Stosswelle Exposition und jede Scheibe in das Protokoll des verfolgen. - Beschriften Sie jedes 6-Well-Platte mit einem eindeutigen Namen & Datum und eine Karte mit den Brunnen von jeder Platte, benennen jedes gut (zB., A, B, C usw..) und jede Scheibe in jede Vertiefung (zB., 1, 2, 3, etc..), so dass jede Scheibe eine eindeutige Kennung ( hat z.B.., A1, A2, A3, etc..).
- Übertragen Sie die 6-Well-Platte in den Inkubator für 1 h um sicherzustellen, dass die Scheiben bei 37 ° C unmittelbar vor der Bildgebung sind.
Hinweis: Vermeiden Sie Überlauf des Mediums oder Luftblasen unter der Gewebekultur einfügen Membran, die die Lebensfähigkeit der Scheiben beeinträchtigen könnten. - 1 h nach der Übertragung auf experimentelle Medium Bild jede Scheibe einzeln mit einem Fluoreszenzmikroskop (2 X Objektiv, NA 0,06) ausgestattet mit einer entsprechenden Anregung (BP 535/50 nm) und Emission (LP 610 nm) Filter Stück Gesundheit vor der Verletzung beurteilen Protokoll wird durchgeführt.
NOTES: Die Scheiben, die Bereiche der dichten roten Färbung in dieser Phase aufweisen sollte als kompromittierten Lebensfähigkeit zu präsentieren und sollte von der weiteren Analyse (diese Stellen in der Regel weniger als 10 % der Gesamtzahl der Scheiben generiert) ausgeschlossen werden. Sicherzustellen, dass die Bildgebung erfolgt in einer sequenziellen Weise und so schnell wie möglich zur Minimierung der Zeit, die die Scheiben außerhalb des Inkubators (in der Regel 6 Brunnen dauert knapp 30 min Bild). - Halten Sie den Deckel des 6-Well-Platte auf, zu allen Zeiten. Auf der Innenseite des Deckels kann sich Kondenswasser ansammeln. In diesem Fall verwenden Sie einen Haartrockner kurz auf die niedrige Einstellung.
- Sicherstellen Sie, dass alle bildgebende Bedingungen an verschiedenen Tagen und zwischen Experimente identisch sind.
Hinweis: Die Bildgebung soll die Gewebe Fluoreszenz zu quantifizieren, damit dieser Schritt ist wichtig, die Reproduzierbarkeit der Ergebnisse zu gewährleisten und ermöglichen den Vergleich der gewonnenen Daten.
(3) eintauchen und den Transport von der Gewebekultur fügt mit dem Hippokampus organotypischen Scheiben
- Unmittelbar nach Bildgebung, in einem Laminar-Flow-Haube, statt einer Gewebekultur einfügen aus der 6-Well-Platte mit Pinzette.
- Sorgfältig sprudelte Übertragung des Einsatzes zu einem sterilen Polyethylen-Beutel (3 "x 5") mit 20 mL Warm (37 ° C) experimentelle Medium frisch vorausgefüllt mit 95 % Sauerstoff und 5 % aus Kohlendioxid.
Hinweis: Sicherstellen, dass der Sauerstoff und Kohlendioxid angereicherte experimentelle Medium war sprudelte mindestens 40 min mit 95 % Sauerstoff und 5 % aus Kohlendioxid mit einem Bubbler abgeschnitten-Glas in einer Flasche Dreschel und in die sterile Polyethylen-Beutel innerhalb übertragen einer Laminar-Flow Gewebekultur Haube mit einer 20 mL Spritze mit einem Bakterienfilter und eine sterile Abfüllung Rohr (127 mm) befestigt. Versiegeln Sie die Taschen sofort zu und übertragen Sie sie auf einem 37 ° C Inkubator für mindestens 1 h bevor der Gewebekultur einfügen übertragen. - Sicherstellen Sie, dass jeder sterilen Beutel richtig (mit der Platte und auch Identifikation) beschriftet ist. Wiederholen Sie diesen Schritt für jede Gewebekultur einfügen. Schließen Sie die Luftblasen vorsichtig bei der Abdichtung der sterile Beutel (sicher getan, durch Drehen der Spitze der Taschen und durch die Anwendung einer Kunststoffklemme).
- Der sterile Beutel mit der Gewebekultur-Einsätze und die 6-Well-Platten mit experimentellen Medium in den Inkubator 37 ° C zurück.
- Verpacken Sie nach 1 h sorgfältig die sterile Beutel mit der Gewebekultur-Einsätze in Kunststoffboxen in einer Thermo-regulierten Box gefüllt mit deionisiertes Wasser bei 37 ° C um die organotypischen Scheiben auf physiologische Temperatur während der Stoßwelle Exposition zu halten Protokoll.
4. Vorbereitung der Schock Röhre und Hippocampal organotypischen Slice Schockwelle Exposition
- Stahl-Zehe Schutzstiefel, ein Laborkittel und Handschuhen während der Vorbereitung des Rohres Schock und die Schockwelle Belichtung zu tragen.
- Schrauben Sie den sterilen Beutel Halter Rahmen auf Schock Röhre distalen Flansch, um sicherzustellen, dass das zentrale Loch mit dem Schock Rohrausgang (mit einem blanking Stab) ausgerichtet ist.
- Montieren Sie zwei Druckaufnehmer radial: Sensor 1, im mittleren Teil des angetriebenen Abschnitts und der Sensor 2 im distalen Flansch der Schock Röhre (Abbildung 1A). Verbinden Sie die Druckaufnehmer mit einem Oszilloskop durch eine aktuelle Quelle Netzteil.
- Stellen Sie sicher, dass alle Schock Röhre Release Ventile und Ablaufsteuerungen geschlossen sind.
- Öffnen Sie die externen Druckluftleitung und laden Sie das Magnetventil bis 2,5 Bar.
- Öffnen Sie das Sicherheitsventil Druckluft Zylinder und langsam den Druckregler um den Druck auf ca. 5 Bar erhöhen.
Hinweis: Der Druck eingestellt für dieses Reglers sollte etwas oberhalb der höchsten Membran Berstdruck liegen. - Bereiten Sie die Membranen durch Schneiden 23 µm dicken Polyesterplatten in 10 x 10 cm2 Quadrate. Bereiten Sie die Griffe mit Autoklav Klebeband und klebt sie auf den oberen und unteren Rand jeder Membran.
- Positionieren einer Membran (single-Slot der doppelte Verschluss - einzelne Membran-Konfiguration) oder zwei Membranen (beide Steckplätze der doppelte Verschluss - doppelte Membran Konfiguration) in der Beckenendlage (Abbildung 1 b).
- Die Membranen zentrieren und spannen sie mit vier M24 Schrauben und Muttern, Befestigung sie nacheinander in einem diagonal symmetrische Weise und um sicherzustellen, dass die Membranen faltenfrei.
- Klemmen Sie jede sterile Beutel einzeln in vertikaler Position auf dem Halter-Rahmen, um sicherzustellen, dass die Oberfläche der Gewebekultur Einsätze mit dem organotypischen hippocampal Scheiben steht vor dem Schock Rohrausgang und Gewebekultur einfügen sich innerhalb der sterilen konzentriert Tasche (Abbildung 1). Stellen Sie sicher, dass die sterile Beutel sicher rundum eingespannt ist, fest und sogar Immobilisierung sicherzustellen.
- Gehörschutz und Schutzbrillen zu tragen, wenn das Schock-Rohr unter Druck. Schalten Sie die aktuelle Quelle Netzteil und Oszilloskop zu erwerben die Stoßwelle Daten (Erfassungsrate 50 Mega-Samples/s, Rekord Länge 20 ms, 1 Million Punkte) und Magnetventil zu schließen.
- Über den Fluss-Regler auf dem Schock-Rohr-Bedienfeld, langsam mit Druck beaufschlagen Sie Bereich Treiber Volumen der Schock Röhre für einzelne Membrane Konfiguration oder Bereich Treiber Volumen und Abschnitt doppelte Verschluss des Rohres Schock für doppelten Membran Konfiguration.
Hinweis: Für einzelne Membrane Konfiguration der Berstdruck hängt nur das Membran-Material und Dicke und die Membran werden spontan platzen, sobald das Material Berstdruck erreicht ist. Für doppelte Membran-Konfiguration der Berstdruck hängt auch die Gas-Druckdifferenz in der Fahrer und der doppelte Verschluss-Kammern und für die Membranen in einer kontrollierten Weise zu platzen, ist die doppelte Verschluss Sicherheitsventil manuell einmal geöffnet dem Ziel Druck erreichen. - Sobald die Membrane Brüche (produziert ein lautes Geräusch), schnell schließen Sie die Druckluft fließen mit dem Fluss-Regler und öffnen Sie des Magnetventils.
Hinweis: Das Gesamtvolumen der Bereich Treiber kann durch die Einfügung der Ausblendung Segmente, so dass ein breiteres Spektrum von Schockwelle Peak Überdruck und Dauer zu erhalten geändert werden. Die ideale Kombination von Schockwelle Parameter sollte ausreichen, um Gewebeschäden verursachen, aber nicht so hoch, daß es verursacht Gewebekultur einfügen oder sterile Beutel Verzerrung oder Bruch. - Freizulegen Sie jede sterile Beutel mit einer Gewebekultur-Einlage zu einer einzigen Schockwelle Rohr und schicken Sie es sofort zum Feld Thermo-geregelt, bevor eine neue sterile Tasche ist aus der Schachtel genommen und auf den Halter Rahmen eingespannt. Stellen Sie sicher, dass Schritte 4.10-4.14 so reibungslos und schnell wie möglich (innerhalb von wenigen Minuten) durchgeführt werden, um die experimentellen mittlere Kühlung zu verhindern, als Temperaturen unter 37 ° C Verletzungen Entwicklung stören können.
- Sobald alle Einsätze in Gewebekultur ausgesetzt worden sind eine Stoßwelle (oder Schein-Protokoll), wieder die Gewebekultur-Einsätze, die ursprüngliche 6-Well-Platte und ihre jeweiligen gut (in einem Laminar-Flow Gewebekultur Kapuze) und Inkubator.
- Halten Sie die 6-Well-Platte im Inkubator mit 5 % Kohlendioxid in der Luft bei 37 ° C bis weitere bildgebende.
- Enthalten Sie Schein Steuerelemente für jedes Experiment, zusammen mit der Scheibe Schockwelle Exposition.
Hinweis: Sham Scheiben sind identisch zu den Scheiben eine Schockwelle (verschlossen in die sterile Beutel mit experimentellen Medium, zum Schock Röhre Labor in der gleichen Thermo-regulierten Box transportiert und auf den Metallrahmen für einen entsprechenden Zeitraum ausgesetzt ausgesetzt behandelt. Zeit) aber der Schock Rohr wird nicht ausgelöst.
5. hippocampal organotypischen Scheibe Verletzungen Quantifizierung
- Bei 24 h, 48 h und 72 h Bild die Scheiben wie in Schritten 2.8 und 2.9 beschrieben.
- Nach dem Imaging bei 72 h Post Schockwelle Exposition, zu verwerfen, das Gewebe folgende lokale biologische Abfälle Protokolle und nicht desinfizieren und Autoklaven das Metall Ringe.
Ergebnisse
Das Schock-Rohr verwendet in dieser Methode ermöglicht die Erzeugung von Überdruck Transienten, die realen Freiland-Explosionen, die nach dem Vorbild der Friedlander Funktion7,8zu simulieren. Überschall Schockwellen mit einer Geschwindigkeit von 440 m/s (Mach 1,3) stammen (Abbildung 2A). Die Wellenformdaten gemeldet ist vom Sensor 2, am Ende des Abschnitts der Schock Röhre getrieben radial angeordnet.
Mit der oben beschriebenen Protokoll entwickeln organotypischen hippocampal Slice Kulturen ausgesetzt zu einer einzigen Schockwelle (Abbildung 2A) erheblichen Verletzungen quantifiziert mit Propidium Jodid, einem stark polaren Fluoreszenzfarbstoff, der nur die Zellen mit eindringt Zellmembranen24,25 (Abb. 2 b, C) in Frage gestellt.
Selbst unter optimalen Bedingungen und konsistent mit anderen OHSC veröffentlicht Modelle21,22, gibt es ein niedriges Niveau der Hintergrund Propidium Jodid Fluoreszenz zurückzuführen, zum Teil, um kleinere Schäden, die aus der inhärenten Gewebe Manipulationen ( wie Medien Änderungen während der Kulturdauer oder Entfernung aus dem Inkubator für die Bildgebung). Diese Explosion TBI Protokoll beinhaltet umfangreiche Manipulation, die das Eintauchen der Scheiben im Medium in sterile Beutel und ein beträchtliches Maß an Handhabung während der Stoßwelle Exposition Protokolls enthält (z. B.., spannen die sterile Beutel, die Halter-Frame). Jedoch wenn alle Schritte sorgfältig durchgeführt werden, diese zusätzliche Manipulation hat keinen Einfluss auf die zugrunde liegenden Gesundheit der OHSC gesehen wurden keine signifikanten Unterschiede zwischen einer Kontrollgruppe von Scheiben in der 6-Well-Platten zu allen Zeiten gehalten (i.e., die Einsätze nicht untergetaucht oder behandelt wurden) und der Sham-Gruppe, die Scheiben enthalten, die in sterilen Beutel eingespannt, das Schock-Rohr (Abb. 2 b) überschwemmt wurden.
Die zwei Schockwellen gewählt, bei 50 kPa und 55 kPa Peak Überdruck produziert signifikante (p < 0,05 und p < 0,0001, beziehungsweise) und reproduzierbare Verletzungen im Vergleich zu den unverletzten Schein Scheiben zu allen Zeitpunkten nach der Explosion-Exposition Protokoll (Abb. 2 b) ohne Schaden anzurichten, um die Gewebekultur-Einsätze oder die sterile Beutel. Um die Empfindlichkeit des Modells, um kleine Unterschiede in der Peak-Überdruck zu ermitteln, haben wir beschlossen Werte wählen, die unterschiedlich von ca. 10 % waren. Diese Ergebnisse zeigen auch, dass, wie erwartet, die Verletzungen, die aus 55 kPa höher als nach einer Schockwelle 50 kPa.
Die Daten sind als Mittelwert ± Standardfehler des Mittelwerts ausgedrückt. Bedeutung wurde anhand einer 2-Wege Messwiederholungen Varianzanalyse mit Holm-Sidak post Hoc Test. Faktor 1 Gruppe (Kontrolle, Sham, Explosion) und Faktor 2 war Zeit nach der Verletzung (-1 h, 24 h, 48 h und 72 h), wo der Faktor 1 wiederholte Faktor war. Die Anpassung der p -Wert für Mehrfachvergleiche diente. P -Werte von weniger als 0,05 wurden ergriffen, um einen signifikanten Unterschied zwischen den Gruppen zu zeigen. Statistische Tests wurden durchgeführt mit einer Grafik und Statistik Software.

Abbildung 1: Schematische der Röhre Stoßsicherung mit dem sterilen Beutel Halter Rahmen. (A). die Schock-Röhre ist ein 3,8 m lange Edelstahl-Rohr, aus drei 1,22 m langen Abschnitten, durch Dichtungen und Flansche verbunden, mit einem Innendurchmesser von 59 mm. (B) sehen Sie die doppelte Verschluss-Montage. Ein oder zwei Mylar-Membranen können in der Baugruppe mit Dichtung zur Verfügung gestellt von o-Gummiringe geklemmt werden. (C) Sterile Beutel Halter Rahmen. Der Körper des Rahmens besteht aus zwei Metallplatten mit einer zentrierten Kreisloch (59 mm Durchmesser), das deckt sich mit dem Schock Rohrausgang. Zwei dünne (4 mm) Blatt Silikon Elastomer sind zwischen zwei Metallplatten ausgestattet. Der Zweck dieser Blätter ist ermöglichen eine gleichmäßige und rutschfeste Oberfläche um die sterile Beutel befestigen. Der Abstand zwischen den Beutel und der Ausgang des Schock-Röhre beträgt 7 cm. Bitte klicken Sie hier für eine größere Version dieser Figur.
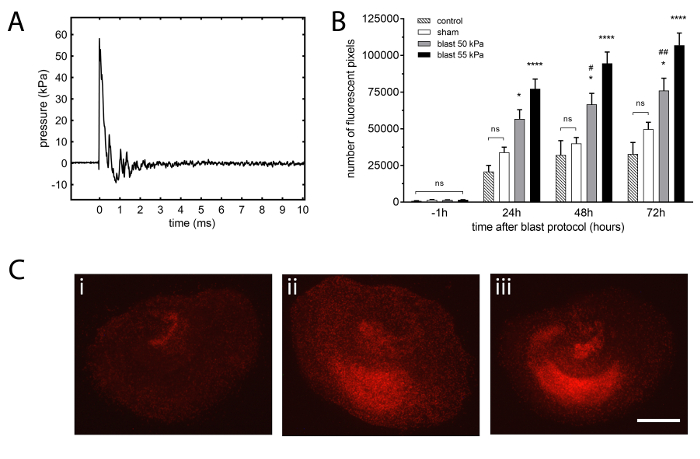
Abbildung 2: typische Shockwave und daraus resultierende Verletzungen in organotypischen hippocampal schneiden Kulturen. (A) repräsentatives Beispiel der Schockwelle mit 23 µm dicken Polyesterfolie, 2.16 bar Berstdruck, 55 kPa Peak Überdruck, 0,4 ms positive Welle Dauer, 10,1 kPa·ms Impuls erzielt. Wellenformdaten wurden von Sensor 2 radial montiert auf den distalen Flansch der Schock Röhre Gefahren Abschnitt erhalten. Die Stoßwelle Geschwindigkeit war 440 m/s (Mach 1,3). (B) die Entwicklung der Verletzungen ist proportional zur Intensität der Stoßwelle. 50 kPa und 55 kPa Peak Überdruck Stoßwellen verursacht erhebliche Verletzungen, die im gesamten 72 h Protokoll im Vergleich mit der Sham-Gruppe entwickelt. Die Verletzungen, die aus einem 55 kPa Peak Überdruck Welle Exposition war deutlich höher als nach 50 kPa bei 48 h und 72 h. Schein Scheiben waren identisch zu Explosion Scheiben behandelt aber Schock Rohr wurde nicht gefeuert. Kontrolle-Scheiben wurden in 6-well-Platten in einem Inkubator ohne jegliche Manipulation aufrechterhalten. Bars sind Mittelwerte und Fehlerbalken Standardfehler (n = 7, Steuerelemente; n = 48, Sham; n = 30, Explosion 50 kPa; n = 51, Explosion 55 kPa; n = Anzahl der Segmente, aus 6 separaten Experimente). * p < 0,05, *p < 0,0001 verglichen mit Schein. # p < 0,05, #p < 0,01 gegenüber Explosion 55 kPa. (C) Vertreter Propidium Jodid Fluoreszenzbilder organotypischen Scheiben aus (ich) Schein, (Ii) Explosion 50 kPa und (Iii) Explosion 55 kPa Gruppen bei 72 h nach der Verletzung. Die Schein-Scheibe zeigt geringe Fluoreszenz, dh., Verletzungen und der Explosion ausgesetzte Scheiben zeigen hohe diffuse Schädigung, stärker auf die 55 kPa Peak Überdruck ausgesetzt Scheibe (Maßstabsleiste = 500 µm). Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Unter den Mechanismen von Verletzungen verbunden mit Blast TBI (primäre, sekundäre und tertiäre Blast Verletzungen Mechanismen), primäre Blast Verletzungen ist einzigartig für Knall-Trauma und es ist am wenigsten verstanden von der Explosion-assoziierte Mechanismen1,2 . Das neue Protokoll hier beschrieben wurde entwickelt, um primäre Explosion TBI mit einer offenen Schock Tube aussetzen in-vitro- Maus hippocampal Slice Kulturen zu einer einzigen Schockwelle verwenden ein einfaches und schnelles Protokoll, die Schaffung einer reproduzierbaren ermöglicht, zu studieren primäre Explosion TBI mit einem hohen Durchsatz.
Die erste in-vitro- primäre Explosion TBI Modelle angewendet hydrostatischen Druckwellen auf Zellen26,27. Jedoch die Druckleistung Friedlander Funktion nicht modellieren, wie einen hydrostatischen Druck Impulsdauer viel länger als in der Luft Explosion Überdruck Wellen13war. Das Merkmal Friedlander Funktion kann leicht im Labor mit einem Schock Röhre1,8modelliert werden. Das Schock-Rohr fertigen Stoßwellen, die realen Freiland Explosionen in einer herkömmlichen Laborumgebung zu simulieren, und ermöglicht die präzise Steuerung der Welle Parameter, z. B. Gipfel Überdruck, positive Welle Dauer und Impuls, durch Variation der Membran-Material und Dicke und der Fahrer Volume8,28,29.
Einfache in-vitro- Modelle wie Zellkulturen fehlt in der Regel die Heterogenität der Zelltypen und synaptischen Verbindungen30. Vor kurzem wurde die Wirkung der Explosion auf in-vitro- Gehirnzelle "Sphäroide" unter Einbeziehung verschiedener Zelltypen untersuchten31. Weiterer Untersuchungen dieser interessanten Zubereitungen ist verdient; Es ist jedoch nicht klar, wie ihre zelluläre Organisation und Vernetzung spiegelt die intakte Gehirn. OHSC sind ein etablierter in-vitro- experimentelles Modell23,32, sind leicht zu Kultur und ihre dreidimensionale Gewebe Cytoarchitecture, Zelldifferenzierung und synaptischen Verbindungen sind gut erhalten und sehr ähnlich wie das in Vivo33,34,35,36. OHSCs repräsentieren ein mittleres Niveau der Komplexität zwischen Zellkultur und ein in Vivo Modell23,32. OHSCs haben gezeigt, zu reproduzieren in Vitro pathologischen Neurodegenerative Cascades in in Vivo Modelle gesehen und sehr nützlich bei der Prüfung der mögliche neuroprotektive Medikamente und ihre Mechanismen der Aktion17,21,22,37,38. Schließlich die anatomische Bereich studiert, Hippocampus, ist hochrelevant in translational TBI Studien, da diese Region häufig in TBI Patienten39,40,41beschädigt ist. OHSC wurden verwendet, um Modell-Explosion TBI28,42,43,44, aber unser Modell ist relativ einfach und kann an bestehenden Schock-Rohre entweder horizontal oder vertikal Konfigurationen ohne komplexe Anpassungen.
OHSC kann in Kultur für viele Tage, gehalten werden, was die Untersuchung biologischer Prozesse über Zeit34erleichtert. In diesem Modell die Gewebeschäden, die von der Schockwelle Exposition geführt wurde gemessen, täglich über drei Tage nach der Explosion-Exposition mit Propidium Jodid, eine gut etablierte Marker von Zellschäden. Propidium Jodid ist ein ungiftiges hochpolaren Farbstoff, der die Zellen mit kompromittierten Zellmembranen eindringt, wo es bindet an Nukleinsäuren und weist eine charakteristische helle rote Fluoreszenz24,25,45. Die Fluoreszenz mit Propidium Jodid gemessen hat nachweislich eine gute Korrelation mit verletzten Zellzahl mit Nissl Färbung46,47.
Angesichts der Tatsache dass die Verletzung in diesem Modell produziert diffuse (Abbildung 2), wurde die Fluoreszenz der ganzen Scheibe gemessen, bei der Analyse, ähnlich wie zuvor veröffentlichte Arbeit in anderen Gehirn Verletzungen Paradigmen21,22 , anstatt bestimmte Regionen, wie in anderen in-vitro- Modelle Explosion TBI28,43,44,48. Der globale Ansatz in das Modell, das in diesem Artikel beschriebenen verwendet entfällt auch die mögliche Variabilität, die eingeführt wird, wenn Regionen von Interesse definierte und ein umfassenderes Bild von der Explosion im Zusammenhang mit Verletzungen bietet. Sowohl Schockwelle Peak Überdrücke, 50 kPa und 55 kPa produziert bedeutende (p < 0,05 und p < 0,0001, beziehungsweise) Verletzungen im Vergleich zu Schein Scheiben (Abbildung 2B). Wie erwartet, die Schockwelle mit den höchsten Gipfel Überdruck produziert 55 kPa, mehr Verletzungen als die 50 kPa-Welle. In einem in Vitro -Modell mit isolierten Gehirn Gewebe direkt ausgesetzt, eine Schockwelle, wie präzise Skalierung auf den gesamten Organismus oder ein menschliches Wesen ist nicht einfach. Dennoch sind die Schockwellen verwendeten wir innerhalb des Bereichs von Peak Überdrücke in dem Gebiet, in der Regel 50-1.000 kPa8,49beobachtet.
Aufrechterhaltung der OHSC physiologische Temperatur und Ebenen von Sauerstoff und Kohlendioxid, gleichzeitig sicherzustellen, dass sie frei von Verunreinigungen im gesamten Schockwelle Exposition Protokoll, waren ausgesetzt waren die Gewebekultur-Einsätze in sterilen versiegelt. Taschen aus Polyethylen nach eine aseptische Technik, eingetaucht in experimentellen Medium auf 37 ° C erwärmt und frisch mit 95 % Sauerstoff und 5 % aus Kohlendioxid, ähnlich wie zuvor veröffentlichte Arbeit28,43,44 sprudelte ,48. Im Gegensatz zu diesen Modellen, wo komplexe Bauteile verwendet wurden, um die sterile Beutel während der Stoßwelle Belichtung, die in diesem Protokoll zu halten, wurde eine einfache und schnelle Methode zur Aussetzung der OHSC Gewebekultur Einsätze vor dem Schock Rohrausgang (Abbildung 1A, C ). Das Modell in diesem Dokument beschriebenen ermöglicht schnelle Verarbeitung und hoher Durchsatz bei gleichzeitiger Minimierung der Gefahr der Unterkühlung. Diese Aspekte sind besonders relevant für Neuroprotektion Studien, angesichts der Tatsache, dass einige therapeutischen Interventionen eine sehr begrenzte Zeitfenster von Einsatzmöglichkeiten nach TBI haben können. Dieses neuartige Schockwelle Exposition Protokoll ermöglicht 6-9 Gewebekultur (in der Regel 36 bis 54 hippocampal organotypischen Gewebe Scheiben) fügt eine Schockwelle in eine kurze Zeitspanne (ca. 1 h) ausgesetzt werden.
Die OHSCs erfordern guten aseptische Technik im gesamten. Es ist wichtig, eine aseptische Laminar-Flow-Haube während der Kultivierung und bei der Übertragung auf die sterile Beutel für Blast verwenden. Um die Slice-Bildgebung unter aseptischen Bedingungen mit den Deckeln der 6-Well-Platten im Ort durchzuführen, verwenden wir maßgeschneiderte Metallringe, um die Zelle-Kultur-Einsätze auf der Brennebene des Mikroskops zu erhöhen. Ein wichtiger Teil unseres Protokolls ist, dass wir unverletzt Schein Scheiben bei jedem Versuch. Sham Scheiben sind identisch zur Explosion Scheiben mit Ausnahme behandelt, dass die Schock-Röhre nicht ausgelöst wird; ein weiterer wichtiger Schritt ist, dass alle Scheiben 1 h vor Verletzungen oder Schein-Behandlung, um sicherzustellen, dass die Gesundheit der Bevölkerung der Scheiben verwendet sind identisch (Abb. 2 b) abgebildet werden.
Neben der Quantifizierung der Zelle Verletzung in die Scheiben im Laufe der Zeit, kann das Gewebe am Ende des Experiments für konventionelle Immunohistochemistry50fixiert werden. Wir entwickelt und evaluiert die Methode mit der Maus hippocampal Scheiben. Unsere Technik könnte jedoch leicht an andere Gewebe zu verwenden, die in der Kultur, wie z. B. Rückenmark, Netzhaut, Lungen- oder Epithelgewebe angebaut werden können. In diesem Papier und unsere bisherige Arbeit mit dem Modell haben wir nur die Auswirkungen der Exposition gegenüber einer einzigen Explosion. Das Modell wäre jedoch gut geeignet, um die Auswirkungen wiederholter Low-Level-Blasten auf Gehirn oder anderes Gewebe zu untersuchen. OHSCs können in Kultur gehalten werden, für viele Wochen oder sogar Monate, so dass chronische Wirkungen untersucht werden.
In-vitro- Modelle, die einfacher als in Vivo Modelle haben einen höheren Durchsatz, sind weniger teuer und Experimente in der Regel auf eine kürzere Zeit Skala17abgeschlossen werden können. Die erzielten Ergebnisse mit in-vitro- Modelle müssen jedoch in Tiermodellen überprüft werden, da in Vitro kultiviert Gewebe sind in einer künstlichen Umgebung gehalten und können zu Verletzungen reagieren unterschiedlich von dem, was würden sie in Vivo17. Dennoch, in-vitro- Modelle waren äußerst wertvoll in unser Verständnis von Gehirn Verletzungen Kaskaden und Screening-neuroprotektive Medikamente vor der Verwendung von komplexeren in Vivo Modelle17,22 , 51 , 52. trotz der vielen Vorteile durch dieses Modell angeboten, es ist wichtig zu beachten, dass in-vitro- Modelle den Schlüssel fehlen Funktionen von TBI zu, bei Tieren und in Vivo Modellen, wie die Auswirkungen auf den Kreislauf-System präsentieren, erhöhte intrakranielle Druck, systemischen Immunantwort und Verhaltensstörungen Funktionsbeeinträchtigung, die die Notwendigkeit unterstreicht, die Ergebnisse in in-vitro- Modelle in das ganze Tier gefunden zu validieren. In-vitro- Modelle wie das Modell in diesem Dokument beschriebenen sind jedoch äußerst nützlich translationally relevanten wissenschaftlichen Instrumente.
Diese Arbeit beschreibt zusammenfassend eine einfache und unkomplizierte neue Methode wo Maus organotypischen hippocampal Gewebekulturen streng kontrollierte und reproduzierbare realen relevanten Stoßwellen mit einem Labor-Schock-Rohr ausgesetzt sind. Die daraus resultierende globale Verletzungen, die quantifiziert wurde mit Propidium Jodid, eine gut etablierte Marker von Zellschäden, ist sehr reproduzierbar und ist proportional zu den Gipfel Überdruck der Stosswellen angewendet.
Offenlegungen
Die Autoren haben keinen finanziellen Interessenkonflikt.
Danksagungen
Unterstützt von: Royal Centre für Verteidigung Medizin, Birmingham, Vereinigtes Königreich, Royal British Legion Center für Blast Verletzungen Studien, Imperial College London, Vereinigtes Königreich. Medical Research Council, London, Vereinigtes Königreich (MC_PC_13064; MR/N027736/1). Die Gas-Sicherheit Vertrauen, London, Vereinigtes Königreich. Rita Campos-Pires erhielt eine Ausbildung von Doktoranden-Auszeichnung von der Fundação Para eine Ciência e ein Tecnologia, Lissabon, Portugal. Katie Harris erhielt ein PhD-Zugehörigkeit aus der Westminster Medical School Research Trust, London, Vereinigtes Königreich.
Dieses Modell wurde mit Unterstützung der Royal British Legion Zentrum für Blast Verletzungen Studien (RBLCBIS) am Imperial College entwickelt. Wir möchten die finanzielle Unterstützung der Royal British Legion zu bestätigen. Forscher, Kooperationen oder weitere Details interessieren wenden die Autoren oder RBLCBIS.
Wir danken Dr. Amarjit Samra, Director of Research, Royal Centre für Verteidigung Medizin, Birmingham, Vereinigtes Königreich, für die Unterstützung dieser Arbeit Scott Armstrong, Klinik für Chirurgie & Krebs, Imperial College London, für die Unterstützung bei Vorversuchen , Theofano Eftaxiopolou, Hari Arora & Luz Ngoc Nguyen, Abteilung für Bioengineering Imperial College London, William Proud, Abteilung von Physik Imperial College London, für die Beratung über die Schock-Röhre, Raquel Yustos, Techniker, Abteilung Forschung Life Sciences, Imperial College London, für technischen Support, Paul Brown MBE, Werkstattleiter und Steve Nelson, Werkstatt-Techniker, Ringe Department of Physics, Imperial College London, dafür, dass das Metall, Neal Powell von der Fakultät für Physik, Imperial College London, für Artwork.
Materialien
| Name | Company | Catalog Number | Comments |
| Geys balanced salt solution | Sigma UK | G9779 | |
| D-glucose | Sigma UK | G8270 | |
| Antibiotic/antimycotic | Sigma UK | A5955 | |
| Minimum essential medium Eagle | Sigma UK | M4655 | |
| Hanks balanced salt solution | Sigma UK | H9269 | |
| Horse serum | Sigma UK | H1138 | |
| L-glutamine | Sigma UK | G7513 | |
| HEPES | VWR Prolabo, Belgium | 441476L | |
| Sodium hydroxide | Sigma UK | S-0945 | |
| Tissue culture inserts | Millicell CM 30 mm low height Millipore | PICM ORG 50 | |
| 6-well plates | NUNC, Denmark | 140675 | |
| Propidium iodide | Sigma UK | P4864 | |
| Sterile polyethylene bags - Twirl'em sterile sample bags | Fisherbrand | 01-002-30 | |
| Portex Avon Kwill Filling Tube 5" (127 mm) | Smiths Medical Supplies | E910 | |
| Epifluorescence microscope | NIKON Eclipse 80i, UK | ||
| Microscope objective | Nikon Plan UW magn. 2x, NA 0.06, WC 7.5 mm | ||
| Microscope filter | Nikon G-2B (longpass emission) | ||
| Mylar electrical insulating film, 304 mm x 200 mm x 0.023 mm | RS Components UK | 785-0782 | |
| Pressure transducer | Dytran Instruments Inc. | 2300V1 | |
| Tissue chopper | Mickle Laboratory Engineering Co., Guildford, Surrey, United Kingdom. | Mcllwain tissue chopper | |
| Silicone elastomer | Dow Corning, USA | Sylgard 184 | |
| Graphing & statistics software | GraphPad Software, USA | Prism 7.0 |
Referenzen
- Risling, M., Davidsson, J. Experimental animal models for studies on the mechanisms of blast-induced neurotrauma. Frontiers in Neurology. 3, 30(2012).
- Nakagawa, A., et al. Mechanisms of primary blast-induced traumatic brain injury: insights from shock-wave research. Journal of Neurotrauma. 28 (6), 1101-1119 (2011).
- Goldstein, L. E., McKee, A. C., Stanton, P. K. Considerations for animal models of blast-related traumatic brain injury and chronic traumatic encephalopathy. Alzheimer's Research & Therapy. 6 (5), 64(2014).
- Rona, R. J., et al. Mild traumatic brain injury in UK military personnel returning from Afghanistan and Iraq: cohort and cross-sectional analyses. Journal of Head Trauma and Rehabilitation. 27 (1), 33-44 (2012).
- Terrio, H., et al. Traumatic brain injury screening: preliminary findings in a US Army Brigade Combat Team. Journal of Head Trauma and Rehabilitation. 24 (1), 14-23 (2009).
- Elder, G. A., Stone, J. R., Ahlers, S. T. Effects of low-level blast exposure on the nervous system: is there really a controversy. Frontiers in Neurology. 5, 269(2014).
- Ling, G., Bandak, F., Armonda, R., Grant, G., Ecklund, J. Explosive blast neurotrauma. Journal of Neurotrauma. 26 (6), 815-825 (2009).
- Bass, C. R., et al. Brain injuries from blast. Annals of Biomedical Engineering. 40 (1), 185-202 (2012).
- Young, L. A., Rule, G. T., Bocchieri, R. T., Burns, J. M. Biophysical mechanisms of traumatic brain injuries. Seminars in Neurology. 35 (1), 5-11 (2015).
- Wolf, S. J., Bebarta, V. S., Bonnett, C. J., Pons, P. T., Cantrill, S. V. Blast injuries. Lancet. 374 (9687), 405-415 (2009).
- Kluger, Y., Nimrod, A., Biderman, P., Mayo, A., Sorkin, P. The quinary pattern of blast injury. American Journal of Disaster Medicine. 2 (1), 21-25 (2007).
- Champion, H. R., Holcomb, J. B., Young, L. A. Injuries from explosions: physics, biophysics, pathology, and required research focus. Journal of Trauma: Injury, Infection, and Critical. 66 (5), 1468-1477 (2009).
- Chen, Y. C., Smith, D. H., Meaney, D. F. In-vitro approaches for studying blast-induced traumatic brain injury. Journal of Neurotrauma. 26 (6), 861-876 (2009).
- Edwards, D. S., Clasper, J. Blast Injury Science and Engineering: A Guide for Clinicians and Researchers. Bull, A. M. J., Clasper, J., Mahoney, P. F. , Springer International Publishing. 87-104 (2016).
- Kirkman, E., Watts, S., Cooper, G. Blast injury research models. Philosophical Translations of the Royal Society B: Biological Sciences. 366 (1562), 144-159 (2011).
- Hicks, R. R., Fertig, S. J., Desrocher, R. E., Koroshetz, W. J., Pancrazio, J. J. Neurological effects of blast injury. J Trauma. 68 (5), 1257-1263 (2010).
- Morrison, B., Elkin, B. S. 3rd, Dolle, J. P., Yarmush, M. L. In vitro models of traumatic brain injury. Annual Reviews of Biomedical Engineering. 13, 91-126 (2011).
- Johnson, V. E., Meaney, D. F., Cullen, D. K., Smith, D. H. Animal models of traumatic brain injury. Handbook of Clinical Neurology. , 115-128 (2015).
- Xiong, Y., Mahmood, A., Chopp, M. Animal models of traumatic brain injury. Nature Reviews Neuroscience. 14 (2), 128-142 (2013).
- Morganti-Kossmann, M. C., Yan, E., Bye, N. Animal models of traumatic brain injury: is there an optimal model to reproduce human brain injury in the laboratory? Injury. 41, Suppl 1. S10-S13 (2010).
- Banks, P., Franks, N. P., Dickinson, R. Competitive inhibition at the glycine site of the N-methyl-D-aspartate receptor mediates xenon neuroprotection against hypoxia-ischemia. Anesthesiology. 112 (3), 614-622 (2010).
- Harris, K., et al. Neuroprotection against traumatic brain injury by xenon, but not argon, is mediated by inhibition at the N-methyl-D-aspartate receptor glycine site. Anesthesiology. 119 (5), 1137-1148 (2013).
- Stoppini, L., Buchs, P. A., Muller, D. A simple method for organotypic cultures of nervous tissue. Journal of Neuroscience Methods. 37 (2), 173-182 (1991).
- Noraberg, J., Kristensen, B. W., Zimmer, J. Markers for neuronal degeneration in organotypic slice cultures. Brain Research Protocols. 3 (3), 278-290 (1999).
- Macklis, J. D., Madison, R. D. Progressive incorporation of propidium iodide in cultured mouse neurons correlates with declining electrophysiological status: a fluorescence scale of membrane integrity. Journal of Neuroscience Methods. 31 (1), 43-46 (1990).
- Salvador-Silva, M., et al. Responses and signaling pathways in human optic nerve head astrocytes exposed to hydrostatic pressure in vitro. Glia. 45 (4), 364-377 (2004).
- Howard, D., Sturtevant, B. In vitro study of the mechanical effects of shock-wave lithotripsy. Ultrasound Medical Biology. 23 (7), 1107-1122 (1997).
- Effgen, G. B., et al. A Multiscale Approach to Blast Neurotrauma Modeling: Part II: Methodology for Inducing Blast Injury to in vitro Models. Front Neurol. 3, 23(2012).
- Nguyen, T. T. The characterisation of a shock tube system for blast injury studies. , Imperial College London. PhD Thesis (2016).
- Noraberg, J., et al. Organotypic hippocampal slice cultures for studies of brain damage, neuroprotection and neurorepair. Current Drug Targets CNS and Neurological Disorders. 4 (4), 435-452 (2005).
- Sawyer, T. W., et al. Investigations of primary blast-induced traumatic brain injury. Shock Waves. 28 (1), 85-99 (2017).
- Gahwiler, B. H. Organotypic monolayer cultures of nervous tissue. Journal of Neuroscience Methods. 4 (4), 329-342 (1981).
- Gahwiler, B. H., Capogna, M., Debanne, D., McKinney, R. A., Thompson, S. M. Organotypic slice cultures: a technique has come of age. Trends in Neuroscience. 20 (10), 471-477 (1997).
- De Simoni, A., Yu, L. M. Preparation of organotypic hippocampal slice cultures: interface method. Nature Protocols. 1 (3), 1439-1445 (2006).
- Gogolla, N., Galimberti, I., DePaola, V., Caroni, P. Long-term live imaging of neuronal circuits in organotypic hippocampal slice cultures. Nature Protocols. 1 (3), 1223-1226 (2006).
- De Simoni, A., Griesinger, C. B., Edwards, F. A. Development of rat CA1 neurones in acute versus organotypic slices: role of experience in synaptic morphology and activity. Journal of Physiology. 550 (Pt 1), 135-147 (2003).
- Sundstrom, L., Morrison, B., Bradley, M. 3rd, Pringle, A. Organotypic cultures as tools for functional screening in the CNS). Drug Discovery Today. 10 (14), 993-1000 (2005).
- Cater, H. L., et al. Stretch-induced injury in organotypic hippocampal slice cultures reproduces in vivo post-traumatic neurodegeneration: role of glutamate receptors and voltage-dependent calcium channels. Journal of Neurochemistry. 101 (2), 434-447 (2007).
- Atkins, C. M. Decoding hippocampal signaling deficits after traumatic brain injury. Translational Stroke Research. 2 (4), 546-555 (2011).
- Bigler, E. D., et al. Hippocampal volume in normal aging and traumatic brain injury. American Journal of Neuroradiology. 18 (1), 11-23 (1997).
- Umile, E. M., Sandel, M. E., Alavi, A., Terry, C. M., Plotkin, R. C. Dynamic imaging in mild traumatic brain injury: support for the theory of medial temporal vulnerability. Archives of Physical Medicine and Rehabilitation. 83 (11), 1506-1513 (2002).
- Effgen, G. B., et al. Primary Blast Exposure Increases Hippocampal Vulnerability to Subsequent Exposure: Reducing Long-Term Potentiation. Journal of Neurotrauma. 33 (20), 1901-1912 (2016).
- Effgen, G. B., et al. Isolated primary blast alters neuronal function with minimal cell death in organotypic hippocampal slice cultures. Journal of Neurotrauma. 31 (13), 1202-1210 (2014).
- Vogel Iii, E. W., et al. Isolated Primary Blast Inhibits Long-Term Potentiation in Organotypic Hippocampal Slice Cultures. Journal of Neurotrauma. , (2015).
- Vornov, J. J., Tasker, R. C., Coyle, J. T. Direct observation of the agonist-specific regional vulnerability to glutamate, NMDA, and kainate neurotoxicity in organotypic hippocampal cultures. Experimental Neurology. 114 (1), 11-22 (1991).
- Cho, S., et al. Spatiotemporal evidence of apoptosis-mediated ischemic injury in organotypic hippocampal slice cultures. Neurochemistry International. 45 (1), 117-127 (2004).
- Newell, D. W., Barth, A., Papermaster, V., Malouf, A. T. Glutamate and non-glutamate receptor mediated toxicity caused by oxygen and glucose deprivation in organotypic hippocampal cultures. The Journal of Neuroscience. 15 (11), 7702-7711 (1995).
- Miller, A. P., et al. Effects of blast overpressure on neurons and glial cells in rat organotypic hippocampal slice cultures. Frontiers in Neurology. 6, 20(2015).
- Panzer, M. B., Wood, G. W., Bass, C. R. Scaling in neurotrauma: how do we apply animal experiments to people. Experimental Neurology. , 120-126 (2014).
- Campos-Pires, R., et al. Xenon Protects against Blast-Induced Traumatic Brain Injury in an In Vitro Model. Journal of Neurotrauma. 35 (8), 1037-1044 (2018).
- Coburn, M., Maze, M., Franks, N. P. The neuroprotective effects of xenon and helium in an in vitro model of traumatic brain injury. Critical Care Medicine. 36 (2), 588-595 (2008).
- Campos-Pires, R., et al. Xenon improves neurologic outcome and reduces secondary injury following trauma in an in vivo model of traumatic brain injury. Critical Care Medicine. 43 (1), 149-158 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten