Method Article
Un modèle novateur In Vitro de Blast traumatisme crânien
Dans cet article
Résumé
Cet article décrit un nouveau modèle de traumatisme crânien de blast primaire. Un tube de choc conduit d’air comprimé est utilisé pour exposer en vitro cultures tranche hippocampe de souris à une seule onde de choc. Il s’agit d’un protocole simple et rapid, générant une lésion tissulaire de cerveau reproductible avec un débit élevé.
Résumé
Traumatisme crânien est des principales causes de décès et d’invalidité chez les populations civiles et militaires. Blast traumatisme cérébral blessures résultats depuis l’explosion d’engins explosifs, cependant, les mécanismes qui sous-tendent les lésions cérébrales résultant de l’exposition de surpression de souffle ne sont pas entièrement comprises et sont considérés comme propres à ce type de lésion cérébrale. Les modèles précliniques sont des outils essentiels qui contribuent à mieux comprendre les lésions cérébrales induite par l’explosion. Un modèle TBI roman in vitro blast a été développé en utilisant un tube de choc à composition non limitée pour simuler des vagues de vie réelle explosion de plein champ modélisées par l’onde de Friedlander. Hippocampe organotypiques souris C57BL/6N ont été exposés à des ondes de choc unique et le développement des lésions a été caractérisé jusqu'à 72 h à l’aide d’un marqueur fluorescent bien établi des lésions cellulaires que seul, l’iodure de propidium pénètre les cellules avec compromis les membranes cellulaires. Fluorescence de l’iodure de Propidium a été significativement plus élevé dans les secteurs exposés à une onde de choc par rapport aux tranches d’imposture pendant toute la durée du protocole. Les lésions du cerveau sont très reproductible et proportionnelle à la surpression de la crête de l’onde de choc appliquée.
Introduction
Lésion cérébrale traumatique de Blast (TBI) est un type complexe de lésions cérébrales résultant de l’explosion d’engins explosifs1,2. Blast TBI est devenue un important problème de santé au cours des 15 dernières années, avec les récents conflits militaires en Irak et en Afghanistan,2,3. Globalement, on estime qu’entre 4,4 % et de 22,8 % des soldats de retour d’Irak et d’Afghanistan ont souffert des TBI doux, une grande partie d'entre elles étant liées au souffle, avec un taux plus élevé rapporté de blast TBI dans les forces américaines contre les forces du Royaume-Uni4 ,,5.
L’utilisation d’engins explosifs a été responsable de la majeure partie du traumatisme lié à l’explosion, y compris blast TBI, endurée par les forces militaires6. La détonation d’une charge explosive se traduit par une très rapide — mais transitoire — augmentation de la pression, se produisant en millisecondes. L’onde de surpression résultant d’une explosion de champ libre de la vie réelle est modélisée par la fonction de Friedlander, avec une hausse soudaine de la surpression maximum suivie d’une décroissance exponentielle7,8. La gamme des forces extrêmes et leur évolution rapide vu lors d’une manifestation de l’explosion ne sont pas généralement expérimentés en traumatismes non-blast1,9. La surpression de pointe, c'est-à-dire la pression maximale de l’onde et la durée de l’onde positive sont soupçonnés d’être des contributeurs importants à une lésion cérébrale blast et ceux-ci dépendent de la charge explosive et la distance de la détonation de10, 11.
Le traumatisme que les résultats d’une explosion explosive est classé comme quatre composants discrets, désignés comme l’explosion primaire, secondaire, tertiaire et quaternaire des blessures10,12,13,14. Chacune de ces composantes est liée à des mécanismes spécifiques de blessure. Blast primaire préjudice est le résultat de l’action directe de l’onde de surpression sur les organes et tissus2,13. Résultats de blessure explosion secondaire de l’impact des fragments de projectiles, provoquant pénétrante et non pénétrantes plaies2,15. Blast tertiaire lésions se produisent lorsque le corps de la victime est déplacé contre le sol ou les objets environnants et est associé à l’accélération/décélération forces1,10,13. Blessure de blast quaternaire décrit un groupe hétérogène de blessures directement liées à l’explosion ne relevant ne pas de la première trois blessure mécanismes décrits12,13. Il inclut (mais n’est pas limité à) lésion thermique, inhalation de fumée, rayonnement, ondes électromagnétiques et des effets psychologiques négatifs13,15. La plupart TBI associée à explosion résulte directement des trois premiers mécanismes de blessures, tandis que les mécanismes du quaternaire des blessures de blast sont généralement associés aux lésions systémiques13. Les effets des forces d’accélération/décélération (p. ex., coup du lapin), émousser et pénétrant de traumatisme crânien ont été intensivement étudiés par rapport à d’autres types de TBI (p. ex., collisions de véhicules automobiles, chutes, blessures balistique). Toutefois, l’onde de surpression de choc primaire est unique à l’injure de l’explosion et ses effets sur les tissus cérébraux sont beaucoup moins bien compris16. Les mécanismes de blessure explosion primaire, associées à une onde de surpression, sont les premiers des forces mécaniques pour interagir avec le cerveau.
Nombreux modèles précliniques de TBI ont été développés durant les dernières décennies qui ont été très précieux pour comprendre les mécanismes TBI souffle de blessures et de physiopathologie et étudier de nouveaux traitements potentiels, qui seraient autrement impossibles à faire exclusivement dans les cliniques définissant le17,18,19. Bien qu’aucun modèle préclinique ne peut reproduire la complexité des traumatismes crâniens blast clinique, généralement différents modèles précliniques de TBI répliquent des aspects distincts de TBI humaine. L’action nuisible des forces associées à une explosion de souffle peut être étudiée isolément ou en combinaison dans les modèles TBI blast fois in vitro et in vivo . In vitro les modèles ont l’avantage de permettre un contrôle strict de l’environnement expérimental (tissu conditions physiologique et biomécanique de la blessure), qui réduit la variabilité biologique et améliore la reproductibilité, permettant l’étude des moléculaires spécifiques des cascades sans les variables confusionnelles présentes dans les animaux modèles20. Notre objectif était de développer un modèle in vitro afin d’étudier les effets d’explosion primaire sur le tissu cérébral. L’étude visait à élaborer un modèle avec une onde de choc supersonique avec un représentant de forme d’onde de Friedlander d’une explosion de champ libre tel que celui produit par un engin explosif improvisé (IED).
Protocole
Les expériences décrites dans ce manuscrit ont été faites conformément à la loi du Royaume-Uni animaux (procédures scientifiques) de 1986 et ont été approuvés par l’Animal Welfare & Ethical Review Body de Imperial College London. Protection des animaux était en conformité avec les orientations institutionnelles de l’Imperial College de Londres.
1. culture et préparation de hippocampe Organotypique tranche
Remarque : Ce protocole permet la production de tranches d’hippocampe organotypique selon la méthode d’interface décrit Stoppini et collègues avec des modifications mineures21,22,23. Idéalement, pas plus de trois animaux devrait être euthanasié et disséqué en une seule séance pour assurer que chaque étape est faite rapidement et pour ne pas compromettre la qualité des tranches. Utiliser une technique aseptique dans l’ensemble.
- S’assurer que les mesures suivantes avant de commencer le protocole de la dissection.
- Préparer et stériliser toutes les solutions à l’avance à l’aide d’un filtre à 0,22 µm de filtration.
- Conserver les solutions à 4 ° C au cours du stockage et tout au long de la dissection du cerveau et de la préparation de l’hippocampe tranche en gardant les contenants d’entreposage et les boîtes de Petri sur un dissipateur thermique métallique, assis sur la glace humide en permanence.
- Autoclave tout métal des instruments, des anneaux et des mouchoirs en papier.
- S’assurer que tous les instruments et les matériaux à utiliser pour chaque étape du protocole sont prêts à l’emploi, disposées à l’avance et pulvérisé avec l’éthanol à 70 %. S’assurer qu’ils sont autorisés à refroidir et sécher.
- Euthanasier un jour 5 – 7-vieux C57BL/6N chiot de souris par dislocation cervicale et brièvement essuyer la surface de la peau entière avec du papier stérile imbibé d’éthanol à 70 %. Pat la peau sèche et décapiter le chiot à l’aide de ciseaux de Mayo.
- Coupez la peau du cuir chevelu avec des iris ciseaux le long de la ligne médiane de la tête à partir de la région occipitale et se termine près du museau et se rétracter latéralement.
- Insérer la pointe des ciseaux de Vannas dans le trou occipital et faire deux petites coupes latérales sur l’OS le long du sinus transverses, puis couper le crâne le long de la ligne médiane jusqu’au bulbe olfactif et faire deux petites coupes perpendiculairement à la ligne médiane dans cette région.
- À l’aide de fine point pince courbée, rentrer les volets d’OS latéralement de la ligne médiane, soigneusement enlever le cerveau avec une petite spatule et transférez-le vers un 90 mm silicone enduit élastomère de pétri contenant « milieu de dissection ».
NOTE : Support de Dissection est que gey équilibré de solution saline (5 mg/mL D-glucose, 1 % solution antibiotique-antimycosiques contenant 10 000 unités/mL de pénicilline, 10 mg/mL de streptomycine et 25 µg/mL d’amphotéricine B). - Enlever le cervelet et séparer les hémisphères cérébraux, le long de la ligne médiane à l’aide d’une lame de rasoir. Utilisez une spatule pour transférer des hémisphères cérébraux à un nouveau silicone 90 mm enduit élastomère pétri rempli de milieu frais dissection glacée. Si plus d’un animal doit être utilisé en une seule séance, répétez les étapes 1,2 et 1,6.
- Sous un stéréomicroscope, couper le bulbe olfactif et la pointe du cortex frontal avec une lame de rasoir et les séparer du reste du tissu cérébral avec une pointe fine pincette de cortex cérébral. Cette étape quitte l’hippocampe exposé sur la surface médiale du tissu cortical. À partir d’à partir de cette étape, utilisez une hotte à flux laminaire culture tissulaire (ultraviolet stérilisé et nettoyés avec une solution d’éthanol à 70 %).
- Appliquez moyen de dissection glacée sur un plat en plastique disque hacheur et, à l’aide d’une spatule, placez le tissu cérébral sur le disque de telle sorte que la surface médiale du cortex est vers le haut et l’axe de l’hippocampe est perpendiculaire à l’axe de la lame à hacher.
- Enlever le plus possible du milieu dissection du disque découper à l’aide d’une pointe fine pipette Pasteur.
- Couper le cerveau en 400 µm tranches à l’aide d’un hachoir de tissu à une vitesse de hacher 50 % et la force.
Remarque : Il est très important que cette étape est faite aussi rapidement que possible car le tissu cérébral n’est pas immergé dans un milieu de dissection. - Remplacer le milieu de la dissection dans le plat de pétri d’enduit élastomère de silicone avec un milieu frais glacé.
- Une fois terminé, le chopper de tissu soigneusement submerger le tissu cérébral dans un milieu frais de dissection et transférer les tissus coupés vers le 90 mm silicone enduit élastomère de Petri stérile à l’aide d’un scalpel à lame droite.
- Sous un stéréomicroscope, soigneusement séparer les tranches corticales à l’aide de pinces à pointe fine. Pour chaque tranche, inspecter l’hippocampe pour la morphologie et le potentiel des lésions tissulaires résultant de la dissection ou tranchage.
- Séparer l’hippocampe, le cortex entorhinal et la fimbria à l’aide de pinces à pointe fine et des petits ciseaux de Vannas. En général, environ 6 à 8 tranches d’hippocampe sont générés par hémisphère.
- Transfert jusqu'à 6 tranches d’hippocampe pour un insert de culture de tissus à l’aide d’une coupe pipette Pasteur et la place à l’intérieur d’un 35 mm Petri dish. Veiller à ce que les tranches soient écartées apart quelques millimètres (cela garantira que chaque tranche peut être photographié individuellement).
- Ajouter immédiatement glacée « milieu de croissance » au fond de chaque boîte de pétri, sous le foyer de la culture de tissus, juste en dessous de la partie supérieure de la culture de tissus insérer la jante.
NOTE : Milieu de culture contient milieu essentiel Eagle de Minimum 50 %, 25 % Hanks balanced solution saline, 25 % de sérum de cheval, 5 mg/mL D-glucose, 2 mmol/L, L-glutamine, 1 % solution antibiotique-antimycosiques et 10 mmol/L HEPES, titré à pH 7.2 à l’hydroxyde de sodium. - Changer le milieu de croissance, au lendemain de la dissection et puis chaque 2 à 3 jours par la suite (utilisation milieu de croissance à 37 ° C). Veiller à ce que le milieu de culture est ajouté en quantité suffisante, mais pas tellement qu’il déborde sur la membrane d’insertion culture tissulaire, mais susceptibles de compromettre la viabilité des tranches des tissus.
- Gardez les tranches de tissus dans un incubateur humidifié à 37 ° C, avec 5 % de dioxyde de carbone dans l’air pendant 12 à 14 jours avant d’être utilisés dans les expériences.
2. préparation des tranches Hippocampal Organotypique pour le protocole TBI explosion expérimentale
Remarque : Toutes les étapes de cette section, à l’exception d’imagerie, ont lieu dans une hotte à flux laminaire vitroplants.
- Insérez les anneaux en acier inoxydable sur mesure dans une assiette bien 6 (un par puits).
NOTES : Les bagues ont une jante avec une encoche (qui doit s’asseoir dans la position de 12:00) et ajustement confortablement à l’intérieur du puits, tandis que la culture de tissus insère s’insérer facilement dans cet anneau. Veiller à ce que les anneaux sont lavés avec un désinfectant bactéricide, soigneusement rincés à l’eau purifiée, stérilisés à l’autoclave et à refroidir au préalable. - Remplir le puits de la plaque 6 puits de pré chauffé (37 ° C) sans sérum « support expérimental » avec l’iodure de propidium.
Remarque : Le milieu expérimental avec l’iodure de propidium est : un milieu essentiel Minimum 75 % aigle, 25 % Hanks balanced solution saline, 5 mg/mL D-glucose, 2 mmol/L, L-glutamine, 1 % solution antibiotique-antimycosiques, 10 mmol/L HEPES et l’iodure de propidium 4,5 µmol/L, pH titré 7.2 à l’hydroxyde de sodium. - S’assurer que le niveau de la moyenne n’atteint pas au-dessus de l’encoche de l’anneau. Placer la plaque 6 puits avec anneaux retour dans l’étuve pendant 1 h pour s’assurer que le support est à 37 ° C, juste avant que les inserts de culture cellulaire sont transférés.
- Transférer les inserts de culture cellulaire avec les tranches d’organotypique de la pétri de 35 mm dans la plaque de 6 puits avec les anneaux et le milieu expérimental avec une pince.
- Faire un point sur le rebord de l’insert dans la position de 03:00 avec un marqueur permanent.
NOTE : Les inserts vont être retirés de la plaque 6 puits pendant l’expérience, et cette étape permet de redresser le foyer à sa position initiale après l’exposition de l’onde de choc et de facilement garder une trace de chaque tranche, tout au long du protocole. - Étiquetez chaque plaque 6 puits avec un nom unique et la date et de faire une carte des puits de chaque plaque, nommant chaque puits (e.g., A, B, C, etc..) et chaque tranche dans chaque puits (e.g., 1, 2, 3, etc..), de sorte que chaque tranche possède un identificateur unique ( par exemple., A1, A2, A3, etc..).
- Placer la plaque de 6 puits dans l’étuve pendant 1 h pour que les tranches soient à 37 ° C, immédiatement avant l’imagerie.
NOTE : Éviter tout débordement du milieu ou les bulles d’air sous la culture de tissus insérer membrane, ce qui pourrait compromettre la viabilité des tranches. - 1 h après le transfert au milieu expérimental, image chaque tranche individuellement à l’aide d’un microscope à fluorescence (objectif X 2, NA 0,06) équipé d’une excitation appropriée (BP 535/50 nm) et le filtre d’émission (LP 610 nm) pour évaluer la santé tranche avant le traumatisme protocole est effectuée.
Note : Les tranches qui présentent des zones de coloration à ce stade de dense rouge devraient être considéré comme présentant une viabilité compromise et devraient être exclus de l’analyse (celles-ci représentent généralement moins de 10 % du nombre total des tranches générée). Veiller à ce que l’imagerie est réalisée de manière séquentielle et aussi rapidement que possible pour réduire au minimum le temps que les tranches sont à l’extérieur de l’incubateur (généralement 6 puits devraient prendre un peu moins 30 min d’image). - Laisser le couvercle de la plaque 6 puits sur à tout moment. Certains condensation peut s’accumuler à l’intérieur du couvercle. Dans ce cas, utiliser brièvement un sèche-cheveux sur le réglage bas.
- Vérifiez que toutes les conditions d’imagerie sont identiques à des jours différents et entre les expériences.
Remarque : Le but de l’imagerie est de quantifier la fluorescence de tissu, c’est pourquoi cette étape est importante pour assurer la reproductibilité des résultats et de permettre la comparaison des données obtenues.
3. l’immersion et le Transport de la Culture de tissus insère avec les tranches Hippocampal Organotypique
- Immédiatement après l’imagerie, dans une hotte à flux laminaire, prendre un insert de culture tissulaire de la plaque 6 puits avec une pincette.
- Attentivement le transfert l’insert d’un sachet stérile (3 "x 5") pré-remplie avec 20 mL de milieu expérimental tiède (37 ° C) fraîchement barboter avec 95 % d’oxygène et 5 % de dioxyde de carbone.
Remarque : S’assurer que le milieu expérimental enrichi d’oxygène et de dioxyde de carbone a été propagé pendant au moins 40 min avec 95 % d’oxygène et 5 % de dioxyde de carbone en utilisant un barboteur scintered-verre à l’intérieur d’une bouteille de Dreschel et transféré vers les sacs de polyéthylène stériles à l’intérieur un hotte à flux laminaire vitroplants à l’aide d’une seringue de 20 mL avec un filtre bactérien et un tube d’aspiration stérile (127 mm) attaché. Sceller les sacs immédiatement et transférez-les dans un incubateur à 37 ° C pendant au moins 1 h avant transfert, insérer la culture de tissus. - Veiller à ce que chaque sac stérile est correctement étiqueté (avec la plaque et bien identification). Répétez cette étape pour chaque insert de culture cellulaire. Exclure les bulles d’air soigneusement à sceller les sacs stériles (faits en toute sécurité en tournant la partie supérieure des sacs et en appliquant une pince en plastique).
- Retourner les sacs stériles avec les inserts de culture de tissus et les plaques 6 puits avec support expérimental dans l’incubateur à 37 ° C.
- Après 1 h, Emballez soigneusement les sacs stériles avec les inserts de culture cellulaire dans des boîtes en plastique à l’intérieur une boîte thermo-régulées, rempli d’eau déminéralisée à 37 ° C afin de garder les tranches organotypique à température physiologique tout au long de l’exposition de l’onde de choc protocole.
4. préparation du Tube à choc et exposition d’onde de choc hippocampe Organotypique tranche
- Porter des bottes protectrices des pieds en acier, un manteau de laboratoire et des gants lors de la préparation du tube à choc et l’exposition de l’onde de choc.
- Boulonnez le bâti de sac stérile sur la bride choc tube distal, veiller à ce que le trou central est aligné avec la sortie de tube de choc (à l’aide d’une tige de suppression de trame).
- Monter les deux transducteurs de pression radiale : capteur 1, dans la partie centrale de la section moteur et capteur 2 dans la bride distale du tube de choc (Figure 1 a). Connecter les capteurs de pression à un oscilloscope à travers un convertisseur courant source.
- Assurez-vous que toutes les vannes de sortie de tube choc et contrôles de flux sont fermés.
- Ouvrez la ligne externe d’air comprimé et charger l’électrovanne à 2,5 bars.
- Ouvrez la soupape de sécurité du cylindre d’air comprimé et ouvrir lentement le régulateur de pression pour augmenter la pression à environ 5 bars.
Remarque : La pression définie pour ce régulateur devrait être légèrement au-dessus du diaphragme plus haut pression de rupture. - Préparer les diaphragmes en coupe 23 µm d’épaisseur polyester de feuilles en carrés de 10 x 10 cm2 . Préparer les poignées à l’aide de ruban autoclave et collant en haut et en bas de chaque membrane.
- Placer un diaphragme (fente unique de la culasse double - configuration de membrane unique) ou deux diaphragmes (les deux fentes de la culasse double - configuration double membrane) dans la culasse (Figure 1 b).
- Centrez les diaphragmes et les pince à l’aide de M24 boulons et écrous, leur fixation dans l’ordre de manière symétrique en diagonale et veiller à ce que les membranes sont infroissables.
- Serrez chaque sac stérile individuellement en position verticale sur le cadre de la porte, s’assurer que la surface des inserts de culture cellulaire avec les tranches d’hippocampe organotypique fait face à la sortie de tube de choc et l’insert de culture cellulaire est centrée à l’intérieur de la stérile sac (Figure 1). Assurez-vous que le sac stérile est solidement fixé tout autour pour assurer l’immobilisation ferme et même.
- Porter les oreilles et lunettes de sécurité pour faire pression sur le tube de choc. Allumez le convertisseur courant source et un oscilloscope pour acquérir les données de l’onde de choc (fréquence d’acquisition des méga-échantillons/s, enregistrement 50 longueur de 20 ms, 1 million de points) et fermer la vanne électromagnétique.
- À l’aide de la manette de réglage sur le panneau de commande de tube de choc, pressuriser lentement la section pilote de volume du tube de choc pour la configuration de membrane unique ou la section de volume conducteur et la section de culasse double du tube choc pour double diaphragme configuration.
NOTE : Pour la configuration de membrane unique, la pression d’éclatement dépendra uniquement du matériau de la membrane et l’épaisseur et le diaphragme vont se rompre spontanément une fois que le matériel pression de rupture est atteint. Pour la configuration à double membranes, la pression d’éclatement dépendra également de la pression différentielle dans le pilote et les chambres doubles de culasse et, pour les diaphragmes exploser de manière contrôlée, la soupape de sûreté de culasse double est ouvert manuellement une fois les pressions de la cible sont atteints. - Dès que le diaphragme se rompt (produisant un bruit sourd), rapidement fermer l’écoulement de l’air comprimé à l’aide de la manette de débit et ouvrir la valve de solénoïde.
Remarque : Le volume total de la section du conducteur peut être modifié par l’insertion du découpage des segments, permettant une gamme plus large de l’onde de choc maximale surpression et durées d’obtenir. La combinaison idéale des paramètres de l’onde de choc devrait être suffisant pour provoquer des lésions, mais pas si élevé qu’il provoque insert de culture cellulaire ou de distorsion de sac stérile ou de rupture. - Exposer chaque sac stérile avec un insert de culture de tissus à une onde de choc unique tube et retourner immédiatement à la boîte thermo-régulé avant un nouveau sac stérile est tiré de la boîte et fixé sur le bâti. Veiller à ce qu’étapes 4.10 – 4.14 sont effectuées aussi facilement et rapidement que possible (à moins de quelques minutes) pour éviter le refroidissement moyen expérimental vers le bas, comme des températures inférieures à 37 ° C peuvent gêner le développement des lésions.
- Une fois que tous les inserts de culture de tissu ont été exposés à une onde de choc (ou protocole de sham), renvoyez les inserts de culture cellulaire à la plaque 6 puits d’origine et à leurs respectifs bien (à l’intérieur d’une hotte à flux laminaire culture tissulaire) et dans l’incubateur.
- Maintenir la plaque de 6 puits dans l’incubateur avec 5 % de dioxyde de carbone dans l’air à 37 ° C jusqu'à ce que davantage d’imagerie.
- Inclure des contrôles pour chaque expérience, ainsi que l’exposition d’onde de choc de tranche.
Nota : Les tranches de Sham sont traités identiquement pour les secteurs exposés à une onde de choc (scellées dans les sachets stériles avec support expérimental, transporté au laboratoire du tube de choc dans la même boîte thermo-régulées et sur le cadre métallique a été suspendu pour une période équivalente de temps) mais le choc tube n’est pas déclenché.
5. hippocampe Organotypique tranche blessure Quantification
- À 24 h, 48 h et 72 h, les tranches d’image tel que décrit dans les étapes 2.8 et 2.9.
- Après l’imagerie à l’onde de choc post-exposition de 72 h, jetez le tissu biologique locale suivant protocoles des déchets et à désinfecter et stériliser le métal anneaux.
Résultats
Le tube de choc utilisé dans cette méthode permet la génération des transitoires de surpression qui simulent des explosions réelles plein champ modélisées par la fonction de Friedlander7,8. Une onde de choc supersonique avec une vitesse de 440 m/s (Mach 1,3) ont été obtenus (Figure 2 a). Les données de forme d’onde signalées provient du capteur 2, placé radialement à la fin de la section entraînement du tube de choc.
En utilisant le protocole décrit ci-dessus, hippocampe par organotypiques exposés à une seule onde de choc (Figure 2 a) développent lésion significative quantifiée à l’aide d’un colorant fluorescent hautement polaire qui seulement pénètre dans les cellules avec l’iodure de propidium compromis les membranes cellulaires24,25 (Figure 2 b, C).
Même dans des conditions optimales et conformément aux autre CSST publièrent modèles21,22, il y a un faible niveau de fluorescence de l’iodure de propidium fond due, en partie, aux dégâts mineurs causés par le tissu inhérente des manipulations ( comme les changements de médias pendant la période de culture ou de la suppression de l’incubateur pour l’imagerie). Cette explosion protocole TBI implique la manipulation substantielle qui inclut la submersion des tranches dans un milieu à l’intérieur des sacs stériles et un degré considérable de manipulation pendant le protocole d’exposition onde de choc (e.g., serrage les sachets stériles pour la cadre de porte). Toutefois, si toutes les mesures sont effectuées avec soin, cette manipulation supplémentaire n’a pas un impact sur la santé sous-jacente de la CSST comme les voyait aucune différence significative entre un groupe témoin de tranches conservés dans les plaques 6 puits en permanence (i.e., les inserts ne sont pas submergées ou manipulés) et du groupe fictif, qui comprenait des tranches qui ont été submergés dans des sacs stériles fixés au tube de choc (Figure 2 b).
Les deux ondes de choc choisis, à 50 kPa et surpression de pointe 55 kPa, produit significatif (p < 0,05 et p < 0,0001, respectivement) et reproductible blessures par rapport à l’imposture blessé tranches à tous les points de temps après l’exposition souffle protocole (Figure 2 b) sans causer de dégâts pour les inserts de culture cellulaire ou les sacs stériles. Afin de déterminer la sensibilité du modèle aux petites différences en crête-surpression, nous avons décidé de sélectionner des valeurs différentes de ~ 10 %. Ces résultats montrent aussi que, comme prévu, le dommage résultant de 55 kPa est supérieur à celui après une onde de choc de 50 kPa.
Les données sont exprimées en moyenne ± écart-type de la moyenne. Signification a été évaluée à l’aide d’une 2 voies à mesures répétées analyse de la variance à l’aide de test post hoc de Holm-Sidak. Facteur 1 était groupe (contrôle, imposture, explosion) et facteur 2 était temps après la blessure (-1 h, 24h, 48 h et 72 h), où le facteur 1 est le facteur répété. L’ajustement de la valeur de p pour les comparaisons multiples a été utilisé. Les valeurs de P de moins de 0,05 ont été prises pour indiquer une différence significative entre les groupes. Les tests statistiques ont été réalisés à l’aide d’un progiciel de statistiques et de graphiques.

Figure 1 : schéma de l’appareil de tube de choc avec le bâti de sac stérile. (A). le tube de choc est un tube en acier inoxydable longue 3,8 m, en trois sections de 1,22 m de long, reliées par des joints et brides, avec un diamètre intérieur de 59 mm. médaillon (B) montre l’assemblage culasse double. Un ou deux diaphragmes de Mylar peuvent être bridés à l’Assemblée avec joint fourni par joints toriques en caoutchouc. Cadre de porte sac stérile (C). Le corps du cadre se compose de deux plaques de métal avec un trou circulaire centré (59 mm de diamètre) qui s’aligne avec la sortie de tube de choc. Deux feuilles minces (4 mm) en élastomère de silicone sont montés entre les deux plaques de métal. Le but de ces fiches est de fournir une surface plane et non glissante pour fixer les sacs stériles. La distance entre le sac et la sortie du tube de choc est de 7 cm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
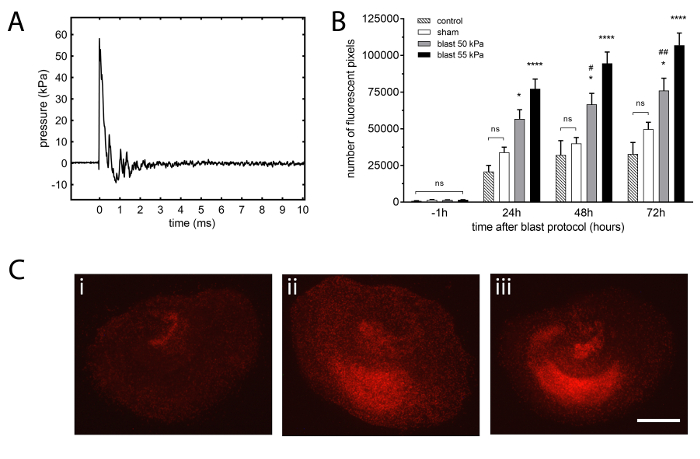
Figure 2 : shockwave typique et le préjudice qui en résulte organotypique hippocampal slice cultures. (A) exemple représentatif de l’onde de choc obtenue à l’aide de 23 µm d’épaisseur film polyester, 2.16 bar pression d’éclatement 55 10,1 kPa·ms impulsion, durée de la vague positive de 0,4 ms, surpression maximale kPa. Données de forme d’onde ont été extraites d’un capteur 2 monté radialement sur la bride distale du tube choc piloté par section. La vitesse de l’onde de choc a été de 440 m/s (Mach 1,3). (B) le développement des lésions est proportionnelle à l’intensité de l’onde de choc. Fois 50 kPa et 55 kPa pic surpression des ondes de choc causé un préjudice important développé dans tout le protocole de 72 h en comparaison avec le groupe fictif. Le dommage résultant d’une exposition de vague 55 kPa pic surpression était significativement plus élevé après 50 kPa à 48 h et tranches de 72 h. Sham ont été traités identiquement aux tranches de souffle mais tube à choc n’était pas déclenché. Tranches de contrôle ont été maintenues dans 6 assiettes bien dans un incubateur sans aucune manipulation. Barres représentent les valeurs moyennes et les barres d’erreur sont les écarts-types (n = 7, contrôles ; n = 48, sham ; n = 30, souffle 50 kPa ; n = 51, souffle 55 kPa ; n = nombre de tranches, des 6 expériences distinctes). * p < 0,05, *p < 0,0001 comparé avec l’imposture. # p < 0,05, #p < 0,01 par rapport à l’explosion 55 kPa. (C) représentant propidium iodure fluorescence images de tranches organotypique de sham (i), (ii) souffle 50 kPa et (iii) souffle 55 kPa groupes à 72 h après une blessure. La tranche de simulacre montre de faibles niveaux de fluorescence, c’est à dire., blessure et l’explosion des tranches exposées montrent des niveaux élevés de lésion diffuse, plus prononcé sur la tranche de surpression exposée de pointe 55 kPa (barre d’échelle = 500 µm). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Parmi tous les mécanismes des lésions associées à explosion TBI (mécanismes de blessure explosion primaire, secondaire et tertiaire), principal blessures blast sont unique à un traumatisme de l’explosion et c’est le moins compris des mécanismes associés à blast1,2 . Le nouveau protocole décrit ici a été développé pour étudier l’explosion primaire TBI en utilisant un tube de choc à composition non limitée pour exposer en vitro cultures tranche hippocampe de souris à une seule onde de choc à l’aide d’un protocole simple et rapid qui permet la création d’un reproductible blast primaire TBI avec un débit élevé.
La première en vitro explosion primaire TBI modèles appliqués ondes de pression hydrostatique à cellules26,27. Toutefois, la sortie de pression modèle pas la fonction de Friedlander comme la durée d’une impulsion de pression hydrostatique était beaucoup plus longue que blast aéroporté surpression vagues13. La caractéristique Friedlander fonction peut être facilement modélisée en laboratoire au moyen d’un choc tube1,8. Le tube de choc peut produire des ondes de choc qui simulent des explosions de terrain dégagé de réelles dans un environnement de laboratoire classiques, tout en permettant un contrôle précis des paramètres de l’onde, comme surpression maximale, la durée de l’onde positive et impulsion, en faisant varier la matériau et épaisseur et le pilote volume8,28,29.
Simple in vitro des modèles tels que les cultures de cellules manquent habituellement de l’hétérogénéité des types de cellules et la connectivité synaptique30. Récemment, l’effet de souffle sur cellule du cerveau in vitro « sphéroïdes » intégrant les différents types de cellules a été étudié31. Une enquête plus poussée de ces préparations intéressantes est justifiée ; Cependant, il n’est pas clair comment leur organisation cellulaire et la connectivité reflète le cerveau intact. CSST sont un bien établie in vitro modèle expérimental23,32, sont faciles à la culture et de leur tissu tridimensionnel cytoarchitecture, la différenciation cellulaire et la connectivité synaptique sont bien conservées et très semblable à celui en vivo33,34,35,36. OHSCs représentent un niveau intermédiaire de complexité entre culture cellulaire et une en vivo modèle23,32. OHSCs ont été démontrées à reproduire in vitro neurodégénératives pathologique cascades vus dans des modèles in vivo et ont été très utiles au contrôle des médicaments neuroprotecteurs potentiels et dans la compréhension de leurs mécanismes de action17,21,22,37,38. Enfin, la zone anatomique étudiée, l’hippocampe, est très pertinente dans les études translationnelles de TBI, car cette région est souvent endommagée dans TBI patients39,40,41. CSST ont servi à blast modèle TBI28,42,43,44, toutefois, notre modèle est relativement simple et peut être adaptée aux chocs-tubes existants soit horizontal ou vertical configurations sans adaptations complexes.
CSST peut être maintenue en culture pendant plusieurs jours, qui facilite l’étude des processus biologiques au fil du temps,34. Dans ce modèle, les lésions résultant de l’exposition de l’onde de choc a été mesurée par jour pendant trois jours, suite à l’exposition de souffle à l’aide de l’iodure de propidium, un marqueur bien établi des dommages cellulaires. L’iodure de Propidium est un colorant fortement polaire non toxique qui pénètre dans les cellules avec les membranes cellulaires compromis, où il se lie aux acides nucléiques et présente une fluorescence rouge vif caractéristique24,25,45. La fluorescence mesurée avec l’iodure de propidium a démontré avoir une bonne corrélation avec la numération lésé à l’aide de Nissl coloration46,47.
Étant donné que la blessure produite dans ce modèle était diffus (Figure 2), la fluorescence de la tranche entière a été mesurée lors de l’exécution de l’analyse, similaire aux travaux déjà publié dans autres cerveau lésions paradigmes21,22 , au lieu d’utiliser des régions spécifiques, comme l’a fait l’autre en vitro blast TBI modèles28,43,44,48. L’approche globale utilisée dans le modèle décrit dans cet article élimine également la variabilité qui est introduite lorsque décrivant régions d’intérêt définies et fournit une image plus complète de la lésion liée au souffle. Les surpressions pic onde de choc, 50 kPa et 55 kPa, produit significatif (p < 0,05 et p < 0,0001, respectivement) blessures par rapport aux tranches de sham (Figure 2B). Comme prévu, l’onde de choc avec la surpression maximale plus élevée, 55 kPa, a causé des lésions plus que la vague de 50 kPa. Un modèle in vitro avec cerveau isolé tissu exposé directement à une onde de choc, comment avec précision à l’échelle de l’organisme entier ou un être humain n’est pas simple. Néanmoins, nous avons utilisé de l’onde de choc s’est dans l’intervalle des surpressions pic observé sur le terrain, généralement 50 – 1 000 kPa8,49.
Afin de maintenir le CSST exposé à des niveaux d’oxygène et de dioxyde de carbone et température physiologique tout en s’assurant qu’ils sont exempts de contamination dans tout le protocole d’exposition onde de choc, les inserts de culture de tissu ont été scellées dans stérile sacs de polyéthylène suivant une technique aseptique, immergée dans un milieu expérimental chauffé à 37 ° C et fraîchement barboter avec 95 % d’oxygène et 5 % de dioxyde de carbone, de même aux travaux déjà publiés28,43,44 ,48. Contrairement à ces modèles où les dispositifs complexes étaient utilisées pour conserver les sacs stériles pendant l’exposition de l’onde de choc, dans ce protocole, une méthode rapide et simple a été utilisée pour suspendre les inserts de culture cellulaire CSST en face de la sortie de tube de choc (Figure 1 a, C ). Le modèle décrit dans le présent document permet un traitement rapide et un débit élevé, tout en minimisant le risque d’hypothermie. Ces aspects sont particulièrement pertinents pour les études de neuroprotection étant donné que certaines interventions thérapeutiques peuvent avoir une fenêtre de temps très limité du potentiel d’application après le TBI. Ce protocole d’exposition nouvelle onde de choc permet de 6 à 9 vitroplants insère (généralement de 36 à 54 organotypique hippocampe tranches de tissus) pour être exposé à une onde de choc dans un court intervalle de temps (environ 1 h).
Les OHSCs besoin bonne asepsie tout au long. Il est important d’utiliser une hotte à flux laminaire aseptique tout au long de la mise en culture et lors du transfert vers les sacs stériles pour l’explosion. Afin de réaliser l’imagerie tranche dans des conditions aseptiques avec les couvercles des plaques 6 puits en place, les anneaux en métal sur mesure nous permet de soulever les inserts de culture cellulaire pour le plan focal du microscope. Une partie importante de notre protocole, c’est que nous incluons des tranches de sham indemne dans chaque expérience. Tranches de trompe-l'œil sont traités identiquement aux tranches de souffle à l’exception que le tube de choc n’est pas déclenché ; une autre étape importante est que toutes les tranches sont imagés 1 h avant l’accident ou traitement simulé, pour s’assurer que la santé de la population de tranches utilisées sont identiques (Figure 2 b).
En plus de la quantification des lésions des cellules dans les tranches au fil du temps, le tissu peut être fixé à la fin de l’expérience pour immunohistochemistry classiques50. Nous avons développé et évalué la méthode à l’aide de tranches d’hippocampe de souris. Cependant, notre technique pourrait être facilement adapté à utiliser d’autres tissus que l'on peut cultiver dans la culture, tels que la moelle épinière, rétine, pulmonaire ou tissu épithélial. Dans cet article et nos travaux antérieurs avec le modèle, nous avons ne étudié que l’effet de l’exposition à une seule émission. Toutefois, le modèle serait bien adapté pour étudier les effets d’explosions répétées de bas niveau sur le cerveau ou d’autres tissus. OHSCs peuvent être maintenues en culture pendant plusieurs semaines voire des mois, ce qui permet des effets chroniques, être l’objet d’une enquête.
Modèles in vitro , étant plus simples que les modèles in vivo , ont un débit plus élevé, sont moins coûteux et expériences peuvent habituellement être complétées sur une échelle de temps plus court17. Toutefois, les résultats obtenus à l’aide des modèles in vitro doivent être validées dans des modèles animaux in vitro culture de tissus sont conservés dans un environnement artificiel et peuvent répondre à l’injure différemment de ce qu’ils le feraient en vivo17. Néanmoins, des modèles in vitro ont été extrêmement précieuses pour améliorer notre compréhension du cerveau cascades de blessures et en dépistage de médicaments neuroprotecteurs avant l’utilisation des plus complexes en vivo modèles17,22 , 51 , 52. malgré les nombreux avantages offerts par ce modèle, il est important de noter que les modèles in vitro n’ont pas la clé caractéristiques du TBI présent chez les animaux et en vivo modèles, tels que les effets sur le système vasculaire, augmenté intracrânienne pression, réponse immunitaire systémique et atteinte fonctionnelle comportementale, qui met en évidence la nécessité de valider les résultats dans des modèles in vitro chez l’animal entier. Néanmoins, en vitro modèles tels que le modèle décrit dans cet article sont extrêmement utiles outils scientifiques pertinents translationnelle.
En conclusion, cet ouvrage décrit une nouvelle méthode simple et directe, où les cultures de tissus hippocampiques souris organotypique sont exposés à étroitement contrôlés et reproductibles réelles pertinentes des ondes de choc à l’aide d’un tube de choc de laboratoire. Le préjudice global, qui a été quantifié à l’aide de l’iodure de propidium, un marqueur bien établi des dommages cellulaires, est très reproductible et est proportionnel à la surpression de la crête de l’onde de choc appliquée.
Déclarations de divulgation
Les auteurs n’ont aucun intérêt financier concurrentes.
Remerciements
Soutenu par : Centre Royal de médecine de la défense, Birmingham, Royaume-Uni, Royal British Legion Centre for Blast blessure études, Imperial College London, United Kingdom. Medical Research Council, London, United Kingdom (MC_PC_13064 ; MR/N027736/1). La sécurité gaz Trust, Londres, Royaume-Uni. Rita Campos-Pires a été le récipiendaire d’une bourse de formation doctorale de la Fundação para a Ciência e a Tecnologia, Lisbonne, Portugal. Katie Harris a reçu une bourse de doctorat de la Westminster Medical School Research Trust, Londres, Royaume-Uni.
Ce modèle a été développé avec le soutien de la Royal British Legion Centre pour les études de blessure Blast (RBLCBIS) à l’Imperial College. Nous tenons à souligner l’appui financier de la Royal British Legion. Chercheurs intéressés de collaborations ou de plus amples renseignements peuvent communiquer avec les auteurs ou les RBLCBIS.
Nous remercions Dr Amarjit Samra, directeur de recherche du Centre Royal de défense médecine, Birmingham, Royaume-Uni, pour soutenir ce travail, Scott Armstrong, département de chirurgie et Cancer, Imperial College London, assistance avec des expériences préliminaires , Theofano Eftaxiopolou, Hari Arora & Luz Ngoc Nguyen, département de génie biologique Imperial College London, William Proud, département de physique Imperial College de Londres, pour obtenir des conseils sur le tube de choc, Raquel Yustos, technicien, ministère de la recherche des Sciences de la vie, Imperial College London, responsable support technique, Paul Brown MBE, atelier et Steve Nelson, technicien d’atelier, département de physique de l’Imperial College de Londres, pour rendre le métal anneaux, Neal Powell du département de physique, Imperial College London, de œuvres d’art.
matériels
| Name | Company | Catalog Number | Comments |
| Geys balanced salt solution | Sigma UK | G9779 | |
| D- glucose | Sigma UK | G8270 | |
| Antibiotic/antimycotic | Sigma UK | A5955 | |
| Minimum essential medium Eagle | Sigma UK | M4655 | |
| Hanks balanced salt solution | Sigma UK | H9269 | |
| Horse serum | Sigma UK | H1138 | |
| L-glutamine | Sigma UK | G7513 | |
| HEPES | VWR Prolabo, Belgium | 441476L | |
| Sodium hydroxide | Sigma UK | S-0945 | |
| Tissue culture inserts | Millicell CM 30 mm low height Millipore | PICM ORG 50 | |
| 6-well plates | NUNC, Denmark | 140675 | |
| Propidium iodide | Sigma UK | P4864 | |
| Sterile polyethylene bags - Twirl'em sterile sample bags | Fisherbrand | 01-002-30 | |
| Portex Avon Kwill Filling Tube 5" (127mm) | Smiths Medical Supplies | E910 | |
| Epifluorescence microscope | NIKON Eclipse 80i, UK | ||
| Microscope objective | Nikon Plan UW magn. 2x, NA 0.06, WC 7.5 mm | ||
| Microscope filter | Nikon G-2B (longpass emission) | ||
| Mylar electrical insulating film, 304 mm x 200 mm x 0.023 mm | RS Components UK | 785-0782 | |
| Pressure transducer | Dytran Instruments Inc. | 2300V1 | |
| Tissue chopper | Mickle Laboratory Engineering Co., Guildford, Surrey, United Kingdom. | Mcllwain tissue chopper | |
| Silicone elastomer | Dow Corning, USA | Sylgard 184 | |
| Graphing & statistics software | GraphPad Software, USA | Prism 7.0 |
Références
- Risling, M., Davidsson, J. Experimental animal models for studies on the mechanisms of blast-induced neurotrauma. Frontiers in Neurology. 3, 30 (2012).
- Nakagawa, A., et al. Mechanisms of primary blast-induced traumatic brain injury: insights from shock-wave research. Journal of Neurotrauma. 28 (6), 1101-1119 (2011).
- Goldstein, L. E., McKee, A. C., Stanton, P. K. Considerations for animal models of blast-related traumatic brain injury and chronic traumatic encephalopathy. Alzheimer's Research & Therapy. 6 (5), 64 (2014).
- Rona, R. J., et al. Mild traumatic brain injury in UK military personnel returning from Afghanistan and Iraq: cohort and cross-sectional analyses. Journal of Head Trauma and Rehabilitation. 27 (1), 33-44 (2012).
- Terrio, H., et al. Traumatic brain injury screening: preliminary findings in a US Army Brigade Combat Team. Journal of Head Trauma and Rehabilitation. 24 (1), 14-23 (2009).
- Elder, G. A., Stone, J. R., Ahlers, S. T. Effects of low-level blast exposure on the nervous system: is there really a controversy. Frontiers in Neurology. 5, 269 (2014).
- Ling, G., Bandak, F., Armonda, R., Grant, G., Ecklund, J. Explosive blast neurotrauma. Journal of Neurotrauma. 26 (6), 815-825 (2009).
- Bass, C. R., et al. Brain injuries from blast. Annals of Biomedical Engineering. 40 (1), 185-202 (2012).
- Young, L. A., Rule, G. T., Bocchieri, R. T., Burns, J. M. Biophysical mechanisms of traumatic brain injuries. Seminars in Neurology. 35 (1), 5-11 (2015).
- Wolf, S. J., Bebarta, V. S., Bonnett, C. J., Pons, P. T., Cantrill, S. V. Blast injuries. Lancet. 374 (9687), 405-415 (2009).
- Kluger, Y., Nimrod, A., Biderman, P., Mayo, A., Sorkin, P. The quinary pattern of blast injury. American Journal of Disaster Medicine. 2 (1), 21-25 (2007).
- Champion, H. R., Holcomb, J. B., Young, L. A. Injuries from explosions: physics, biophysics, pathology, and required research focus. Journal of Trauma: Injury, Infection, and Critical. 66 (5), 1468-1477 (2009).
- Chen, Y. C., Smith, D. H., Meaney, D. F. In-vitro approaches for studying blast-induced traumatic brain injury. Journal of Neurotrauma. 26 (6), 861-876 (2009).
- Edwards, D. S., Clasper, J., Bull, A. M. J., Clasper, J., Mahoney, P. F. . Blast Injury Science and Engineering: A Guide for Clinicians and Researchers. , 87-104 (2016).
- Kirkman, E., Watts, S., Cooper, G. Blast injury research models. Philosophical Translations of the Royal Society B: Biological Sciences. 366 (1562), 144-159 (2011).
- Hicks, R. R., Fertig, S. J., Desrocher, R. E., Koroshetz, W. J., Pancrazio, J. J. Neurological effects of blast injury. J Trauma. 68 (5), 1257-1263 (2010).
- Morrison, B., Elkin, B. S., Dolle, J. P., Yarmush, M. L. In vitro models of traumatic brain injury. Annual Reviews of Biomedical Engineering. 13, 91-126 (2011).
- Johnson, V. E., Meaney, D. F., Cullen, D. K., Smith, D. H. Animal models of traumatic brain injury. Handbook of Clinical Neurology. , 115-128 (2015).
- Xiong, Y., Mahmood, A., Chopp, M. Animal models of traumatic brain injury. Nature Reviews Neuroscience. 14 (2), 128-142 (2013).
- Morganti-Kossmann, M. C., Yan, E., Bye, N. Animal models of traumatic brain injury: is there an optimal model to reproduce human brain injury in the laboratory?. Injury. 41, S10-S13 (2010).
- Banks, P., Franks, N. P., Dickinson, R. Competitive inhibition at the glycine site of the N-methyl-D-aspartate receptor mediates xenon neuroprotection against hypoxia-ischemia. Anesthesiology. 112 (3), 614-622 (2010).
- Harris, K., et al. Neuroprotection against traumatic brain injury by xenon, but not argon, is mediated by inhibition at the N-methyl-D-aspartate receptor glycine site. Anesthesiology. 119 (5), 1137-1148 (2013).
- Stoppini, L., Buchs, P. A., Muller, D. A simple method for organotypic cultures of nervous tissue. Journal of Neuroscience Methods. 37 (2), 173-182 (1991).
- Noraberg, J., Kristensen, B. W., Zimmer, J. Markers for neuronal degeneration in organotypic slice cultures. Brain Research Protocols. 3 (3), 278-290 (1999).
- Macklis, J. D., Madison, R. D. Progressive incorporation of propidium iodide in cultured mouse neurons correlates with declining electrophysiological status: a fluorescence scale of membrane integrity. Journal of Neuroscience Methods. 31 (1), 43-46 (1990).
- Salvador-Silva, M., et al. Responses and signaling pathways in human optic nerve head astrocytes exposed to hydrostatic pressure in vitro. Glia. 45 (4), 364-377 (2004).
- Howard, D., Sturtevant, B. In vitro study of the mechanical effects of shock-wave lithotripsy. Ultrasound Medical Biology. 23 (7), 1107-1122 (1997).
- Effgen, G. B., et al. A Multiscale Approach to Blast Neurotrauma Modeling: Part II: Methodology for Inducing Blast Injury to in vitro Models. Front Neurol. 3, 23 (2012).
- Nguyen, T. T. . The characterisation of a shock tube system for blast injury studies. , (2016).
- Noraberg, J., et al. Organotypic hippocampal slice cultures for studies of brain damage, neuroprotection and neurorepair. Current Drug Targets CNS and Neurological Disorders. 4 (4), 435-452 (2005).
- Sawyer, T. W., et al. Investigations of primary blast-induced traumatic brain injury. Shock Waves. 28 (1), 85-99 (2017).
- Gahwiler, B. H. Organotypic monolayer cultures of nervous tissue. Journal of Neuroscience Methods. 4 (4), 329-342 (1981).
- Gahwiler, B. H., Capogna, M., Debanne, D., McKinney, R. A., Thompson, S. M. Organotypic slice cultures: a technique has come of age. Trends in Neuroscience. 20 (10), 471-477 (1997).
- De Simoni, A., Yu, L. M. Preparation of organotypic hippocampal slice cultures: interface method. Nature Protocols. 1 (3), 1439-1445 (2006).
- Gogolla, N., Galimberti, I., DePaola, V., Caroni, P. Long-term live imaging of neuronal circuits in organotypic hippocampal slice cultures. Nature Protocols. 1 (3), 1223-1226 (2006).
- De Simoni, A., Griesinger, C. B., Edwards, F. A. Development of rat CA1 neurones in acute versus organotypic slices: role of experience in synaptic morphology and activity. Journal of Physiology. 550 (Pt 1), 135-147 (2003).
- Sundstrom, L., Morrison, B., Bradley, M., Pringle, A. Organotypic cultures as tools for functional screening in the CNS). Drug Discovery Today. 10 (14), 993-1000 (2005).
- Cater, H. L., et al. Stretch-induced injury in organotypic hippocampal slice cultures reproduces in vivo post-traumatic neurodegeneration: role of glutamate receptors and voltage-dependent calcium channels. Journal of Neurochemistry. 101 (2), 434-447 (2007).
- Atkins, C. M. Decoding hippocampal signaling deficits after traumatic brain injury. Translational Stroke Research. 2 (4), 546-555 (2011).
- Bigler, E. D., et al. Hippocampal volume in normal aging and traumatic brain injury. American Journal of Neuroradiology. 18 (1), 11-23 (1997).
- Umile, E. M., Sandel, M. E., Alavi, A., Terry, C. M., Plotkin, R. C. Dynamic imaging in mild traumatic brain injury: support for the theory of medial temporal vulnerability. Archives of Physical Medicine and Rehabilitation. 83 (11), 1506-1513 (2002).
- Effgen, G. B., et al. Primary Blast Exposure Increases Hippocampal Vulnerability to Subsequent Exposure: Reducing Long-Term Potentiation. Journal of Neurotrauma. 33 (20), 1901-1912 (2016).
- Effgen, G. B., et al. Isolated primary blast alters neuronal function with minimal cell death in organotypic hippocampal slice cultures. Journal of Neurotrauma. 31 (13), 1202-1210 (2014).
- Vogel Iii, E. W., et al. Isolated Primary Blast Inhibits Long-Term Potentiation in Organotypic Hippocampal Slice Cultures. Journal of Neurotrauma. , (2015).
- Vornov, J. J., Tasker, R. C., Coyle, J. T. Direct observation of the agonist-specific regional vulnerability to glutamate, NMDA, and kainate neurotoxicity in organotypic hippocampal cultures. Experimental Neurology. 114 (1), 11-22 (1991).
- Cho, S., et al. Spatiotemporal evidence of apoptosis-mediated ischemic injury in organotypic hippocampal slice cultures. Neurochemistry International. 45 (1), 117-127 (2004).
- Newell, D. W., Barth, A., Papermaster, V., Malouf, A. T. Glutamate and non-glutamate receptor mediated toxicity caused by oxygen and glucose deprivation in organotypic hippocampal cultures. The Journal of Neuroscience. 15 (11), 7702-7711 (1995).
- Miller, A. P., et al. Effects of blast overpressure on neurons and glial cells in rat organotypic hippocampal slice cultures. Frontiers in Neurology. 6, 20 (2015).
- Panzer, M. B., Wood, G. W., Bass, C. R. Scaling in neurotrauma: how do we apply animal experiments to people. Experimental Neurology. , 120-126 (2014).
- Campos-Pires, R., et al. Xenon Protects against Blast-Induced Traumatic Brain Injury in an In Vitro Model. Journal of Neurotrauma. 35 (8), 1037-1044 (2018).
- Coburn, M., Maze, M., Franks, N. P. The neuroprotective effects of xenon and helium in an in vitro model of traumatic brain injury. Critical Care Medicine. 36 (2), 588-595 (2008).
- Campos-Pires, R., et al. Xenon improves neurologic outcome and reduces secondary injury following trauma in an in vivo model of traumatic brain injury. Critical Care Medicine. 43 (1), 149-158 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon