Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Verlängerung der Lebensdauer von löslichen führen Flow-Batterien mit einer Natrium-Acetat-Additiv
In diesem Artikel
Zusammenfassung
Ein Protokoll für den Bau einer löslichen Lead-Flow-Batterie mit eine lange Lebensdauer, welche Natrium Acetat im Methanesulfonic Elektrolyt als Zusatzstoff, geliefert wird präsentiert.
Zusammenfassung
In diesem Bericht stellen wir eine Methode für den Bau von einem löslichen Lead-Flow-Batterie (SLFB) mit einer längeren Lebensdauer. Durch die Bereitstellung einer ausreichenden Menge an Natriumacetat (NaOAc), der Elektrolyt, ist eine Verlängerung der Lebensdauer der Zyklus von über 50 % für SLFBs über langfristige Galvanostatic Lade/Entlade Experimente gezeigt. Eine höhere Qualität der PbO2 Electrodeposit an der positiven Elektrode wird quantitativ für NaOAc hinzugefügt Elektrolyt durch werfen Index (TI) Messungen validiert. Bilder von Rasterelektronenmikroskopie (SEM) erworben zeigen auch stärker integrierten PbO2 Oberflächenmorphologie, wenn die SLFB mit dem NaOAc hinzugefügt Elektrolyt betrieben wird. Diese Arbeit zeigt, dass Elektrolyt Änderung eine plausible Route wirtschaftlich aktivieren Sie SLFBs für groß angelegte Energiespeicher bezeichnen kann.
Einleitung
Erneuerbare Energiequellen wie Solar- und Windenergie für Jahrzehnte entwickelt worden, aber ihre nur unregelmäßig stellt vor große Herausforderungen. Für eine zukünftige Stromnetz mit erneuerbaren Energien aufgenommen Netzstabilisierung und Last Nivellierung sind kritisch und können durch die Integration der Energiespeicher erreicht werden. Redox-Flow-Batterien (RFBs) sind eine der viel versprechenden Optionen für Raster angelegte Energiespeicher. Traditionelle RFBs enthalten ionenselektive Membranen, die Trennung von cher und Katholyt-; zum Beispiel All-Vanadium RFB hat gezeigt, dass um mit hohem Wirkungsgrad zu betreiben und ein langen Zyklus Leben1,2. Ihr Marktanteil als Energiespeicher ist jedoch sehr begrenzt, teilweise aufgrund der teuren bestehend aus Materialien und ineffektiv ionenselektive Membranen. Auf der anderen Seite ist eine lösliche Lead Single-Flow-Flow-Batterie (SLFB) von Plectcher Et Al. vorgestellt. 1 , 2 , 3 , 4 , 5. die SLFB Membran-weniger ist, weil es nur einen aktiven Spezies, Pb(II) Ionen hat. PB(II) Ionen sind galvanisch an der positiven Elektrode als PbO2 und die negative Elektrode als Pb gleichzeitig während des Ladevorgangs und zurück konvertieren Pb(II) während der Entladung. Ein SLFB muß daher eine Umwälzpumpe und ein Elektrolyt Vorratsbehälter nur, was wiederum möglicherweise zu reduzierten Kapital- und Betriebskosten im Vergleich zu herkömmlichen RFBs führen kann. Die veröffentlichten Lebensdauer des SLFBs, ist jedoch so weit beschränkt sich auf weniger als 200 Zyklen unter normalen Bedingungen6,7,8,9,10.
Faktoren führt zu einer kurzen SLFB-Lebensdauer ist vorläufig mit Ablagerung/Auflösung der PbO2 an der positiven Elektrode verbunden. Während der Lade-/Entlade-Prozesse die Elektrolyt-Säure findet sich tief oder wiederholte Zyklen11zunehmen, und Protonen werden vorgeschlagen, um die Generation der eine Passivierungsschicht nicht stöchiometrischen PbOX12, induzieren 13. das Vergießen von PbO2 ist ein weiteres Phänomen im Zusammenhang mit SLFB Abbau. Schuppen Sie PbO2 Teilchen sind irreversibel und können nicht mehr verwendet werden. Coulomb (CE) Effizienzder SLFBs lehnt konsequent durch unausgewogene elektrochemischen Reaktionen sowie angesammelten Elektroplattierungen an beiden Elektroden. Lebensdauer der SLFBs, stabilisiert den pH-Wert zu verlängern sind Fluktuation und Electrodeposit Struktur entscheidend. Eine neuere Arbeit zeigt eine verbesserte Leistung und längere Lebensdauer des SLFBs mit Zusatz von Natriumacetat (NaOAc) in Methanesulfonic Elektrolyt11.
Hier wird ein detailliertes Protokoll für den Einsatz von NaOAc als Zusatz zu den Methanesulfonic Elektrolyten in SLFBs beschrieben. Die SLFB Leistung zeigt sich verbessert werden und die Lebensdauer kann verlängert werden, um über 50 % im Vergleich zu SLFBs ohne NaOAc Zusätze. Darüber hinaus werden Verfahren zur Messung der Index (TI) zu werfen für die Zwecke der quantitativen Vergleich der additive Effekte auf Galvanisierung illustriert. Schließlich eine Scan Rasterelektronenmikroskopie (SEM) Probe Vorbereitung Methode für Electrodeposit an den SLFB Elektroden wird beschrieben und die additive Wirkung auf Electrodeposit manifestiert sich in aufgenommenen Bilder.
Protokoll
(1) Bau einer SLFB-Becher-Zelle mit Natrium Acetat Zusatz
Hinweis: Dieser Abschnitt beschreibt das Verfahren, um eine SLFB-Becher-Zelle mit Additiv für Radsport Langzeitversuchs zu konstruieren. Das Protokoll enthält die Elektrolyt-Vorbereitung mit und ohne Additiv, Elektrode Vorbehandlung, Zelle Montage und Effizienzberechnungen.
-
Vorbereitung der Blei-Methanesulfonate (1 L, 1 M als Beispiel)
- Fügen Sie in der Dunstabzugshaube 274,6 g Methanesulfonic Säure (MSA, 70 % ein) in ein Becherglas, Rühren mit Stir bar Auflösen der MSA mit 300 mL entionisiertem Wasser (DI).
- Bereiten Sie 223,2 g Blei (II) oxid (98 % zu) und in Schritten zu den oben genannten Becher bis die vorbereiteten Bleioxid vollständig gelöst ist.
- Filtern Sie durch den Büchner-Trichter mit 70 mm Zellulose Filterpapier alle ungelösten Bleioxid zu trennen.
- Wiederholen Sie diesen Vorgang für 3 Mal. Fügen Sie DI Wasser auf 1 L Gesamtvolumen zu erreichen.
-
Vorbereitung des Elektrolyten ohne Zusatz (300 mL)
- Einen Becher 20,595 g der MSA (70 %) hinzufügen. Den gleichen Becher 150 mL der vorbereiteten 1 M Blei Methanesulfonate hinzufügen.
- Fügen Sie DI-Wasser um 300 mL Gesamtvolumen zu erreichen und den Elektrolyten bis gleichmäßig vermischt, die Ergebnisse in einer Lösung von 0,5 M Blei Methanesulfonate mit 0,5 M MSA gemischt Rühren hinzu.
-
Vorbereitung der Elektrolyt mit Natriumacetat (300 mL)
- Einen Becher 20,595 g der MSA (70 %) hinzufügen. Den gleichen Becher 150 mL der vorbereiteten 1 M Blei Methanesulfonate hinzufügen.
- Das Becherglas 1,23 g NaOAc (98 %) als additive Agent hinzufügen.
- Fügen Sie DI-Wasser um 300 mL Gesamtvolumen zu erreichen und den Elektrolyten bis gleichmäßig vermischt, die Ergebnisse in einer Lösung von 0,5 M Blei Methanesulfonate, 0,5 M Methanesulfonic Säure und 50 mM Natriumacetat Rühren hinzu.
-
Vorbehandlung der positiven und negativen Elektroden
- Immer wieder polieren das Positive (kommerzielle Carbon-Composite) und negative (Nickel) Elektroden mit einem Schleifpapier (Aluminiumoxid, P100) bis keine sichtbaren Verunreinigungen sind links und Elektroden mit VE-Wasser nachspülen.
- 20,83 g Chlorwasserstoff (35 %) in 200 mL DI Wasser und rühren Sie die Lösung, bis alle der Chlorwasserstoff wird aufgelöst.
- Tauchen Sie die gesamte positive Elektrode in die fertige 1 M Chlorwasserstoff Lösung über Nacht um Verunreinigungen an der Elektrodenoberfläche zu entfernen.
- Spülen Sie die positive Elektrode mit VE-Wasser gründlich und trocknen Sie die Elektrode mit heiklen Aufgabe Scheibenwischer. Band einer Seite jeder Elektrode mit Polytetrafluorethylen (PTFE) Band während der Freilegung der anderen Seite der Elektroden.
- Bereiten Sie eine andere Lösung mit 3,03 g Kaliumnitrat (99 %) und 300 mL DI-Wasser, die Ergebnisse in eine Lösung von 0,1 M Kaliumnitrat.
- Tauchen Sie die positiven und negativen Elektroden in 0,1 M Kaliumnitrat mit die freiliegende Oberfläche vor jeder Elektrode.
- Die positive Elektrode für 5 min ein Potenzial von 1,80 V vs. Ag/AgCl zuweisen. Anschließend wenden Sie ein Potential von -1,0 V vs. Ag/AgCl an der positiven Elektrode 2 min. lang.
-
Montieren die SLFB Becher-Zelle
- Ein hausgemachter Elektrode Positionierung Board für einen festen Elektrodenabstand der vorbehandelten positiven und negativen Elektroden zuordnen. Setzen Sie die Positionierung Platine zusammen mit Elektroden in ein Becherglas wie in Abbildung 1 schematisch dargestellt und den Becher fügen Sie Elektrolyt hinzu, bis die dafür vorgesehenen Ebene eintauchen.
- Legen Sie ein Magnetrührer in das Becherglas, positionieren Sie das Becherglas auf einer heißen Platte und Steuern Sie die rotierende Rührer. Schließen Sie der Batterietester an den Elektroden an und decken Sie die Becher-Zelle mit Plastikfolie um Verdunstung zu verhindern.
-
Berechnen Sie den Wirkungsgrad der Batterie
- Berechnen Sie nach Galvanostatic laden / entladen die Leistung des Akkus wie folgt:
Coulomb Effizienz: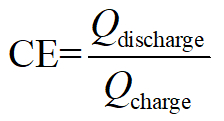
Spannung Effizienz: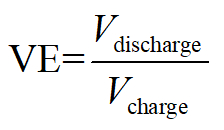
Energieeffizienz:
Hier bezeichnet Q Coulomb entspricht Elektronen geladen/entladen, V anwenden/Ausgangsspannung und E die Gesamtenergie gespeichert/verbraucht.
- Berechnen Sie nach Galvanostatic laden / entladen die Leistung des Akkus wie folgt:
2. werfen Index Messung
Hinweis: Dieser Abschnitt beschreibt das Verfahren zur Messung der werfende Index (TI) des Electrodeposit an positiven Elektroden in SLFB Zellen. Rückwärtsfahren die Rolle der positiven und negativen Elektroden, liefert die andere Gruppe von TI Ergebnisse. Hier wird TI untersucht mit Hilfe einer selbst gebastelten Haring-Blum-Zelle wie schematisch in Abbildung 2dargestellt.
-
Messung
- Weigh und nimmt zwei positiven Elektroden bzw. vor den versuchen.
- Stellen Sie die negative Elektrode in den Mittelpunkt einer Haring-Blum-Zelle und einer positiven Elektrode im Verhältnis Entfernung 1 von der negativen Elektrode. Legen Sie die zweite positive Elektrode in einem anderen Abstand Verhältnis von der negativen Elektrode (Take 6 als Beispiel in Abbildung 2).
- Tauchen Sie die beiden positiven Elektroden und einer negativen Elektrode mit der gleichen eingetaucht Fläche (2 cm2 hier) in der Haring-Blum-Zelle mit dem Elektrolyten von Interesse.
- Wenden Sie eine kontrollierte Stromdichte (20 mA·cm-2 hier) an den Elektroden mithilfe eines Batterie-Testers an. Führen Sie die Galvanostatic-Gebühr für einen bestimmten Zeitraum (hier 30 min).
- Spülen Sie nach der Beschichtung die beiden positiven Elektroden mit VE-Wasser und über Nacht bei Zimmertemperatur trocknen.
- Wiegen und wieder jeweils zwei positiven Elektroden aufnehmen und die Metall Ausschüttungsquote (MDR) gemäß der unten aufgeführten Gleichung zu berechnen.
- Wiederholen Sie die oben genannten Experimente indem die zweite positive Elektrode an verschiedenen Verhältnissen in Luftlinie (LR), die TI-Diagramm (variiert von 6 zu 1 hier) zu erwerben.
-
Berechnung
- Als Beispiel betrachten die Anode als die Elektrode von Interesse, und bestimmen alle Daten auf dem TI-Diagramm durch die gemessenen MDR gegen LR, die wie folgt berechnet werden:
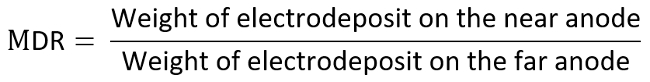
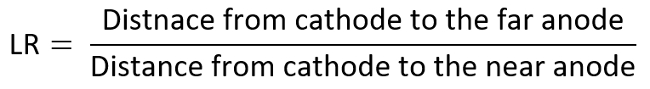
- Als Beispiel betrachten die Anode als die Elektrode von Interesse, und bestimmen alle Daten auf dem TI-Diagramm durch die gemessenen MDR gegen LR, die wie folgt berechnet werden:
3. SEM Probenvorbereitung
- Die Graphitelektrode mit VE-Wasser spülen und Trocknen bei Raumtemperatur nach Galvanik.
- Slice-Graphit-Elektroden in die gewünschte Stichprobengröße von Diamond sah mit Sorgfalt. Kälte die Elektrode Probe zu montieren und dann mechanisch Polieren mit 14, 8 und 3 μm Siliciumcarbid Sand Papiere, anschließend.
- Weiter Polieren der Proben mit 1 μm Diamantsuspensionen und 0,05 μm Al2O3. Einzahlung der kalten montierte Probe mit Platin und befestigen Sie es mit Kupfer Bänder, Leitfähigkeit für SEM Beobachtung zu gewährleisten.
Ergebnisse
Um die Lebensdauer des SLFBs zu verlängern, wird NaOAc als Additiv Elektrolyt geliefert. Leistung des SLFBs mit und ohne Additiv NaOAc Radfahren parallel untersucht und Ergebnisse sind in Abbildung 3dargestellt. Für einfachere quantitativen Vergleich der Lebensdauer definieren wir den "Tod" des SLFB als wenn seine CE weniger als 80 % unter kontinuierlicher Galvanostatic Lade/Entlade ist. Abbildung 3a und 3 b ze...
Diskussion
Dieser Beitrag beschreibt ein wirtschaftliches Verfahren zur Verlängerung der Lebensdauer der SLFBs: durch den Einsatz von NaOAc Agent als Elektrolyt Additiv. Eine Charge von frisch Graphitelektroden und Nickel Platten sind wie bereits erwähnt, in Schritt 1 vor Radsport Langzeitexperimente vorverarbeitet. Da Inkonsistenz zwischen kommerziellen Kohleelektroden Leistung Abweichung von der SLFBs führen kann, ist die physikalisch/chemische Vorbehandlung in Schritt 1.4 entscheidend für Oberfläche Rückstände zu entferne...
Offenlegungen
Wir haben nichts zu veröffentlichen.
Danksagungen
Diese Arbeit wurde unterstützt durch das Ministerium für Wissenschaft und Technologie, r.o.c., unter der Finanzierung zahlreicher NSC 102-2221-E-002 - 146-, die meisten 103-2221-E-002 - 233- und die meisten 104-2628-E-002-016-MY3.
Materialien
| Name | Company | Catalog Number | Comments |
| 70 mm cellulose filter paper | Advance | ||
| Autolab | Metrohm | PGSTA302N | |
| BT-Lab | BioLogic | BCS-810 | |
| commercial carbon composite electrode | Homy Tech,Taiwan | Density 1.75 g cm-3, and electrical conductivity 330 S cm-1 | |
| Diamond saw | Buehler | ||
| Hydrochloric Acid | SHOWA | 0812-0150-000-69SW | 35% |
| Lead (II) Oxide | SHOWA | 1209-0250-000-23SW | 98% |
| Lutropur MSA | BASF | 50707525 | 70% |
| nickel plate | Lien Hung Alloy Trading Co., LTD., Taiwan, | 99% | |
| Potassium Nitrate | Scharlab | 28703-95 | 99% |
| Scanning electron microscopy | JEOL | JSM-7800F | at accelerating voltage of 15 kV |
| Sodium Acetate | SHOWA | 1922-5250-000-23SW | 98% |
| water purification system | Barnstead MicroPure | 18.2 MΩ • cm |
Referenzen
- Soloveichik, G. L. Flow batteries: current status & trends. Chemical Reviews. 115 (20), 11533-11558 (2015).
- Ravikumar, M. K., Rathod, S., Jaiswal, N., Patil, S., Shukla, A. The renaissance in redox flow batteries. Journal of Solid State Electrochemistry. 21 (9), 2467-2488 (2017).
- Hazza, A., Pletcher, D., Wills, R. A novel flow battery: A lead acid battery based on an electrolyte with soluble lead (II) Part I. Preliminary studies. Physical Chemistry Chemical Physics. 6 (8), 1773-1778 (2004).
- Pletcher, D., Wills, R. A novel flow battery: A lead acid battery based on an electrolyte with soluble lead (II) Part II. Flow cell studies. Physical Chemistry Chemical Physics. 6 (8), 1779-1785 (2004).
- Pletcher, D., Wills, R. A novel flow battery-a lead acid battery based on an electrolyte with soluble lead (II). III. The influence of conditions on battery performance. Journal of Power Sources. 149, 96-102 (2005).
- Hazza, A., Pletcher, D., Wills, R. A novel flow battery-a lead acid battery based on an electrolyte with soluble lead (II). IV. The influence of additives. Journal of Power Sources. 149, 103-111 (2005).
- Pletcher, D., Zhou, H., Kear, G., Low, C. T. J., Walsh, F. C., Wills, R. G. A. A novel flow battery-A lead-acid battery based on an electrolyte with soluble lead (II). V. Studies of the lead negative electrode. Journal of Power Sources. 180 (1), 621-629 (2008).
- Pletcher, D., Zhou, H., Kear, G., Low, C. T. J., Walsh, F. C., Wills, R. G. A. A novel flow battery-A lead-acid battery based on an electrolyte with soluble lead (II). Part VI. Studies of the lead dioxide positive electrode. Journal of Power Sources. 180 (1), 630-634 (2008).
- Li, X., Pletcher, D., Walsh, F. C. A novel flow battery: a lead acid battery based on an electrolyte with soluble lead (II). Part VII. Further studies of the lead dioxide positive electrode. Electrochimica Acta. 54 (20), 4688-4695 (2009).
- Krishna, M., Fraser, E. J., Wills, R. G. A., Walsh, F. C. Developments in soluble lead flow batteries and remaining challenges: An illustrated review. Journal of Energy Storage. 15, 69-90 (2018).
- Lin, Y. -. T., Tan, H. -. L., Lee, C. -. Y., Chen, H. -. Y. Stabilizing the electrodeposit-electrolyte interphase in soluble lead flow batteries with ethanoate additive. Electrochimica Acta. 263, 60-67 (2018).
- Oury, A., Kirchev, A., Bultel, Y., Chainet, E. PbO2/Pb2+ cycling in methanesulfonic acid and mechanisms associated for soluble lead-acid flow battery applications. Electrochimica Acta. 71, 140-149 (2012).
- Oury, A., Kirchev, A., Bultel, Y. Potential response of lead dioxide/Lead (II) galvanostatic cycling in methanesulfonic acid: a morphologico-kinetics interpretation. Journal of The Electrochemical Society. 160 (1), A148-A154 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten