È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Estendere la durata delle batterie di flusso dei Lead solubile con un additivo di acetato di sodio
In questo articolo
Riepilogo
Un protocollo per la costruzione di una batteria di flusso di piombo solubile con una durata della vita estesa, in cui sodio acetato è fornito nell'elettrolita metansulfonico come additivo, è presentato.
Abstract
In questo rapporto, presentiamo un metodo per la costruzione di una batteria di flusso di piombo solubile (SLFB) con un lungo ciclo di vita. Fornendo un'adeguata quantità di acetato di sodio (NaOAc) all'elettrolita, un prolungamento della vita di ciclo di oltre il 50% è dimostrata per SLFBs tramite esperimenti a lungo termine di carica/Scarica galvanostatici. Una qualità superiore del PbO2 electrodeposit presso l'elettrodo positivo è quantitativamente convalidata per elettrolita aggiunto NaOAc gettando misurazioni indice (TI). Immagini acquisite da microscopia elettronica (SEM) presentano anche più integrato PbO2 morfologia superficiale quando il SLFB è operato con l'elettrolito NaOAc-aggiunto. Questo lavoro indica che modifica di elettrolita può essere un itinerario plausibile per abilitare economicamente SLFBs per accumulo di energia su larga scala.
Introduzione
Vento e fonti rinnovabili tra cui solare sono state sviluppate per decenni, ma la loro natura intermittente pone grandi sfide. Per una griglia di potere futuro con fonti di energia rinnovabili integrate, stabilizzazione di griglia e livellamento del carico sono fondamentali e possono essere raggiunti integrando immagazzinamento dell'energia. Batterie di flusso redox (RFBs) sono una delle opzioni promettenti per stoccaggio di energia di griglia-scala. RFBs tradizionali contengono membrane iono-selettivi che separa l'anolyte e catolita; ad esempio, la RFB tutti-vanadio ha dimostrato di operare con alta efficienza e un lungo ciclo vita1,2. Tuttavia, la loro quota di mercato come stoccaggio di energia è molto limitato in parte a causa di materiali composto da costoso e inefficace membrane iono-selettivi. D'altra parte, una batteria di flusso di flusso semplice piombo solubile (SLFB) è presentata da Plectcher et al. 1 , 2 , 3 , 4 , 5. the SLFB è membrana-di meno perché ha solo una specie attive, Pb(II) ioni. PB(II) ioni sono elettrolitico all'elettrodo positivo come PbO2 e l'elettrodo negativo come Pb simultaneamente durante la carica e convertire in Pb(II) durante la scarica. Così, un SLFB ha bisogno di una circolazione pompa e serbatoio di stoccaggio dell'uno elettrolito solo, che a sua volta può potenzialmente portare a capitale ridotto e costi di esercizio rispetto ai convenzionali RFBs. La vita di ciclo pubblicato di SLFBs, tuttavia, è finora limitata a meno di 200 cicli sotto flusso normale condizioni6,7,8,9,10.
Fattori che conducono ad una breve vita di ciclo SLFB sono preliminarmente associati con deposizione/dissoluzione di PbO2 presso l'elettrodo positivo. Durante i processi di carica/Scarica, l'acidità dell'elettrolito è trovata per aumentare più profonda o ripetuti cicli11, e protoni sono suggerite per indurre la generazione di uno strato di passivazione non stechiometrico PbOx12, 13. lo spargimento di PbO2 è un altro fenomeno legato alla degradazione di SLFB. Capannone PbO2 particelle sono irreversibili e non è più utilizzabile. L'efficienza coulombic (CE) di SLFBs di conseguenza declina a causa reazioni elettrochimiche squilibrate come pure electrodeposits accumulati presso entrambi gli elettrodi. Per estendere il ciclo di vita di SLFBs, stabilizzare il pH fluttuazione ed electrodeposit struttura sono fondamentali. Una carta recente dimostra un prestazioni migliorate e un esteso ciclo di vita di SLFBs con aggiunta di acetato di sodio (NaOAc) in metansulfonico elettrolita11.
Qui, un protocollo dettagliato per impiegare NaOAc come additivo per l'elettrolito metansulfonico in SLFBs è descritto. Le prestazioni di SLFB sono indicata per essere migliorata e la durata della vita può essere esteso oltre il 50% rispetto ai SLFBs senza additivi NaOAc. Inoltre, le procedure per il lancio di misura dell'indice (TI) sono illustrate ai fini del confronto quantitativo di effetti additivi elettrodeposizione. Infine, è descritto il metodo di preparazione del campione scansione microscopia elettronica (SEM) per electrodeposit su elettrodi SLFB e l'additivo impatto sulla electrodeposit si manifesta nelle immagini acquisite.
Protocollo
1. costruzione di una cella di Beaker SLFB con un additivo di acetato di sodio
Nota: Questa sezione descrive la procedura per costruire una cella di Becher SLFB con un additivo per esperimento a lungo termine in bicicletta. Il protocollo prevede la preparazione di elettroliti con e senza additivo, il pretrattamento dell'elettrodo, gruppo della cella e calcoli di efficienza.
-
Preparazione di piombo methanesulfonate (1 L, 1 M come esempio)
- In cappa, aggiungere 274,6 g di Acido metansulfonico (MSA, 70%) in un becher mescolando con un'ancoretta. Sciogliere il MSA con 300 mL di acqua deionizzata (DI).
- Preparare 223,2 g di ossido di piombo (II) (98%) e aggiungere in incrementi becher di cui sopra fino a quando l'ossido di piombo preparati è completamente sciolto.
- Filtrare attraverso il filtro Büchner con 70 mm cellulosa carta da filtro per separare qualsiasi ossido di piombo non disciolto.
- Ripetere questa procedura per 3 volte. Aggiungere dell'acqua distillata per raggiungere 1 L di volume totale.
-
Preparazione dell'elettrolita senza additivo (300 mL)
- Aggiungi 20,595 g di MSA (70%) in un becher. Aggiungere 150 mL di preparato 1 M piombo methanesulfonate Becher stesso.
- Aggiungere dell'acqua distillata per raggiungere 300 mL in volume totale e mescolare l'elettrolita fino a uniformemente miscelati, che risultati in una soluzione di 0,5 M piombo methanesulfonate mescolati con 0,5 M MSA.
-
Preparazione dell'elettrolito con acetato di sodio (300 mL)
- Aggiungi 20,595 g di MSA (70%) in un becher. Aggiungere 150 mL di preparato 1 M piombo methanesulfonate Becher stesso.
- Aggiungere 1,23 g di NaOAc (98%) Becher come agente additivo.
- Aggiungere dell'acqua distillata per raggiungere 300 mL in volume totale e mescolare l'elettrolita fino a uniformemente miscelati, che si traduce in una soluzione di 50 millimetri di acetato di sodio, Acido metansulfonico 0,5 M e 0,5 M piombo methanesulfonate.
-
Pretrattamento degli elettrodi positivi e negativi
- Ripetutamente polacco il positivo (composito di carbonio commerciale) e negativi (nichel) elettrodi con una carta vetrata (ossido di alluminio, P100) fino a nessun impurità visibile sono a sinistra e poi risciacquare gli elettrodi con acqua DI.
- Aggiungere 20,83 g di cloruro di idrogeno (35%) in 200 mL DI acqua e mescolare la soluzione fino a quando tutto il cloruro di idrogeno è dissolto.
- Immergere l'elettrodo positivo intero a 1 M cloruro di idrogeno soluzione preparata durante la notte per rimuovere le impurità sulla superficie dell'elettrodo.
- Sciacquare l'elettrodo positivo accuratamente con acqua deionizzata e asciugare l'elettrodo con tergicristalli delicato compito. Un lato del nastro di ogni elettrodo con del nastro di politetrafluoroetilene (PTFE) mentre esponendo l'altro lato degli elettrodi.
- Preparare un'altra soluzione con 3,03 g di nitrato di potassio (99%) e 300 mL DI acqua, che si traduce in una soluzione di nitrato di potassio 0.1 M.
- Immergere gli elettrodi positivi e negativi in nitrato di potassio 0,1 M con la superficie esposta verso ciascun elettrodo.
- Applicare un potenziale di 1.80 V vs Ag/AgCl all'elettrodo positivo per 5 min. Successivamente, applicare un potenziale di -1,0 V vs Ag/AgCl all'elettrodo positivo per 2 min.
-
Montare il Cella SLFB Becher
- Collegare gli elettrodi positivi e negativi pretrattati per una tavola di posizionamento elettrodo fatto in casa per una distanza di elettrodo fisso. Posizionare la scheda posizionamento insieme con elettrodi in un becher come schematicamente illustrata nella Figura 1 e aggiungere elettrolita becher fino al raggiungimento del livello di immersione.
- Posizionare un agitatore magnetico nel becher, posizionare il bicchiere su un piatto caldo e controllare la velocità di rotazione dell'agitatore. Collegare il tester batteria agli elettrodi e coprire la cella di Becher con involucro di plastica per evitare l'evaporazione.
-
Calcolare l'efficienza della batteria
- Dopo ciclazioni carica e Scarica, calcolare l'efficienza della batteria come indicato di seguito:
Efficienza coulombic: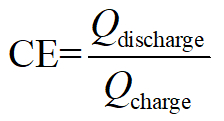
Efficienza di tensione: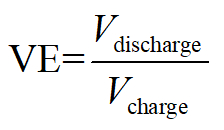
Efficienza energetica:
Qui, Q denota Coulomb di elettroni equivalenti cariche/scariche, V la tensione di uscita/applica ed E il totale memorizzato/consumo di energia.
- Dopo ciclazioni carica e Scarica, calcolare l'efficienza della batteria come indicato di seguito:
2. misura dell'indice di lancio
Nota: Questa sezione descrive la procedura per misurare l'indice lancio (TI) di electrodeposit a elettrodi positivi in cellule di SLFB. Il ruolo degli elettrodi positivi e negativi di retromarcia batte l'altro set di risultati di TI. Qui, TI è studiato utilizzando una cella di Haring-Blum fatta in casa come schematicamente rappresentata in Figura 2.
-
Misura
- Pesare e registrare due elettrodi positivi rispettivamente prima degli esperimenti.
- Posizionare l'elettrodo negativo al centro di una cella di Haring-Blum e un elettrodo positivo con un rapporto di distanza di 1 dall'elettrodo negativo. Posizionare l'elettrodo positivo secondo un altro rapporto di distanza dall'elettrodo negativo (take 6 come un esempio nella Figura 2).
- Immergere i due elettrodi positivi e un elettrodo negativo con la stessa immerso superficie (cm 22 qui) nella cella Haring-Blum con l'elettrolito di interesse.
- Applicare una densità di corrente controllata (20 mA·cm-2 qui) agli elettrodi utilizzando un tester per batterie. Effettuare la carica di galvanostatici per una certa durata (30 min qui).
- Dopo il placcaggio, sciacquare i due elettrodi positivi con dell'acqua distillata e asciugare a temperatura ambiente durante la notte.
- Pesare e registrare nuovamente rispettivamente due elettrodi positivi e calcolare il rapporto di distribuzione del metallo (MDR) secondo l'equazione elencato di seguito.
- Ripetere gli esperimenti di cui sopra inserendo il secondo elettrodo positivo a vari rapporti di distanza lineare (LR) per acquisire il diagramma di TI (variato da 6 a 1 qui).
-
Calcolo
- Ad esempio, considerano l'anodo l'elettrodo di interesse e determinare ogni tecnica relativa al diagramma TI dal misurato MDR contro LR, che sono calcolati come indicato di seguito:
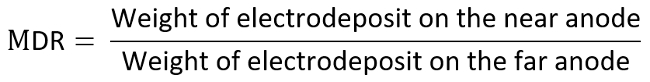
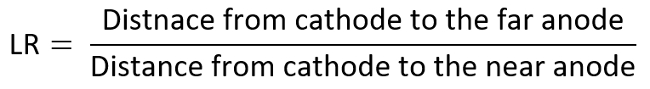
- Ad esempio, considerano l'anodo l'elettrodo di interesse e determinare ogni tecnica relativa al diagramma TI dal misurato MDR contro LR, che sono calcolati come indicato di seguito:
3. preparazione del campione SEM
- Sciacquare l'elettrodo di grafite con dell'acqua distillata e asciugare a temperatura ambiente dopo galvanica.
- Elettrodi di grafite di fetta nella dimensione del campione desiderato dal diamante visto con cura. Freddo inserire il campione di elettrodo e poi meccanicamente lucidare con 14, 8 e 3 μm in carburo di silicio sabbia paper, successivamente.
- Ulteriori polacco i campioni con 1 μm diamante sospensione e 0,05 μm Al2O3. Depositare il campione freddo-montato con platino e fissare il tutto con nastri di rame per assicurare la conducibilità per osservazione SEM.
Risultati
Per estendere il ciclo di vita di SLFBs, NaOAc è fornito come un elettrolita additivo. Prestazioni di SLFBs con e senza NaOAc additivo di ciclismo sono esaminati in parallelo, e risultati sono mostrati in Figura 3. Per un più facile confronto quantitativo di ciclo di vita, definiamo la "morte" di un SLFB come quando suo CE è inferiore a 80% sotto continuo ciclazioni carica/scarica. Figura 3a e 3b mostrano che ...
Discussione
Questo articolo descrive un metodo economico per prolungare la durata del ciclo di SLFBs: impiegando NaOAc agente come elettrolito additivo. Una serie di elettrodi di grafite fresco e piastre del nichel sono pre-elaborato come citato nel passaggio 1 prima di esperimenti a lungo termine in bicicletta. Perché un'incoerenza tra gli elettrodi di carbonio commerciali potrebbe causare deviazioni di prestazioni della SLFBs, il pretrattamento chimico/fisiche in passo 1.4 è fondamentale per rimuovere residui di superficie. La s...
Divulgazioni
Non abbiamo nulla di divulgare.
Riconoscimenti
Questo lavoro è stato supportato dal Ministero della scienza e della tecnologia, r.o.c., sotto il numero finanziamento di NSC 102-2221-E-002 - 146-, la maggior parte delle 103-2221-E-002 - 233 - e la maggior parte delle 104-2628-E-002-016-MY3.
Materiali
| Name | Company | Catalog Number | Comments |
| 70 mm cellulose filter paper | Advance | ||
| Autolab | Metrohm | PGSTA302N | |
| BT-Lab | BioLogic | BCS-810 | |
| commercial carbon composite electrode | Homy Tech,Taiwan | Density 1.75 g cm-3, and electrical conductivity 330 S cm-1 | |
| Diamond saw | Buehler | ||
| Hydrochloric Acid | SHOWA | 0812-0150-000-69SW | 35% |
| Lead (II) Oxide | SHOWA | 1209-0250-000-23SW | 98% |
| Lutropur MSA | BASF | 50707525 | 70% |
| nickel plate | Lien Hung Alloy Trading Co., LTD., Taiwan, | 99% | |
| Potassium Nitrate | Scharlab | 28703-95 | 99% |
| Scanning electron microscopy | JEOL | JSM-7800F | at accelerating voltage of 15 kV |
| Sodium Acetate | SHOWA | 1922-5250-000-23SW | 98% |
| water purification system | Barnstead MicroPure | 18.2 MΩ • cm |
Riferimenti
- Soloveichik, G. L. Flow batteries: current status & trends. Chemical Reviews. 115 (20), 11533-11558 (2015).
- Ravikumar, M. K., Rathod, S., Jaiswal, N., Patil, S., Shukla, A. The renaissance in redox flow batteries. Journal of Solid State Electrochemistry. 21 (9), 2467-2488 (2017).
- Hazza, A., Pletcher, D., Wills, R. A novel flow battery: A lead acid battery based on an electrolyte with soluble lead (II) Part I. Preliminary studies. Physical Chemistry Chemical Physics. 6 (8), 1773-1778 (2004).
- Pletcher, D., Wills, R. A novel flow battery: A lead acid battery based on an electrolyte with soluble lead (II) Part II. Flow cell studies. Physical Chemistry Chemical Physics. 6 (8), 1779-1785 (2004).
- Pletcher, D., Wills, R. A novel flow battery-a lead acid battery based on an electrolyte with soluble lead (II). III. The influence of conditions on battery performance. Journal of Power Sources. 149, 96-102 (2005).
- Hazza, A., Pletcher, D., Wills, R. A novel flow battery-a lead acid battery based on an electrolyte with soluble lead (II). IV. The influence of additives. Journal of Power Sources. 149, 103-111 (2005).
- Pletcher, D., Zhou, H., Kear, G., Low, C. T. J., Walsh, F. C., Wills, R. G. A. A novel flow battery-A lead-acid battery based on an electrolyte with soluble lead (II). V. Studies of the lead negative electrode. Journal of Power Sources. 180 (1), 621-629 (2008).
- Pletcher, D., Zhou, H., Kear, G., Low, C. T. J., Walsh, F. C., Wills, R. G. A. A novel flow battery-A lead-acid battery based on an electrolyte with soluble lead (II). Part VI. Studies of the lead dioxide positive electrode. Journal of Power Sources. 180 (1), 630-634 (2008).
- Li, X., Pletcher, D., Walsh, F. C. A novel flow battery: a lead acid battery based on an electrolyte with soluble lead (II). Part VII. Further studies of the lead dioxide positive electrode. Electrochimica Acta. 54 (20), 4688-4695 (2009).
- Krishna, M., Fraser, E. J., Wills, R. G. A., Walsh, F. C. Developments in soluble lead flow batteries and remaining challenges: An illustrated review. Journal of Energy Storage. 15, 69-90 (2018).
- Lin, Y. -. T., Tan, H. -. L., Lee, C. -. Y., Chen, H. -. Y. Stabilizing the electrodeposit-electrolyte interphase in soluble lead flow batteries with ethanoate additive. Electrochimica Acta. 263, 60-67 (2018).
- Oury, A., Kirchev, A., Bultel, Y., Chainet, E. PbO2/Pb2+ cycling in methanesulfonic acid and mechanisms associated for soluble lead-acid flow battery applications. Electrochimica Acta. 71, 140-149 (2012).
- Oury, A., Kirchev, A., Bultel, Y. Potential response of lead dioxide/Lead (II) galvanostatic cycling in methanesulfonic acid: a morphologico-kinetics interpretation. Journal of The Electrochemical Society. 160 (1), A148-A154 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon