JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
나트륨 아세테이트 첨가제와 함께 수용 성 리드 흐름 배터리의 수명 연장
요약
나트륨에서 아세테이트는 첨가제로 methanesulfonic 전해질에서 제공 된 확장 된 수명으로 녹는 리드 흐름 배터리의 건설에 대 한 프로토콜 제공 됩니다.
초록
이 보고서에서 우리 확장된 사이클 인생 성 리드 흐름 배터리 (SLFB)의 건설 하는 방법을 제시. 적절 한 양의 전해질에 아세트산 나트륨 (NaOAc)를 제공 하 여 사이클 수명 연장 50% 이상의 장기 galvanostatic 충전/방전 실험을 통해 SLFBs에 대 한 시연입니다. 긍정적인 전극에서 PbO2 electrodeposit의 높은 품질은 양적 인덱스 (TI) 측정을 throw 하 여 NaOAc 추가 된 전해질에 대 한 유효성 검사. 이미지 스캐닝 전자 현미경 (SEM) 의해 인수는 SLFB NaOAc 추가 된 전해질에와 함께 작동 하면 또한 통합된 PbO2 표면 형태를 전시 한다. 이 작품 전해질 수정 경제적으로 SLFBs 수 있도록 대규모 에너지 저장에 대 한 그럴듯한 경로 수 나타냅니다.
서문
바람과 태양 열 등 신 재생 에너지 소스, 수십 년 동안 개발 되었습니다 하지만 그들의 간헐적인 자연 큰 도전 포즈. 신 재생 에너지 소스 통합 미래 파워 그리드에 대 한 그리드 안정화 부하 평준화 중요 한 고 에너지 저장을 통합 하 여 달성 될 수 있다. Redox 흐름 배터리 (RFBs) 격자 규모 에너지 저장을 위한 유망한 옵션 중 하나입니다. 전통적인 RFBs 포함 anolyte 그리고 catholyte; 분리 이온 선택적 막 예를 들어 모든 바나듐 RFB 높은 효율으로 작동 하도록 것으로 나타났습니다 그리고 긴 사이클 인생1,2. 그러나, 에너지 저장으로 그들의 시장 점유율은 매우 비싼 구성 재료와 효과 이온 선택적 막 때문에 제한 됩니다. 다른 한편으로, 단일 흐름 성 리드 흐름 배터리 (SLFB) Plectcher 그 외 여러분 에 의해 제공 됩니다. 1 , 2 , 3 , 4 , 5. the SLFB는 막 덜 단 하나의 활성 종, Pb(II) 이온을가지고 있기 때문에. Pb(II) 이온은 전기 긍정적인 전극에서 PbO2 및 부정적인 전극으로 Pb로 동시에 충전 하는 동안 하 고 방전 하는 동안 Pb(II)을 다시 변환. SLFB는 따라서 하나의 순환 펌프 및 1 개의 전해액 저장 탱크만, 차례로 이어질 수 있는 잠재적으로 감소 된 자본 및 운영 비용을 기존의 RFBs에 비해 필요 합니다. 그러나, SLFBs의 게시 주기 생활은 정상적인 흐름 조건6,7,8,,910에서 200 미만 사이클 제한까지.
짧은 SLFB 주기 생활을 선도 하는 요인 예비 PbO2 긍정적인 전극에서의 증 착/해체와 연결 됩니다. 충전/방전 과정 동안 전해질 산 깊은 또는 반복 주기11, 증가를 발견 하 고 양성자 제안 비 화학 량 론 PbOx12, 의 패 시 베이 션 층의 생성을 유도 하 고 13. SLFB 저하와 관련 된 또 다른 현상은 이다 PbO2 흘리기. 창 고 PbO2 입자 돌이킬 수 없습니다 및 더 이상 이용 될 수 있다. SLFBs의 coulombic 효율 (CE) consequentially 불균형 전기 화학 반응으로 두 전극에 축적 된 electrodeposits 때문에 거절합니다. SLFBs, pH 안정화의 사이클 수명을 연장 변동 및 electrodeposit 구조는 중요 합니다. 최근 종이 향상 된 성능 및 확장된 주기 생활 SLFBs의 나트륨 아세테이트 (NaOAc) methanesulfonic 전해질11의 추가 함께 보여 줍니다.
여기, SLFBs에 methanesulfonic 전해질에 첨가물으로 NaOAc를 고용에 대 한 상세한 프로토콜을 설명 합니다. SLFB 성능 향상 된 표시 됩니다 하 고 수명을 NaOAc 첨가물 없이 SLFBs에 비해 50% 이상으로 확장할 수 있습니다. 또한, 인덱스 (TI) 측정을 던지고에 대 한 절차는 electrodeposition에 첨가제 효과의 양적 비교 목적으로 그림. 마지막으로, SLFB 전극에 electrodeposit에 대 한 스캐닝 전자 현미경 (SEM) 샘플 준비 방법 설명 하 고 electrodeposit에 첨가제 영향 획득된 이미지에 나타나 신입니다.
프로토콜
1. 나트륨 아세테이트 첨가제와 SLFB 비 커 셀의 건설
참고:이 섹션에서는 장기 순환 실험에 대 한 첨가제와 SLFB 비 커 셀을 구성 하는 절차를 설명 합니다. 프로토콜에는 전해질 준비와 첨가제, 전극 전처리, 셀 어셈블리 및 효율 계산 없이 포함 되어 있습니다.
-
리드 methanesulfonate (1 리터, 예를 들어 1 M)의 준비
- 증기 두건에서 저 어 바 교 반 비 커를 274.6 g methanesulfonic 산 (MSA, 70%)를 추가 합니다. MSA 이온된 (DI) 물 300 mL를 용 해.
- 납 (II) 산화물 (98%)의 223.2 g를 준비 하 고 준비 납 산화물은 완전히 용 해 될 때까지 위에서 언급 한 비 커에 단위로 추가.
- 모든 소화 납 산화물을 70 m m 룰 필터 종이와 Büchner 퍼 널을 통해 필터링.
- 3 번이 절차를 반복 합니다. 총 볼륨에서 1 리터를 도달 하 디 물을 추가 합니다.
-
첨가제 (300ml) 없이 전해질의 준비
- 비 커에 MSA (70%)의 20.595 g을 추가 합니다. 같은 비 커를 준비 1 M 리드 methanesulfonate의 150 mL를 추가 합니다.
- 300 mL 전체 볼륨에 도달 하 고 0.5 M 리드 methanesulfonate의 솔루션에서 결과 0.5 m MSA 혼합 전해질 균일 하 게 혼합 때까지 저 어 디 물을 추가 합니다.
-
준비 나트륨 아세테이트 (300 mL)와 전해질의
- 비 커에 MSA (70%)의 20.595 g을 추가 합니다. 같은 비 커를 준비 1 M 리드 methanesulfonate의 150 mL를 추가 합니다.
- 1.23 g NaOAc (98%)의 비 커에 첨가제 에이전트 추가.
- 300 mL 전체 볼륨에 도달 하 고 전해질까지 균일 하 게 혼합, 0.5 M 리드 methanesulfonate, 0.5 M methanesulfonic 산, 및 50 mM 아세트산 나트륨의 솔루션에서 어떤 결과 저 어 디 물을 추가 합니다.
-
긍정적이 고 부정적인 전극의 전처리
- 반복적으로 긍정적인 (상업 탄소 합성) 폴란드어와 네거티브 (니켈) 사 포 (산화 알루미늄, P100) 아무 표시 불순물까지 함께 전극 남아 있으며 후 전극 디 물으로 린스.
- 200ml 디 물에 염화 수소 (35%)의 20.83 g를 추가 하 고 솔루션 염화 수소의 모두 해산 때까지 휘저어.
- 담가 준비 1 M 염화 수소 솔루션에 하룻밤 전극 표면에서 불순물을 제거 하는 전체 긍정적인 전극.
- 긍정적인 전극 디 물으로 깨끗이 린스 하 고 섬세 한 작업 퍼와 전극 건조. 테이프는 전극의 다른 측면을 노출 하면서 소계 (PTFE) 테이프를 사용 하 여 각 전극의 한쪽.
- 다른 솔루션 3.03 g 칼륨 질산염 (99%)의 준비와 300 mL 디 물 0.1 M 질 산 칼륨의 솔루션을.
- 각 전극에 직면 하는 노출 표면 0.1 M 질 산 칼륨에에서 긍정적이 고 부정적인 전극을 담가.
- 5 분에 대 한 긍정적인 전극에 1.80 V 대 Ag/AgCl의 잠재력을 적용 됩니다. 그 후, 적용-V 1.0의 잠재력 대 Ag/AgCl 2 분에 대 한 긍정적인 전극에.
-
조립 는 SLFB 비 커 셀
- 청소용된 긍정적이 고 부정적인 전극 고정된 전극 거리에 대 한 집에서 만든 전극 위치 보드에 연결 합니다. 개요로 그림 1 에서 그림으로 비 커에서 전극 함께 위치 보드를 놓고 침수의 지정 된 수준까지 비 커에 전해질을 추가 합니다.
- 비 커에는 자력을 배치, 뜨거운 접시에 비 커 놓고는 활동가의 회전 속도 제어 합니다. 배터리 테스터 전극에 연결 하 고 비 커 셀 증발을 방지 하기 위해 플라스틱 포장으로 커버.
-
배터리 효율 계산
- Galvanostatic 충전 및 방전 후 다음으로 배터리의 효율을 계산.
Coulombic 효율: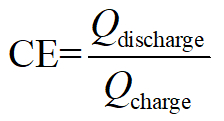
전압 효율: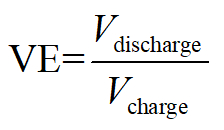
에너지 효율:
여기, Q 저장/소비 총 에너지를의 충전/방전 동등 전자, V 적용/출력 전압 및 E 트를 나타냅니다.
- Galvanostatic 충전 및 방전 후 다음으로 배터리의 효율을 계산.
2. 투사 지 수 측정
참고:이 섹션에서는 SLFB 셀에 긍정적인 전극에서 electrodeposit의 투사 인덱스 (TI)를 측정 하는 절차를 설명 합니다. 긍정적이 고 부정적인 전극의 역할을 반대로 TI 결과의 다른 세트를 제공 합니다. 여기, TI는 집에서 만든 링 블 룸 셀으로 개요로 그림 2에 표시를 사용 하 여 조사 하 고 있다.
-
측정
- 그리고 무게는 실험 전에 각각 2 개의 긍정적인 전극 기록.
- 부정적인 전극 링 블 룸 셀 및 부정적인 전극에서 1의 거리 비율에 1 개의 긍정적인 전극의 중심에 놓습니다. 부정적인 전극 ( 그림 2에서 예제로 받아 6)에서 다른 거리 비율에 두 번째 긍정적인 전극을 배치 합니다.
- 2 개의 긍정적인 전극 및 관심의 전해질으로 링 블 셀에 같은 털된 노출 영역 (2 cm2 자)와 하나의 부정적인 전극에 젖어.
- 배터리 테스터를 사용 하 여 전극에 제어 전류 밀도 (20 mA·cm-2 여기)를 적용 합니다. 특정 시간 (30 분 여기)에 대 한 galvanostatic 충전을 실시 합니다.
- 도금, 후 디 물으로 2 개의 긍정적인 전극 린스 하 고 하룻밤 실 온에서 건조.
- 무게와 다시 각각 2 개의 긍정적인 전극을 기록 하 고 아래에 나열 된 방정식에 따라 판매 비율 (MDR).
- 두 번째 긍정적인 전극 다양 한 선형 거리 비율 (LR) 취득 (6에서 1 여기에 변화 되는) TI 다이어그램에 배치 하 여 상기 실험을 반복 합니다.
-
계산
- 예를 들어, 관심, 전극으로 양극을 고려 하 고 결정 각 데이터는 측정 된 MDR 대 LR, 여 티 다이어그램에는 다음과 같이 계산 됩니다:
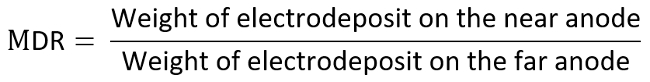
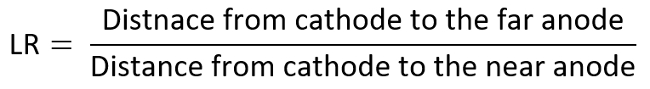
- 예를 들어, 관심, 전극으로 양극을 고려 하 고 결정 각 데이터는 측정 된 MDR 대 LR, 여 티 다이어그램에는 다음과 같이 계산 됩니다:
3. SEM 시료 준비
- 흑연 전극 디 물으로 린스 하 고 전기 도금 후 실 온에서 건조.
- 조각 흑연 전극 다이아몬드에 의해 원하는 샘플 크기에 관심을가지고 보았다. 감기 전극 샘플을 탑재 하 고 기계적으로 그것 폴란드 14, 8, 및 3 μ m 실리콘 탄 화물 모래 종이, 이후에.
- 추가 1 μ m 다이아몬드 펜션과 0.05 μ m Al2O3와 함께 샘플 폴란드어. 백 금 냉 탑재 샘플 보증금과 SEM 관찰에 대 한 전도성을 보장 하기 위해 구리 테이프와 그것을 연결.
결과
SLFBs의 사이클 수명을 연장, NaOAc 전해질 첨가제로 제공 됩니다. 병렬로, 검사는 자전거와 첨가제 NaOAc 없이 SLFBs의 성능 및 결과 그림 3에 나와 있습니다. 쉽게 주기 생활의 양적 비교를 위해 우리로 SLFB의 "죽음"를 정의 하는 때 그것의 CE는 연속 galvanostatic 충전/방전에서 80% 보다 낮은. 그림 3a 와 3b 쇼는 약 50% 주기는 S...
토론
이 문서에서는 설명 합니다 SLFBs의 사이클 수명을 연장 하는 경제적인 방법: 전해질 첨가제로 NaOAc 에이전트를 사용 하 여. 신선한 흑연 전극 및 니켈 플레이트의 배치는 장기 사이클 실험 하기 전에 1 단계에서에서 상기 전처리는. 상업적인 탄소 전극 사이 불일치는 SLFBs의 성능 편차를 발생할 수 있습니다, 때문에 물리/화학적 전처리 단계 1.4에서 표면 잔류물을 제거 하려면 중요 하다. 단계 1.4의 ?...
공개
공개 하는 것이 없다.
감사의 말
이 작품은 과학과 기술, R.O.C., NSC 102의 자금 수 아래에 의해 지원 되었다-2221-E-002-146-, 대부분 103-2221-E-002-233-, 그리고 대부분 104-2628-E-002-016-MY3.
자료
| Name | Company | Catalog Number | Comments |
| 70 mm cellulose filter paper | Advance | ||
| Autolab | Metrohm | PGSTA302N | |
| BT-Lab | BioLogic | BCS-810 | |
| commercial carbon composite electrode | Homy Tech,Taiwan | Density 1.75 g cm-3, and electrical conductivity 330 S cm-1 | |
| Diamond saw | Buehler | ||
| Hydrochloric Acid | SHOWA | 0812-0150-000-69SW | 35% |
| Lead (II) Oxide | SHOWA | 1209-0250-000-23SW | 98% |
| Lutropur MSA | BASF | 50707525 | 70% |
| nickel plate | Lien Hung Alloy Trading Co., LTD., Taiwan, | 99% | |
| Potassium Nitrate | Scharlab | 28703-95 | 99% |
| Scanning electron microscopy | JEOL | JSM-7800F | at accelerating voltage of 15 kV |
| Sodium Acetate | SHOWA | 1922-5250-000-23SW | 98% |
| water purification system | Barnstead MicroPure | 18.2 MΩ • cm |
참고문헌
- Soloveichik, G. L. Flow batteries: current status & trends. Chemical Reviews. 115 (20), 11533-11558 (2015).
- Ravikumar, M. K., Rathod, S., Jaiswal, N., Patil, S., Shukla, A. The renaissance in redox flow batteries. Journal of Solid State Electrochemistry. 21 (9), 2467-2488 (2017).
- Hazza, A., Pletcher, D., Wills, R. A novel flow battery: A lead acid battery based on an electrolyte with soluble lead (II) Part I. Preliminary studies. Physical Chemistry Chemical Physics. 6 (8), 1773-1778 (2004).
- Pletcher, D., Wills, R. A novel flow battery: A lead acid battery based on an electrolyte with soluble lead (II) Part II. Flow cell studies. Physical Chemistry Chemical Physics. 6 (8), 1779-1785 (2004).
- Pletcher, D., Wills, R. A novel flow battery-a lead acid battery based on an electrolyte with soluble lead (II). III. The influence of conditions on battery performance. Journal of Power Sources. 149, 96-102 (2005).
- Hazza, A., Pletcher, D., Wills, R. A novel flow battery-a lead acid battery based on an electrolyte with soluble lead (II). IV. The influence of additives. Journal of Power Sources. 149, 103-111 (2005).
- Pletcher, D., Zhou, H., Kear, G., Low, C. T. J., Walsh, F. C., Wills, R. G. A. A novel flow battery-A lead-acid battery based on an electrolyte with soluble lead (II). V. Studies of the lead negative electrode. Journal of Power Sources. 180 (1), 621-629 (2008).
- Pletcher, D., Zhou, H., Kear, G., Low, C. T. J., Walsh, F. C., Wills, R. G. A. A novel flow battery-A lead-acid battery based on an electrolyte with soluble lead (II). Part VI. Studies of the lead dioxide positive electrode. Journal of Power Sources. 180 (1), 630-634 (2008).
- Li, X., Pletcher, D., Walsh, F. C. A novel flow battery: a lead acid battery based on an electrolyte with soluble lead (II). Part VII. Further studies of the lead dioxide positive electrode. Electrochimica Acta. 54 (20), 4688-4695 (2009).
- Krishna, M., Fraser, E. J., Wills, R. G. A., Walsh, F. C. Developments in soluble lead flow batteries and remaining challenges: An illustrated review. Journal of Energy Storage. 15, 69-90 (2018).
- Lin, Y. -. T., Tan, H. -. L., Lee, C. -. Y., Chen, H. -. Y. Stabilizing the electrodeposit-electrolyte interphase in soluble lead flow batteries with ethanoate additive. Electrochimica Acta. 263, 60-67 (2018).
- Oury, A., Kirchev, A., Bultel, Y., Chainet, E. PbO2/Pb2+ cycling in methanesulfonic acid and mechanisms associated for soluble lead-acid flow battery applications. Electrochimica Acta. 71, 140-149 (2012).
- Oury, A., Kirchev, A., Bultel, Y. Potential response of lead dioxide/Lead (II) galvanostatic cycling in methanesulfonic acid: a morphologico-kinetics interpretation. Journal of The Electrochemical Society. 160 (1), A148-A154 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유