Method Article
Lumineszenz-Lebensdauer-Bildgebung von O2 mit einem Frequency-Domain-basierten Kamerasystem
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Wir beschreiben die Verwendung einer neuartigen, Frequenzbereichs-Lumineszenz-Lebensdauerkamera zur Kartierung von 2D O2-Verteilungen mit optischen Sensorfolien. Das Kamerasystem und die Bildanalyseverfahren werden zusammen mit der Vorbereitung, Kalibrierung und Anwendung von Sensorfolien zur Visualisierung der O 2-Mikroumgebung in der Rhizosphäre von Wasserpflanzen beschrieben.
Zusammenfassung
Wir beschreiben eine Methode, um gelösten Sauerstoff (O2), in 2D bei hoher räumlicher Auflösung (< 50-100 m) und zeitlicher (< 10 s) Auflösung abzubilden. Das Verfahren verwendet O2 empfindliche Leuchtsensorfolien (planare Optoden) in Kombination mit einem speziellen Kamerasystem zur Bildgebung der Lumineszenzlebensdauer im Frequenzbereich. Planare Optode werden durch Auflösen desO2-empfindlichenIndikatorfarbstoffs in einem Polymer und Das Streuen der Mischung auf einem festen Träger in einer definierten Dicke mittels Messerbeschichtung hergestellt. Nach der Verdunstung des Lösungsmittels wird die planare Optode in engem Kontakt mit der Interessenprobe gesetzt - hier demonstriert mit den Wurzeln der Wasserpflanze Littorella uniflora. Die konzentrationsabhängigeO2-Änderung der Lumineszenzlebensdauer des Indikatorfarbstoffs innerhalb des planaren Optods wird über die Rückseite der transparenten Trägerfolie und Aquarienwand mit einer speziellen Kamera abgebildet. Diese Kamera misst die Lumineszenzlebensdauer (s) über eine Verschiebung des Phasenwinkels zwischen einem modulierten Anregungssignal und einem Emissionssignal. Diese Methode ist den Bildgebungsverfahren der Lumineszenzintensität überlegen, da das Signal unabhängig von der Farbkonzentration oder -intensität der Anregungsquelle ist und sich ausschließlich auf die Lumineszenzzerfallszeit stützt, die ein intrinsisch referenzierter Parameter ist. Folglich ist kein zusätzlicher Referenzfarbstoff oder ein anderes Referenzmittel erforderlich. Wir demonstrieren den Einsatz des Systems zur makroskopischen O 2-Bildgebung von Pflanzenrhizosphären, aber das Kamerasystem lässt sich auch einfach an ein Mikroskop koppeln.
Einleitung
Die Verteilung und Dynamik von gelösten Gasen und Ionen in Sedimenten und Böden liefern wichtige Informationen über biogeochemische Prozesse wie mikrobielle Atmung1,2, oder radialen Sauerstoffverlust von Pflanzenwurzeln3,4,5, und die chemische Mikroumgebung von Mikroben6,7, Pflanzenrhizosphären5,8,9 und tierische Naschen10, 11,12. Biologische und chemische Aktivitäten in solchen diffusionsbegrenzten Umgebungen können zu steilen Gradienten chemischer Substrate oder Produkte biogeochemischer Prozesse führen. Insbesondere die O2-Verfügbarkeit hat einen großen Einfluss auf biogeochemische Prozesse und damit auf die Biologie und Ökologie eines Systems13. Daher ist die Analyse vonO2-Konzentrationen bei hoher räumlicher und zeitlicher Auflösung in den aquatischen und terrestrischen Wissenschaften von größter Bedeutung. Zunächst wurden elektrochemische und optische Mikrosensoren14,15 entwickelt, um diesen wichtigen Analyten zu messen. Später wurde die 2-dimensionale (2D) Bildgebung von O2 mit planaren Optoden12,16,17,18,19eingeführt, was die Visualisierung und Quantifizierung der heterogenenO2-Verteilung in Böden und Sedimenten ermöglichte.
Planare O2 Optode bestehen aus einemO2-empfindlichenIndikatorfarbstoff20, der in einem geeigneten Polymer21gelöst wird. Der Indikatorfarbstoff wird bei bestimmten optischen Wellenlängen angeregt und strahlt bei Entspannung in Form von Lumineszenz rot verschiebbares Licht aus. In Gegenwart von O2kann der angeregte Indikatorfarbstoff seine Energie bei einer Kollision auf dasO2-Molekül übertragen, das als kollisionsbasierte Lumineszenzabschreckung22bezeichnet wird. Daher werden die Lumineszenzintensität sowie die Lumineszenzlebensdauer mit zunehmenderO2-Konzentration 23reduziert. Im Idealfall folgt die Änderung der Intensität und Lebensdauer der Stern-Volmer-Gleichung (Gleichung 1) unter Verwendung der Lumineszenzintensität oder der Lebensdauer in Abwesenheit (I0;0) oder der Anwesenheit (I, b) von O2 bei einer gegebenen Konzentration [Q]. Die Stern-Volmer-Konstante (Ksv) ist ein Maß für die Empfindlichkeit der Optode gegenüber O2; KSV ist abhängig von Umweltvariablen wie Temperatur und Druck.
(1)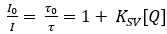
Die Aufzeichnung solcher Lumineszenzänderungen über eine planare Sensorfolie mit einem Kamerasystem kann verwendet werden, um die entsprechenden Änderungen in der O2-Verteilung zu visualisieren. Zunächst wurde eine einfache Lumineszenzintensitäts-basierte O 2-Bildgebung verwendet18. Eine solche Methode ist jedoch sehr empfindlich gegenüber äußeren Interferenzen, die die Zuverlässigkeit der Ergebnisse durch heterogene Beleuchtung, Schwankungen in der Anregungsquelle oder Kamera sowie eine ungleichmäßige Verteilung des Indikatorfarbstoffs innerhalb des planaren Optodes beeinträchtigen.
Einige dieser Einschränkungen können durch die Verwendung planarer Optoden für die ratiometrische Bildgebung17,24, wo derO2-empfindlicheIndikatorfarbstoff in der Polymerschicht des planaren Optodes mit einem unempfindlichen Referenzfarbstoff, der in einem anderen Spektralbereich als derO2-Indikatoremittiert, mitimmobilisiert werden. Basierend auf Emissionsbildern, die in zwei Spektralfenstern aufgenommen wurden, wird dasO2-empfindlicheEmissionssignal durch das Referenzsignal dividiert, wodurch ein Verhältnisbild erzeugt wird, das weniger anfällig für die oben genannten Interferenzenist 5,17. Das Verfahren erfordert die Verwendung eines zweiten Farbstoffs, der idealerweise durch dieselbe Anregungsquelle angeregt werden kann, aber bei einer anderen Wellenlänge (ohne signifikante Spektralüberlappung) in einem anderen Spektralfenster der Kamera ausstrahlt (z. B. in einem anderen Farbkanal einer RGB-Kamera).
Alternativ kann dieO2-Bildgebung auf der Quantifizierung derO2-abhängigenVeränderung der Lumineszenzlebensdauer des Indikatorfarbstoffs basieren, die nicht durch ungleichmäßige Beleuchtung oder Heterogenitäten in der Indikatorkonzentration25beeinflusst wird. Erste Lumineszenz-Lebensdauer-basierte O 2-Bildgebungssysteme basierten auf Zeitbereichsmessungen mit einem Gate-fähigen charged coupled Device (CCD) Kamerasystem26, bei dem eine gepulste Anregungsquelle verwendet wird und Lumineszenzbilder in definierten Zeitintervallen innerhalb der Anregung oder Emission des Indikators8,23, 27aufgenommen werden. Aus solchen Bildern kann die Lumineszenzlebensdauer bestimmt und mit der entsprechendenO2-Konzentration in einer Kalibrierung korreliert werden. Anschließend können Lumineszenz-Lebensdauerbilder für eine bestimmte Probe, die gegen die planare Optode gedrückt wird, in Bilder der entsprechenden 2D-Verteilung derO2-Konzentration umgewandelt werden. Dieses System wurde in vielen Anwendungen sowohl im Labor als auch in situ16,28verwendet, aber die wesentliche gate-fähige CCD-Kamera ist nicht mehr kommerziell erhältlich.
Kürzlich wurde ein anderes Lumineszenz-Lebensdauer-Kamerasystem veröffentlicht, das Bilder in der Frequenz-Domäne8erfasst. Zur Anregung setzt das System auf eine kontinuierlich modulierte Lichtquelle. Dies kann entweder eine sinusförmige oder quadratische Welle anstelle einer gepulsten Anregung sein, die für die Bildaufnahme im Zeitbereich verwendet wird. Diese Modulation führt zu einer modulierten Lumineszenzemission des O2-Indikatorfarbstoffs, der phasenversetzt um einen Winkel , , der von der Lumineszenzlebensdauer des Indikatorfarbstoffs abhängt (siehe Gleichung 2).
(2)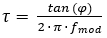
Die Veränderung zwischen Anregungs- und Emissionsamplitude (d.h. der sogenannte Modulationsindex oder -tiefe (Amplitude geteilt durch den konstanten Lumineszenzteil)) ist ebenfalls von der Lumineszenzlebensdauer abhängig. Durch die Einstellung einer bekannten Modulationsfrequenz ist der spezielle CMOS-Bildsensor innerhalb der Kamera in der Lage, die Lumineszenzlebensdauer im Ns-bis-S-Bereich zu messen, wie an anderer Stelle ausführlich beschrieben 8,29,30. Eine allgemeine Anleitung zum Funktionsprinzip finden Sie (unter folgendem Link https://www.youtube.com/watch?v=xPAB_eVWOr8).
Im folgenden Protokoll zeigen wir den Einsatz des neuartigen Kamerasystems zur Abbildung der Verteilung derO2-Konzentration um die Wurzeln der aquatischen Süßwasserpflanze Littorella uniflora in 2D9,31. Wir möchten betonen, dass diese Methode keineswegs auf diese Anwendung beschränkt ist. Sauerstoffempfindliche Optoden oder Sensorpartikel27 in Kombination mit verschiedenen bildgebenden Verfahren wurden in der medizinischen Forschung32, im Bioprinting33, für druckempfindliche Farben34,35, oder zur Untersuchung photosynthetischer Systeme2,36,37, um nur einige andere Anwendungsbereiche zu nennen verwendet.
Protokoll
1. Herstellung von planarem O2 Optode
- 1,5 mg des leuchtendenO2-Indikatorfarbstoffs Platin(II)-5,10,15,20-tetrakis-(2,3,4,5,6-pentafluorphenyl)-porphyrin (PtTFPP) und 100 mg Polystyrol (PS) in 1 g Chloroform auflösen, um den sogenannten "Sensorcocktail" zu erhalten.
HINWEIS: Der Cocktail kann in einer geschlossenen, gasdichten Glasflasche für ein paar Stunden im Kühlschrank und Dunkelheit bis zur weiteren Verwendung aufbewahrt werden. - Befestigen Sie eine saubere, staubfreie Polyethylenterephthalatfolie (PET) (anwendungsabhängige Größe) mit Hilfe eines Wassers oder Ethanols (70%) auf einer gereinigten Glasplatte Film (Abbildung 1A).
- Legen Sie die gereinigte Messerbeschichtungsvorrichtung (120 m) auf die Folie und tragen Sie eine Linie des Sensorcocktails mit einer Glaspipette vor das Gerät auf (Abbildung 1B). Ziehen Sie dann die Messerbeschichtung langsam und gleichmäßig über die PET-Folie, um den Cocktail gleichmäßig zu verteilen.
HINWEIS: Alle Materialien und Werkzeuge müssen gründlich gereinigt werden, und die Herstellung sollte in einer staubfreien Umgebung erfolgen, z. B. einer Dunstabzugshaube, einer Fließbank oder unter einer Punktabsaugvorrichtung. Um Heterogenitäten in der endlichen Sensorfolie zu vermeiden, sollten die Schritte nach dem Auftragen des Sensorcocktails auf die Folie schnell durchgeführt werden, da die Chloroform schnell verdunstet. - Trocknen Sie die fertige planare O2-empfindliche Optode in der Umgebungsluft für 1 h und dann über Nacht in einem Heizschrank bei 50-60 °C, was zu einer endgültigen Schichtdicke nach einer Lösungsmittelverdampfung von 12 m führt. Lagern Sie die erzeugten Optoden in Dunkelheit (z.B. in einem Papierumschlag) bis zur weiteren Verwendung(Abbildung 1C).
HINWEIS: Planare O2 Optodes können vor der Anwendung mehrere Monate bis Jahre trocken und in Dunkelheit gelagert werden. Eine Endschichtdicke von 1-20 m hat sich als gute Ergebnisse erwiesen, mit ausreichend Lumineszenzsignal und ausreichenden Reaktionszeiten.
2. Rhizo-Sandwich-Kammer
- Reinigen Sie zwei Glasplatten (24,5 x 14 cm2, Dicke: 4 mm) mit 96% Ethanol.
- Verwenden Sie lichthärtenden, Acryl-basierten Sofortkleber (siehe Materialtabelle),um Mikroskopschlitten (76 x 26 mm2, Dicke: 1 mm) entlang der Ränder der ersten Glasplatte (d. h. der hinteren Kammerseite) zu kleben, während eine lange Kante offen bleibt. Verwenden Sie einen Glasschneider, um Mikroskopschlitten nach Bedarf zu kürzen.
VORSICHT: Schneiden von Glas kann scharfe Kanten verursachen und sollte mit Sorgfalt behandelt werden.
HINWEIS: Die Mikroskopschlitten fungieren als Abstandshalter zwischen Vorder- und Rückseite, und je nach Dicke der Wurzeln und Pflanzengröße können mehrere Schichten von Mikroskopschlitten übereinander geklebt werden. - Schneiden Sie die planare Optode in die gewünschte Form und Größe, um in den Raum zwischen den geklebten Mikroskop-Dias zu passen. Legen Sie es auf der Innenseite der vorderen Glasplatte mit der beschichteten Seite nach oben, um den Kontakt mit der Probe von Interesse zu ermöglichen, wenn sie gegen sie gedrückt.
- Eine Kante der Optodefolie auf die Glasplatte kleben und zwischen der Glasplatte und der Optodenfolie ein paar Tropfen Leitungswasser hinzufügen (Abbildung 2A). Senken Sie die Folie auf diesen Wassertröpfchen langsam ab, sodass sie sich auf der Glasoberfläche ausrichten kann.
- Entfernen Sie vorsichtig Luftblasen, die zwischen der planaren Optode und der Glasplatte mit einem Weichgewebe eingeschlossen sind, und vermeiden Sie Kratzer der Sensorbeschichtung. Wischen Sie die Glasplatte trocken und verkleben Sie die restlichen Kanten der Optodenfolie auf die Glasplatte (Abbildung 2B).
HINWEIS: Es sollte ein Band mit geeigneter Haftung unter Wasser gewählt werden. - Sieben Sie das Sediment mit einer Maschenöffnung von 0,5 mm. Legen Sie einen Löffel nassen Sediments auf die erste Glasplatte (Abbildung 2C).
HINWEIS: Die Maschenöffnung sollte nicht größer als die Hälfte der Abstandsstärke sein. - Verteilen Sie das Sediment gleichmäßig und passen Sie es mit einer flachen Glasplatte auf die gleiche Dicke wie die Mikroskop-Dia-Spacer an. Reinigen Sie die obere Oberfläche der Mikroskopschlitten sorgfältig, um sicherzustellen, dass die zweite Glasplatte die Kammer richtig abdichtet.
- Siliziumfett auf die Mikroskop-Diaoberfläche auftragen. Bedecken Sie das Sediment mit einem dünnen Wasserfilm, während Sie die Bildung von Luftblasen sorgfältig vermeiden.
- Waschen Sie vorsichtig einen einzigen Schuss Littorella uniflora und legen Sie es auf das Sediment, mit den Pflanzenblättern, die von der oberen offenen Seite herausragen (Abbildung 2D).
- Legen Sie die zweite Glasplatte mit der daran befestigten Optode auf das Sediment und setzen Sie sanften Druck auf, um die Optode in engen Kontakt mit den Pflanzenwurzeln und dem umgebenden Sediment zu bringen.
HINWEIS: Im Sediment eingeschlossene Luftblasen können entfernt werden, indem die Glasplatten gekippt und gleichzeitig zusammengeführt werden. - Befestigen Sie die Glasplatten mit Klemmen (Abbildung 2E). Trocknen Sie die äußeren Ränder mit Tissuepapier. Halten Sie die Blätter während der gesamten Montage des Rhizo-Sandwiches mit Feuchtigkeit versorgt (z.B. durch häufige Zugabe von ein paar Tropfen Wasser).
- Ziehen Sie die Rhizo-Sandwich-Kammer mit Vinyl-Elektroband fest. Versiegeln Sie die Kanten mit Modellierton und verkleben Sie sie zusätzlich mit Vinyl-Elektroband (Abbildung 2F).
HINWEIS: Wenn sich viele Luftblasen im Sediment oder Sedimentkörner zwischen den Abstandsmikroskop-Dias und der zweiten Glasplatte befinden, sollte die Kammer wieder zusammengesetzt werden, da Porenwasser auslaufen kann (Wiederholungsschritte 2.4 - 2.8). - Verwenden Sie einen undurchsichtigen Kunststoff, um das Rhizo-Sandwich zu bedecken, aber lassen Sie einen Schlitz in der Folie für die Pflanzenblätter herausstechen. Schneiden Sie ein Fenster in die Kunststofffolie, so dass es für die Experimente durch Entfalten geöffnet werden kann. Schließen Sie das Fenster während der Akklimatisierungszeiten mit Gummibändern (Abbildung 2G), um die Optode vor Fotobleichen zu schützen, während die Pflanze inkubiert wird.
HINWEIS: Da das Algenwachstum möglicherweise die gemessenenO2-Konzentrationen beeinträchtigen könnte, empfehlen wir, es zu minimieren, indem wir gefiltertes Wasser, vorgereinigte Versuchsgeräte und das Entfernen von Algen bei der Bildung verwenden.
3. Rhizo-Sandwich-Kammer-Inkubation
- Legen Sie die Rhizo-Sandwich-Kammer in einen Wassertank (32 x 7 x 28 cm3) in einer leicht geneigten Position, um das Wurzelwachstum gegen die planare Optode zu fördern.
- Füllen Sie den Wassertank mit genügend Wasser, um die Pflanzenblätter vollständig unter Wasser zu setzen.
- Richten Sie einen 14 h hellen, 10 h dunklen Zyklus für die Akklimatisierung der Anlage mit einer zeitgesteuerten Lampe ein. Legen Sie einen Luftstein oder eine Wasserpumpe in den Tank, um die Belüftung und Dasmetzung des Wassers zu gewährleisten (Abbildung 2H).
4. Imaging
- Imaging-Setup
- Entfernen Sie die Kunststofffolie, die das planare Optode in der Rhizo-Sandwich-Kammer bedeckt. Positionieren Sie die Kammer mit der Glaswand mit der Optode aufrecht gegen die Aquarienwand. Drücken Sie mit einem Abstandsraum die Rhizo-Sandwich-Kammer gegen die Aquarienwand.
HINWEIS: Die Gesamtdicke der Aquarienwand plus der Rhizo-Sandwich-Kammerwand sollte nicht zu dick werden, jedoch werden Glasdicken für Aquarienwände für die Lumineszenzbildgebung mit > 1 cm empfohlen, um räumliches Quergespräch zu reduzieren, indem die Dämpfung des Streulichts erhöht wird. Es ist wichtig, das gleiche Material für beide Glaswände (gleicher feuerfester Index) zu verwenden, um die Lichtstreuung an der Materialschnittstelle zu minimieren; da dies zu einem verschwommenen Bild führen würde, sowie12. - Platzieren Sie die frequenzbereichsbasierte Lumineszenzkamera, die mit einem Objektiv (siehe Materialtabelle)ausgestattet ist, vor das Aquarium und das Interessengebiet (Wurzeln der Wasserpflanze Littorella uniflora, die in direktem Kontakt mit der planaren Optode stehen)(Abbildung 3).
HINWEIS: Die Kamera kann auf einem Laborständer platziert werden, um eine einfache Höhenverstellung der Kamera zu ermöglichen. Die Position des Laborständers sollte markiert und fixiert werden. Zusätzlich kann die Kamera auf den Laborständer geklebt werden, um eine versehentliche Bewegung der Kamera während des Experiments zu vermeiden. - Schrauben Sie einen geeigneten Emissionsfilter zur Abbildung von PtTFPP als Indikatorfarbstoff (siehe Materialtabelle)auf das Kameraobjektiv, um Rückschlüsse aus der Anregungsquelle zu entfernen.
HINWEIS: Schraubfilter sind ideal, aber quadratische Filter können auch mit einem geeigneten Adapter oder durch sorgfältiges Kleben auf das Objektiv verwendet werden. - Schließen Sie eine LED-Anregungsquelle (siehe Materialtabelle)an die Modulation und den dunklen Gate-Ausgang der Kamera an.
HINWEIS: Ersteres liefert das Modulationssignal für die Lichtquelle, während letzteres das Licht während der Bildauslesung des Bildsensors ausschaltet. Schließen Sie die LED-Anregungsquelle und die Kamera an einen Computer an. Hintergrundlicht sollte während der Bildauslesung minimiert werden, indem entweder der gesamte Raum verdunkelt oder ein dichtes, schwarzes Tuch über das gesamte Set-up gelegt wird. Im letzteren Fall ist es wichtig, eine ausreichende Belüftung zu gewährleisten, um eine Erwärmung der Kamera zu vermeiden. - Befestigen Sie die Lichtführung in der LED-Anregungsquelle und positionieren Sie sie, um die planare Optodefolie, die den Interessenbereich abdeckt, gleichmäßig auszuleuchten.
HINWEIS: In der verwendeten LED-Anregungsquelle ist es möglich, zwischen 3 verschiedenen LEDs (460 nm, 528 nm, 625 nm) zu wechseln, deren Intensität über die Steuerungssoftware eingestellt werden kann.
- Entfernen Sie die Kunststofffolie, die das planare Optode in der Rhizo-Sandwich-Kammer bedeckt. Positionieren Sie die Kammer mit der Glaswand mit der Optode aufrecht gegen die Aquarienwand. Drücken Sie mit einem Abstandsraum die Rhizo-Sandwich-Kammer gegen die Aquarienwand.
- Einstellungen und Kamerabedienung
HINWEIS: Für die beschriebenen Experimente haben wir eine frequenzbereichsbasierte Lebensdauerkamera in Kombination mit einem dedizierten Modul für die Lebensdauer-Bildgebung in einem kommerziell erhältlichen Softwarepaket verwendet (siehe Tabelle der Materialien).- Wählen Sie die Kamera in der gewählten Software vor der Verwendung aus.
HINWEIS: Die Software- und Kameratreiber müssen vor der Bildgebung gemäß den Herstellerrichtlinien installiert werden. - Öffnen Sie die LED-Steuerungssoftware (wieder installiert vor Beginn des Experiments) und wählen Sie die passende LED (hier: 528 nm) aus, indem Sie den Standby-Vorgang abhaken. Stellen Sie die LED-Intensität nach Bedarf ein (hier auf 30 %). Stellen Sie sicher, dass die LED durch die externe TTL ausgelöst wird. Dies geschieht durch Ankreuzen von Analog und Synchronisierung für die LED.
HINWEIS: Die LED-Intensität muss individuell angepasst werden, da eine zu hohe Laserleistung zu einer beschleunigten Fotobleiche des Indikators oder Referenzfarbstoffs führen kann. - Fokussieren Sie die Kamera und passen Sie die Blende des Objektivs manuell an (in der vorliegenden Studie verwenden Sie f = 2.8).
HINWEIS: Es ist wichtig, die Kamera auf die planare Optode und nicht auf das Aquariumglas zu fokussieren; dies kann sichergestellt werden, indem man ein Bild mit einem Lineal für Maßstab nimmt und sich auf den Schatten des Lineals auf der Optode konzentriert und nicht auf das eigentliche Lineal. - Legen Sie die folgenden Parameter im Kamerabedienfeld der Software fest: interne Modulationsquelle; Sinuswelle für die Ausgangswellenform; zusätzliche Phasenstichproben (Ja); 8 Phasenproben, Phasenreihenfolge gegenüber, Tap A + B Auslesung; 5 kHz Modulationsfrequenz.
HINWEIS: Diese Parameter wirken sich auf die Bildqualität aus und können bei Bedarf geändert werden. Der Hersteller der Kamera gibt Richtlinien zu den einzelnen Parametern (Der Kamerahersteller veröffentlicht Richtlinien und Updates, wenn die Software aktualisiert wird). - Nehmen Sie ein Referenzbild vor den Experimenten auf.
HINWEIS: Dies kann entweder durch Die Abbildung eines Kalibrierstandards (ein Leuchtstofffarbstoff mit einer bekannten Lebensdauer (ns oder s)) oder durch Verwendung des reflektierten Lichts der LED erfolgen. Im letzteren Fall muss der Emissions-Langpassfilter aus dem Objektiv entfernt und die bekannte Lebensdauer kann auf 1 ns eingestellt werden. - Passen Sie die Belichtungszeit im Kalibrierungsbereich der dedizierten Bildgebungssoftware an, bis die ROI-Statistik (unten in diesem Panel) für das normalisierte Lumineszenzintensitätsbild im Bereich von 0,68 - 0,72 liegt.
HINWEIS: Nun wird die Referenzlebensdauer (z.B. 1 ns) als Eingabe in die Software gegeben. - Drücken Sie Capture-Referenz, um mit der Erfassung einer Referenzmessreihe zu beginnen.
HINWEIS: Nach Fertigstellung werden die Referenzdaten gespeichert, und entweder Einzel- oder Zeitraffermessungen können an Proben durchgeführt werden.
- Wählen Sie die Kamera in der gewählten Software vor der Verwendung aus.
- Kalibrierung der O2 Optode
- Positionieren Sie ein Stückeines planaren O 2-empfindlichen Optoden in einem (kleinen) Glasaquarium. Fixieren Sie das planare Optode an der Glaswand der Kalibrierkammer wie zuvor beschrieben (siehe Abschnitt 2.3). Stellen Sie das Kalibrieraquarium vor die Kamera. Sorgen Sie für eine gleichmäßige Beleuchtung durch die LED sowie dafür, dass die Optode das gesamte Sichtfeld ausfüllt.
HINWEIS: Die planare Optode sollte aus demselben Stück Folie stammen oder aus demselben Sensorcocktail hergestellt werden, wie die Folie, die im eigentlichen Experiment verwendet wurde. - Füllen Sie das Aquarium mit dem gleichen flüssigen Medium wie in den Experimenten verwendet.
HINWEIS: Die Verwendung verschiedener Medien für Kalibrierungen und Experimente kann die Messung beeinflussen (z. B. durch Änderung der Sensorreaktion und/oder der O 2-Löslichkeit). Daher sollte die Kalibrierung im selben Medium und bei der gleichen Temperatur wie das eigentliche Experiment erfolgen. Temperaturschwankungen beeinflussen das Lumineszenzsignal und sollten vermieden werden. Wenn die Temperatur jedoch nicht stabil gehalten werden kann, muss die Temperaturkompensation durch Die Kalibrierung derO2-empfindlichenOptode (mehrere Punkte) bei unterschiedlichen (relevanten) Temperaturen und die anschließende Neuberechnung der Werte erfolgen. - Stellen Sie dieO2-Konzentration im Kalibrieraquarium ein, indem Sie das Wasser mit einem Luft/N2-Gasgemisch bekannterO2-Konzentration mit einem Gasmischgerät spülen. Stellen Sie sicher, dass das Wasser durch Belüften für eine ausreichende Zeit gut mit dem verwendeten Gasgemisch ausgeglichen wird (abhängig von der Durchflussmenge und Größe des Aquariums).
HINWEIS: Wir empfehlen, denO2-Pegel im Kalibrieraquarium mit einem externen, kalibriertenO2-Sensor mit Temperaturkompensation (z. B. mit einem Faseroptik- oder elektrochemischen O2-Sensor) zu überwachen. - Nehmen Sie eine Reihe von Bildern mit unterschiedlichenO2-Konzentrationen in der Kalibrierkammer auf.
HINWEIS: Es sollten mindestens fünf verschiedeneO2-Konzentrationen gemessen werden, um eine angemessene Kurve zu ermöglichen, die an die erfassten Kalibrierdaten angepasst werden kann. Es ist wichtig, bei 0 hPa (anoxische Bedingungen) zu messen und dann die anderen Werte über den dynamischen Bereich Ihres spezifischen Indikatorfarbstoffs zu verteilen. Hier haben wir PtTFPP alsO2-empfindlichenIndikatorfarbstoff verwendet, der in einer Polystyrolmatrix immobilisiert ist. Die Bilder wurden unter 0, 48, 102, 156 und 207 hPa aufgenommen; 207 hPa entspricht einer 100%igen Luftsättigung beim gegebenen Salzgehalt und Druck.
- Positionieren Sie ein Stückeines planaren O 2-empfindlichen Optoden in einem (kleinen) Glasaquarium. Fixieren Sie das planare Optode an der Glaswand der Kalibrierkammer wie zuvor beschrieben (siehe Abschnitt 2.3). Stellen Sie das Kalibrieraquarium vor die Kamera. Sorgen Sie für eine gleichmäßige Beleuchtung durch die LED sowie dafür, dass die Optode das gesamte Sichtfeld ausfüllt.
- Bildgebung der Probe
- Stellen Sie das Muster vor die Kamera und sorgen Sie für eine gleichmäßige Ausleuchtung.
- Schalten Sie die Lichtbestrahlung der Anlage (und aller anderen Lichtquellen) kurz vor dem Erwerb des Lumineszenz-Lebensdauerbildes der Pflanze aus. Passen Sie die Erfassungszeit basierend auf dem Intensitätsbild an, um sicherzustellen, dass das Signal bei der Lebensdauerbestimmung weder übersättigt noch zu schwach für ein gutes Signal-Rausch-Verhältnis (S/N) ist.
- Setzen Sie die Pflanze unterschiedlichen Lichtverhältnissen (z. B. hell/dunkel) aus und erfassen Sie eine Reihe von Bildern.
- Schalten Sie das Licht im Raum ein, um ein Strukturbildzu erhalten.
HINWEIS: Wenn das Hintergrundlicht eingeschaltet ist, misst die Kamera kein realistisches Lebensdauerbild. Das Intensitätsbild zeigt nun jedoch das gesamte Sichtfeld, wie es durch die halbtransparente Optode gesehen wird. - Nehmen Sie ein Bild mit einem Lineal oder ähnlichen im Sichtfeld auf, um eine spätere Skalierung der erfassten Bilder zu ermöglichen.
5. Datenanalyse
- Exportieren Sie die Phasenlebensdauer- und Intensitätsbilder direkt aus der dedizierten Bildverarbeitungssoftware, indem Sie das vom Kamerahersteller bereitgestellte Makro verwenden.
- Führen Sie weitere Bildanalysen mit einer frei verfügbaren Bildanalysesoftware durch (siehe Materialtabelle).
- Öffnen Sie die Phasenlebensdauerbilder der Kalibrierung in der Bildanalysesoftware und bestimmen Sie mit der Messfunktion den Mittelwert des gesamten Bildes. Zeichnen Sie die gemessenen Lebensdauern mit den bekanntenO2-Konzentrationen, um die Kalibrierfunktion zu bestimmen (Abbildung 4A).
- Berechnen Sie aus allen Daten die Berechnung von 0/b ( 0 ist die gemessene Phasenlebensdauer in Abwesenheit von O2). Zeichnen Sie diese Werte im Vergleich zu den bekanntenO2-Konzentrationen (Abbildung 4B).
- Bestimmen Sie die Parameter Ksv und f aus dem Kalibrierdiagramm, indem Sie das vereinfachte Zwei-Standort-Modell für dynamisches Kollisionsabschreckungs-(Gleichung 3)38,39, wobei [Q] dieO2-Konzentration ist. Definieren Sie die Fit-Funktion in der Datenanalysesoftware, die dann Ksv und f bestimmt.
(3)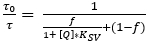
- Öffnen Sie die erfassten Beispielbilder in der Bildanalysesoftware, um die abgebildeten Lebensdauern unter Verwendung der ermittelten Parameter Ksv, f und 0 inO2-Konzentrationen umzuwandeln.
HINWEIS: Alternativ können auch die erfassten Lebensdauerwerte der Kalibrierphase (Abbildung 4A) direkt verwendet werden. In diesem Fall wird für die Kalibrierung eine exponentielle Passung mit der Kurvenanpassungsfunktion verwendet. - Öffnen Sie das Bild mit dem Lineal als nächstes in der Bildanalysesoftware und messen Sie mit dem Messwerkzeug eine bekannte Entfernung. Legen Sie diese Messung als globale Skala unter Set-Skalafest.
Ergebnisse
Als Anwendungsbeispiel für das neue Bildgebungssystem zeigen wir 2DO2-Bildgebung einer komplexen biologischen Probe (d.h. die Rhizosphäre der Wasserpflanze Littorella uniflora).
Zunächst beschreibt die Methode die Herstellung einer planaren Sensorfolie, einer sogenannten planaren Optode. Wie in Abbildung 1 zu sehen,besteht ein solches Optode aus einer dünnen Schicht eines optischen Indikators in einer Polymermatrix, die auf einer transparenten Stütze verteilt ist. Durch befolgen des beschriebenen Protokolls wird eine homogene Sensorfolie mit einer gleichmäßigen Dicke, wie sie durch den Spalt der Messerbeschichtungsvorrichtung definiert ist, erhalten. Wenn die produzierte Optode eine lückenhafte Sensormaterialverteilung aufweist (z. B. Löcher in der Beschichtung, zeigt Streifen oder Farbstoffaggregate (dies kann visuell und visuell mit Hilfe einer UV-Lampe bewertet werden)), muss das Protokoll wiederholt werden und alle Materialien müssen gründlich mit Aceton gereinigt werden.
Sobald die planare Optode vorbereitet ist, kann die Probe in engen Kontakt mit der Sensorschicht des planaren Optoden gebracht werden, wie hier mit der planaren Optode in einer Rhizo-Sandwich-Kammer gezeigt, wo die Wurzeln einer Pflanze innerhalb einer umgebenden Sedimentmatrix in engem Kontakt mit der planaren Optode positioniert werden können (Abbildung 2). Bei richtiger Vorbereitung sollte die Rhizo-Sandwich-Kammer leicht von einem Aquarium (Inkubation) zum anderen (Messung) bewegt werden können. Wenn die Rhizo-Sandwich-Kammer nicht richtig konstruiert ist, kann sie instabil sein, Sedimente verlieren oder Luftblasen enthalten. Eine visuelle Untersuchung der Rhizo-Sandwichkammer direkt nach der Montage wird daher empfohlen.
Das gegebene Protokoll ermöglicht eine frequenzbereichsbasierte Lumineszenz-Lebensdauer-Bildgebung der Probe in Kontakt mit der planaren Optode mit der frequenzbereichsbasierten Lumineszenz-Lebensdauerkamera. Weitere Details zu diesem Kamerasystem wie die Art der Bildaufnahme und wissenschaftlich komplementäre Metalloxid-Halbleiter (SCMOS) Kameraeigenschaften sind in den jüngsten Publikationen8,29angegeben.
Das Setup selbst ist ziemlich einfach und enthält nur die Kamera, die eine Lichtquelle steuert (in diesem Fall eine LED-Anregungsquelle) und das Sample mit der Optode (Abbildung 3). Stellen Sie sicher, dass alle Teile korrekt angeschlossen sind und die Probe homogen ausleuchtet ist. Hintergrundlicht muss bei vorformenden Messungen vermieden werden.
Vor der Abbildung der Probe muss die Optode kalibriert werden. Wie in Abbildung 4Adargestellt, nimmt die gemessene Lumineszenzlebensdauer mit steigenderO2-Konzentration nach einem quasi-exponentiellen Zerfall ab. Diese Beziehung kann auch mit dem vereinfachten Modell mit zwei Standorten beschrieben werden(Abbildung 4B und Gleichung 3). Im gegebenen Beispiel wurden die Parameter, die für die anschließende Berechnung derO2-Konzentration erforderlich waren, wie folgt angegeben; 0 = 56,26 s, Ksv = 0,032 hPa-1 und f = 0,86.
Die Durchführung einer Kalibrierung ist auch eine ideale Möglichkeit, um zu testen, ob das System ordnungsgemäß funktioniert. Wenn alle Komponenten wie hier beschrieben (oder gemäß den Herstellerrichtlinien) installiert sind, sollte die gemessene Lebensdauer die gleicheO2-Abhängigkeit aufweisen wie in Abbildung 4. Darüber hinaussollte bei der gleichen Kombination vonO2-Sensormaterialien (Polymer und Farbstoff) die gemessene 0 im gleichen Bereich (ca. ein paar s) liegen, wie hier gemessen (hauptsächlich beeinflusst durch die Versuchstemperatur). Wenn Sie keine ähnliche Kalibrierkurve erhalten können, stellen Sie sicher, dass alle Schritte korrekt ausgeführt wurden. Manchmal wird die Optode versehentlich mit der empfindlichen Seite zur Glaswand und nicht mit der Probe fixiert, oder die aufgenommenen Bilder sind über- oder unterbelichtet.
Mit den Kalibrierparametern ist es möglich, dieO2-Konzentration durch Abbildung der Lumineszenzlebensdauer zu bestimmen. Dies zeigt Abbildung 5A,B, wo die Verteilung derO2-Konzentration in der Rhizosphäre von Littorella uniflora in der Dunkelheit und nach Lichteinwirkung von 500 mol Photonen m-2 s-1 für 12 h abgebildet wurde. Aufgrund der photosynthetischen Aktivität der Pflanze erhöhte sich dieO2-Konzentration in der Rhizosphäre nach Lichteinwirkung. Neben Lebensdauerbildern können auch "strukturelle" Bilder unter externer Beleuchtung aufgenommen werden, wobei die Bildgeometrie fixiert bleibt. Auf diese Weise können O2-Bilder präzise mit dem Strukturbild (Abbildung 5C), Querschnitten oder Interessengebieten korreliert werden. Als Beispiel wurden O 2-Konzentrationsprofile über eine einzelne Wurzel aus dem Bild extrahiert, das in Dunkelheit bzw. Licht aufgenommen wurde (Abbildung 5D).

Abbildung 1: Herstellung einer planaren O2 Optode. (A) Eine PET-Folie wird auf einer Glasplatte befestigt und die Messerbeschichtungsvorrichtung auf die Folie gelegt. (B) Der vorbereitete Sensorcocktail wird auf der PET-Folie als dünne Linie vor der Messerbeschichtungsvorrichtung verteilt. (C) Die Messerbeschichtungwirdin wird nach unten bewegt, um den Sensorcocktail als dünner Film auf der PET-Folie zu verteilen, was nach Derlöseverdampfung zu einem gebrauchsfertigen planaren Optod führt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Rhizo-Sandwich-Kammerbaugruppe mit Integration eines planaren O2 Optoden. (A) Die Optode wird mit einem Wasserfilm auf einer der Glasplatten befestigt. (B) Die Optode wird mit Klebeband auf die Platte geklebt. (C) Sediment wird mit den angebrachten Abstandshaltern (d.h. Mikroskopschlitten) in die gegenüberliegende Platte gefüllt. (D) Die Pflanzenwurzeln werden auf das gleichmäßig verteilte Sediment gelegt. (E) Die Rhizo-Sandwich-Kammer ist geschlossen und vorübergehend mit Klemmen fixiert. (F) Voll geschlossene und montierte Rhizo-Sandwich-Kammer. (G) Um die Optode vor Lichteinwirkung durch die Inkubationslampe zu schützen und Algenwachstum zu vermeiden, wird eine Kunststoffabdeckung über die montierte Rhizo-Sandwich-Kammer gelegt. (H) Die in einem Aquarium inkubierte Rhizo-Sandwich-Kammer. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Imaging-Setup mit der frequenzbereichsbasierten Lumineszenz-Lebensdauerkamera, wobei das Objektiv über die transparenten Aquarium- und Rhizo-Sandwich-Kammerwände von hinten auf die Probe mit der Optode von hinten fokussiert ist. Die Lichtführung der LED-Anregungsquelle ist so positioniert, dass die Probe gleichmäßig beleuchtet wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
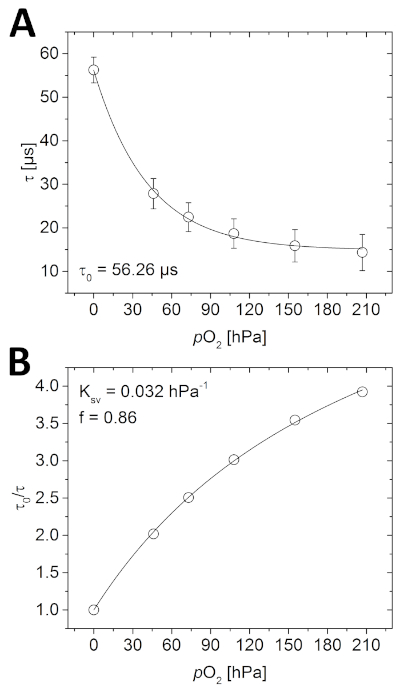
Abbildung 4: Kalibrierkurven für planare O 2-Optode. (A) Unterschiedliche Phosphoreszenzlebensdauern, die bei den jeweiligenO2-Konzentrationen in der mit Wasser gefüllten Kalibrierkammer gemessen werden. (B) Stern-Volmer-Diagramm der Kalibrierdaten, die mit dem vereinfachten Zwei-Standort-Modell für dynamisches Kollisionsabschreckungs-Quenching (Gleichung 3) angepasst wurden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
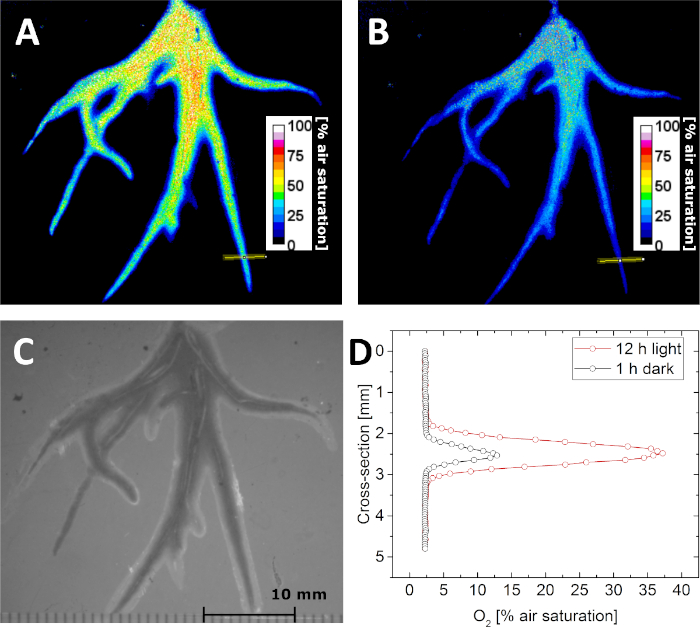
Abbildung 5: Lebensdauerbildgebung derO2-Verteilung in der Rhizosphäre der Wasserpflanze Littorella uniflora. (A)O2-Verteilung nach 12 h unter Licht gehalten, bei ca. 500 mol Photonen m-2 s-1. (B)O2 Verteilung nach Dem Halten der Pflanze in Dunkelheit für 1 h. (C) Strukturelles Bild der Pflanzenwurzeln durch die planare Optode gesehen. (D) Querschnitts-O2-Konzentrationsprofil (die Position wird durch die gelbe Linie in Panel A und B) nach 12 h bei Licht (rot) und 1 h bei Dunkelheit (schwarz) angezeigt. Angepasst mit Genehmigung von (Koren, K., Moßhammer, M., Scholz, V. V., Borisov, S.M., Holst, G., Kühl, M. Luminescence Lifetime Imaging of Chemical Sensors - A Comparison between Time-Domain and Frequency-Domain Based Camera Systems. Analytische Chemie. 91 (5), 3233-3238, doi: 10.1021/acs.analchem.8b05869 (2019)). Copyright (2019) American Chemical Society. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
In diesem Protokoll wird der gesamte Arbeitsablauf von der Optodenvorbereitung bis zur O 2-Bildanalyse abgedeckt. Durch das Befolgen dieses Protokolls können chemische Bilder mit der neuartigen frequenzbereichsbasierten Lumineszenz-Lebensdauerkamera gewonnen werden. Je nach Anwendung können die planaren Optoden in verschiedenen Größen und Schichtstärken der Sensorschicht hergestellt werden, von robusten 50-100 m dicken planaren Optoden von mehreren Zehntelquadratzentimetern bis hin zu Mikroskopabdeckungsrutschen mit <1 'm dicken Sensorschichten6,40. Das Potenzial dieser Methode wurde mit einer bestimmten Anwendung demonstriert, ist aber nicht nur aufO2-Bildgebung in Pflanzenrhizosphären12,28beschränkt.
Diese Methode hat mehrere Vorteile im Vergleich zu reinen Lumineszenzintensitäts-basierten chemischen Bildgebungsmethoden. Die Lumineszenzlebensdauer-Bildgebung ist nicht oder zumindest viel weniger von ungleichmäßiger Beleuchtung, ungleichmäßiger Optodedicke und Fotobleiche25betroffen. Diese Methode vermeidet auch die Verwendung eines zusätzlichen Referenzfarbstoffs, der in der ratiometrischen Bildgebung17,37verwendet wird. Im Vergleich zu anderen lebenslangen Kamerasystemen, wie z. B. häufig verwendeten Gated-Time-Domain-Kameras8,26, kann das hier vorgestellte neuartige Kamerasystem und Protokoll vergleichbare Ergebnisse liefern. In einer kürzlich veröffentlichten Veröffentlichung wurden die analytischen Merkmale dieser beiden Systeme verglichen, und es wurde festgestellt, dass das frequenzbereichsbasierte Lumineszenz-Lebensdauer-Kamerasystem zumindest mit dem eingestellten zeitdomänenbasierten Vorgänger8vergleichbar ist.
Wir haben das einfachste O2 Optode präsentiert, das nur aus einem Indikator in einer Polymermatrix besteht. Neben mehreren anderen möglichen O2-Indikatoren können20, die verwendet werden könnten, additive, d.h. Streumittel wie TiO2 oder Diamantpulver2, aufgenommen werden, um das Sensorsignal zu erhöhen und gleichzeitig die Transparenz des Optodes zu reduzieren. Auch zusätzliche Farbstoffe könnten verwendet werden, um die Signalintensität durch Energieübertragung41zu erhöhen.
Für die planare Optodefertigung empfehlen wir bei Verwendung der beschriebenen Sensorcocktailzusammensetzung die Verwendung eines Spalts in der Messerbeschichtungsvorrichtung von 75 - 120 m, um eine endgültige Sensorschichtdicke von ca. 7,5 bis 12 m nach Lösemittelverdampfung (ca. 10% des verwendeten Spalts) zu erzielen. Dies ist ein guter Kompromiss zwischen der Signalintensität, die durch höhere Farbbelastung oder durch die Wahl von Indikator- und Referenzfarbstoffen mit höherer Helligkeit und Reaktionszeit geändert werden kann. Eine Erhöhung der Schichtdicke führt zu einer Erhöhung der Reaktionszeit, da die Zeitspanne, die für den Analyten erforderlich ist, um ein thermodynamisches Gleichgewicht in der Sensorschicht mit den umgebenden Medien zuerreichen, um 12erhöht wird.
Optodes reagieren, wie hier beschrieben, auf Veränderungen derO2-Konzentration innerhalb weniger Sekunden17 und haben dennoch ein ausreichend starkes Lumineszenzsignal. Ultradünne Sensorbeschichtungen mit Ansprechzeiten unter Sekunden können mit Spin-Coating6realisiert werden. Wenn der Träger oder die Messerbeschichtungsvorrichtung nicht gut gereinigt ist, kann dies zu inhomogenen Sensorschichten führen. Auch wenn der Cocktail nach dem Ausbreiten vor der Beschichtungsvorrichtung nicht vollständig homogen ist oder zu schnell aufgetragen wird, kann ein solches unerwünschtes Ergebnis beobachtet werden. Daher kann es einige Übung, um optimale Optodes vorzubereiten.
Die Methode kann verwendet werden, um Proben abzubilden, die in engem Kontakt mit der Optode, wie bestimmte Meerestiere42, Biofilme6 und Böden31, um nur einige zu nennen. Wir präsentieren ein eigenständiges Setup mit einem Objektiv, aber die Kamera kann leicht an ein Mikroskop für chemische Bildgebung mit höherer Auflösung gekoppelt werden43.
Während die zeitdomänenbasierte Lumineszenzlebensdauer-Bildgebung die Unterdrückung der Hintergrundfluoreszenz26ermöglichte, ist dies ein Problem bei der Verwendung des neuen frequenzbereichsbasierten Kamerasystems8. Aufgrund der kontinuierlichen Bildaufnahme zeichnet diese Kamera jede Hintergrundfluoreszenz der Probe auf, die durch die ausgewählte LED angeregt werden kann und im ausgewählten Spektralfenster emittiert, wie durch den Emissionsfilter auf dem Kameraobjektiv definiert. Dies führt zu einer scheinbar niedrigeren Lebensdauer und folglich zu falschen Messwerten. Wenn Sie mit Proben mit einer signifikanten intrinsischen Fluoreszenz arbeiten, die sich mit der Anregung und Emission desO2-Sensors überlappt, ist es wichtig, eine zusätzliche optische Isolierung auf die Optode aufzutragen, indem Sie eine zusätzliche Schicht mit Ruß2,17beschichten. So erreicht nur die Lumineszenz, die von der planaren Optode ausgeht, die Kamera. Um die Hintergrundlumineszenz zu überprüfen, kann ein Bild ohne Optode aufgenommen werden, das dann ausschließlich die intrinsische Lumineszenz der Probe zeigen würde. Es ist auch möglich, Streumittel wie TiO2 oder Diamantpulver2,44, zum Sensorcocktail hinzuzufügen, um die Lumineszenzintensität des Indikatorfarbstoffs zu erhöhen. Dies kann jedoch auch zu einer schnelleren Fotobleiche führen und TiO2 ist ein bekannter Fotokatalysator, der die Photostabilität eines Farbstoffs beeinträchtigen kann41. Ein weiterer Aspekt, der zu berücksichtigen ist, ist das Hintergrundlicht. Bei der Bildgebung von Lumineszenzlebensdauern muss Hintergrundlicht so effizient wie möglich vermieden werden. Daher erfordert diese Bildgebungsmethode, dass die Einrichtung in einer dunklen Umgebung platziert wird und jede externe Lichtquelle während der Bildaufnahme vorübergehend ausgeschaltet werden muss.
Zusammenfassend lässt sich sagen, dass die Bildgebung der Lumineszenzlebensdauer eine robuste chemische Bildgebungsmethode ist, die an viele verschiedene Anwendungen angepasst werden kann. Dieses Protokoll (siehe Abschnitt 1 - 5) deckt alle wesentlichen Schritte zum Generieren eines O2-Bildes ab und verwendet das derzeit flexibelste Frequenzbereichs-Lumineszenz-Lebensdauer-Bildgebungssystem, das die eingestellte Gated-Time-Domain-Kamera für 2D O 2-Bildgebung durch planare Optoden ersetzen kann.
Offenlegungen
Der Autor Gerhard Holst ist Mitarbeiter der PCO AG, die das in diesem Artikel verwendete Kamerasystem herstellt. Die PCO AG hat sich finanziell an den Publikations- und Open-Access-Kosten dieses Artikels beteiligt.
Danksagungen
Wir danken Sofie Lindegaard Jakobsen (Universität Kopenhagen) und Lars Borregaard Pedersen (Universität Aarhus) für die technische Unterstützung. Die Finanzierung dieser Studie wurde durch ein Sapere-Aude Advanced-Stipendium des Unabhängigen Forschungsfonds Dänemark (DFF-1323-00065B; MK), Projektzuschüsse aus dem unabhängigen Forschungsfonds Dänemark | Naturwissenschaften (DFF-8021-00308B; MK) & Technische und Produktionswissenschaften (DFF-8022-00301B und DFF-4184-00515B; MK), der Dänischen National Research Foundation (DNRF136) und der Poul Due Jensen Foundation (KK).
Materialien
| Name | Company | Catalog Number | Comments |
| Air pump with air stone and water pump | Local aquarium store | ||
| Chloroform | Sigma Aldrich | 67-66-3 | |
| DC4 silicone compound | Dow Corning GmbH | 2793695 | |
| Gas mixer | Vögtlin Instruments GmbH | red-y compact meter GCM | This is just one possible instrument. Several companies offer gas mixing devices |
| Glass plates and aquaria | Local aquarium or hardware store | ||
| ImageJ Software | ImageJ | Freely available imaging software (imagej.nih.gov/ij/index.html) | |
| Knife-coating device | BYK-GARDNER GMBH byk.com | 2021 | This is a four sided film applicator enabling easy variation of the film thickness. Other versions are also available. We recommend a thickness of the applied film between 75-120 µm, which yields a final sensor layer thickness of ~10% of the applied thickness before solvent evaporation. |
| LED lamp, Reflector PAR38 | Megaman | MM17572 | |
| LED LEDHUB | Omicon Laserage, Germany | Can be configured with a variety of LEDs. For the presented example, the green LED (528 nm) is essential | |
| LOCTITE AA 3494 | Henkel AG & Co. KGaA | NA | Acrylic-based instant adhesive |
| NIS Elements AR Software | Nikon Inc | Software package used for image acquisition | |
| pco.flim | PCO AG, Germany | Frequency domain based luminescence lifetime camera | |
| platinum(II)-5,10,15,20-tetrakis-(2,3,4,5,6-pentafluorphenyl)-porphyrin (PtTFPP) | Frontier Scientific | PtT975 | O2 indicator |
| polyethylene terephthalate (PET) foil | Goodfellow | 320-992-72 | Such foils might also be found from other providers and serve as solid support |
| Polystyrene (PS) | Sigma Aldrich | 9003-53-6 | Polymer matrix |
| Schott RG610 filter | www.uviroptics.com | Here 52mm screw on Filters can obtained. Other sources offer square glass filters from Schott glass that can be fixed in front of the objective | |
| Vinyl electrical tape | Scotch, Super 33+ | NA | |
| Zeiss Makro Planar 2/100 with Hama C for Nikon adaptor | delivered with the camera | Here any other objective might also be used in combination with an adaptor if the objective does not have a C-mount |
Referenzen
- Glud, R. N., Kühl, M., Kohls, O., Ramsing, N. B. Heterogeneity of oxygen production and consumption in a photosynthetic microbial mat as studied by planar optodes. Journal of Phycology. 35 (2), 270-279 (1999).
- Moßhammer, M., Strobl, M., Kühl, M., Klimant, I., Borisov, S. M., Koren, K. Design and Application of an Optical Sensor for Simultaneous Imaging of pH and Dissolved O2 with Low Cross-Talk. ACS Sensors. 1 (6), 681-687 (2016).
- Jensen, S. I., Kühl, M., Glud, R. N., Jørgensen, L. B., Priemé, A. Oxic microzones and radial oxygen loss from roots of Zostera marina. Marine Ecology Progress Series. , 49-58 (2005).
- Larsen, M., Santner, J., Oburger, E., Wenzel, W. W., Glud, R. N. O2 dynamics in the rhizosphere of young rice plants (Oryza sativa L.) as studied by planar optodes. Plant and Soil. 390 (1-2), 279-292 (2015).
- Brodersen, K. E., Koren, K., Moßhammer, M., Ralph, P. J., Kühl, M., Santner, J. Seagrass-Mediated Phosphorus and Iron Solubilization in Tropical Sediments. Environmental Science and Technology. 51, 14155-14163 (2017).
- Kühl, M., Rickelt, L. F., Thar, R. Combined imaging of bacteria and oxygen in biofilms. Applied and Environmental Microbiology. 73 (19), 6289-6295 (2007).
- Sønderholm, M., et al. Tools for studying growth patterns and chemical dynamics of aggregated Pseudomonas aeruginosa exposed to different electron acceptors in an alginate bead model. npj Biofilms and Microbiomes. 3, 1-11 (2018).
- Koren, K., Moßhammer, M., Scholz, V. V., Borisov, S. M., Holst, G., Kühl, M. Luminescence Lifetime Imaging of Chemical Sensors - A Comparison between Time-Domain and Frequency-Domain Based Camera Systems. Analytical Chemistry. 91 (5), 3233-3238 (2019).
- Brodersen, K. E., Koren, K., Lichtenberg, M., Kühl, M. Nanoparticle-based measurements of pH and O2 dynamics in the rhizosphere of Zostera marina L.: effects of temperature elevation and light-dark transitions. Plant, Cell & Environment. 39 (7), 1619-1630 (2016).
- Zhu, Q., Aller, R. C., Fan, Y. High-Performance Planar pH Fluorosensor for Two-Dimensional pH Measurements. in Marine Sediment and Water. Environmental Science & Technology. 39, 8906-8911 (2005).
- Murniati, E., Gross, D., Herlina, H., Hancke, K., Glud, R. N., Lorke, A. Oxygen imaging at the sediment-water interface using lifetime-based laser induced fluorescence (τLIF) of nano-sized particles. Limnology and Oceanography: Methods. 14 (8), 506-517 (2016).
- Santner, J., Larsen, M., Kreuzeder, A., Glud, R. N. Two decades of chemical imaging of solutes in sediments and soils - a review. Analytica Chimica Acta. , 9-42 (2015).
- Glud, R. N. Oxygen dynamics of marine sediments. Marine Biology Research. 4 (4), 243-289 (2008).
- Revsbech, N. P., Jorgensen, B. B., Blackburn, T. H. Oxygen in the Sea Bottom Measured with a Microelectrode. Science. 207 (4437), 1355-1356 (1980).
- Klimant, I., Meyer, V., Kuhl, M. Fiberoptic oxygen microsensors, a new tool in aquatic biology. Limnology and Oceanography. 40 (6), 1159-1165 (1995).
- Glud, R. N., Tengberg, A., Kühl, M., Hall, P. O. J., Klimant, I., Holst, G. An in situ instrument for planar O2 optode measurements at benthic interfaces. Limnology and Oceanography. 46 (8), 2073-2080 (2001).
- Larsen, M., Borisov, S. M., Grunwald, B., Klimant, I., Glud, R. N. A simple and inexpensive high resolution color ratiometric planar optode imaging approach: application to oxygen and pH sensing. Limnology and Oceanography: Methods. 9, 348-360 (2011).
- Glud, R., Ramsing, N., Gundersen, J., Klimant, I. Planar optrodes:a new tool for fine scale measurements of two-dimensional O2 distribution in benthic communities. Marine Ecology Progress Series. 140, 217-226 (1996).
- Frederiksen, M. S., Glud, R. N. Oxygen dynamics in the rhizosphere of Zostera marina: A two-dimensional planar optode study. Limnology and Oceanography. 51 (2), 1072-1083 (2006).
- Quaranta, M., Borisov, S. M., Klimant, I. Indicators for optical oxygen sensors. Bioanalytical Reviews. 4, 115-157 (2012).
- Koren, K., Hutter, L., Enko, B., Pein, A., Borisov, S. M., Klimant, I. Tuning the dynamic range and sensitivity of optical oxygen-sensors by employing differently substituted polystyrene-derivatives. Sensors and Actuators B: Chemical. 176 (100), 344-350 (2013).
- Borisov, S. M. Fundamentals of Quenched Phosphorescence O2 Sensing and Rational Design of Sensor Materials. Quenched-phosphorescence Detection of Molecular Oxygen: Applications in Life Sciences. , 1-18 (2018).
- Wang, X., Wolfbeis, O. S. Optical methods for sensing and imaging oxygen: materials, spectroscopies and applications. Chemical Society Reviews. 43, 3666-3761 (2014).
- Ehgartner, J., Wiltsche, H., Borisov, S. M., Mayr, T. Low cost referenced luminescent imaging of oxygen and pH with a 2-CCD colour near infrared camera. The Analyst. 139 (19), 4924 (2014).
- Meier, R. J., Fischer, L. H., Wolfbeis, O. S., Schäferling, M. Referenced luminescent sensing and imaging with digital color cameras: A comparative study. Sensors and Actuators B: Chemical. 177, 500-506 (2013).
- Holst, G., Kohls, O., Klimant, I., König, B., Kühl, M., Richter, T. A modular luminescence lifetime imaging system for mapping oxygen distribution in biological samples. Sensors and Actuators B. 51, 163-170 (1998).
- Moßhammer, M., Brodersen, K. E., Kühl, M., Koren, K. Nanoparticle- and microparticle-based luminescence imaging of chemical species and temperature in aquatic systems: a review. Microchimical Acta. , 1-28 (2019).
- Koren, K., Kühl, M. CHAPTER 7. Optical O2 Sensing in Aquatic Systems and Organisms. Quenched-phosphorescence Detection of Molecular Oxygen: Applications in Life Sciences. 1, 145-174 (2018).
- Chen, H., Holst, G., Gratton, E. Modulated CMOS camera for fluorescence lifetime microscopy. Microscopy Research and Technique. 78, 1075-1081 (2015).
- Franke, R., Holst, G. A. Frequency-domain fluorescence lifetime imaging system (pco.flim) based on a in-pixel dual tap control CMOS image sensor. Proceedings of SPIE 93281, Imaging, Manipulation, and Analysis of Biomolecules, Cells, and Tissues XIII. , 1-19 (2015).
- Williams, P. N., et al. Localized flux maxima of arsenic, lead, and iron around root apices in flooded lowland rice. Environmental Science and Technology. 48 (15), 8498-8506 (2014).
- Schreml, S., et al. 2D luminescence imaging of physiological wound oxygenation. Experimental dermatology. 20 (7), 550-554 (2011).
- Trampe, E., et al. Functionalized Bioink with Optical Sensor Nanoparticles for O2 Imaging in 3D-Bioprinted Constructs. Advanced Functional Materials. 1804411, 1804411 (2018).
- Gouterman, M. Oxygen Quenching of Luminescence of Pressure Sensitive Paint for Wind Tunnel Research. Journal of Chemical Education. 74 (6), 697 (1997).
- Fischer, L. H., et al. Referenced dual pressure- and temperature-sensitive paint for digital color camera read out. Chemistry. 18 (49), 15706-15713 (2012).
- Fabricius-Dyg, J., Mistlberger, G., Staal, M., Borisov, S. M., Klimant, I., Kühl, M. Imaging of surface O2 dynamics in corals with magnetic micro optode particles. Marine Biology. 159 (7), 1621-1631 (2012).
- Koren, K., Jakobsen, S. L., Kühl, M. In-vivo imaging of O2 dynamics on coral surfaces spray-painted with sensor nanoparticles. Sensors and Actuators B: Chemical. 237, 1095-1101 (2016).
- Carraway, E. R., Demas, J. N., DeGraff, B. A., Bacon, J. R. Photophysics and Photochemistry of Oxygen Sensors Based on Luminescent Transition-Metal Complexes. Analytical Chemistry. 63 (4), 337-342 (1991).
- Klimant, I., Ruckruh, F., Liebsch, G., Stangelmayer, A., Wolfbeis, O. S. Fast response oxygen micro-optodes based on novel soluble ormosil glasses. Mikrochimica Acta. 131, 35-46 (1999).
- Askaer, L., Elberling, B., Glud, R. N., Kühl, M., Lauritsen, F. R., Joensen, H. P. Soil heterogeneity effects on O2 distribution and CH4 emissions from wetlands: In situ and mesocosm studies with planar O2 optodes and membrane inlet mass spectrometry. Soil Biology and Biochemistry. 42 (12), 2254-2265 (2010).
- Mayr, T., Borisov, S. M., Abel, T., Enko, B., Waich, K. Light Harvesting as a Simple and Versatile Way to Enhance Brightness of Luminescent Sensors. Analytical Chemistry. 81, 6541-6545 (2009).
- Kühl, M., et al. Microenvironmental Ecology of the Chlorophyll b-Containing Symbiotic Cyanobacterium Prochloron in the Didemnid Ascidian Lissoclinum patella. Frontiers in microbiology. 3, 1-18 (2012).
- Dalfen, I., Dmitriev, R. I., Holst, G., Klimant, I., Borisov, S. M. Background-Free Fluorescence-Decay-Time Sensing and Imaging of pH with Highly Photostable Diazaoxotriangulenium Dyes. Analytical Chemistry. 91 (1), 808-816 (2019).
- Chatni, M. R., Maier, D. E., Porterfield, D. M. Evaluation of microparticle materials for enhancing the performance of fluorescence lifetime based optrodes. Sensors and Actuators B: Chemical. 141, 471-477 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten