Method Article
Люминесценция Пожизненное изображение O2 с частотой домена на основе камеры системы
* Эти авторы внесли равный вклад
В этой статье
Резюме
Мы описываем использование новой, частотно-домен люминесценции жизни камеры для отображения 2D O2 распределения с оптическим датчиком фольги. Описаны камеры системы и процедуры анализа изображений наряду с подготовкой, калибровкой и применением сенсорной фольги для визуализации микросреды O2 в rhizosphere водных растений.
Аннотация
Мы описываем метод изображения растворенного кислорода (O2),в 2D при высоком пространственном (Злт; 50-100 мкм) и временном (Злт; 10 с) разрешением. Метод использует O2 чувствительных люминесцентных фольги датчика (планар оптод) в сочетании со специализированной системой камеры для визуализации люминесценции жизни в частотном домене. Планарные оптоиды готовятся путемрастворения O 2-чувствительного крася индикатора в полимере и распространения смеси на твердую опору в определенной толщине через покрытие ножом. После испарения растворителя планарная оптода помещается в тесном контакте с образцом интереса - здесь продемонстрированы корни водного растения Littorella uniflora. O2 концентрации-зависимых изменений в люминесценции жизни индикатора красителя в планере оптод изображен через заднюю часть прозрачной фольги перевозчика и аквариумстены стены с помощью специальной камеры. Эта камера измеряет срок службы люминесценции (к) через сдвиг в фазе угла между модулированным сигналом возбуждения и сигналом выбросов. Этот метод превосходит методы визуализации интенсивности люминесценции, так как сигнал не зависит от концентрации красителя или интенсивности источника возбуждения, и опирается исключительно на время распада люминесценции, которое является внутренне ссылкапара. Следовательно, дополнительный эталонный краситель или другие средства ссылки не нужны. Мы демонстрируем использование системы для макроскопической визуализации Ризосферы растений O2, но система камеры также может быть легко соединена с микроскопом.
Введение
Распределение и динамика растворенных газов и ионов в отложениях и почвах обеспечивают ключевую информацию о биогеохимических процессах, таких как микробное дыхание1,2,или потеря радиального кислорода из корней растений3,4,5, и химическая микросреда микробов6,7, корневища растений5,8,9 и животных норы10, 11,12. Биологическая и химическая активность в таких средах с ограниченным диффузией может создавать крутые градиенты химических субстратов или продуктов биогеохимических процессов. В частности, доступность O2 оказывает огромное влияние на биогеохимические процессы и, таким образом, на биологию и экологию системы13. Поэтому анализ концентраций O2 при высоком пространственном и временном разрешении имеет первостепенное значение в водных и наземных науках. Во-первых, электрохимические и оптические микросенсоры14,15 были разработаны для измерения этого важного анализ. Позже, 2 мерных (2D) изображения O2 с планарными оптодами был введен12,16,17,18,19, что позволило визуализации и количественной визуализации неоднородных O2 распределения в почвах и отложениях.
Planar O2 оптод состоят из O2-чувствительныйиндикатор красителя20, который растворяется в подходящем полимере21. Краситель индикатора возбуждается на определенных оптических длинах волн и излучает красный сдвинутый свет при расслаблении в виде люминесценции. В присутствии O2, возбужденный краситель индикатора может передавать свою энергию молекуле O2 при столкновении, которая называется свечением на основе столкновений, утоляющим22. Таким образом, интенсивность люминесценции, а также люминесценции жизни снижается с увеличением концентрации O2 23. В идеальном случае изменение интенсивности и продолжительности жизни следует уравнению Стерна-Волмера (уравнение 1), используя либо интенсивность люминесценции или продолжительность жизнив отсутствие (I0;0),либо присутствие (I, q) O2 при заданной концентрации. Константа Стерн-Волмер (Ksv) является мерой для чувствительности оптода к O2; KSV зависит от экологических переменных, таких как температура и давление.
(1)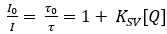
Запись таких изменений в люминесценции над фольгой планарного датчика с системой камеры может быть использована для визуализации соответствующих изменений в распределении O2. Первоначально, простой интенсивности люминесценции на основе O2 изображения был использован18. Однако такая методология очень чувствительна к внешним помехам, которые ставят под угрозу надежность результатов из-за разнородного освещения, колебаний источника возбуждения или камеры, а также неравномерного распределения красителя индикатора в рамках планарного оптода.
Некоторые из этих ограничений можно облегчить с помощью планарных оптодов для социеметрической визуализации17,24, где O2-чувствительныйкраситель индикатора совместно иммобилизован в полимерном слое планарного оптода с нечувствительным эталонным красителями, испускающим в другом спектральном диапазоне, чем O2-индикатор. На основе изображений выбросов, полученных в двух спектральных окнах, сигнал O2-чувствительныйэмиссионный сигнал делится на эталонный сигнал, генерируя изображение соотношения, которое менее подвержено вышеупомянутым помехам5,17. Метод требует использования второго красителя, который в идеале может быть возбужден одним и тем же источником возбуждения, но испускает на другой длине волны (без значительного спектрального перекрытия), в другом спектральном окне камеры (например, в другом цветном канале камеры RGB).
Кроме того, Изображение O2 может быть основано на количественной оценке O2-зависимогоизменения в сроке службы свечения красителя индикатора, который не зависит от неравномерного освещения или неоднородности в концентрации индикатора25. Первый люминесценции жизни на основе O2 визуализации системы были основаны на времени домена измерений с воротами в состоянии заряженного совместного устройства (CCD) камеры системы26, где импульсный источник возбуждения используется и люминесценции изображения принимаются в течение определенных временных интервалов в пределах возбуждения или выбросовиндикатора 8,23,27. Из таких изображений, люминесценции жизни может быть определена и коррелирует с соответствующей концентрации O2 в калибровке. Впоследствии изображения люминесценции для данного образца, прижатые к планарной оптоде, могут быть преобразованы в изображения соответствующего 2D-распределения концентрации O2. Эта система была использована во многих приложениях как в лаборатории, так и на situ16,28, но основные ворота в состоянии CCD камеры больше не коммерчески доступны.
Недавно была выпущена другая система камеры люминесценции, которая приобретает изображения в частотном домене8. Система опирается на постоянно модулированный источник света для возбуждения. Это может быть синусоидальная или квадратная волна вместо импульсного возбуждения, которое используется для приобретения изображения в домене времени. Эта модуляция приводит к модулированному излучению люминесценции красителя индикатора O2, который смещается по фазе под углом, а это зависит от срока службы свечения красителя индикатора (см. уравнение 2).
(2)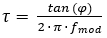
Изменение между возбуждением и эмиссионной амплитудой (т.е. так называемым индексом модуляции или глубиной (амплитуда, разделенная на постоянную люминесценцию) также зависит от жизни люминесценции. Таким образом, установив известную частоту модуляции, специальный датчик изображения CMOS в камере способен измерять срок службы люминесценции в диапазоне нс до диапазона,как подробно описано в другом месте 8,29,30. Общее руководство по принципу операции можно найти (с помощью следующей ссылки https://www.youtube.com/watch?v=xPAB_eVWOr8).
В следующем протоколе, мы демонстрируем использование новой системы камеры для визуализации распределения концентрации O2 вокруг корней водного пресноводного растения Littorella унифлоры в 2D9,31. Мы хотели бы подчеркнуть, что этот метод ни в коем случае не ограничивается этим приложением. Чувствительные к кислороду оптоды или сенсорные частицы27 в сочетании с различными методами визуализации были использованы в медицинских исследованиях32, в биопечати33, для чувствительных к давлению красок34,35, или для изучения фотосинтетических систем2,36,37, просто назвать несколько других областей применения.
протокол
1. Изготовление планара O2 оптода
- Растворите 1,5 мг люминесцентного индикатора O2 индикатора красителя платины (II)-5,10,15,20-тетракис-(2,3,4,5,5-пентафторфенил)-порфирин (PtTFPP) и 100 мг полистирола (PS) в 1 г хлороформа, чтобы получить так называемый 'сенсор.
ПРИМЕЧАНИЕ: Коктейль можно хранить в закрытом, герметичном стеклянном флаконе в течение нескольких часов в холодильнике и темноте до дальнейшего использования. - Исправить чистую, свободную от пыли полиэтиленовую терефталат (ПЭТ) фольгу (размер зависит от применения) на очищенной стеклянной пластине с помощью воды или этанола (70%) фильм(Рисунок 1А).
- Поместите очищенное устройство покрытия ножом (120 мкм) на фольгу и нанесите линию датчика коктейль перед устройством с помощью стеклянной пипетки (Рисунок 1B). Затем перетащите устройство для покрытия ножом медленно и равномерно над ПЭТ-фольгой, чтобы равномерно распределить коктейль.
ПРИМЕЧАНИЕ: Все материалы и инструменты должны быть тщательно очищены и изготовление должно быть сделано в свободной от пыли среде, такие как дым капот, поток скамейке или под устройством всасывания точки. Чтобы избежать неоднородности в конечной фольге датчика, шаги после нанесения датчика коктейль на фольгу должно быть сделано быстро, как хлороформ быстро испаряется. - Сухие готовые планар O2чувствительных оптодов в окружающем воздухе в течение 1 ч, а затем на ночь в отопительном шкафу при 50-60 градусов по Цельсию, в результате чего в окончательном слое толщины после растворителя испарения в размере 12 мкм. Хранить производства оптодов в темноте (например, в бумажном конверте) до дальнейшего использования (Рисунок 1C).
ПРИМЕЧАНИЕ: Planar O2 оптод ы могут храниться в сухих и в темноте в течение нескольких месяцев до лет до использования. Толщина окончательного слоя в диапазоне от 1-20 мкм показала хорошие результаты, при достаточном сигнале люминесценции и адекватном времени отклика.
2. Камера Ризо-сэндвич
- Очистите две стеклянные пластины (24,5 х 14 см2,толщина: 4 мм) с 96% этанола.
- Используйте светоизлечимый, акриловый клей (см. Таблица Материалов)для клейа микроскопа слайды (76 х 26 мм2, толщина: 1 мм) по краям первой стеклянной пластины (т.е. задняя камера стороны), оставляя один длинный край открытым. Используйте стеклорез, чтобы сократить микроскоп слайды по мере необходимости.
ВНИМАНИЕ: Резка стекла может вызвать острые края и должны быть обработаны с осторожностью.
ПРИМЕЧАНИЕ: Микроскоп слайды функции как прокладки между передней и задней, и в зависимости от толщины корней и размера растений, несколько слоев микроскопа слайды могут быть наклеены друг на друга. - Вырежьте планарную оптоду в требуемую форму и размер, чтобы поместиться в пространство между склеенными слайдами микроскопа. Поместите его на внутренней стороне передней стеклянной пластины с покрытием стороны вверх, чтобы контакт с образцом интереса при нажатии на него.
- Лента один край фольги оптодов к стеклянной пластине и добавить несколько капель водопроводной воды между стеклянной пластиной и фольгой оптодов(рисунок 2A). Медленно опустите фольгу на эти капли воды, позволяя ей выпрямить себя на стеклянной поверхности.
- Тщательно удалите пузырьки воздуха, застрявввввввающие между планарной оптодой и стеклянной пластиной, используя мягкую ткань, избегая при этом царапин сенсорного покрытия. Протрите стеклянную тарелку сухой и ленты оставшиеся края фольги оптодов к стеклянной пластине(Рисунок 2B).
ПРИМЕЧАНИЕ: Лента с подходящей сливкой под водой должна быть выбрана. - Осейоса с помощью сетки размером 0,5 мм. Поместите ложку влажного осадка на первую стеклянную пластину(рисунок 2С).
ПРИМЕЧАНИЕ: Размер сетки не должен быть больше половины толщины прокладки. - Равномерно распределите осадок и отрегулируйте его до той же толщины, что и прокладки слайд-слайдов микроскопа, используя плоскую стеклянную пластину. Тщательно очистите верхнюю поверхность слайдов микроскопа, чтобы убедиться, что вторая стеклянная пластина уплотнения камеры должным образом.
- Нанесите кремниевую смазку на поверхность слайда микроскопа. Обложка осадка с тонкой водяной пленкой, в то время как тщательно избегая образования пузырьков воздуха.
- Тщательно промыть один побег из унифлоры Littorella и поместите его на осадок, с листьями растений торчали из верхней открытой стороны(рисунок 2D).
- Поместите вторую стеклянную пластину, с прикрепленным к ней оптодом, на осадок и нанесите мягкое давление, чтобы привести оптоду в тесный контакт с корнями растений и окружающими отложениями.
ПРИМЕЧАНИЕ: Воздушные пузыри, попающие в осадок, могут быть удалены, наклонив стеклянные пластины, объединив их. - Закрепите стеклянные пластины вместе с помощью зажимов(Рисунок 2E). Высушите внешние края салфеткой. Держите листья увлажненные на протяжении всей сборки ризо-сэндвича (например, путем частого добавления нескольких капель воды).
- Затяните rhizo-сэндвич камеры с помощью виниловой электрической ленты. Печать края с моделированием глины и дополнительно ленты их с виниловой электрической лентой(рисунок 2F).
ПРИМЕЧАНИЕ: Если есть много пузырьков воздуха в отложениях, или осадочных зерен между слайдами микроскопа проспейса и второй стеклянной пластиной, камера должна быть собрана, как пора вода может просочиться (повторить шаги 2,4 - 2,8). - Используйте непрозрачный пластик, чтобы покрыть rhizo-сэндвич, но оставьте щель в фольге для листьев растения торчать. Вырежьте окно в пластиковой фольге, так что его можно открыть для экспериментов, развернув. Закройте окно во время акклиматизации раз с помощью резинки(Рисунок 2G) для защиты оптод от фото отбеливания в то время как растение инкубируется.
ПРИМЕЧАНИЕ: Как рост водорослей потенциально может помешать O2 концентрации измеряется, мы рекомендуем попытаться свести к минимуму его, с помощью фильтрованной воды, предварительно очищенных экспериментального оборудования и удаления водорослей при формировании.
3. Инкубация камеры Rhizo-сэндвича
- Поместите rhizo-сэндвич камеры в резервуар для воды (32 х 7 х 28 см3) в слегка наклоненее положение, чтобы стимулировать рост корня против планарной оптоды.
- Заполните резервуар с водой с достаточным количеством воды, чтобы полностью погрузить листья растения.
- Установите 14 ч свет, 10 ч темный цикл для акклиматизации растения с использованием контролируемой временем лампы. Поместите воздушный камень или водяной насос в бак для обеспечения аэрации и смешивания воды(рисунок 2H).
4. Визуализация
- Настройка изображений
- Удалите пластиковую фольгу, покрывающую планарную оптоду в корневой сэндвич-камере. Расположите камеру стеклянной стеной с оптодой в вертикальном положении к стене аквариума. Используйте спейсер, чтобы прижать rhizo-сэндвич камеры к стене аквариума.
ПРИМЕЧАНИЕ: Общая толщина стены аквариума плюс rhizo-сэндвич камерная стена не должна получить слишком толщиной, однако, толщины стекла для стен окатория для изображения люминесценции порекомендованы с йgt; 1 см, для того чтобы уменьшить пространственный перекрестный разговор путем увеличивать затухание рассеянного света. Важно использовать один и тот же материал для обеих стеклянных стен (один и тот же огнеупорный индекс), чтобы свести к минимуму рассеяние света на материальном интерфейсе; как это приведет к размытое изображение, а12. - Поместите частоту домена основе люминесценции жизни камеры оснащены целью (см. Таблица материалов) перед аквариумом и области интереса (корни водного растения Littorella uniflora, которые находятся в непосредственном контакте с планарной оптод) (Рисунок 3).
ПРИМЕЧАНИЕ: Камера может быть помещена на лабораторном стенде, чтобы легко регулировка высоты камеры. Положение лабораторного стенда должно быть помечено и закреплено. Кроме того, камера может быть приклеена к лабораторной стойке, чтобы избежать случайного движения камеры во время эксперимента. - Винт подходящий фильтр выбросов для изображения PtTFPP в качестве индикатора красителя (см. Таблица материалов) на цели камеры, чтобы удалить выводы из источника возбуждения.
ПРИМЕЧАНИЕ: Винт-на фильтры являются идеальными, но квадратные фильтры также могут быть использованы либо с соответствующим адаптером, или тщательно лентой их к цели. - Подключите светодиодный источник возбуждения (см. Таблица материалов) к модуляции и темные ворота выход камеры.
ПРИМЕЧАНИЕ: Первый обеспечивает сигнал модуляции для источника света, в то время как последний выключает свет во время считывания изображения датчика изображения. Подключите источник светодиодного возбуждения и камеру к компьютеру. Фоновый свет должен быть сведен к минимуму во время считывания изображения, либо затемнение всей комнаты или положить плотную, черную ткань на протяжении всей настройки. В последнем случае важно обеспечить достаточную вентиляцию, чтобы избежать нагрева камеры. - Закрепите световое направляющее в источник едких светодиодных возбуждений ных и расположите его, чтобы равномерно осветить планарную оптодную фольгу, покрывающую интересующую область.
ПРИМЕЧАНИЕ: В использованном светодиодном источнике возбуждения можно переключаться между 3 различными светодиодами (460 нм, 528 нм, 625 нм), интенсивность которых может быть скорректирована с помощью программного обеспечения для управления.
- Удалите пластиковую фольгу, покрывающую планарную оптоду в корневой сэндвич-камере. Расположите камеру стеклянной стеной с оптодой в вертикальном положении к стене аквариума. Используйте спейсер, чтобы прижать rhizo-сэндвич камеры к стене аквариума.
- Настройки и операторы камеры
ПРИМЕЧАНИЕ: Для описанных экспериментов мы использовали камеру на основе частотного домена в сочетании с выделенным модулем для визуализации в течение всей жизни в коммерчески доступном пакете программного обеспечения (см. Таблица Материалов).- Выберите камеру в выбранном программном обеспечении перед использованием.
ПРИМЕЧАНИЕ: Программное обеспечение и драйверы камер должны быть установлены до изображения в соответствии с руководящими принципами производителей. - Откройте программное обеспечение для управления светодиодами (опять же установлендое до начала эксперимента) и выберите подходящий светодиод (здесь: 528 нм), отметив резервное. Установите интенсивность светодиодов по мере необходимости (здесь до 30%). Убедитесь, что светодиод срабатывает внешним TTL; это делается путем тикания аналоговых и синхронизации для светодиодов.
ПРИМЕЧАНИЕ: Интенсивность светодиодов должна быть скорректирована индивидуально, так как слишком высокая мощность лазера может привести к ускоренному отбеливанию фото индикатора или эталонного красителя. - Сосредоточьте камеру и отрегулируйте диафрагму объектива вручную (в настоящем исследовании используйте f 2.8).
ПРИМЕЧАНИЕ: Важно сфокусировать камеру на планарной оптоде, а не на аквариумном стекле; это может быть обеспечено путем принятия изображения с линейкой для масштаба, и упором на тень правителя на оптоде, а не на фактической правителя. - Установите следующие параметры в панели управления камерой программного обеспечения: внутренний источник модуляции; синусоидальная волна для выходной волны; дополнительная фаза выборки (Да); 8 фазовые образцы, фазовый порядок напротив, Tap A и B считывания; Частота модуляции 5 кГц.
ПРИМЕЧАНИЕ: Эти параметры влияют на качество изображения и могут быть изменены в случае необходимости. Производитель камеры предоставляет рекомендации по отдельным параметрам (производитель камеры выпускает руководящие принципы и обновления всякий раз, когда программное обеспечение обновляется). - Возьмите эталонное изображение перед экспериментами.
ПРИМЕЧАНИЕ: Это может быть сделано либо путем визуализации калибровки стандарта (люминесцентный краситель с известным сроком службы (нс или )), или с помощью отраженного света светодиода. В последнем случае фильтр длительного прохода выбросов должен быть удален из цели и известный срок службы может быть установлен до 1 нс. - Отрегулируйте время экспозиции в разделе калибровки специального программного обеспечения для визуализации до считывания ROI Statistics (в нижней части этой панели) для нормализованного изображения интенсивности люминесценции в диапазоне 0,68 - 0,72.
ПРИМЕЧАНИЕ: Теперь срок службы отсчета (например, 1 нс) дается в качестве вклада в программное обеспечение. - Ссылка на захват прессы для начала приобретения серии эталонных измерений.
ПРИМЕЧАНИЕ: После завершения, справочные данные сохраняются и либо один или промежуток времени измерения могут быть сделаны на образцах.
- Выберите камеру в выбранном программном обеспечении перед использованием.
- Калибровка оптода O2
- Расположите кусок планара O2-чувствительного оптода в (маленьком) стеклянном аквариуме. Исправьте планарную оптоду на стеклянной стене калибровочной камеры, как описано ранее (см. раздел 2.3). Поместите калибровочный аквариум перед камерой. Обеспечить даже освещение светодиодом, а также то, что оптод заполняет все поле зрения.
ПРИМЕЧАНИЕ: планарная оптода должна быть из того же куска фольги или изготовлена из того же датчика, что и фольга, используемая в самом эксперименте. - Заполните аквариум той же жидкой средой, что и в экспериментах.
ПРИМЕЧАНИЕ: Использование различных носителей для калибровки и экспериментов может повлиять на измерение,(например, путем изменения реакции датчика и/или растворимости O2). Таким образом, калибровка должна проводиться в той же среде и при той же температуре, что и фактический эксперимент. Колебания температуры повлияют на сигнал люминесценции и следует избегать. Однако, если температура не может быть стабильной, компенсация температуры должна быть сделана путем калибровки O2-чувствительныхоптод (несколько точек) при различных (соответствующих) температурах и последующего пересчета значений. - Отрегулируйте концентрацию O2 в калибровочном аквариуме, промывая воду с помощью газо-смеси воздуха/N2 известной концентрации O2 с помощью газоемконебного устройства. Убедитесь, что вода хорошо уравновеш— с используемой газовой смесью путем аератива в течение достаточного времени (зависит от скорости потока и размера аквариума).
ПРИМЕЧАНИЕ: Мы рекомендуем мониторинг уровня O2 в калибровочном аквариуме с помощью внешнего, откалиброватого датчика O2 с компенсацией температуры (например, с помощью оптоволоконного или электрохимического датчика O2). - Возьмите серию изображений в различных концентрациях O2 в камере калибровки.
ПРИМЕЧАНИЕ: По крайней мере пять различных концентраций O2 должны быть измерены для того, чтобы позволить надлежащей кривой подходят к приобретенным калибровки данных. Важно измерить на 0 hPa (аноксические условия), а затем распределить другие значения по динамическому диапазону вашего конкретного красителя индикатора. Здесь мы использовали PtTFPPв качестве O 2-чувствительный индикатор красителя обездвижены в полистирола матрицы. Изображения были сделаны по адресу 0, 48, 102, 156 и 207 hPa; 207 hPa соответствует 100% насыщению воздуха при заданной сослюне и давлении.
- Расположите кусок планара O2-чувствительного оптода в (маленьком) стеклянном аквариуме. Исправьте планарную оптоду на стеклянной стене калибровочной камеры, как описано ранее (см. раздел 2.3). Поместите калибровочный аквариум перед камерой. Обеспечить даже освещение светодиодом, а также то, что оптод заполняет все поле зрения.
- Изображение образца
- Поместите образец перед камерой и обеспечить даже освещение.
- Выключите свет, снабжающий облучение растений (и всех других источников света) непосредственно перед приобретением люминесценции жизни изображение завода. Отрегулируйте время приобретения на основе изображения интенсивности, гарантируя, что сигнал не является ни перенасыщенным, ни слишком слабым для хорошего сигнала к шуму (S/N) в определении продолжительности жизни.
- Подвергаете растение различным световым условиям (например, свету/темне) и приобретайте набор изображений.
- Включите свет в комнате, чтобы приобрести структурное изображение.
ПРИМЕЧАНИЕ: Когда фоновый свет включен, камера не будет измерять реалистичное изображение жизни. Тем не менее, изображение интенсивности теперь показывает все поле зрения, как видно через полупрозрачный оптод. - Возьмите изображение с линейкой или так в поле зрения, чтобы позже масштабирования приобретенных изображений.
5. Анализ данных
- Экспорт фазового срока службы и интенсивности изображений непосредственно из специального программного обеспечения изображений, используя макрос, предоставляемый производителем камеры.
- Выполняйте дальнейший анализ изображений с помощью свободно доступного программного обеспечения для анализа изображений (см. Таблицу Материалов).
- Откройте фазовые изображения калибровки в программном обеспечении для анализа изображений и определите среднее количество всего изображения с помощью функции измерения. Участок измеренных жизней против известных концентраций O2, чтобы определить функцию калибровки(Рисунок 4A).
- Вычислите 0/з из всех данных(0 является измеренной фазы жизни в отсутствие O2). Участок эти значения по сравнению с известными Концентрации O2 (Рисунок 4B).
- Определите параметры Ksv и f от калибровочного участка, используя упрощенную двухместную модель для динамического закалки коллизии (equation 3)38,39, где является концентрация O2. Определите подгонку-функцию в программном обеспечении анализа данных, которое затем определяет Ksv и f.
(3)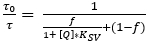
- Откройте приобретенные образец изображений в программном обеспечении для анализа изображений для преобразования изображений в концентрации O2, используя определенные параметры Ksv,f и No0.
ПРИМЕЧАНИЕ: В качестве альтернативного подхода также приобретенные значения фазы калибровки(рисунок 4А)могут быть использованы непосредственно. В этом случае для калибровки используется экспоненциальная подгонка с использованием функции кривой. - Откройте изображение с линейкой рядом в программном обеспечении анализа изображений и измерьте известное расстояние с помощью измерительного инструмента. Установите это измерение как глобальную шкалу под шкалой Set.
Результаты
В качестве примера применения новой системы визуализации мы показываем 2D O2 изображения сложного биологического образца (т.е. ризосферы водного растения Littorella uniflora).
Во-первых, метод описывает изготовление пленки датчика планара, так называемой планарной оптоды. Как видно на рисунке 1,такая оптода изготовлена из тонкого слоя оптического индикатора в полимерной матрице, которая распространяется на прозрачную опору. Следуя описанному протоколу, получается однородная сенсорная пленка с равномерной толщиной, определяемая зазором устройства покрытия ножом. Если произведенная оптода имеет пятнистое распределение материала датчика (например, отверстия в покрытии, показывает полоски, или агрегаты красителя (это можно оценить визуально, и визуально with the help of лампа UV)), то протокол нужно повторить и все материалы нужно тщательно очистить используя ацетон.
После того, как планар оптод подготовлен, образец может быть приведен в тесном контакте с зондирующим слоем планарной оптоды, как показано здесь с планарным оптодом, интегрированным в rhizo-сэндвич камеру, где корни растения в окружающей матрице осадочных отложений могут быть расположены в тесном контакте с планарной оптодой(рисунок 2). При правильном приготовлении, rhizo-сэндвич камера должна быть легко подвижна из одного аквариума (инкубация) в другой (измерение). Если не сконструировано правильно, то rhizo-sandwich камера может быть нестабильна, потерять осадок или содержать пузырьки воздуха. Таким образом, рекомендуется визуальное обследование rhizo-сэндвичской камеры непосредственно после сборки.
Данный протокол позволяет частотно-домен основе люминесценции жизни изображения образца в контакте с планарной оптод с помощью частоты домена основе люминесценции жизни камеры. Более подробная информация об этой системекамеры,такие как режим приобретения изображения и научно-дополнительные металлооксид-полупроводниковые (SCMOS) характеристики камеры приведены в последних публикациях8,29.
Сама установка довольно проста и включает в себя только камеру, которая управляет источником света (в данном случае, светодиодный источник возбуждения) и образец с оптодой(рисунок 3). Убедитесь, что все части правильно соединены и что образец освещается однородно. Фоновый свет следует избегать при преформировании измерений.
Перед визуализацией образца необходимо откалибровать оптоду. Как видно на рисунке 4A, измеренный срок службы люминесценции уменьшается с увеличением концентрации O2 после квазиэкспоненциального распада. Эта взаимосвязь также может быть описана с помощью упрощенной двухузловой модели(рисунок 4B и уравнение 3). В данном примере параметры, необходимые для последующего расчета концентрации O2, были следующими; 0 - 56,26 х, Ксв 0,032 hPa-1 и f 0,86.
Выполнение калибровки также является идеальным способом проверки правильной работы системы. Если все компоненты установлены, как описано здесь (или в рамках руководящих принципов производителей), измеренный срок службы должен показать ту же зависимость O2, как видно на рисунке 4. Кроме того, для той же комбинации материалов зондирования O2 (полимер и краситель) измеренныйq 0 должен находиться в том же диапазоне (несколько сея), как измеряется здесь (главным образом под влиянием экспериментальной температуры). Если не удается получить аналогичную кривую калибровки, убедитесь, что все шаги были выполнены правильно. Иногда оптод случайно фиксируется с чувствительной стороной, обращенной к стеклянной стене, а не образец, или приобретенные изображения чрезмерно или недоэкспонированных.
С параметрами калибровки, можно определить концентрацию O2 путем визуализации люминесценции жизни (я). Это показано на рисунке 5A,B, где распределение концентрации O2 в rhizosphere унифлоры Littorella был изображен в темноте и после воздействия света на 500 фотонов м-2 s-1 на 12 ч, соответственно. Из-за фотосинтетической активности растения концентрация O2 в ризосфере увеличилась после воздействия света. Помимо изображений, также "структурные" изображения могут быть приобретены под внешним освещением, сохраняя при этом геометрию изображения фиксированной. Таким образом, изображения O2 могут быть точно коррелированы со структурным изображением(рисунок 5C),поперечными секциями или областями интереса. Например, профили концентрации O2 на одном корне были извлечены из изображения, полученного в темноте и свете, соответственно(рисунок 5D).

Рисунок 1: Изготовление планара O2 оптода. (A) ПЭТ-фольга фиксируется на стеклянной пластине и устройство для покрытия ножом помещается на фольгу. (B) Подготовленный датчик коктейль распространяется на ПЭТ фольги, как тонкая линия перед ножом покрытия устройства. (C) Устройство для покрытия ножом перемещается вниз, чтобы распространить датчик коктейль как тонкая пленка на ПЭТ фольги, которая после растворителя испарения приводит к готовым к использованию планарной оптоды. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 2: Ризо-сэндвич камерная сборка с интеграцией планара O2 оптод. (A) Оптод фиксируется на одной из стеклянных пластин с помощью водяной пленки. (B) Оптод приклеен к пластине с электрической лентой. (C) Осадок заполняется в противоположной пластине с прикрепленными прокладками (т.е. слайдами микроскопа). (D) Корни растений помещаются на равномерно распределенные осадки. (E) Rhizo-сэндвич камера закрыта и временно закреплена с зажимами. (F) Полностью закрытая и собранная rhizo-сэндвич камера. (G) Для защиты оптод от воздействия света инкубационной лампой и во избежание роста водорослей пластиковая крышка помещается над собранной rhizo-сэндвич камеры. (H) Rhizo-сэндвич камеры инкубируется в аквариуме. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 3: Установка изображения, содержащая частоту домена основе люминесценции жизни камеры, с целью сосредоточены на образец с оптод сзади через прозрачный аквариум и rhizo-сэндвич камерных стен. Световое руководство источника светодиодного возбуждения расположено для равномерного освещения образца. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
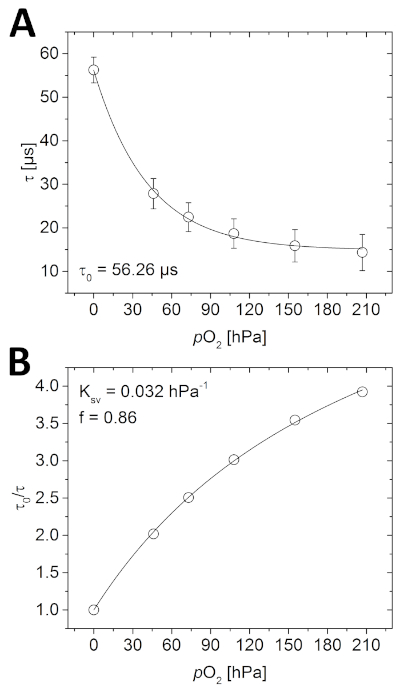
Рисунок 4: Кривые калибровки для планара O2 оптода. (A) Различные фосфоресценции жизни измеряется в соответствующих Концентрации O2 в заполненной водой калибровочной камере. (B) Стерн-Волмер участок калибровочных данных, установленных с использованием упрощенной двухузловой модели для динамического закалки коллизии (уравнение 3). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
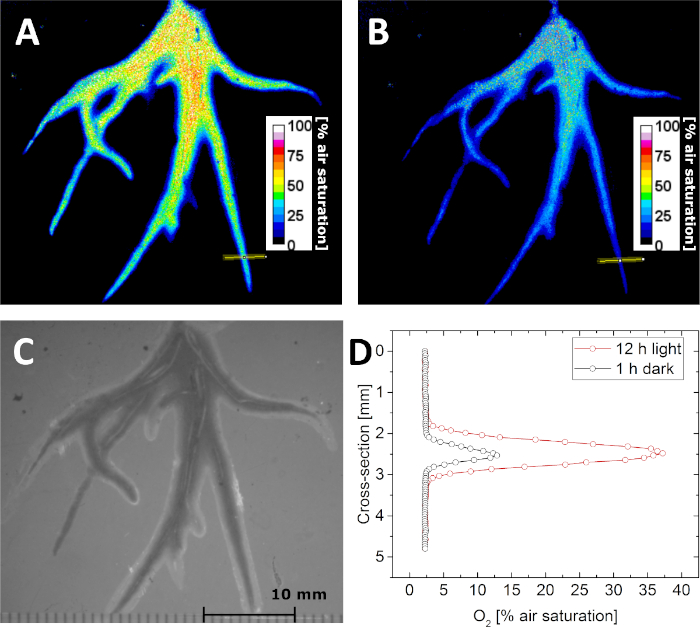
Рисунок 5: Пожизненная визуализация распределения O2 в rhizosphere водного растения Littorella uniflora. (A) O2 распределение после поддержания завода под светом в течение 12 ч при примерно 500 фотонов м-2 s-1. (B) O2 распределения после сохранения завода в темноте в течение 1 ч. (C) Структурное изображение корней растений, как видно через планар оптоды. (D) Поперечный профиль концентрации O2 (место указывается желтой линией в панели A и B) после 12 ч в свете (красный) и 1 ч в темноте (черный). Адаптированс с разрешения (Корен, К., Мохаммер, М., Шольц, В.В., Борисов, С.М., Холст, Г., Кюль, М. Люминесценция Пожизненная Изображение химических датчиков - Сравнение между time-Domain и частотно-домен систем ы камеры. Аналитическая химия. 91 (5), 3233-3238, doi: 10.1021/acs.analchem.8b05869 (2019)). Авторское право (2019) Американское химическое общество. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
В этом протоколе охватывается весь рабочий поток от подготовки оптодов к анализу изображений O2. Следуя этому протоколу, химические изображения могут быть получены с помощью новой частоты домена основе люминесценции жизни камеры. В зависимости от применения, планар оптод может быть изготовленв в различных размерах и толщиной слоя слоя сенсорного слоя, начиная от надежных 50-100 мкм толщиной планар оптод несколько десятых квадратных сантиметров до микроскопа крышка скользит с lt;1 мкм толщиной датчика слоев6,40. Потенциал этого метода был продемонстрирован с конкретным применением, но не ограничивается только O2 изображения в растениях rhizospheres12,28.
Этот метод имеет несколько преимуществ по сравнению с чистой люминесценции интенсивности на основе химических методов визуализации. Люминесценция жизни изображения не является, или, по крайней мере, гораздо меньше, пострадавших от неравномерного освещения, неравномернотолотачение толщины, и фото отбеливания25. Кроме того, этот метод позволяет избежать использования дополнительного эталонного красителя, распространенного в коэффициентеметрической визуализации17,37. По сравнению с другими системами камер на основе жизни, таких как широко используемые закрытые камеры тайм-домен8,26, новая система камеры и протокол, представленный здесь может доставить сопоставимые результаты. В недавней публикации были сопоставлены аналитические характеристики этих двух систем, и было установлено, что система люминесценции на основе частотного домена, по крайней мере, сопоставима с прекращенным предшественником на основе тайм-домена8.
Мы представили простейшую оптоду O2, состоящую только из индикатора в полимерной матрице. Помимо нескольких других возможных индикаторов O22, которые могут быть использованы добавки могут быть включены, т.е. рассеяния агентов, таких как TiO 2 или алмазный порошок2 для увеличения сигнала датчика при одновременном снижении прозрачности оптоды. Также дополнительные красители могут быть использованы для повышения интенсивности сигнала с помощью передачи энергии41.
Для изготовления планарного оптода мы рекомендуем использовать зазор в устройстве покрытия ножом 75 - 120 мкм, чтобы дать окончательный сенсорный слой толщиной около 7,5 до 12 мкм после испарения растворителя (около 10% от используемого зазора), при использовании описанного состава датчика коктейль. Это хороший компромисс между интенсивностью сигнала, который может быть изменен более высокой загрузкой красителя, или путем выбора индикатора и эталонных красителей более высокой яркости и времени отклика. Увеличение толщины слоя приводит к увеличению времени отклика, так как временной промежуток, необходимый для поиска термодинамического равновесия в сенсирующем слое с окружающими носителями, увеличивается на12.
Оптоды, как описано здесь, реагируют на изменения концентрации O2 в течение нескольких секунд17, имея при этом достаточно сильный сигнал люминесценции. Ультратонкие сенсорные покрытия с субсекундным временем отклика могут быть реализованы со спин-покрытием6. Если опоры или устройство для покрытия ножом не хорошо очищены, это может привести к неоднородным слоям датчика. Кроме того, когда коктейль не является полностью однородным или применяется слишком быстро после распространения перед устройством покрытия такой нежелательный результат может наблюдаться. Поэтому, возможно, потребуется некоторая практика для подготовки оптимальных оптодов.
Метод может быть использован для изображения образцов, которые могут быть помещены в тесном контакте с оптодой, таких как некоторые морские животные42, биопленки6 и почвы31 просто назвать несколько. Мы представляем автономную установку с помощью цели, однако, камера может быть легко соединена с микроскопом для химического изображения более высокого разрешения43.
В то время как время домена на основе люминесценции жизни изображения включенповпой фоновой флуоресценции26, это проблема при использовании новой частоты домена на основе камеры системы8. Благодаря непрерывному приобретению изображения, эта камера будет записывать любой фон флуоресценции образца, которые могут быть возбуждены по выбранному светодиоду и испускает в выбранном спектральном окне, как это определено фильтром выбросов на цели камеры. Это приведет к явно более низкому сроку службы и, следовательно, к ложным показаниям. В случае, если вы работаете с образцами со значительным внутренней флуоресценции перекрытия с O2 датчик возбуждения и выбросов, важно применять дополнительную оптическую изоляцию на верхней части оптоды, путем покрытия дополнительный слой, содержащий углеродный черный2,17. Таким образом, только люминесценция, излучаемых из планара оптод достигнет камеры. Для того, чтобы проверить на фоне люминесценции изображение без оптоды может быть принято, что затем будет исключительно показать внутреннюю люминесценцию образца. Также можно добавить рассеяния агентов, таких как TiO2 или алмазный порошок2,44, к датчику коктейль, чтобы увеличить интенсивность люминесценции красителя индикатора. Тем не менее, это также может привести к более быстрому отбеливанию фотографий и TiO2 является известным фотокатализатором, который может ухудшить фотостабильность красителя41. Еще одним аспектом для рассмотрения является фоновый свет. При визуализации люминесценции жизни, фоновый свет необходимо избегать как можно более эффективно. Таким образом, этот метод визуализации требует установки, которая будет помещена в темную среду и любой внешний источник света должен быть временно выключен во время приобретения изображения.
Таким образом, люминесценция жизни изображения является надежным химическим методом визуализации, которые могут быть адаптированы к различным приложениям. Этот протокол (см. раздел 1 - 5) охватывает все основные шаги для создания изображения O2 и использует в настоящее время наиболее гибкую систему визуализации люминесценции частотного домена, которая может заменить прекращенную закрытой временной домен камеры для 2D O2 изображений с планарными оптодами.
Раскрытие информации
Автор Герхард Холст является сотрудником PCO AG, который производит камеру системы, используемой в этой статье. PCO AG внесла финансовый вклад в публикацию и расходы на открытый доступ к этой статье.
Благодарности
Мы благодарим Софи Линдегор Якобсен (Копенгагенский университет) и Ларса Боррегора Педерсена (Орхусский университет) за техническую помощь. Финансирование этого исследования было получено за результат гранта Sapere-Aude Advanced от Независимого исследовательского фонда Дании (DFF-1323-00065B; МК), гранты на проекты от Независимого исследовательского фонда Дании естественные науки (DFF-8021-00308B; МК) и технические и производственные науки (DFF-8022-00301B и DFF-4184-00515B; МК), Датский национальный исследовательский фонд (DNRF136) и Фонд Поул Ду Йенсена (KK).
Материалы
| Name | Company | Catalog Number | Comments |
| Air pump with air stone and water pump | Local aquarium store | ||
| Chloroform | Sigma Aldrich | 67-66-3 | |
| DC4 silicone compound | Dow Corning GmbH | 2793695 | |
| Gas mixer | Vögtlin Instruments GmbH | red-y compact meter GCM | This is just one possible instrument. Several companies offer gas mixing devices |
| Glass plates and aquaria | Local aquarium or hardware store | ||
| ImageJ Software | ImageJ | Freely available imaging software (imagej.nih.gov/ij/index.html) | |
| Knife-coating device | BYK-GARDNER GMBH byk.com | 2021 | This is a four sided film applicator enabling easy variation of the film thickness. Other versions are also available. We recommend a thickness of the applied film between 75-120 µm, which yields a final sensor layer thickness of ~10% of the applied thickness before solvent evaporation. |
| LED lamp, Reflector PAR38 | Megaman | MM17572 | |
| LED LEDHUB | Omicon Laserage, Germany | Can be configured with a variety of LEDs. For the presented example, the green LED (528 nm) is essential | |
| LOCTITE AA 3494 | Henkel AG & Co. KGaA | NA | Acrylic-based instant adhesive |
| NIS Elements AR Software | Nikon Inc | Software package used for image acquisition | |
| pco.flim | PCO AG, Germany | Frequency domain based luminescence lifetime camera | |
| platinum(II)-5,10,15,20-tetrakis-(2,3,4,5,6-pentafluorphenyl)-porphyrin (PtTFPP) | Frontier Scientific | PtT975 | O2 indicator |
| polyethylene terephthalate (PET) foil | Goodfellow | 320-992-72 | Such foils might also be found from other providers and serve as solid support |
| Polystyrene (PS) | Sigma Aldrich | 9003-53-6 | Polymer matrix |
| Schott RG610 filter | www.uviroptics.com | Here 52mm screw on Filters can obtained. Other sources offer square glass filters from Schott glass that can be fixed in front of the objective | |
| Vinyl electrical tape | Scotch, Super 33+ | NA | |
| Zeiss Makro Planar 2/100 with Hama C for Nikon adaptor | delivered with the camera | Here any other objective might also be used in combination with an adaptor if the objective does not have a C-mount |
Ссылки
- Glud, R. N., Kühl, M., Kohls, O., Ramsing, N. B. Heterogeneity of oxygen production and consumption in a photosynthetic microbial mat as studied by planar optodes. Journal of Phycology. 35 (2), 270-279 (1999).
- Moßhammer, M., Strobl, M., Kühl, M., Klimant, I., Borisov, S. M., Koren, K. Design and Application of an Optical Sensor for Simultaneous Imaging of pH and Dissolved O2 with Low Cross-Talk. ACS Sensors. 1 (6), 681-687 (2016).
- Jensen, S. I., Kühl, M., Glud, R. N., Jørgensen, L. B., Priemé, A. Oxic microzones and radial oxygen loss from roots of Zostera marina. Marine Ecology Progress Series. , 49-58 (2005).
- Larsen, M., Santner, J., Oburger, E., Wenzel, W. W., Glud, R. N. O2 dynamics in the rhizosphere of young rice plants (Oryza sativa L.) as studied by planar optodes. Plant and Soil. 390 (1-2), 279-292 (2015).
- Brodersen, K. E., Koren, K., Moßhammer, M., Ralph, P. J., Kühl, M., Santner, J. Seagrass-Mediated Phosphorus and Iron Solubilization in Tropical Sediments. Environmental Science and Technology. 51, 14155-14163 (2017).
- Kühl, M., Rickelt, L. F., Thar, R. Combined imaging of bacteria and oxygen in biofilms. Applied and Environmental Microbiology. 73 (19), 6289-6295 (2007).
- Sønderholm, M., et al. Tools for studying growth patterns and chemical dynamics of aggregated Pseudomonas aeruginosa exposed to different electron acceptors in an alginate bead model. npj Biofilms and Microbiomes. 3, 1-11 (2018).
- Koren, K., Moßhammer, M., Scholz, V. V., Borisov, S. M., Holst, G., Kühl, M. Luminescence Lifetime Imaging of Chemical Sensors - A Comparison between Time-Domain and Frequency-Domain Based Camera Systems. Analytical Chemistry. 91 (5), 3233-3238 (2019).
- Brodersen, K. E., Koren, K., Lichtenberg, M., Kühl, M. Nanoparticle-based measurements of pH and O2 dynamics in the rhizosphere of Zostera marina L.: effects of temperature elevation and light-dark transitions. Plant, Cell & Environment. 39 (7), 1619-1630 (2016).
- Zhu, Q., Aller, R. C., Fan, Y. High-Performance Planar pH Fluorosensor for Two-Dimensional pH Measurements. in Marine Sediment and Water. Environmental Science & Technology. 39, 8906-8911 (2005).
- Murniati, E., Gross, D., Herlina, H., Hancke, K., Glud, R. N., Lorke, A. Oxygen imaging at the sediment-water interface using lifetime-based laser induced fluorescence (τLIF) of nano-sized particles. Limnology and Oceanography: Methods. 14 (8), 506-517 (2016).
- Santner, J., Larsen, M., Kreuzeder, A., Glud, R. N. Two decades of chemical imaging of solutes in sediments and soils - a review. Analytica Chimica Acta. , 9-42 (2015).
- Glud, R. N. Oxygen dynamics of marine sediments. Marine Biology Research. 4 (4), 243-289 (2008).
- Revsbech, N. P., Jorgensen, B. B., Blackburn, T. H. Oxygen in the Sea Bottom Measured with a Microelectrode. Science. 207 (4437), 1355-1356 (1980).
- Klimant, I., Meyer, V., Kuhl, M. Fiberoptic oxygen microsensors, a new tool in aquatic biology. Limnology and Oceanography. 40 (6), 1159-1165 (1995).
- Glud, R. N., Tengberg, A., Kühl, M., Hall, P. O. J., Klimant, I., Holst, G. An in situ instrument for planar O2 optode measurements at benthic interfaces. Limnology and Oceanography. 46 (8), 2073-2080 (2001).
- Larsen, M., Borisov, S. M., Grunwald, B., Klimant, I., Glud, R. N. A simple and inexpensive high resolution color ratiometric planar optode imaging approach: application to oxygen and pH sensing. Limnology and Oceanography: Methods. 9, 348-360 (2011).
- Glud, R., Ramsing, N., Gundersen, J., Klimant, I. Planar optrodes:a new tool for fine scale measurements of two-dimensional O2 distribution in benthic communities. Marine Ecology Progress Series. 140, 217-226 (1996).
- Frederiksen, M. S., Glud, R. N. Oxygen dynamics in the rhizosphere of Zostera marina: A two-dimensional planar optode study. Limnology and Oceanography. 51 (2), 1072-1083 (2006).
- Quaranta, M., Borisov, S. M., Klimant, I. Indicators for optical oxygen sensors. Bioanalytical Reviews. 4, 115-157 (2012).
- Koren, K., Hutter, L., Enko, B., Pein, A., Borisov, S. M., Klimant, I. Tuning the dynamic range and sensitivity of optical oxygen-sensors by employing differently substituted polystyrene-derivatives. Sensors and Actuators B: Chemical. 176 (100), 344-350 (2013).
- Borisov, S. M. Fundamentals of Quenched Phosphorescence O2 Sensing and Rational Design of Sensor Materials. Quenched-phosphorescence Detection of Molecular Oxygen: Applications in Life Sciences. , 1-18 (2018).
- Wang, X., Wolfbeis, O. S. Optical methods for sensing and imaging oxygen: materials, spectroscopies and applications. Chemical Society Reviews. 43, 3666-3761 (2014).
- Ehgartner, J., Wiltsche, H., Borisov, S. M., Mayr, T. Low cost referenced luminescent imaging of oxygen and pH with a 2-CCD colour near infrared camera. The Analyst. 139 (19), 4924 (2014).
- Meier, R. J., Fischer, L. H., Wolfbeis, O. S., Schäferling, M. Referenced luminescent sensing and imaging with digital color cameras: A comparative study. Sensors and Actuators B: Chemical. 177, 500-506 (2013).
- Holst, G., Kohls, O., Klimant, I., König, B., Kühl, M., Richter, T. A modular luminescence lifetime imaging system for mapping oxygen distribution in biological samples. Sensors and Actuators B. 51, 163-170 (1998).
- Moßhammer, M., Brodersen, K. E., Kühl, M., Koren, K. Nanoparticle- and microparticle-based luminescence imaging of chemical species and temperature in aquatic systems: a review. Microchimical Acta. , 1-28 (2019).
- Koren, K., Kühl, M. CHAPTER 7. Optical O2 Sensing in Aquatic Systems and Organisms. Quenched-phosphorescence Detection of Molecular Oxygen: Applications in Life Sciences. 1, 145-174 (2018).
- Chen, H., Holst, G., Gratton, E. Modulated CMOS camera for fluorescence lifetime microscopy. Microscopy Research and Technique. 78, 1075-1081 (2015).
- Franke, R., Holst, G. A. Frequency-domain fluorescence lifetime imaging system (pco.flim) based on a in-pixel dual tap control CMOS image sensor. Proceedings of SPIE 93281, Imaging, Manipulation, and Analysis of Biomolecules, Cells, and Tissues XIII. , 1-19 (2015).
- Williams, P. N., et al. Localized flux maxima of arsenic, lead, and iron around root apices in flooded lowland rice. Environmental Science and Technology. 48 (15), 8498-8506 (2014).
- Schreml, S., et al. 2D luminescence imaging of physiological wound oxygenation. Experimental dermatology. 20 (7), 550-554 (2011).
- Trampe, E., et al. Functionalized Bioink with Optical Sensor Nanoparticles for O2 Imaging in 3D-Bioprinted Constructs. Advanced Functional Materials. 1804411, 1804411 (2018).
- Gouterman, M. Oxygen Quenching of Luminescence of Pressure Sensitive Paint for Wind Tunnel Research. Journal of Chemical Education. 74 (6), 697 (1997).
- Fischer, L. H., et al. Referenced dual pressure- and temperature-sensitive paint for digital color camera read out. Chemistry. 18 (49), 15706-15713 (2012).
- Fabricius-Dyg, J., Mistlberger, G., Staal, M., Borisov, S. M., Klimant, I., Kühl, M. Imaging of surface O2 dynamics in corals with magnetic micro optode particles. Marine Biology. 159 (7), 1621-1631 (2012).
- Koren, K., Jakobsen, S. L., Kühl, M. In-vivo imaging of O2 dynamics on coral surfaces spray-painted with sensor nanoparticles. Sensors and Actuators B: Chemical. 237, 1095-1101 (2016).
- Carraway, E. R., Demas, J. N., DeGraff, B. A., Bacon, J. R. Photophysics and Photochemistry of Oxygen Sensors Based on Luminescent Transition-Metal Complexes. Analytical Chemistry. 63 (4), 337-342 (1991).
- Klimant, I., Ruckruh, F., Liebsch, G., Stangelmayer, A., Wolfbeis, O. S. Fast response oxygen micro-optodes based on novel soluble ormosil glasses. Mikrochimica Acta. 131, 35-46 (1999).
- Askaer, L., Elberling, B., Glud, R. N., Kühl, M., Lauritsen, F. R., Joensen, H. P. Soil heterogeneity effects on O2 distribution and CH4 emissions from wetlands: In situ and mesocosm studies with planar O2 optodes and membrane inlet mass spectrometry. Soil Biology and Biochemistry. 42 (12), 2254-2265 (2010).
- Mayr, T., Borisov, S. M., Abel, T., Enko, B., Waich, K. Light Harvesting as a Simple and Versatile Way to Enhance Brightness of Luminescent Sensors. Analytical Chemistry. 81, 6541-6545 (2009).
- Kühl, M., et al. Microenvironmental Ecology of the Chlorophyll b-Containing Symbiotic Cyanobacterium Prochloron in the Didemnid Ascidian Lissoclinum patella. Frontiers in microbiology. 3, 1-18 (2012).
- Dalfen, I., Dmitriev, R. I., Holst, G., Klimant, I., Borisov, S. M. Background-Free Fluorescence-Decay-Time Sensing and Imaging of pH with Highly Photostable Diazaoxotriangulenium Dyes. Analytical Chemistry. 91 (1), 808-816 (2019).
- Chatni, M. R., Maier, D. E., Porterfield, D. M. Evaluation of microparticle materials for enhancing the performance of fluorescence lifetime based optrodes. Sensors and Actuators B: Chemical. 141, 471-477 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены