Method Article
Luminescenza Lifetime Imaging di O2 con un sistema di telecamere basato su frequenza-dominio
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Descriviamo l'uso di una nuova telecamera a vita di luminescenza del dominio di frequenza per la mappatura delle distribuzioni 2D O2 con fogli di sensori ottici. Il sistema di telecamere e le procedure di analisi delle immagini sono descritte insieme alla preparazione, alla calibrazione e all'applicazione di fogli di sensori per la visualizzazione del microambiente O2 nella rizosfera delle piante acquatiche.
Abstract
Viene descritto un metodo per l'immagine di ossigeno disciolto (O2), in 2D ad alta risoluzione spaziale (< 50-100 m) e temporale (< 10 s). Il metodo utilizza fogli di sensori luminescenti sensibili O2 (optode planari) in combinazione con un sistema di telecamere specializzato per l'imaging della durata della luminescenza nel dominio della frequenza. Gli optodi planari vengono preparati sciogliendo il colorante indicatore sensibileOin un polimero e diffondendo la miscela su un supporto solido in uno spessore definito tramite rivestimento del coltello. Dopo l'evaporazione del solvente, l'optode planare viene posto a stretto contatto con il campione di interesse - qui dimostrato con le radici della pianta acquatica Littorella uniflora. Ilcambiamento o 2 dipendente dalla concentrazione nella durata della luminescenza del coloranti indicatore all'interno dell'optode planare è immagine attraverso il retro della pellicola portante trasparente e la parete dell'acquario utilizzando una fotocamera speciale. Questa telecamera misura la durata della luminescenza (z) attraverso uno spostamento dell'angolo di fase tra un segnale di eccitazione modulato e un segnale di emissione. Questo metodo è superiore ai metodi di imaging dell'intensità della luminescenza, in quanto il segnale è indipendente dalla concentrazione o dall'intensità del colore della fonte di eccitazione e si basa esclusivamente sul tempo di decadimento della luminescenza, che è un parametro intrinsecamente referenziato. Di conseguenza, non è necessario un tintura di riferimento aggiuntiva o altri mezzi di riferimento. Dimostriamo l'uso del sistema per l'imaging macroscopico O2 di rizosfere vegetali, ma il sistema di telecamere può anche essere facilmente accoppiato a un microscopio.
Introduzione
La distribuzione e la dinamica di gas e ioni disciolti nei sedimenti e nei suoli forniscono informazioni chiave sui processi biogeochimici come la respirazione microbica1,2, o la perdita radiale di ossigeno dalle radici vegetali3,4,5, e il microambiente chimico dei microbi6,7, rizosfere vegetali5,8,9 e tane animali10, 11,12. L'attività biologica e chimica in tali ambienti con diffusione limitata può creare ripide sfumature di substrati chimici o prodotti di processi biogeochimici. In particolare, la disponibilità di O2 ha un enorme impatto sui processi biogeochimici e quindi sulla biologia e l'ecologia di un sistema13. Pertanto, l'analisi delle concentrazioni di O2 ad alta risoluzione spaziale e temporale è di primaria importanza nelle scienze acquatiche e terrestri. In primo luogo, sono stati sviluppati microsensori elettrochimici e ottici14,15 per misurare questo importante analita. Successivamente, è stata introdotta l'imaging 2 dimensionale (2D) di O2 con optodi planari12,16,17,18,19, che ha permesso la visualizzazione e la quantificazione della distribuzione eterogenea O2 nei suoli e nei sedimenti.
Gli optodi Planar O2 sono costituiti da un coloranti indicatore sensibile O22, che viene sciolto in un polimero adatto21. Il coloranti indicatore è eccitato a specifiche lunghezze d'onda ottiche ed emette luce spostando verso il rosso al rilassamento sotto forma di luminescenza. In presenza di O2, il colorante indicatore eccitato può trasferire la sua energia alla molecola O2 al momento della collisione, che è indicato come disintazione di luminescenza basata sulla collisione22. Pertanto, l'intensità della luminescenza e la durata della luminescenza sono ridotte con l'aumento della concentrazione di O22 . In un caso ideale il cambiamento di intensità e durata segue l'equazione Stern-Volmer (equazione 1) utilizzando l'intensità di luminescenza o la durata in assenza (I0;)o presenza (I, ) di O2 ad una data concentrazione [Q]. La costante Stern-Volmer (Ksv) è una misura per la sensibilità dell'optode verso O2; KSV dipende da variabili ambientali come temperatura e pressione.
(1)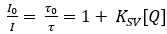
La registrazione di tali cambiamenti nella luminescenza su un foglio di sensore planare con un sistema di telecamere può essere utilizzata per visualizzare i cambiamenti corrispondenti nella distribuzione O2. Inizialmente, è stato utilizzato l'imaging O2 basato sull'intensità della luminescenza semplice18. Tuttavia, tale metodologia è molto sensibile alle interferenze esterne, che compromettono l'affidabilità dei risultati a causa di un'illuminazione eterogenea, fluttuazioni nella fonte di eccitazione o fotocamera, nonché distribuzione irregolare del tintura indicatore all'interno dell'optode planare.
Alcune di queste limitazioni possono essere alleviate utilizzando optodi planari per l'imaging ratiometrico17,24, dove il colorante indicatore sensibile O2è co-immobilizzato nello strato polimerico dell'optode planare con un colorante di riferimento insensibile che emette in un intervallo spettrale diverso rispetto all'indicatore O2. Sulla base di immagini di emissione acquisite in due finestre spettrali, il segnale di emissione sensibile a O2è diviso per il segnale di riferimento, generando un'immagine di rapporto meno incline alle suddette interferenze5,17. Il metodo richiede l'uso di un secondo coloranti, che idealmente può essere eccitato dalla stessa sorgente di eccitazione, ma emette a una diversa lunghezza d'onda (senza sovrapposizione spettrale significativa), in un'altra finestra spettrale della fotocamera (ad esempio, in un altro canale di colore di una fotocamera RGB).
In alternativa, l'imaging O2 può essere basato sulla quantificazione del cambiamento dipendente da O2nella durata della luminescenza del colorante indicatore, che non è influenzato da illuminazione o eterogeneità irregolare nella concentrazione dell'indicatore25. I primi sistemi di imaging O2 basati sulla luminescenza si basavano su misurazioni del dominio temporale con un sistema di telecamere a dispositivo accoppiato caricato (CCD) gate-able26, in cui viene utilizzata una fonte di eccitazione pulsata e le immagini della luminescenza vengono rilevate su intervalli di tempo definiti all'interno dell'eccitazione o dell'emissione dell'indicatore8,23,27. Da tali immagini, la durata della luminescenza può essere determinata e correlata alla corrispondente concentrazione di O2 in una calibrazione. Successivamente, le immagini a vita di luminescenza per un dato campione premuto contro l'optode planare possono essere convertite in immagini della corrispondente distribuzione 2D della concentrazione di O2. Questo sistema è stato utilizzato in molte applicazioni sia in laboratorio che in situ16,28, ma l'essenziale telecamera CCD gate-able non è più disponibile in commercio.
Recentemente, è stato rilasciato un diverso sistema di telecamere a vita di luminescenza, che acquisisce le immagini nel dominio di frequenza8. Il sistema si basa su una fonte di luce continuamente modulata per l'eccitazione. Questo può essere un'onda sinusoidale o quadrata invece di un'eccitazione pulsata, che viene utilizzata per l'acquisizione di immagini nel dominio temporale. Questa modulazione si traduce in un'emissione modulata di luminescenza del colorante indicatore O2, che è spostata di fase da un angolo, - che dipende dalla durata della luminescenza del colorante indicatore (vedi equazione 2).
(2)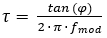
Il cambiamento tra l'ampiezza di eccitazione e di emissione (cioè il cosiddetto indice di modulazione o profondità (ampiezza divisa per la parte di luminescenza costante)) dipende anche dalla durata della luminescenza. Quindi, impostando una frequenza di modulazione nota, lo speciale sensore di immagine CMOS all'interno della fotocamera è in grado di misurare la durata della luminescenza nella gamma ns fino alla gamma s come descritto nel dettaglio altrove 8,29,30. È possibile trovare una guida generale sul principio operativo (utilizzando il seguente collegamento https://www.youtube.com/watch?v=xPAB_eVWOr8).
Nel seguente protocollo, dimostriamo l'uso del nuovo sistema di telecamere per l'imaging della distribuzione della concentrazione di O2 intorno alle radici della pianta acquatica d'acqua dolce Littorella uniflora in 2D9,31. Vorremmo sottolineare che questo metodo non è affatto limitato a questa applicazione. Optodi sensibili all'ossigeno o particelle di sensori27 in combinazione con vari metodi di imaging sono stati utilizzati nella ricerca medica32, in biostampa33, per vernici sensibili alla pressione34,35, o per studiare i sistemi fotosintetici2,36,37, solo per citarne alcuni altri campi di applicazione.
Protocollo
1. Fabbricazione di optode planare O2
- Sciogliere 1,5 mg di colorante luminescente O2 colorante platino(II)-5,10,15,25-tetrakis-(2,3,5,6-pentafluorphenyl)-porphyrin (PtTFPP) e 100 mg di polistirolo (PS) in 1 g di cloroformio per ottenere il cosiddetto 'sensore'.
NOTA: Il cocktail può essere conservato in una fiala di vetro chiusa e a tenuta di gas per alcune ore in frigo e buio fino a ulteriore utilizzo. - Fissare un terephthalate (PET) in polietilene pulito (PET) (dimensioni a seconda dell'applicazione) su una lastra di vetro pulita con l'aiuto di un'acqua o di etanolo (70%) pellicola (Figura 1A).
- Posizionare il dispositivo di rivestimento pulito del coltello (120 m) sulla lamina e applicare una linea del cocktail del sensore davanti al dispositivo utilizzando una pipetta di vetro (Figura 1B). Quindi, trascinare il dispositivo di rivestimento del coltello lentamente e uniformemente sulla lamina PET per distribuire il cocktail in modo uniforme.
NOTA: tutti i materiali e gli strumenti devono essere puliti accuratamente e la fabbricazione deve essere eseguita in un ambiente privo di polvere, come un cappuccio con fumi, una panca di flusso o sotto un dispositivo di aspirazione a punti. Per evitare eterogeneità nel foglio del sensore finale, i passaggi successivi all'applicazione del cocktail del sensore sulla lamina devono essere eseguiti rapidamente, poiché il cloroformio evapora rapidamente. - Asciugare l'optode planare finito O2-sensibile nell'aria ambiente per 1 h e poi la notte in un armadio riscaldante a 50-60 gradi centigradi, risultando ad uno spessore finale dello strato dopo l'evaporazione del solvente di 12 m . Conservare le optode prodotte nel buio (ad esempio, in una busta di carta) fino a un ulteriore utilizzo (Figura 1C).
NOTA: gli optodi Planar O2 possono essere conservati a secco e al buio per diversi mesi o anni prima dell'uso. Uno spessore finale dello strato compreso tra 1 e 20 m ha dimostrato di fornire buoni risultati, con un segnale di luminescenza sufficiente e tempi di risposta adeguati.
2. Camera Rhizo-sandwich
- Pulire due lastre di vetro (24,5 x 14 cm2,spessore: 4 mm) con 96% di etanolo.
- Utilizzare adesivo istantaneo a base di acrilico, in base alla luce, (vedi Tabella dei materiali)per incollare i vetrini al microscopio (76 x 26 mm2,spessore: 1 mm) lungo i bordi della prima lastra di vetro (cioè il lato della camera posteriore), lasciando un lungo bordo aperto. Utilizzare una taglierina per accorciare i vetrini del microscopio in base alle esigenze.
AVVISO: il vetro di taglio può causare bordi taglienti e deve essere maneggiato con cura.
NOTA: I vetrini al microscopio funzionano come distanziali tra la parte anteriore e posteriore, e a seconda dello spessore delle radici e delle dimensioni della pianta, più strati di vetrini al microscopio possono essere incollati uno sopra l'altro. - Tagliare l'optode planare nella forma e nelle dimensioni richieste per adattarsi allo spazio tra i vetrini del microscopio incollato. Posizionarlo all'interno della lastra di vetro anteriore con il lato rivestito verso l'alto, per consentire il contatto con il campione di interesse quando viene premuto contro di esso.
- Nastro un bordo della lamina optode alla piastra di vetro e aggiungere alcune gocce di acqua del rubinetto tra la piastra di vetro e la pellicola di optode (Figura 2A). Abbassare lentamente la pellicola su queste goccioline d'acqua permettendogli di raddrizzare se stesso sulla superficie del vetro.
- Rimuovere con attenzione le bolle d'aria intrappolate tra l'optode planare e la piastra di vetro utilizzando un tessuto molle, evitando di graffiare il rivestimento del sensore. Asciugare la lastra di vetro e nastro i restanti bordi della lamina optode alla lastra di vetro (Figura 2B).
NOTA: È necessario scegliere un nastro con adere adeguata sott'acqua. - Setacciare il sedimento utilizzando una dimensione della rete di 0,5 mm. Posizionare un cucchiaio di sedimento bagnato sulla prima lastra di vetro (Figura 2C).
NOTA: la dimensione della mesh non deve essere maggiore della metà dello spessore del distanziale. - Distribuire il sedimento in modo uniforme e regolarlo allo stesso spessore dei distanziali a scorrimento al microscopio utilizzando una piastra di vetro piatto. Pulire con cura la superficie superiore dei vetrini del microscopio per garantire che la seconda lastra di vetro sigilli correttamente la camera.
- Applicare il grasso di silicio sulla superficie del vetrino del microscopio. Coprire il sedimento con una sottile pellicola d'acqua, evitando con attenzione la formazione di bolle d'aria.
- Lavare con cura un singolo germoglio di Littorella uniflora e posizionarlo sul sedimento, con le foglie della pianta sporgenti dal lato superiore aperto (Figura 2D).
- Posizionare la seconda lastra di vetro, con l'optode attaccata ad esso, sul sedimento e applicare una leggera pressione per portare l'optode a stretto contatto con le radici della pianta e il sedimento circostante.
NOTA: Le bolle d'aria intrappolate nel sedimento possono essere rimosse inclinando le lastre di vetro mentre le riuniscono. - Fissare le lastre di vetro insieme utilizzando morsetti (Figura 2E). Asciugare i bordi esterni con carta velina. Mantenere le foglie idratate per tutto l'assemblaggio del rhizo-sandwich (ad esempio, con l'aggiunta frequente di qualche goccia d'acqua).
- Stringere la camera rhizo-sandwich utilizzando nastro elettrico in vinile. Sigillare i bordi con l'argilla di modellazione e nastro aggiuntivo con nastro elettrico in vinile (Figura 2F).
NOTA: Se ci sono molte bolle d'aria nel sedimento, o grani di sedimenti tra i vetrini del microscopio distanziale e la seconda piastra di vetro, la camera deve essere rimontata come acqua pore può fuoriuscire (ripetere i passaggi 2.4 - 2.8). - Utilizzare una plastica opaca per coprire il rhizo-sandwich, ma lasciare una fessura nel foglio per le foglie della pianta a sporgere. Tagliare una finestra nella lamina di plastica, in modo che possa essere aperto per gli esperimenti dispiegandosi. Chiudere la finestra durante i tempi di acclimatazione utilizzando elastici (Figura 2G) per proteggere l'optode dallo sbiancamento fotografico mentre la pianta è incubata.
NOTA: Poiché la crescita delle alghe potrebbe potenzialmente interferire con le concentrazioni di O2 misurate, si consiglia di cercare di ridurla al minimo, utilizzando acqua filtrata, attrezzature sperimentali prepulite e rimuovendo le alghe al momento della formazione.
3. Incubazione camera Rhizo-sandwich
- Posizionare la camera di rhizo-sandwich in un serbatoio d'acqua (32 x 7 x 28 cm3) in una posizione leggermente inclinata per favorire la crescita della radice contro l'optode planare.
- Riempire il serbatoio dell'acqua con acqua sufficiente a sommergere completamente le foglie della pianta.
- Stabilire un ciclo di 14 h luce, 10 h scuro per l'acclimatamento della pianta utilizzando una lampada a controllo del tempo. Mettere una pietra d'aria o una pompa dell'acqua nel serbatoio per garantire l'aerazione e la miscelazione dell'acqua (Figura 2H).
4. Imaging
- Configurazione dell'imaging
- Rimuovere la pellicola di plastica che copre l'optode planare nella camera rhizo-sandwich. Posizionare la camera con la parete di vetro con l'optode in posizione verticale contro la parete dell'acquario. Utilizzare un distanziale per premere la camera rhizo-sandwich contro la parete dell'acquario.
NOTA: Lo spessore complessivo della parete dell'acquario più la parete della camera rhizo-sandwich non dovrebbe diventare troppo spesso, tuttavia, gli spessori di vetro per le pareti di acquari per l'imaging della luminescenza sono raccomandati con > 1 cm, al fine di ridurre il cross-talk spaziale aumentando l'attenuazione della luce diffusa. È importante, utilizzare lo stesso materiale per entrambe le pareti di vetro (stesso indice refrattario), al fine di ridurre al minimo la dispersione della luce all'interfaccia del materiale; in quanto ciò porterebbe ad un'immagine sfocata e a12. - Posizionare la telecamera a vita di luminescenza basata su dominio di frequenza dotata di un obiettivo (vedi Tabella dei materiali)di fronte all'acquario e l'area di interesse (radici della pianta acquatica Littorella uniflora, che sono in contatto diretto con l'optode planare) (Figura 3).
NOTA: la fotocamera potrebbe essere posizionata su un supporto di laboratorio per consentire una facile regolazione dell'altezza della fotocamera. La posizione del supporto di laboratorio deve essere contrassegnata e mantenuta fissa. Inoltre, la fotocamera può essere attaccata al supporto del laboratorio per evitare movimenti accidentali della fotocamera durante l'esperimento. - Allevare un filtro di emissione adatto per l'imaging PtTFPP come tinri indicatore (vedi Tabella dei materiali)sull'obiettivo della fotocamera, per rimuovere le deduzioni dalla sorgente di eccitazione.
NOTA: I filtri a vite sono ideali, ma i filtri quadrati possono essere utilizzati anche con un adattatore appropriato o con un attento tocco verso l'obiettivo. - Collegare una sorgente di eccitazione LED (vedere Tabella dei materiali) all'output di modulazione e buio della fotocamera.
NOTA: Il primo fornisce il segnale di modulazione per la sorgente luminosa, mentre il secondo spegne la luce durante la lettura dell'immagine del sensore di immagine. Collegare la sorgente di eccitazione LED e la fotocamera a un computer. La luce di fondo deve essere ridotta al minimo durante la lettura dell'immagine, oscurando l'intera stanza o mettendo un panno denso e nero sull'intero set-up. In quest'ultimo caso, è importante garantire una ventilazione sufficiente per evitare il riscaldamento della fotocamera. - Fissare la guida luminosa nella sorgente di eccitazione LED e posizionarla per illuminare uniformemente la lamina di optode planare che copre l'area di interesse.
NOTA: Nella sorgente di eccitazione LED utilizzata è possibile passare tra 3 diversi LED (460 nm, 528 nm, 625 nm), la cui intensità può essere regolata tramite il software di controllo.
- Rimuovere la pellicola di plastica che copre l'optode planare nella camera rhizo-sandwich. Posizionare la camera con la parete di vetro con l'optode in posizione verticale contro la parete dell'acquario. Utilizzare un distanziale per premere la camera rhizo-sandwich contro la parete dell'acquario.
- Impostazioni e funzionamento della fotocamera
NOTA: per gli esperimenti descritti, abbiamo utilizzato una videocamera a vita basata su dominio di frequenza in combinazione con un modulo dedicato per l'imaging a vita in un pacchetto software disponibile in commercio (vedere Tabella dei materiali).- Selezionare la fotocamera nel software scelto prima dell'uso.
NOTA: i driver software e fotocamera devono essere installati prima di creare immagini seguendo le linee guida del produttore. - Aprire il software di controllo LED (di nuovo installato prima di avviare l'esperimento) e scegliere il LED adatto (qui: 528 nm) selezionando standby. Impostare l'intensità del LED in base alle esigenze (qui al 30%). Assicurarsi che il LED sia attivato dal TTL esterno; questo viene fatto ticchettio analogico e la sincronizzazione per il LED.
NOTA: L'intensità del LED deve essere regolata individualmente, in quanto una potenza laser troppo elevata può portare a uno sbiancamento fotografico accelerato dell'indicatore o del tintura di riferimento. - Mettere a fuoco la fotocamera e regolare manualmente l'apertura dell'obiettivo (nel presente studio utilizzare f - 2,8).
NOTA: È importante mettere a fuoco la fotocamera sull'optode planare e non sul vetro dell'acquario; questo può essere assicurato prendendo un'immagine con un righello per la scala, e concentrandosi sull'ombra del righello sull'optodo, piuttosto che sul righello effettivo. - Impostare i seguenti parametri all'interno del pannello di controllo della telecamera del software: sorgente di modulazione interna; onda sinusoidale per la forma d'onda in uscita; campionamento di fase supplementare (Sì); 8 campioni di fase, ordine di fase opposto, Toccare A e B lettura; Frequenza di modulazione a 5 kHz.
NOTA: questi parametri influiscono sulla qualità dell'immagine e possono essere modificati se necessario. Il produttore della fotocamera fornisce linee guida sui singoli parametri (il produttore della fotocamera sta rilasciando linee guida e aggiornamenti ogni volta che il software viene aggiornato). - Prendere un'immagine di riferimento prima degli esperimenti.
NOTA: Questo può essere fatto sia esaminando uno standard di calibrazione (un colore luminescente con una durata nota (ns o s)), o utilizzando la luce riflessa del LED. In quest'ultimo caso, il filtro passa lungo emissione deve essere rimosso dall'obiettivo e la durata nota può essere impostata su 1 ns. - Regolare il tempo di esposizione nella sezione di calibrazione del software di imaging dedicato fino a quando la lettura delle statistiche del ROI (nella parte inferiore di questo pannello) per l'immagine normalizzata dell'intensità della luminescenza è compresa nell'intervallo da 0,68 a 0,72.
NOTA: ora la durata del riferimento (ad esempio, 1 ns) viene fornita come input al software. - Premere Acquisisci riferimento per avviare l'acquisizione di una serie di misurazione di riferimento.
NOTA: Al termine, i dati di riferimento vengono memorizzati e le misurazioni singole o time lapse possono essere eseguite su campioni.
- Selezionare la fotocamera nel software scelto prima dell'uso.
- Calibrazione dell'optode O2
- Posizionare un pezzo di un optode planare O2-sensibilein un (piccolo) acquario di vetro. Fissare l'optode planare sulla parete di vetro della camera di calibrazione come descritto in precedenza (vedere la sezione 2.3). Posizionare l'acquario di calibrazione di fronte alla fotocamera. Assicurarsi che l'illuminazione uniforme da parte del LED, così come che l'optode riempie l'intero campo visivo.
NOTA: L'optode planare deve essere dallo stesso pezzo di stagnola o realizzato dallo stesso cocktail sensore della lamina utilizzata nell'esperimento vero e proprio. - Riempire l'acquario con lo stesso mezzo liquido utilizzato negli esperimenti.
NOTA: l'utilizzo di diversi supporti per le tarature e gli esperimenti può influenzare la misurazione (ad esempio, modificando la risposta del sensore e/o lasolubilità del sensore). Pertanto, la calibrazione deve essere eseguita nello stesso mezzo e alla stessa temperatura dell'esperimento effettivo. Le fluttuazioni della temperatura influenzeranno il segnale di luminescenza e dovrebbero essere evitate. Tuttavia, se la temperatura non può essere mantenuta stabile, la compensazione della temperatura deve essere effettuata calibrando l'optode sensibile O2(più punti) a temperature diverse (rilevanti) e il successivo ricalcolo dei valori. - Regolare la concentrazione di O2 all'interno dell'acquario di calibrazione lavando l'acqua con una miscela di gas aria /N2 di concentrazione nota di O2, utilizzando un dispositivo di miscelazione del gas. Assicurarsi che l'acqua sia ben equilibrata con la miscela di gas utilizzata aerando per un tempo sufficiente (dipende dalla portata e dalle dimensioni dell'acquario).
NOTA: Si consiglia di monitorare il livello O2 nell'acquario di calibrazione con un sensore O2 esterno calibrato con compensazione della temperatura (ad esempio, utilizzando un sensore O2 in fibra ottica o elettrochimico). - Scattare una serie di immagini a diverse concentrazioni di O2 nella camera di calibrazione.
NOTA: è necessario misurare almeno cinque diverse concentrazioni di O2 per consentire una curva adeguata adatta ai dati di calibrazione acquisiti. È importante misurare a 0 hPa (condizioni anossiche), quindi distribuire gli altri valori nell'intervallo dinamico del tintura indicatore specifico. Qui abbiamo usato PtTFPP come colorante sensibile O2immobilizzato in una matrice di polistirolo. Le immagini sono state scattate a 0, 48, 102, 156 e 207 hPa; 207 hPa corrisponde al 100% della saturazione dell'aria alla salinità e alla pressione date.
- Posizionare un pezzo di un optode planare O2-sensibilein un (piccolo) acquario di vetro. Fissare l'optode planare sulla parete di vetro della camera di calibrazione come descritto in precedenza (vedere la sezione 2.3). Posizionare l'acquario di calibrazione di fronte alla fotocamera. Assicurarsi che l'illuminazione uniforme da parte del LED, così come che l'optode riempie l'intero campo visivo.
- Imaging del campione
- Posizionare il campione davanti alla fotocamera e garantire un'illuminazione uniforme.
- Spegnere la luce che fornisce irradia zione alla pianta (e a tutte le altre sorgenti luminose) appena prima di acquisire l'immagine di durata della luminescenza della pianta. Regolare il tempo di acquisizione in base all'immagine di intensità, assicurandosi che il segnale non sia né sovrasaturato né troppo debole per un buon rapporto segnale/rumore (S/N) nella determinazione della durata.
- Esporre la pianta a condizioni di luce variabili (ad esempio, luce / scuro) e acquisire una serie di immagini.
- Accendere la luce nella stanza per acquisire un'immagine strutturale.
NOTA: quando la luce di sfondo è accesa, la fotocamera non misura un'immagine realistica a vita. Tuttavia, l'immagine di intensità ora mostra l'intero campo visivo visto attraverso l'optode semitrasparente. - Acquisire un'immagine con un righello o simili nel campo visivo per consentire il ridimensionamento successivo delle immagini acquisite.
5. Analisi dei dati
- Esportare la durata della fase e le immagini di intensità direttamente dal software di imaging dedicato, utilizzando la macro fornita dal produttore della fotocamera.
- Eseguire ulteriori analisi delle immagini utilizzando un software di analisi delle immagini disponibile liberamente (vedere Tabella dei materiali).
- Aprire le immagini della durata della fase della calibrazione nel software di analisi delle immagini e determinare la media dell'intera immagine utilizzando la funzione di misurazione. Tracciare le durate misurate rispetto alle concentrazioni note di O2 per determinare la funzione di calibrazione (Figura 4A).
- Calcolare 0 / s da tutti i dati (0 è la durata della fase misurata in assenza di O2). Tracciare questi valori rispetto alle concentrazioni note di O2 (Figura 4B).
- Determinare i parametri Ksv e f dal grafico di calibrazione, utilizzando il modello a due siti semplificato per lo spegnimento collisionale dinamico (equazione 3)38,39 dove [Q] è la concentrazione O2. Definire la funzione di adattamento nel software di analisi dei dati, che determina quindi Ksv e f.
(3)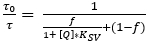
- Aprire le immagini di esempio acquisite nel software di analisi delle immagini per convertire le durate delle immagini in concentrazioni O2, utilizzando i parametri determinati Ksv, f e 0.
NOTA: Come approccio alternativo, anche i valori di durata della fase di calibrazione acquisita (Figura 4A) possono essere utilizzati direttamente. In questo caso, per la calibrazione viene utilizzata una misura esponenziale che utilizza la funzione di adattamento della curva. - Aprire l'immagine con il righello successivo nel software di analisi delle immagini e misurare una distanza nota utilizzando lo strumento di misurazione. Impostare questa misurazione come scala globale in Imposta scala.
Risultati
Come esempio applicativo per il nuovo sistema di imaging, mostriamo l'imaging 2D O2 di un campione biologico complesso (cioè la rizosfera della pianta acquatica Littorella uniflora).
In primo luogo, il metodo descrive la fabbricazione di una pellicola sensore planare, un cosiddetto optode planare. Come si vede nella Figura 1, tale optode è costituito da uno strato sottile di un indicatore ottico in una matrice polimerica che si diffonde su un supporto trasparente. Seguendo il protocollo descritto, si ottiene una pellicola sensore omogenea con uno spessore uniforme, come definito dallo spazio del dispositivo di rivestimento del coltello. Se l'optode prodotto ha una distribuzione del materiale del sensore patchy (ad esempio, fori nel rivestimento, mostra strisce o aggregati di tintura (questo può essere valutato visivamente e visivamente con l'aiuto di una lampada UV)), il protocollo deve essere ripetuto e tutti i materiali devono essere accuratamente puliti utilizzando acetone.
Una volta preparata l'optode planare, il campione può essere portato a stretto contatto con lo strato di rilevamento dell'optode planare, come mostrato qui con l'optode planare integrato in una camera rhizo-sandwich, dove le radici di una pianta all'interno di una matrice di sedimenti circostante possono essere posizionate a stretto contatto con l'optode planare (Figura 2). Se preparata correttamente, la camera rhizo-sandwich dovrebbe essere facilmente spostabile da un acquario (incubazione) all'altro (misurazione). Se non è stata costruita correttamente, la camera rhizo-sandwich può essere instabile, perdere sedimenti o contenere bolle d'aria. Si raccomanda pertanto l'esame visivo della camera rhizo-sandwich direttamente dopo l'assemblaggio.
Il protocollo specificato consente l'imaging a vita della luminescenza basata su dominio di frequenza del campione a contatto con l'optode planare utilizzando la fotocamera a vita di luminescenza basata su dominio di frequenza. Maggiori dettagli su questo sistema di telecamere come la modalità di acquisizione di immagini e le caratteristiche scientifiche complementari della telecamera metal-ossido-semiconduttore (SCMOS) sono fornite nelle recenti pubblicazioni8,29.
La configurazione stessa è piuttosto semplice e include solo la fotocamera che controlla una fonte di luce (in questo caso, una sorgente di eccitazione LED) e il campione con l'optode (Figura 3). Assicurarsi che tutte le parti siano collegate correttamente e che il campione sia illuminato in modo omogeneo. La luce di fondo deve essere evitata durante la preformazione delle misurazioni.
Prima di imaging del campione, l'optode deve essere calibrato. Come si vede nella Figura 4A, la durata della luminescenza misurata diminuisce con l'aumento della concentrazione di O2 a seguito di un decadimento quasi-esponenziale. Questa relazione può essere descritta anche utilizzando il modello a due siti semplificato(Figura 4B e equazione 3). Nell'esempio dato, i parametri necessari per calcolare successivamente la concentrazione di O2 sono stati come segue; 0 x 56,26 s, Ksv - 0,032 hPa-1 e f - 0,86.
L'esecuzione di una calibrazione è anche un modo ideale per verificare che il sistema funzioni correttamente. Se tutti i componenti sono installati come descritto qui (o all'interno delle linee guida dei produttori), la durata misurata dovrebbe mostrare la stessa dipendenza O2 come si vede nella Figura 4. Inoltre, per la stessa combinazione di materiali di rilevamento O2 (polimero e tinri), il misurato0 dovrebbe essere nella stessa gamma (a pochi z) misurata qui (principalmente influenzata dalla temperatura sperimentale). Se non è possibile ottenere una curva di calibrazione simile, assicurarsi che tutti i passaggi siano stati seguiti correttamente. A volte l'optode viene accidentalmente fissato con il lato sensibile rivolto verso la parete di vetro piuttosto che il campione, o le immagini acquisite sono sovra o sottoesposte.
Con i parametri di calibrazione, è possibile determinare la concentrazione di O2 esaminando la durata della luminescenza . Ciò è dimostrato nella Figura 5A,B, dove la distribuzione della concentrazione di O2 nella rizosfera di Littorella uniflora è stata fotografata al buio e dopo l'esposizione alla luce a 500 fotoni mol m-2 s-1 per 12 h, rispettivamente. A causa dell'attività fotosintetica della pianta, la concentrazione di O2 nella rizosfera è aumentata dopo l'esposizione alla luce. Oltre alle immagini a vita, anche le immagini "strutturali" possono essere acquisite sotto l'illuminazione esterna, mantenendo fissa la geometria dell'immagine. In questo modo, le immagini O2 possono essere correlate con precisione all'immagine strutturale (Figura 5C), alle sezioni trasversali o alle regioni di interesse. Ad esempio, i profili di concentrazione O2 in una singola radice sono stati estratti dall'immagine acquisita rispettivamente nel buio e nella luce (Figura 5D).

Figura 1: Fabbricazione di un optode planare O2. (A) Un foglio di PET è fissato su una lastra di vetro e il dispositivo di rivestimento del coltello è posto sul foglio. (B) Il cocktail sensore preparato viene diffuso sulla lamina PET come una linea sottile davanti al dispositivo di rivestimento del coltello. (C) Il dispositivo di rivestimento del coltello viene spostato verso il basso per diffondere il cocktail del sensore come una pellicola sottile sulla lamina PET, che dopo l'evaporazione del solvente si traduce in un optode planare pronto all'uso. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: assemblaggio da camera Rhizo-sandwich con integrazione di un optode planare O2. (A) L'optode è fissato su una delle lastre di vetro utilizzando una pellicola d'acqua. (B) L'optode è incollato alla piastra con nastro elettrico. (C) Il sedimento viene riempito nella piastra opposta con i distanziali collegati (cioè i vetrini al microscopio). (D) Le radici delle piante sono poste sul sedimento uniformemente diffuso. (E) La camera rizo-sandwich è chiusa e temporaneamente fissata con morsetti. (F) Camera completamente chiusa e assemblata di rhizo-sandwich. (G) Per proteggere l'optode dall'esposizione alla luce da parte della lampada di incubazione ed evitare la crescita delle alghe, viene posto un coperchio di plastica sopra la camera assemblata di rhizo-sandwich. (H) La camera rhizo-sandwich incubata in un acquario. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Configurazione dell'imaging contenente la fotocamera a vita della luminescenza basata su dominio di frequenza, con l'obiettivo focalizzato sul campione con l'optode da dietro attraverso l'acquario trasparente e le pareti della camera rhizo-sandwich. La guida luminosa della sorgente di eccitazione LED è posizionata per illuminare il campione in modo uniforme. Fare clic qui per visualizzare una versione più grande di questa figura.
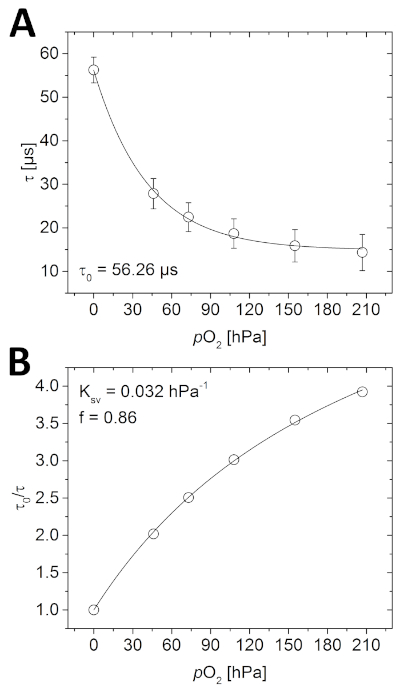
Figura 4: Curve di calibrazione per optode planare O2. (A) Diverse durate di fosforescenza misurate alle rispettive concentrazioni di O2 nella camera di taration riempita d'acqua. (B) Grafico Stern-Volmer dei dati di calibrazione montato utilizzando il modello a due siti semplificato per lo spegnimento collisionale dinamico (equazione 3). Fare clic qui per visualizzare una versione più grande di questa figura.
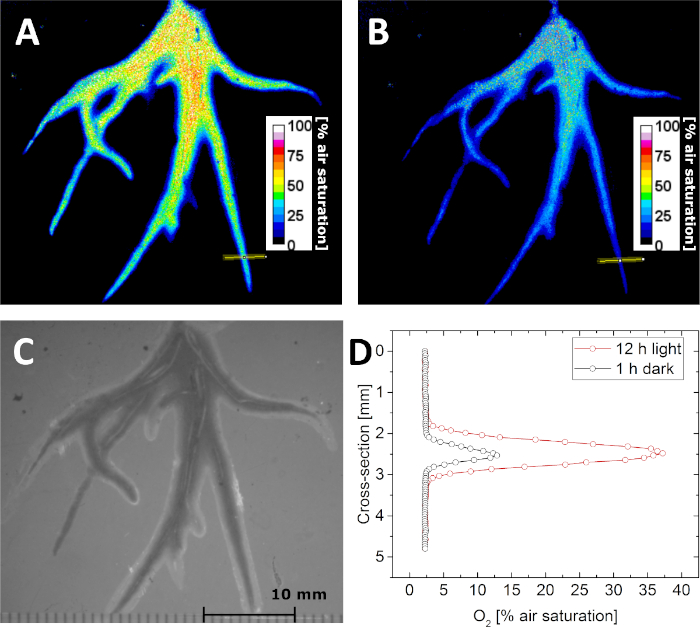
Figura 5: Immagini a vita della distribuzione O2 nella rizosfera della pianta acquatica Littorella uniflora. (A) O2 distribuzione dopo aver tenuto la pianta sotto luce per 12 h a circa 500 fotoni mol m-2 s-1. (B) O2 distribuzione dopo aver tenuto la pianta al buio per 1 h. (C) Immagine strutturale delle radici della pianta come visto attraverso l'optode planare. (D) Profilo di concentrazione o2 trasversale (la posizione è indicata dalla linea gialla nel pannello A e B) dopo 12 h in luce (rosso) e 1 h nel buio (nero). Adattato con il permesso di (Koren, K., Mo'hammer, M., Scholz, V. V., Borisov, S.M., Holst, G., K'hl, M. Luminescence Lifetime Imaging of Chemical Sensors - Un confronto tra Time-Domain e Frequency-Domain Based Camera Systems. Chimica analitica. 91 (5), 3233-3238, doi: 10.1021/acs.analchem.8b05869 (2019)). Diritto d'autore (2019) American Chemical Society. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
In questo protocollo, viene coperto l'intero flusso di lavoro dalla preparazione dell'optode all'analisi delle immagini O2. Seguendo questo protocollo, le immagini chimiche possono essere ottenute utilizzando la nuova fotocamera a vita di luminescenza basata su dominio di frequenza. A seconda dell'applicazione, gli optodi planari possono essere fabbricati in varie dimensioni e spessore dello strato dello strato del sensore che vanno da robusti optodi planari spessi 50-100 m di diversi decimi quadrati a scivolamenti di copertura al microscopio con strati di sensore <1 m di spessore6,40. Il potenziale di questo metodo è stato dimostrato con una particolare applicazione, ma non è solo limitato all'imaging O2 nelle rizosfere vegetali12,28.
Questo metodo ha diversi vantaggi rispetto ai metodi di imaging chimico basati sull'intensità della luminescenza pura. L'imaging a vita di luminescenza non è, o almeno molto inferiore, influenzato da un'illuminazione irregolare, spessore di optode irregolare e sbiancamento fotografico25. Inoltre, questo metodo evita l'uso di un tintura di riferimento aggiuntiva comune nell'imagingratiometrico 17,37. Rispetto ad altri sistemi di telecamere a vita, come le telecamere gated time-domain di uso comune8,26, il nuovo sistema di telecamere e il protocollo qui presentati possono fornire risultati comparabili. In una recente pubblicazione, le caratteristiche analitiche di questi due sistemi sono state confrontate e si è scoperto che il sistema di telecamere a vita a vita di luminescenza basato su frequenza-dominio è almeno paragonabile al predecessore basato su dominio temporaleinterrotto 8.
Abbiamo presentato la più semplice optode O2 costituita solo da un indicatore in una matrice polimerica. Oltre a molti altri possibili indicatori O2 20 che potrebbero essere utilizzati additivi possono essere inclusi, cioè agenti di dispersione come TiO2 o polvere di diamante2 per aumentare il segnale del sensore riducendo la trasparenza dell'optode. Anche coloranti aggiuntivi potrebbero essere utilizzati per migliorare l'intensità del segnale tramite trasferimento di energia41.
Per la fabbricazione di optodi planari, si consiglia di utilizzare uno spazio nel dispositivo di rivestimento del coltello di 75 - 120 m per produrre uno spessore finale dello strato del sensore di circa 7,5 a 12 m dopo l'evaporazione del solvente (circa il 10% dello spazio utilizzato), quando si utilizza la composizione del cocktail del sensore descritto. Questo è un buon compromesso tra l'intensità del segnale, che può essere modificato da un maggiore carico di tinture, o scegliendo indicatore e coloranti di riferimento di maggiore luminosità e tempo di risposta. Un aumento dello spessore dello strato comporta un aumento del tempo di risposta, poiché l'intervallo di tempo necessario all'analita per raggiungere un equilibrio termodinamico nello strato di rilevamento con il supporto circostante aumentadi 12.
Gli optodi, come descritto qui, reagiscono ai cambiamenti di concentrazione di O2 entro pochi secondi17 pur avendo un segnale di luminescenza sufficientemente forte. I rivestimenti dei sensori ultrasottili con tempi di risposta al secondo possono essere realizzati con spin-coating6. Se il supporto o il dispositivo di rivestimento del coltello non sono ben puliti, potrebbe causare strati di sensori inomogenei. Inoltre, quando il cocktail non è completamente omogeneo o applicato troppo rapidamente dopo la diffusione davanti al dispositivo di rivestimento un tale risultato indesiderato può essere osservato. Pertanto, potrebbe essere necessario un po 'di pratica per preparare optodi ottimali.
Il metodo può essere utilizzato per l'immagine di campioni che possono essere messi a stretto contatto con l'optode, come alcuni animali marini42, biofilm6 e suoli31 solo per citarne alcuni. Vi presentiamo una configurazione autonoma utilizzando un obiettivo, tuttavia, la fotocamera può essere facilmente accoppiata ad un microscopio per l'imaging chimico ad alta risoluzione43.
Mentre l'imaging a vita di luminescenza basato su dominio temporale ha consentito la soppressione della fluorescenza di fondo26, si tratta di un problema quando si utilizza il nuovo sistema di telecamere basato su dominio di frequenza8. Grazie all'acquisizione continua dell'immagine, questa fotocamera registrerà qualsiasi fluorescenza di fondo del campione che può essere eccitata dal LED selezionato ed emette nella finestra spettrale selezionata come definito dal filtro di emissione sull'obiettivo della fotocamera. Questo si tradurrà in una durata apparentemente inferiore e di conseguenza in false letture. Nel caso in cui si lavori con campioni con una significativa fluorescenza intrinseca sovrapposta all'eccitazione e all'emissione del sensore O2, è essenziale applicare un isolamento ottico aggiuntivo sopra l'optode, ricoprendo uno strato aggiuntivo contenente il nero carbonio2,17. Così, solo la luminescenza emessa dall'optode planare raggiungerà la fotocamera. Al fine di verificare la luminescenza di sfondo può essere presa un'immagine senza l'optode, che poi mostrerebbe esclusivamente la luminescenza intrinseca del campione. È anche possibile aggiungere agenti di dispersione come TiO2 o polvere di diamante2,44, al cocktail del sensore, per aumentare l'intensità della luminescenza del tinio indicatore. Tuttavia, questo può anche portare a più veloce foto sbiancamento e TiO2 è un noto foto-catalizzatore, che può compromettere la fotostabilità di un colorante41. Un altro aspetto da considerare è la luce di fondo. Quando si immagina la durata della luminescenza, la luce di fondo deve essere evitata nel modo più efficiente possibile. Pertanto, questo metodo di imaging richiede che la configurazione sia posizionata in un ambiente scuro e qualsiasi sorgente luminosa esterna deve essere temporaneamente spenta durante l'acquisizione dell'immagine.
In sintesi, l'imaging a vita della luminescenza è un metodo di imaging chimico robusto che può essere adattato a molte applicazioni diverse. Questo protocollo (vedere la sezione 1 - 5) copre tutti i passaggi essenziali per generare un'immagine O2 e utilizza il sistema di imaging a vita di luminosità del dominio di frequenza attualmente più flessibile, che può sostituire la fotocamera del dominio temporale interrotta per l'imaging 2D O2 con optodi planari.
Divulgazioni
L'autore Gerhard Holst è un dipendente di PCO AG che produce il sistema di telecamere utilizzato in questo articolo. PCO AG ha contribuito finanziariamente alla pubblicazione e ai costi di accesso aperto di questo articolo.
Riconoscimenti
Ringraziamo Sofie Lindegaard Jakobsen (Università di Copenaghen) e Lars Borregaard Pedersen (Università di Aarhus) per l'assistenza tecnica. I finanziamenti per questo studio sono stati ottenuti da una sovvenzione di Sapere-Aude Advanced dell'Independent Research Fund Denmark (DFF-1323-00065B; MK), sovvenzioni ai progetti dell'Independent Research Fund Danimarca Scienze naturali (DFF-8021-00308B; MK) & Scienze Tecniche e di Produzione (DFF-8022-00301B e DFF-4184-00515B; MK), la Danish National Research Foundation (DNRF136) e la Poul Due Jensen Foundation (KK).
Materiali
| Name | Company | Catalog Number | Comments |
| Air pump with air stone and water pump | Local aquarium store | ||
| Chloroform | Sigma Aldrich | 67-66-3 | |
| DC4 silicone compound | Dow Corning GmbH | 2793695 | |
| Gas mixer | Vögtlin Instruments GmbH | red-y compact meter GCM | This is just one possible instrument. Several companies offer gas mixing devices |
| Glass plates and aquaria | Local aquarium or hardware store | ||
| ImageJ Software | ImageJ | Freely available imaging software (imagej.nih.gov/ij/index.html) | |
| Knife-coating device | BYK-GARDNER GMBH byk.com | 2021 | This is a four sided film applicator enabling easy variation of the film thickness. Other versions are also available. We recommend a thickness of the applied film between 75-120 µm, which yields a final sensor layer thickness of ~10% of the applied thickness before solvent evaporation. |
| LED lamp, Reflector PAR38 | Megaman | MM17572 | |
| LED LEDHUB | Omicon Laserage, Germany | Can be configured with a variety of LEDs. For the presented example, the green LED (528 nm) is essential | |
| LOCTITE AA 3494 | Henkel AG & Co. KGaA | NA | Acrylic-based instant adhesive |
| NIS Elements AR Software | Nikon Inc | Software package used for image acquisition | |
| pco.flim | PCO AG, Germany | Frequency domain based luminescence lifetime camera | |
| platinum(II)-5,10,15,20-tetrakis-(2,3,4,5,6-pentafluorphenyl)-porphyrin (PtTFPP) | Frontier Scientific | PtT975 | O2 indicator |
| polyethylene terephthalate (PET) foil | Goodfellow | 320-992-72 | Such foils might also be found from other providers and serve as solid support |
| Polystyrene (PS) | Sigma Aldrich | 9003-53-6 | Polymer matrix |
| Schott RG610 filter | www.uviroptics.com | Here 52mm screw on Filters can obtained. Other sources offer square glass filters from Schott glass that can be fixed in front of the objective | |
| Vinyl electrical tape | Scotch, Super 33+ | NA | |
| Zeiss Makro Planar 2/100 with Hama C for Nikon adaptor | delivered with the camera | Here any other objective might also be used in combination with an adaptor if the objective does not have a C-mount |
Riferimenti
- Glud, R. N., Kühl, M., Kohls, O., Ramsing, N. B. Heterogeneity of oxygen production and consumption in a photosynthetic microbial mat as studied by planar optodes. Journal of Phycology. 35 (2), 270-279 (1999).
- Moßhammer, M., Strobl, M., Kühl, M., Klimant, I., Borisov, S. M., Koren, K. Design and Application of an Optical Sensor for Simultaneous Imaging of pH and Dissolved O2 with Low Cross-Talk. ACS Sensors. 1 (6), 681-687 (2016).
- Jensen, S. I., Kühl, M., Glud, R. N., Jørgensen, L. B., Priemé, A. Oxic microzones and radial oxygen loss from roots of Zostera marina. Marine Ecology Progress Series. , 49-58 (2005).
- Larsen, M., Santner, J., Oburger, E., Wenzel, W. W., Glud, R. N. O2 dynamics in the rhizosphere of young rice plants (Oryza sativa L.) as studied by planar optodes. Plant and Soil. 390 (1-2), 279-292 (2015).
- Brodersen, K. E., Koren, K., Moßhammer, M., Ralph, P. J., Kühl, M., Santner, J. Seagrass-Mediated Phosphorus and Iron Solubilization in Tropical Sediments. Environmental Science and Technology. 51, 14155-14163 (2017).
- Kühl, M., Rickelt, L. F., Thar, R. Combined imaging of bacteria and oxygen in biofilms. Applied and Environmental Microbiology. 73 (19), 6289-6295 (2007).
- Sønderholm, M., et al. Tools for studying growth patterns and chemical dynamics of aggregated Pseudomonas aeruginosa exposed to different electron acceptors in an alginate bead model. npj Biofilms and Microbiomes. 3, 1-11 (2018).
- Koren, K., Moßhammer, M., Scholz, V. V., Borisov, S. M., Holst, G., Kühl, M. Luminescence Lifetime Imaging of Chemical Sensors - A Comparison between Time-Domain and Frequency-Domain Based Camera Systems. Analytical Chemistry. 91 (5), 3233-3238 (2019).
- Brodersen, K. E., Koren, K., Lichtenberg, M., Kühl, M. Nanoparticle-based measurements of pH and O2 dynamics in the rhizosphere of Zostera marina L.: effects of temperature elevation and light-dark transitions. Plant, Cell & Environment. 39 (7), 1619-1630 (2016).
- Zhu, Q., Aller, R. C., Fan, Y. High-Performance Planar pH Fluorosensor for Two-Dimensional pH Measurements. in Marine Sediment and Water. Environmental Science & Technology. 39, 8906-8911 (2005).
- Murniati, E., Gross, D., Herlina, H., Hancke, K., Glud, R. N., Lorke, A. Oxygen imaging at the sediment-water interface using lifetime-based laser induced fluorescence (τLIF) of nano-sized particles. Limnology and Oceanography: Methods. 14 (8), 506-517 (2016).
- Santner, J., Larsen, M., Kreuzeder, A., Glud, R. N. Two decades of chemical imaging of solutes in sediments and soils - a review. Analytica Chimica Acta. , 9-42 (2015).
- Glud, R. N. Oxygen dynamics of marine sediments. Marine Biology Research. 4 (4), 243-289 (2008).
- Revsbech, N. P., Jorgensen, B. B., Blackburn, T. H. Oxygen in the Sea Bottom Measured with a Microelectrode. Science. 207 (4437), 1355-1356 (1980).
- Klimant, I., Meyer, V., Kuhl, M. Fiberoptic oxygen microsensors, a new tool in aquatic biology. Limnology and Oceanography. 40 (6), 1159-1165 (1995).
- Glud, R. N., Tengberg, A., Kühl, M., Hall, P. O. J., Klimant, I., Holst, G. An in situ instrument for planar O2 optode measurements at benthic interfaces. Limnology and Oceanography. 46 (8), 2073-2080 (2001).
- Larsen, M., Borisov, S. M., Grunwald, B., Klimant, I., Glud, R. N. A simple and inexpensive high resolution color ratiometric planar optode imaging approach: application to oxygen and pH sensing. Limnology and Oceanography: Methods. 9, 348-360 (2011).
- Glud, R., Ramsing, N., Gundersen, J., Klimant, I. Planar optrodes:a new tool for fine scale measurements of two-dimensional O2 distribution in benthic communities. Marine Ecology Progress Series. 140, 217-226 (1996).
- Frederiksen, M. S., Glud, R. N. Oxygen dynamics in the rhizosphere of Zostera marina: A two-dimensional planar optode study. Limnology and Oceanography. 51 (2), 1072-1083 (2006).
- Quaranta, M., Borisov, S. M., Klimant, I. Indicators for optical oxygen sensors. Bioanalytical Reviews. 4, 115-157 (2012).
- Koren, K., Hutter, L., Enko, B., Pein, A., Borisov, S. M., Klimant, I. Tuning the dynamic range and sensitivity of optical oxygen-sensors by employing differently substituted polystyrene-derivatives. Sensors and Actuators B: Chemical. 176 (100), 344-350 (2013).
- Borisov, S. M. Fundamentals of Quenched Phosphorescence O2 Sensing and Rational Design of Sensor Materials. Quenched-phosphorescence Detection of Molecular Oxygen: Applications in Life Sciences. , 1-18 (2018).
- Wang, X., Wolfbeis, O. S. Optical methods for sensing and imaging oxygen: materials, spectroscopies and applications. Chemical Society Reviews. 43, 3666-3761 (2014).
- Ehgartner, J., Wiltsche, H., Borisov, S. M., Mayr, T. Low cost referenced luminescent imaging of oxygen and pH with a 2-CCD colour near infrared camera. The Analyst. 139 (19), 4924 (2014).
- Meier, R. J., Fischer, L. H., Wolfbeis, O. S., Schäferling, M. Referenced luminescent sensing and imaging with digital color cameras: A comparative study. Sensors and Actuators B: Chemical. 177, 500-506 (2013).
- Holst, G., Kohls, O., Klimant, I., König, B., Kühl, M., Richter, T. A modular luminescence lifetime imaging system for mapping oxygen distribution in biological samples. Sensors and Actuators B. 51, 163-170 (1998).
- Moßhammer, M., Brodersen, K. E., Kühl, M., Koren, K. Nanoparticle- and microparticle-based luminescence imaging of chemical species and temperature in aquatic systems: a review. Microchimical Acta. , 1-28 (2019).
- Koren, K., Kühl, M. CHAPTER 7. Optical O2 Sensing in Aquatic Systems and Organisms. Quenched-phosphorescence Detection of Molecular Oxygen: Applications in Life Sciences. 1, 145-174 (2018).
- Chen, H., Holst, G., Gratton, E. Modulated CMOS camera for fluorescence lifetime microscopy. Microscopy Research and Technique. 78, 1075-1081 (2015).
- Franke, R., Holst, G. A. Frequency-domain fluorescence lifetime imaging system (pco.flim) based on a in-pixel dual tap control CMOS image sensor. Proceedings of SPIE 93281, Imaging, Manipulation, and Analysis of Biomolecules, Cells, and Tissues XIII. , 1-19 (2015).
- Williams, P. N., et al. Localized flux maxima of arsenic, lead, and iron around root apices in flooded lowland rice. Environmental Science and Technology. 48 (15), 8498-8506 (2014).
- Schreml, S., et al. 2D luminescence imaging of physiological wound oxygenation. Experimental dermatology. 20 (7), 550-554 (2011).
- Trampe, E., et al. Functionalized Bioink with Optical Sensor Nanoparticles for O2 Imaging in 3D-Bioprinted Constructs. Advanced Functional Materials. 1804411, 1804411 (2018).
- Gouterman, M. Oxygen Quenching of Luminescence of Pressure Sensitive Paint for Wind Tunnel Research. Journal of Chemical Education. 74 (6), 697 (1997).
- Fischer, L. H., et al. Referenced dual pressure- and temperature-sensitive paint for digital color camera read out. Chemistry. 18 (49), 15706-15713 (2012).
- Fabricius-Dyg, J., Mistlberger, G., Staal, M., Borisov, S. M., Klimant, I., Kühl, M. Imaging of surface O2 dynamics in corals with magnetic micro optode particles. Marine Biology. 159 (7), 1621-1631 (2012).
- Koren, K., Jakobsen, S. L., Kühl, M. In-vivo imaging of O2 dynamics on coral surfaces spray-painted with sensor nanoparticles. Sensors and Actuators B: Chemical. 237, 1095-1101 (2016).
- Carraway, E. R., Demas, J. N., DeGraff, B. A., Bacon, J. R. Photophysics and Photochemistry of Oxygen Sensors Based on Luminescent Transition-Metal Complexes. Analytical Chemistry. 63 (4), 337-342 (1991).
- Klimant, I., Ruckruh, F., Liebsch, G., Stangelmayer, A., Wolfbeis, O. S. Fast response oxygen micro-optodes based on novel soluble ormosil glasses. Mikrochimica Acta. 131, 35-46 (1999).
- Askaer, L., Elberling, B., Glud, R. N., Kühl, M., Lauritsen, F. R., Joensen, H. P. Soil heterogeneity effects on O2 distribution and CH4 emissions from wetlands: In situ and mesocosm studies with planar O2 optodes and membrane inlet mass spectrometry. Soil Biology and Biochemistry. 42 (12), 2254-2265 (2010).
- Mayr, T., Borisov, S. M., Abel, T., Enko, B., Waich, K. Light Harvesting as a Simple and Versatile Way to Enhance Brightness of Luminescent Sensors. Analytical Chemistry. 81, 6541-6545 (2009).
- Kühl, M., et al. Microenvironmental Ecology of the Chlorophyll b-Containing Symbiotic Cyanobacterium Prochloron in the Didemnid Ascidian Lissoclinum patella. Frontiers in microbiology. 3, 1-18 (2012).
- Dalfen, I., Dmitriev, R. I., Holst, G., Klimant, I., Borisov, S. M. Background-Free Fluorescence-Decay-Time Sensing and Imaging of pH with Highly Photostable Diazaoxotriangulenium Dyes. Analytical Chemistry. 91 (1), 808-816 (2019).
- Chatni, M. R., Maier, D. E., Porterfield, D. M. Evaluation of microparticle materials for enhancing the performance of fluorescence lifetime based optrodes. Sensors and Actuators B: Chemical. 141, 471-477 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon