Method Article
Ein einfaches und effektives Transplantationsgerät für Zebrafischembryonen
In diesem Artikel
Zusammenfassung
Embryologische Manipulationen wie Exstirpation und Transplantation von Zellen sind wichtige Werkzeuge, um die frühe Entwicklung zu untersuchen. Dieses Protokoll beschreibt ein einfaches und effektives Transplantationsgerät, um diese Manipulationen in Zebrafischembryonen durchzuführen.
Zusammenfassung
Klassische embryologische Manipulationen, wie das Entfernen von Zellen und das Transplantieren von Zellen innerhalb oder zwischen Embryonen, sind mächtige Techniken, um komplexe Entwicklungsprozesse zu untersuchen. Zebrafischembryonen eignen sich ideal für diese Manipulationen, da sie leicht zugänglich, relativ groß und transparent sind. Zuvor entwickelte Geräte zur Zellentfernung und -transplantation sind jedoch umständlich in der Anwendung oder teuer in der Anschaffung. Im Gegensatz dazu ist das hier vorgestellte Transplantationsgerät wirtschaftlich, einfach zu montieren und einfach zu bedienen. In diesem Protokoll stellen wir zunächst die Handhabung des Transplantationsgeräts sowie dessen Montage aus handelsüblichen und weit verbreiteten Teilen vor. Wir stellen dann drei Anwendungen für seine Verwendung vor: die Erzeugung von ektopischen Klonen zur Untersuchung der Signalausbreitung aus lokalisierten Quellen, die Extirpation von Zellen zur Herstellung größenreduzierter Embryonen und die Keimbahntransplantation zur Erzeugung mütterlich-zygotischer Mutanten. Schließlich zeigen wir, dass das Werkzeug auch für embryologische Manipulationen bei anderen Arten wie dem japanischen Reisfisch Medaka verwendet werden kann.
Einleitung
Aus den klassischen Experimenten von Mangold und Spemann, die die Existenz eines Organizers demonstrierten, der die Bildung einer embryonalen Achse anordnet1, ist die Transplantation von Zellen zwischen Embryonen zu einer etablierten Technik zur Untersuchung der Embryonalentwicklung geworden2,3,4,5,6,7,8,9,10 . Ein häufig verwendeter Aufbau für die Transplantation besteht aus einer mikrometergesteuerten, antriebsgesteuerten gasdichten Spritze, die über einen flexiblen Schlauch mit einem Mikropipettenhalter verbunden ist, und einem mit Mineralöl gefüllten Reservoir12,13. Bei diesem Setup wird der Kolben der Spritze durch eine Schraube bewegt. Der so erzeugte Druck wird auf die Mikropipette übertragen und verwendet, um Zellen aus einem Embryo herauszuziehen und in einen anderen zu deponieren. Dieses hydraulisch betriebene Gerät besteht jedoch aus vielen Teilen und ist mühsam von Grund auf neu zu montieren. Ähnliche Geräte können auch als komplettes Arbeitsset erworben werden, das normalerweise als manuelle Mikroinjektoren verkauft wird, und diese kommerziellen Versionen kosten in der Regel mehr als 1500 US $. Sowohl in der hausgemachten als auch in der kommerziellen Version wird die Mikropipette für die Embryomanipulation durch ölgefüllte Schläuche von der druckerzeugenden Vorrichtung (der gasdichten Spritze) getrennt. Die Manipulation der Mikropipette und die Bewegung des Kolbens müssen daher separat mit verschiedenen Händen betrieben werden, was den Durchsatz und den Nutzen verringert. Darüber hinaus sind die Geräte umständlich für die Vorbereitung auf die Transplantation, da der Schlauch sorgfältig mit Öl gefüllt werden muss, während die Bildung von Blasen vermieden wird. Hier beschreiben wir ein alternatives pneumatisch betriebenes Gerät zur Zellentnahme und -transplantation, das kostengünstig, einfach zu montieren und einfach zu bedienen ist.
Das hier vorgestellte Gerät besteht aus einer 25 μL gasdichten Spritze, die mit einem Mikropipettenhalter ausgestattet ist und insgesamt weniger als 80 US$ kostet. Das Gerät kann einfach montiert werden, indem der Mikropipettenhalter über die Luer-Verriegelung in die Spritze eingeführt wird (Abbildung 1A). Das Gerät wird dann direkt auf einem Mikromanipulator montiert, so dass der Benutzer sowohl seine Position als auch die Absaugung mit einer Hand direkt am Mikromanipulator steuern kann. Dies lässt die andere Hand bequem frei, um die Transplantationsschale mit Spender- und Wirtsembryonen zu stabilisieren und zu bewegen. Das Gerät arbeitet durch direkte Absaugung mit Luft und muss nicht mit Mineralöl gefüllt werden. Aufgrund der Anziehungskräfte zwischen dem Wasser und den Wänden der Glasnadel wird eine große Bewegung im Kolben der Spritze in eine kleinere Bewegung des Wasserspiegels innerhalb der Nadel übersetzt, solange sich der Wasserstand im sich verjüngenden Ende der Glasnadel befindet. Dies ermöglicht eine präzise Kontrolle über die Anzahl der angesaugten Zellen und den Ort ihrer Einführung.
Um den Nutzen dieses Geräts zu demonstrieren, stellen wir drei Anwendungen in Zebrafisch-Embryonen (Danio rerio) vor. Zunächst zeigen wir, wie man lokalisierte Quellen von sezernierten Signalmolekülen erzeugt, die zur Untersuchung der Gradientenbildung verwendet werden können2,4,6. Hier werden Spenderembryonen mit mRNA injiziert, die für ein fluoreszierend markiertes Signalmolekül kodiert. Die fluoreszenzmarkierten Spenderzellen werden dann in Wildtyp-Wirtrembryonen transplantiert, wo die Bildung eines Signalgradienten abgebildet und analysiert werden kann. Zweitens beschreiben wir, wie das Gerät verwendet werden kann, um Zellen durch Extirpation zu entfernen, um größenreduzierte Embryonen zu erzeugen5,13. Schließlich zeigen wir, wie man mütterlich-zygotische Mutanten robust produzieren kann, indem Zellen, die einen primordialen Keimzellreporter tragen, in Wirtsembryonen transplantiert werden, in denen die Keimbahn abgetragen wurde6,10. In Zukunft kann das hier beschriebene Transplantationsgerät leicht an andere embryologische Manipulationen angepasst werden, die die Entfernung oder Transplantation von Zellen erfordern.
Protokoll
1. Zusammenbau und Verwendung des Transplantationsgeräts
- Montage des Transplantationsgeräts.
- Schließen Sie die gasdichte 25-μL-Spritze mit Luer-Spitze und einen Mikropipettenhalter mit Luer-Verriegelung an, um das Transplantationsgerät zusammenzubauen (Abbildung 1A).
HINWEIS: Die Benetzung der Luer-Spitze mit einem dünnen Wasserfilm kann dazu beitragen, die Verbindung zu verbessern, indem die Teile über Wasseradhäsion und Kohäsion zusammengehalten werden. - Montieren Sie das Gerät direkt auf einem manuellen Mikromanipulator (Abbildung 1B). Das Gerät kann allein mit der dominanten Hand gesteuert werden, wodurch die andere Hand für zusätzliche Aufgaben frei wird.
- Schließen Sie die gasdichte 25-μL-Spritze mit Luer-Spitze und einen Mikropipettenhalter mit Luer-Verriegelung an, um das Transplantationsgerät zusammenzubauen (Abbildung 1A).
- Vorbereitung der Transplantationsnadel.
- Erzeugen Sie eine Transplantationsnadel, indem Sie eine Glaskapillarpipette (ohne Filament) mit einem Mikropipettenzieher ziehen.
- Brechen Sie die Nadelspitze so glatt wie möglich, da scharfe Kanten die Wahrscheinlichkeit erhöhen, das Eigelb während der Transplantation zu zerkratzen, was für den Embryo tödlich ist.
HINWEIS: Die Spitze kann leicht mit einer Rasierklinge mit gerader Schneide unter einem Stereomikroskop gebrochen werden. Die Verwendung einer Mikroschmiede ermöglicht es jedoch, eine präzise Öffnung der gewünschten Größe zu erzeugen. Für die Erzeugung ektopischer Quellen ist ein Außendurchmesser von ca. 50-60 μm geeignet. Bei Extipationen und Keimbahntransplantationen sollte der Außendurchmesser der Nadel etwa 80-90 μm betragen, um die Anzahl der transplantierten Zellen zu erhöhen. - Führen Sie die gebrauchsfertige Nadel in das Transplantationsgerät ein (Abbildung 1A).
- Verwendung des Transplantationsgeräts.
- Platzieren Sie den Mikromanipulator mit dem Transplantationsgerät neben einem Stereomikroskop (Abbildung 1B).
- Entfernen Sie den Kolben und senken Sie die Transplantationsnadel in der mit Ringers Lösung gefüllten Transplantationsschale (siehe Schritt 2.2.1) in einem Winkel von 45°, bis die Nadelspitze eingetaucht ist (Abbildung 1B). Wasser wird die Nadel aufgrund der Kapillarwirkung hochstürzen.
- Führen Sie den Kolben ungefähr zur Hälfte ein, um die Lösungen des Ringers auszuspülen, und lassen Sie nur ein kleines Wasservolumen in dem dünnen, sich verjüngenden Teil der Nadel zurück (Abbildung 1C).
HINWEIS: Dies ist die neutrale Position, und der Wasserstand sollte dort für eine Weile stabil sein (>20 min). Wenn der Wasserstand instabil ist, tritt die Luft aus; Schließen Sie die Luer-Verriegelung wieder an, oder ersetzen Sie die Spritze. - Wenn Sie zum ersten Mal eine Transplantationsnadel verwenden, beschichten Sie ihr Inneres, indem Sie Eigelb aus einem geopferten Embryo ziehen und dann das Eigelbmaterial vollständig ausstoßen. Die Beschichtung wird dazu beitragen, die Haftung der Zellen auf dem Glas bei nachfolgenden Verfahren zu reduzieren.
- Positionieren Sie den Spenderembryo vorsichtig mit Hilfe der Nadel und positionieren Sie dann die Nadelöffnung orthogonal zur Oberfläche des Embryos (Abbildung 1D).
HINWEIS: Die Position ist für verschiedene Assays unterschiedlich. Für die Erzeugung ektopischer Signalmolekülquellen und Zellexpretionen wird dies die Oberseite des Tierpols sein (Abbildung 1E); bei der Keimbahntransplantation ist dies der Rand (Abbildung 1D,F). - Ziehen Sie langsam und vorsichtig den Kolben hoch, um die Zellen in die Nadel zu ziehen.
HINWEIS: Wenn die Zellen zu schnell aufgenommen werden, können sie beschädigt werden. Wenn es richtig gemacht wird, sollten die Zellen als zylindrische Säule herauskommen. Vermeiden Sie es, Eigelb in die Nadel aufzunehmen, da das transplantierte Eigelb für den Wirtsembryo toxisch ist. - Stoppen Sie die Absaugung, indem Sie den Kolben vorsichtig leicht nach unten drücken, sobald die gewünschte Anzahl von Zellen eingezogen ist. Entfernen Sie die Nadel vom Embryo, indem Sie die Nadel in einer kurzen und schnellen Bewegung zur Seite ziehen. Lassen Sie etwas Ringer-Lösung auf beiden Seiten der Zellsäule und beschränken Sie die Zellen auf das sich verjüngende Ende der Nadel (Abbildung 1C,D).
HINWEIS: Die Flüssigkeit vor der Zellsäule hilft, die Zellen der Wirtsembryonen bei der Ablagerung der Zellsäule auseinanderzudrücken. - Entfernen Sie das verbleibende Eigelb oder Zelltrümmer, indem Sie den Kolben langsam auf und ab bewegen - während die Nadel eingetaucht bleibt -, um die Zellen mit Ringers Lösung zu waschen. Wenn es richtig gemacht wird, bleiben die unbeschädigten Zellen in einer Säule zusammengeklebt, während die Trümmer weggespült werden.
HINWEIS: Bei diesem Schritt ist große Vorsicht geboten, da der Wasserstand über das sich verjüngende Ende der Nadel hinaus ansteigt. Dies führt zu einem plötzlichen Zustrom von Wasser, das zum Waschen der Zellen verwendet werden kann. Sobald der Wasserstand jedoch das sich verjüngende Ende passiert hat, wird die Feinkontrolle mit dem Kolben reduziert und der Kolben muss langsamer und vorsichtiger bewegt werden. - Bewegen Sie die Transplantationsschale mit der nicht dominanten Hand, um die Nadel orthogonal zur Oberfläche (entweder Tierpol oder Rand) des Wirtsembryo zu positionieren (Abbildung 1D-F).
- Üben Sie vorsichtig leichten Druck aus und geben Sie dann eine schnelle, scharfe Bewegung, um die umhüllende Schicht des Wirtsembryo zu durchbohren. Achten Sie darauf, das Eigelb nicht mit der Nadel zu zerkratzen.
HINWEIS: Die Anwendung von leichtem Druck auf den Embryo durch vorsichtiges Drücken gegen die Wände des Brunnens erhöht die Oberflächenspannung des Embryos und erleichtert so das Durchstechen der umhüllenden Schicht. - Sobald sich die Nadel im Inneren befindet, drücken Sie vorsichtig auf den Kolben, um die Zellsäule in den Embryo zu extrudieren, während Sie gleichzeitig die Nadel langsam zurückziehen (Abbildung 1D-F).
- Reinigen der Transplantationsnadel.
- Spülen Sie die Nadel aus, indem Sie den Kolben auf und ab bewegen, während die Nadel in deionisiertes Wasser eingetaucht wird.
HINWEIS: Wenn die Nadel schmutzig bleibt, spülen Sie sie mit 10 M Natronlauge ab, bevor Sie sie erneut mit Wasser abspülen. - Bewahren Sie die Nadel zur weiteren Verwendung in einer geeigneten Box auf.
- Spülen Sie die Nadel aus, indem Sie den Kolben auf und ab bewegen, während die Nadel in deionisiertes Wasser eingetaucht wird.
2. Erzeugung ektopischer Quellen von sezernierten Signalmolekülen in Zebrafischembryonen
- Vorbereitung der Wirts- und Spenderembryonen.
- Sammeln Sie frisch gelegte Embryonen, indem Sie Zebrafische paaren.
- Dechorionieren Sie Zebrafischembryonen im 1-Zell-Stadium, indem Sie bis zu 100 Embryonen in 0,5 mg/ ml Pronaselösung für ca. 15 min in einer kleinen Glas-Petrischale inkubieren (eine detaillierte Beschreibung dieses Verfahrens wurde von Rogers, K. W. et al.14 veröffentlicht).
HINWEIS: Alternativ können die Embryonen auch kurz vor der Transplantation im hohen Stadium dehorioniert werden (Schritt 2.2), dies erfordert jedoch, dass die injizierten Spenderembryonen und die nicht injizierten Wirtsembryonen separat dehorioniert werden. - Tauchen Sie die Embryonen in embryonales Medium in ein 200 ml Becherglas.
HINWEIS: Dekahorionierte Blastula- und Gastrula-Stadiumsembryonen sind sehr empfindlich. Ihr freiliegendes Eigelb haftet auf Kunststoffoberflächen und reißt bei Kontakt mit Luft. Daher müssen sie vollständig in das Embryomedium eingetaucht bleiben, mit einem Glaspipette übertragen und entweder in Agarose-beschichteten (1% im Embryomedium) Kunststoffschalen oder In Petrischalen aus Glas gehalten werden. - Leeren Sie vorsichtig den größten Teil des Embryomediums und füllen Sie das Becherglas langsam mit frischem Embryomedium. Die auf diese Weise verursachte leichte Erregung erleichtert die Entfernung der geschwächten Chorionen. Wiederholen Sie diesen Schritt 2-3 Mal.
- Übertragen Sie die dekumentierten Embryonen mit einer Pasteurpipette aus Glas in eine mit Agarose beschichtete Injektionsschale.
HINWEIS: Das Entflammen der Spitze der Pasteurpipette des Glases durch Aussetzen einer Bunsenbrennerflamme kann schmelzen und den Rand glätten, um Schäden an den Embryonen zu vermeiden. - Injizieren Sie die mRNA, die für das fluoreszenzmarkierte Protein kodiert, in eine Untergruppe von Embryonen (eine detaillierte Beschreibung dieses Verfahrens wurde von Rogers, K. W. et al.14 veröffentlicht). Injizieren Sie die mRNA in die Zelle, nicht das Eigelb, für eine nahezu homogene Expression. Injizierte Embryonen dienen als Spender, während nicht injizierte Embryonen als Wirte dienen.
HINWEIS: Die Menge und Art der injizierten mRNA hängt von dem untersuchten Signalmolekül ab und liegt normalerweise zwischen 20 und 200 pg2,4,5,6 (kann aber in bestimmten Fällen bis zu 1000 pg betragen4). - Übertragen Sie die injizierten Embryonen in eine mit Agarose beschichtete Sechs-Well-Schale, die mit Embryomedium gefüllt ist. Bei 28 °C inkubieren, bis die Embryonen das frühe Kugelstadium erreicht haben.
- Transplantation von Zellen, um ektopische Quellen zu erzeugen.
- Füllen Sie eine Transplantationsschale (mit einzelnen dreieckigen keilförmigen Vertiefungen, siehe Materialtabelle) mit Ringers Lösung (116 mM NaCl, 2,8 mM KCl, 1 mM CaCl2, 5 mM HEPES; lagern Sie den HEPES-Puffer bei 4 °C).
HINWEIS: Das Kalzium in Ringers Lösung fördert die Zelladhäsion und hilft dem Embryo, von der Transplantation zu heilen. - Übertragen Sie die Embryonen in die Transplantationsschale.
- Positionieren Sie den Wirts- und Spenderembryonen in abwechselnden Säulen, jeweils mit der Tierstange, die auf die Transplantationsnadel ausgerichtet ist.
- Führen Sie die Transplantation wie in Abschnitt 1.3 beschrieben durch. Für die ektopische Quellentransplantation nehmen Sie Quellzellen von der Oberseite des Tierpols und deponieren sie an derselben Stelle im Wirtsembryo (Abbildung 1E).
HINWEIS: Das Waschen der Zellen mit Ringers Lösung, wie in Schritt 1.3.8 beschrieben, ist wichtig für die Erzeugung ektopischer Quellen, um sicherzustellen, dass bereits sezernierte Signalmoleküle nicht auf den Wirt übertragen werden. Transplantieren Sie nicht zu viele Zellen, um sicherzustellen, dass die Quelle nicht dispergiert ist. Eine Säule mit einem Durchmesser von ca. 80 μm und einer Länge von 100 μm eignet sich für viele Anwendungen. - Lassen Sie den Wirtsembryo 30 Minuten bis 1 h in Ringers Lösung bleiben, um sich zu erholen.
- Untersuchen Sie, ob Zellen mit einem Fluoreszenz-Stereomikroskop erfolgreich transplantiert wurden (Abbildung 2).
- Nach der Genesung werden die Embryonen auf eine mit Agarose beschichtete Sechs-Well-Platte übertragen, die mit Embryomedium gefüllt ist, und bei 28 °C inkubiert.
- Füllen Sie eine Transplantationsschale (mit einzelnen dreieckigen keilförmigen Vertiefungen, siehe Materialtabelle) mit Ringers Lösung (116 mM NaCl, 2,8 mM KCl, 1 mM CaCl2, 5 mM HEPES; lagern Sie den HEPES-Puffer bei 4 °C).
3. Erzeugung größenreduzierter Embryonen durch Zellexkretion
- Vorbereitung der Embryonen für die Ausrottung.
- Sammeln Sie frisch gelegte Embryonen von Zebrafischen des gewünschten Genotyps.
- Inkubieren Sie die Embryonen bei 28 °C, bis sie das hohe Stadium erreichen.
- Dekreionieren Sie die Embryonen wie in den Schritten 2.1.2-2.1.5 beschrieben, wenn die Embryonen das hohe Stadium erreichen.
HINWEIS: In diesem Beispiel wird die Zellerregung in der Kugelstufe durchgeführt. Dementsprechend werden Embryonen etwa 30 min bis 1 h früher dehorioniert.
- Optional: Beschriftung der Eigelb-Synzytialschicht (YSL).
HINWEIS: Falls gewünscht, injizieren Sie fluoreszierendes Dextrans in das YSL, bevor Sie zellen ausrotten. Mit dieser Technik kann festgestellt werden, ob das YSL nach der Zellentfernung intakt bleibt, was für die normale Embryogenese wichtig ist15. Alternativ können auch in vitro synthetisierte mRNAs oder Proteine in das YSL injiziert werden.- Verwenden Sie eine Pasteur-Pipette, um die dekumentierten Embryonen in eine mit Agarose beschichtete Injektionsschale zu übertragen, die mit Embryonenwasser gefüllt ist.
- Richten Sie die Embryonen seitlich aus, wobei der Blastodermenrand auf die Injektionsnadel zeigt (Abbildung 3A).
- Injizieren Sie 0,5 nL von 1,5 μg / μL 10 kDa Alexa568-Dextran in das YSL und zielen Sie auf einen Bereich zwischen den Blastodermzellen und dem Eigelb in einer Tiefe von etwa einem Drittel des Embryodurchmessers ab. Injizieren Sie alle Embryonen innerhalb einer Reihe.
HINWEIS: Da die Injektionsnadel nicht durch das Chorion durchbohren muss, ist eine kleine (~4 μm) und scharfe Öffnung von Vorteil. - Drehen Sie die Embryonen um 180°, so dass die gegenüberliegende Seite des Blastodermenrands auf die Injektionsnadel zeigt (Abbildung 3A).
- Injizieren Sie weitere 0,5 nL 1,5 μg/μL 10 kDa Alexa568-Dextran in das YSL, wie in Schritt 3.2.3 beschrieben, was ein Gesamteinjektionsvolumen von 1 nL pro Embryo ergibt.
HINWEIS: Die Injektion von zwei Seiten ermöglicht eine gleichmäßigere Verteilung des fluoreszierenden Dextrans innerhalb des YSL. - Untersuchen Sie das Ergebnis der Injektion unter einem Fluoreszenz-Stereomikroskop. Wenn es richtig gemacht wird, wird das Fluoreszenzsignal auf das YSL beschränkt (Abbildung 3B) und ist im Interzellularraum des Blastoderms nicht sichtbar.
- Zellen ausrotten
- Füllen Sie eine Transplantationsschale mit Ringer-Lösung (siehe Schritt 2.2.1).
- Übertragen Sie die Embryonen in die Transplantationsschale.
- Richten Sie die Embryonen mit dem Tierpol auf die Transplantationsnadel aus (Abbildung 3C).
- Entfernen Sie vorsichtig Zellen aus der tierischen Polregion, wie in den Schritten 1.3.5-1.3.7 beschrieben, wodurch das Blastoderm auf die gewünschte Größe reduziert wird.
- Verwerfen Sie die entfernten Zellen, indem Sie sie aus der Transplantationsnadel ausstoßen.
- Sobald der Eingriff abgeschlossen ist, lassen Sie die Embryonen 30 Minuten bis 1 h in Ringers Lösung bleiben, um sich zu erholen.
- OPTIONAL: Untersuchen Sie die Integrität des YSL unter einem Fluoreszenz-Stereomikroskop (Abbildung 3D).
- Die Embryonen werden auf eine mit Embryonenmedium gefüllte, mit Agarose beschichtete Platte überführt und bei 28 °C inkubiert.
4. Erzeugung mütterlich-zygotischer Mutanten durch Keimbahntransplantation
- Vorbereitung von Wirts- und Spenderembryonen.
- Sammeln Sie frisch gelegte Embryonen von mutierten und Wildtyp-Zebrafischen. Embryonen von Zebrafischen mit mutiertem Hintergrund dienen als Spender, während Embryonen von Zebrafischen mit Wildtyphintergrund als Wirte dienen.
HINWEIS: Die Keimbahntransplantation erfordert eine hohe Anzahl von Startembryonen (~ 50 für Spender, ~ 500 für Wirte), um eine gute Anzahl erfolgreicher Keimbahntransplantationen zu gewährleisten, die bis ins Erwachsenenalter überleben. - Überführen Sie die Embryonen mit einer Pasteurpipette in eine mit Agarose beschichtete Injektionsschale mit Embryomedium.
HINWEIS: Injektionen werden vor der Dekationierung durchgeführt, um den Durchsatz zu erhöhen. Nadeln für die Injektion durch das Chorion müssen stumpf sein und eine größere Öffnung (~ 10 μm) haben, um ein Verstopfen zu verhindern. - Injizieren Sie den Spenderembryonen 1 nL 100 ng/μL mRNA, die für GFP kodiert, mit einer Nos1 3'UTR. Injizieren Sie die mRNA in das Eigelb, um den Durchsatz zu erhöhen.
HINWEIS: Die Nos1 3'UTR stabilisiert die mRNA in den primordialen Keimzellen, wodurch die Keimzellen 1 Tag nach der Befruchtung stark fluoreszierend sind10. - Injizieren Sie den Wirtsembryonen 1 nL 0,33 mM (3 μg/μL) Sackgasse (dnd) Morpholino. Injizieren Sie das Morpholino in das Eigelb, um den Durchsatz zu erhöhen.
HINWEIS: Der dnd morpholino blockiert die primordiale Keimzellbildung, wodurch sichergestellt wird, dass die Keimbahn des Wirtsembryo nach der Transplantation ausschließlich mit Zellen des Spenders besiedelt wird10. - Übertragen Sie die injizierten Embryonen mit Embryomedium in Plastik-Petrischalen. Bei 28 °C inkubieren, bis die Embryonen das hohe Stadium erreicht haben.
- Dekreionieren Sie die Embryonen wie in den Schritten 2.1.2-2.1.5 beschrieben, wenn die Embryonen das hohe Stadium erreichen.
- Sammeln Sie frisch gelegte Embryonen von mutierten und Wildtyp-Zebrafischen. Embryonen von Zebrafischen mit mutiertem Hintergrund dienen als Spender, während Embryonen von Zebrafischen mit Wildtyphintergrund als Wirte dienen.
- Transplantation von Keimzellen
- Füllen Sie eine Transplantationsschale mit Ringer-Lösung (siehe Schritt 2.2.1).
- Übertragen Sie die dekumentierten Kugel- bis Kuppelstadium-Embryonen in die Transplantationsschale.
- Positionieren Sie die Wirtsembryonen und Spenderembryonen in abwechselnden Säulen, um die Zellen von einem Spenderembryo auf sechs verschiedene Wirtembryonen zu transplantieren. Dies erhöht die Wahrscheinlichkeit, dass Keimzellen aus einem bestimmten Wirtsembryo erfolgreich transplantiert werden.
- Richten Sie die Embryonen mit dem Rand auf die Transplantationsnadel aus und führen Sie die Transplantation wie in Abschnitt 1.3 beschrieben durch. Für Keimbahntransplantationen (Abbildung 1D,F) nehmen Sie die Quellzellen vom Rand (wo sich die primordialen Keimzellen befinden) und deponieren Sie sie an derselben Stelle im Wirtsembryo.
HINWEIS: Das Umpflanzen einer großen Säule (ca. 80 μm Durchmesser und 600 μm Länge) erhöht die Chance auf eine erfolgreiche Keimbahntransplantation. - Lassen Sie den Embryo 30 Minuten bis 1 h in Ringers Lösung bleiben, um sich nach Abschluss der Transplantation zu erholen.
HINWEIS: Wenn nicht alle Spenderembryonen homozygote Mutanten sein sollen - z. B. wenn sie aus einer heterozygoten Kreuzung resultieren - müssen sie nach der Transplantation genotypisiert werden, um den Genotyp der transplantierten zukünftigen Keimbahn des Wirts zu bestimmen. Stellen Sie in diesem Fall sicher, dass die Positionen des Wirts und der Spenderembryonen während der Handhabung nicht verwechselt werden. - Verwenden Sie ein Fluoreszenz-Stereomikroskop, um zu untersuchen, ob die Zellen erfolgreich transplantiert wurden (Abbildung 4A,B).
- Übertragen Sie die Embryonen in eine 24-Well-Agarose-beschichtete Platte. Gruppieren Sie alle Wirtsembryonen, die Zellen von derselben Spenderin erhalten haben, in denselben Brunnen und markieren Sie sie entsprechend. Inkubieren Sie sie bis zum nächsten Tag bei 28 °C.
- Falls erforderlich, übertragen Sie die Spenderembryonen zur Genotypisierung in markierte PCR-Streifen.
- Screening auf erfolgreiche Keimbahntransplantationen
- Screening der Wirtsembryonen auf erfolgreiche Keimbahntransplantationen unter einem Fluoreszenz-Stereomikroskop etwa 30 h nach der Befruchtung (hpf). Die Keimzellen befinden sich an der Rille oberhalb der Dotterverlängerung (Abbildung 4C).
HINWEIS: Typische Experimente mit dem hier vorgestellten Gerät und der hier vorgestellten Strategie haben eine Erfolgsrate von ~ 60% -80%, um mindestens einen Wirtsembryo zu erhalten, der transplantierte Keimzellen pro Spenderembryo trägt. Ein früherer Bericht beschrieb einen Wirkungsgrad von ~ 10%10. - Falls zutreffend, entsorgen Sie Embryonen, die Zellen von Spenderembryonen mit einem falschen Genotyp erhalten haben. Züchten Sie Larven mit erfolgreich transplantierten Keimzellen bis ins Erwachsenenalter gemäß den üblichen Haltungsbedingungen und nach institutionellen Richtlinien.
- Screening der Wirtsembryonen auf erfolgreiche Keimbahntransplantationen unter einem Fluoreszenz-Stereomikroskop etwa 30 h nach der Befruchtung (hpf). Die Keimzellen befinden sich an der Rille oberhalb der Dotterverlängerung (Abbildung 4C).
Ergebnisse
Erfolg und Misserfolg bei der Verwendung des Transplantationsgeräts für die drei oben beschriebenen Anwendungen können leicht durch visuelle Inspektion unter einem Stereomikroskop beurteilt werden. Bei erfolgreichen Transplantationen sollte der Embryo normal und in Form und Eigelbklarheit untransplantierten Embryonen ähnlich aussehen, ohne große Risse im Blastoderm. Wenn der Embryo sichtbar geschädigt ist (Abbildung 4B), entwickelt er sich nicht normal. Idealerweise sollten transplantierte Zellen, die einen fluoreszierenden Marker exprimieren, als kontinuierliche Säule erscheinen, wenn sie unter einem Fluoreszenz-Stereomikroskop betrachtet werden (Abbildung 2A, Abbildung 4A). Wenn die Säule fragmentiert ist, deutet dies darauf hin, dass die Zellen durch das Absaugen in die Transplantationsnadel geschert wurden oder dass die Ablagerung der Zellen zu stark erfolgte. Dies kann verhindert werden, indem der Kolben langsamer und sanfter bewegt wird.
Obwohl das Transplantationsgerät hauptsächlich bei Zebrafischembryonen im Blastulastadium5,6 eingesetzt wurde, funktionieren Transplantation und Zellexkrementierung genauso gut für dekaminierte Blastula-Embryonen des japanischen Reisfisch-Medaka (Oryzias latipes) (Abbildung 2B). Abgesehen von der embryonalen Dekationierung, die von Porazinski, S. R. et al.17 beschrieben wurde, können die gleichen Verfahren wie oben beschrieben angewendet werden.
Im speziellen Fall der Keimbahntransplantation führt eine gute Transplantation zu einem Embryo mit einer langen horizontalen Zellsäule direkt über dem Eigelbrand (Abbildung 4A). Ob Keimzellen erfolgreich transplantiert wurden, kann jedoch erst am Folgetag beurteilt werden (Abbildung 4C-F) aufgrund der Hintergrundexpression von GFP in Blastula-Stadien (Abbildung 1F). Die primordialen Keimzellen erscheinen als kleine fluoreszierende Kugeln in der Rille direkt über der Dotterverlängerung (Abbildung 4C-E). Die Anwesenheit dieser Zellen am richtigen Ort weist auf eine erfolgreiche Keimbahntransplantation hin. Zellen mit einer anderen Form sind keine Keimzellen (z. B. sind längliche Zellen typischerweise Muskelzellen, Abbildung 4F). Wenn primordiale Keimzellen außerhalb der Rille gefunden werden, bedeutet dies, dass sie nicht richtig gewandert sind und nicht zur Keimbahn des Embryos beitragen können. Schließlich sollte die allgemeine Morphologie transplantierter Embryonen ähnlich wie bei nichttransplantierten Embryonen aussehen (Abbildung 4D); Der Schwanz sollte nicht verformt werden, und der Kopf sollte nicht geschrumpft sein oder Augen fehlen (Abbildung 4E). Diese Defekte resultieren in der Regel aus zu hohen Morpholinokonzentrationen oder aus Embryoschäden während der Transplantation. Keimbahntransplantationsexperimente, wie hier beschrieben, führen typischerweise zu 1-2 von 6 Wirtsembryonen mit erfolgreich transplantierten Keimzellen für 60% -80% der Spenderembryonen, abhängig von der Erfahrung des Experimentators. Daher müssen Zellen von 40-50 homozygoten Spenderembryonen in 200-300 Wirtsembryonen transplantiert werden, um etwa 30 Individuen mit mutierten Keimzellen zu züchten.
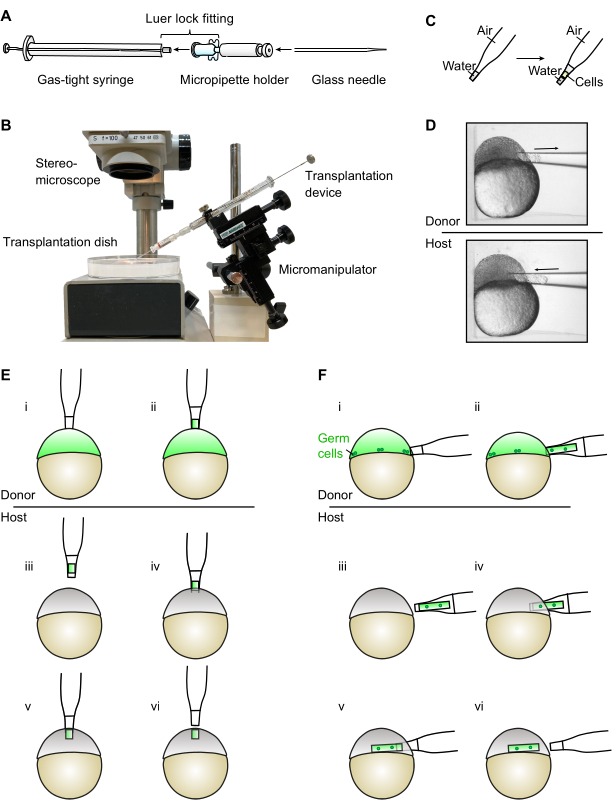
Abbildung 1: Montage und Verwendung des Transplantationsgeräts. (A) Das Transplantationsgerät wird durch Anschließen einer gasdichten Spritze mit einem Mikropipettenhalter durch Luer-Verriegelung montiert. Die Glasnadel zur Transplantation wird dann in den Mikropipettenhalter eingeführt. (B) Foto des zusammengebauten Transplantationsgeräts, das auf einem Mikromanipulator montiert ist (bitte beachten Sie, dass Hintergrund und Etiketten aus dem Bild entfernt wurden). (C) Bei der Verwendung des Transplantationsgeräts ist darauf zu achten, dass der Wasserstand in der Transplantationsnadel am konischen Ende bleibt. (D) Das Gerät wird unter einem Stereomikroskop verwendet, um Zellen aus und in Teleost-Embryonen zu entnehmen und einzufügen, die in einzelne Vertiefungen einer Transplantationsschale platziert sind. (E) Zur Erzeugung ektopischer Quellen werden Zellen aus dem Tierpol eines Spenderembryo (i-ii) entnommen und in den tierischen Pol eines Wirtembryos (iii-vi) übertragen. (F) Bei der Keimbahntransplantation wird eine größere Anzahl von Zellen aus dem Rand eines Spenderembryo (i-ii) entnommen, wo sich die Keimzellen befinden. Die Zellen werden dann in den Rand der Wirtsembryonen übertragen (iii-vi). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
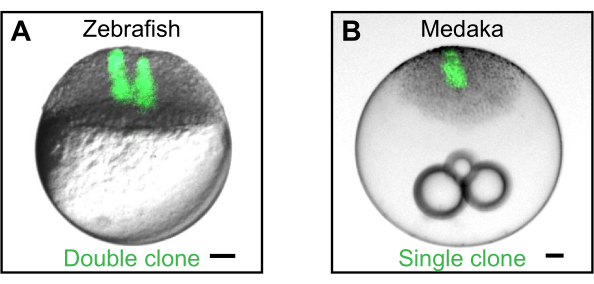
Abbildung 2: Erzeugung von Klonen durch Zelltransplantation. (A) Beispiel für einen Doppelklon, der durch sequentielle Transplantation fluoreszierender Zellen (grün) von einem Zebrafischspender in einen Zebrafisch-Wirtsembryo erzeugt wird. Einzel- und Doppelklone können verwendet werden, um zu untersuchen, wie sekretierte Signalmoleküle raumzeitliche Gradienten bilden2,4,5,6. (B) Beispiel eines einzelnen Klons, der durch Transplantation von Zellen aus einem transgenen eGFP-exprimierenden Medaka-Spender (Wimbledon)17 in einen Wildtyp-Medaka-Wirt erzeugt wird. Maßstabsbalken stellen 100 μm dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
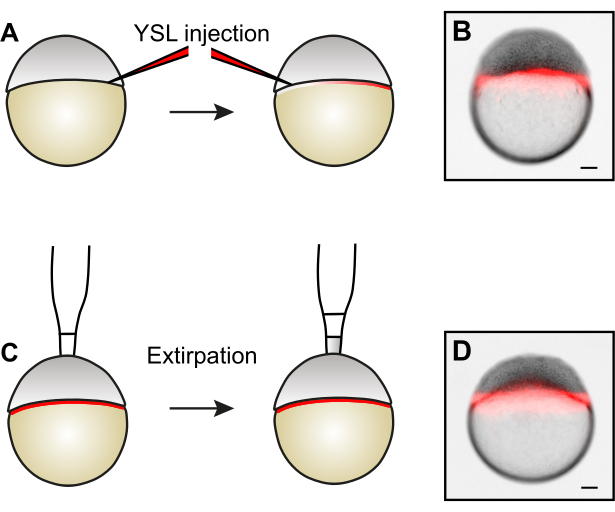
Abbildung 3: Erzeugung größenreduzierter Embryonen durch Zellexkretion. (A) Vor der Entfernung von Zellen durch Exstirpation kann das YSL markiert werden, indem Fluoreszenzfarbstoffe in zwei gegenüberliegende Seiten des YSL injiziert werden. (B) Beispiel eines Embryos nach YSL-Injektion. (C) Um größenreduzierte Embryonen zu erzeugen, werden Zellen aus dem Tierpfahl durch Exstirpation entfernt5. (D) Beispiel eines Embryos nach Zellexkretion. Beachten Sie, dass das YSL intakt bleibt. Maßstabsbalken stellen 100 μm dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
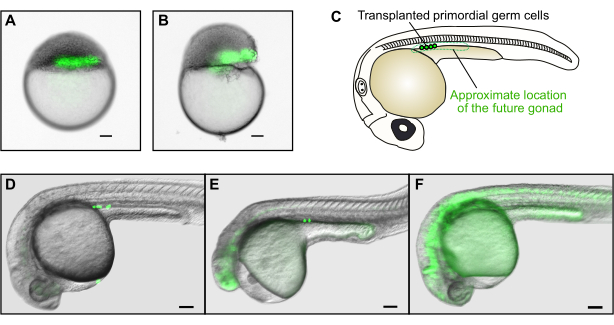
Abbildung 4: Keimbahntransplantation. (A) Beispiel für eine erfolgreiche Transplantation von Spenderzellen (grün) in die Randzone des Wirts. (B) Beispiel für eine erfolglose Transplantation. Das Eigelb des Wirtembryos wurde stark beschädigt, und der Embryo kann sich nicht normal entwickeln. (C) Bei 30 hpf finden sich erfolgreich transplantierte Keimzellen ausschließlich im Gonadenmesoderm an der vorderen Region der Dotterverlängerung. (D) Beispiel für eine erfolgreiche Transplantation, bei der mehrere GFP-markierte Spenderkeimzellen die zukünftige Gonade des Wirts besiedelt haben. (E) Beispiel für eine erfolglose Transplantation. Obwohl Keimzellen das Gonadenmesoderm erreicht haben, ist der Wirtsembryo stark deformiert und entwickelt sich nicht normal. (F) Beispiel für eine erfolglose Transplantation. Fluoreszierende Keimzellen, die nicht an den richtigen Ort gewandert sind, werden die Gonaden nicht wieder bevölkern. Maßstabsbalken stellen 100 μm dar. Die Bilder in D-F wurden mit einer Gesamtvergrößerung von ca. 50x aufgenommen .
Diskussion
Der Erfolg eines Transplantationsexperiments hängt stark von der Feinmotorik des Experimentators ab. Um die Verfahren erfolgreich durchzuführen, ist Übung erforderlich. Das hier vorgestellte Instrument ist jedoch im Vergleich zu anderen auf dem Markt relativ einfach zu erlernen und anzuwenden, und im Allgemeinen sind nur wenige Tage Übung erforderlich.
Der Erfolg des Transplantationsverfahrens kann durch mehrere Vorsichtsmaßnahmen verbessert werden. Ein Schritt besteht darin, sicherzustellen, dass der Mikromanipulator von guter Qualität ist und reibungslos funktionieren kann. Das Hinzufügen eines Okulars mit höherer Vergrößerung zum Stereomikroskop kann helfen, die Nadel relativ zum Embryo genau zu positionieren. Die Verwendung von gut gezüchteten Zebrafischen oder Medaka zur Gewinnung gesunder Embryonen und die Sorge, die Embryonen während der Handhabung (insbesondere während und nach dem Dekationierungsschritt) nicht zu beschädigen, wird auch die Erfolgsrate erhöhen.
Probleme mit verzögerter Toxizität können schwieriger zu beheben sein. Wenn ein Embryo nach einigen Stunden stirbt - aber nicht unmittelbar nach der Transplantation - könnte das Eigelb durch die Nadel beschädigt worden sein (z. B. durch zu tiefes Eindringen in den Embryo), oder vielleicht wurden die Zellen zu stark ausgestoßen. Verzögerte Toxizität und embryonaler Tod können auch durch Eigelb oder Zelltrümmer entstehen, die zusammen mit den Spenderzellen injiziert werden; Eine weitere Ursache kann eine Verschlechterung des HEPES-Puffers in der Ringer-Lösung sein. Diese Probleme können durch Waschen der Zellen (siehe Schritt 1.3.8) bzw. durch einfache Verwendung einer neuen Charge Puffer überwunden werden. Darüber hinaus können deformierte Wirtsembryonen in Keimbahntransplantationsexperimenten auf zu hohe Morpholinokonzentrationen zurückzuführen sein. Es ist entscheidend, genügend Morpholino zu verwenden, um die Wildtyp-Keimbahn des Wirts vollständig abzutragen und so zu verhindern, dass diese Zellen zum Nachwuchs beitragen - aber gleichzeitig müssen zu hohe Morpholino-Konzentrationen vermieden werden. Konsistente Morpholinomengen über alle injizierten Wirtsembryonen (einige hundert in einem typischen Experiment) sind daher der Schlüssel zum Erfolg von Keimbahntransplantationen. Dies kann durch die Ergänzung des Morpholino-Injektionsmixes mit einem leicht sichtbaren Tracerfarbstoff14 unterstützt werden, der unter einem Fluoreszenz-Stereomikroskop verfolgt werden kann, um sicherzustellen, dass alle Embryonen das gleiche Injektionsvolumen erhalten.
Die in diesem Protokoll beschriebenen Verfahren beinhalten ausschließlich Manipulationen von Zellen in Zebrafisch- oder Medaka-Embryonen im Blastula-Stadium, aber in Zukunft wird es wahrscheinlich möglich sein, das Gerät an verschiedene Stadien und Spezies anzupassen, indem der Durchmesser und die Form der Transplantationsnadel geändert werden.
Offenlegungen
Die Autoren haben keine Interessenkonflikte zu erklären.
Danksagungen
Dieses Projekt wurde von der Max-Planck-Gesellschaft unterstützt und vom Europäischen Forschungsrat (ERC) im Rahmen des Forschungs- und Innovationsprogramms Horizon 2020 der Europäischen Union gefördert (Finanzhilfevereinbarung Nr. 637840 (QUANTPATTERN) und Finanzhilfevereinbarung Nr. 863952 (ACE-OF-SPACE)).
Materialien
| Name | Company | Catalog Number | Comments |
| 1.0 mm glass capillary, ends cut without filament | To make the transplantation needle | ||
| 1.0 mm glass capillary, ends cut with filament | To make injection needles | ||
| 200 mL glass beaker | For embryo dechorionation | ||
| 24-well plastic plate | To be coated with agarose in order to incubate embryos | ||
| 5 cm diameter glass Petri dish | For embryo dechorionation | ||
| 6-well plastic plate | To be coated with agarose in order to incubate embryos | ||
| Agarose | To coat plastic dishes | ||
| dnd1 morpholino | Gene Tools | Sequence: GCTGGGCATCCATGTCTCCGAC CAT | |
| Embryo medium | 250 mg/L Instant Ocean salt, 1 mg/L methylene blue in reverse osmosis water adjusted to pH 7 with NaHCO3 | ||
| Fluorescence stereomicroscope with GFP/RFP filters and light source | To assess YSL injections and germ-line transplantations | ||
| Glass micropipette puller | Sutter Instrument Company | P-1000 | To make the transplantation needle |
| Glass pasteur pipette | Kimble Chase (via Fisher) | 63A53WT | For pipetting embryos; the tips can be flamed to smoothen out the edge |
| Incubator at 28 °C | For incubating zebrafish embryos | ||
| Luer tip 25 μL Hamilton syringe, 1700 series | Hamilton | Ref: 80201 | Part of the transplantation device |
| Manual micromanipulator with 3 axes of movement | Narishige | M-152 | For controlling the transplantation device |
| Manual pipetting pump | Bio-Tek | Cat. # 641 | For use with the glass pipettes to transfer embryos |
| Metal dissecting probe | For moving and rotating zebrafish embryos | ||
| Microforge | Narishige | MF2 | To make the transplantation needle |
| Microinjection apparatus | For injection of mRNA and morpholino into embryos | ||
| Microinjection molds, triangular grooves | Adaptive Science Tools | TU-1 | To prepare microinjection plates with agarose |
| Microinjection-molds, single wells | Adaptive Science Tools | PT-1 | To prepare transplantation plates with agarose |
| Micropipette holder with Luer fitting for a 1.0 mm glass capillary | World Precision Instruments | MPH6S10 | Part of the transplantation device |
| mMessage mMachine Sp6 transcription kit | Life Technologies | AM1340M | To generate capped mRNA for injection into embryos |
| Plasmid with GFP-nos1 3'UTR | Plasmid that can be transcriped to produce mRNA encoding GFP with the 3'UTR of nos1 | ||
| Plastic petri dish 100 mm | To be coated with agarose in order to make injection and transplantation dishes | ||
| Protease from Streptomyces griseus | Sigma | P5147 | For embryo dechorionation: Make a 5 mg/ml stock and use at 1 mg/ml to dechorionate embryos |
| Ringer’s solution | For 1 L: Add 6.78 g of NaCl, 0.22 g of KCl, 0.26 g of CaCl2 and 1.19 g of HEPES; then fill to 1 L; adjust pH to 7.2; sterilize by filtration | ||
| Stereomicroscope | For injection and transplantation |
Referenzen
- Spemann, H., Mangold, H. Induction of embryonic primordia by implantation of organizers from a different species. Archives for Microscopic Anatomy and Developmental Mechanics. 100 (3-4), 599-638 (1924).
- Müller, P., et al. Differential diffusivity of Nodal and Lefty underlies a reaction-diffusion patterning system. Science. 336 (6082), 721-724 (2012).
- Donovan, P., et al. Paracrine Activin-A signaling promotes melanoma growth and metastasis through immune evasion. Journal of Investigative Dermatology. 137 (12), 2578-2587 (2017).
- Pomreinke, A. P., et al. Dynamics of BMP signaling and distribution during zebrafish dorsal-ventral patterning. eLife. 6, 25861 (2017).
- Almuedo-Castillo, M., et al. Scale-invariant patterning by size-dependent inhibition of Nodal signaling. Nature Cell Biology. 20, 1032-1042 (2018).
- Soh, G. H., Pomreinke, A. P., Müller, P. Integration of Nodal and BMP signaling by mutual signaling effector antagonism. Cell Reports. 31 (1), 107487 (2020).
- Mahalwar, P., Walderich, B., Singh, A. P., Nüsslein-Volhard, C. Local reorganization of xanthophores fine-tunes and colors the striped pattern of zebrafish. Science. 345 (6202), 1362-1364 (2014).
- Frohnhöfer, H. G., Krauss, J., Maischein, H. M., Nüsslein-Volhard, C. Iridophores and their interactions with other chromatophores are required for stripe formation in zebrafish. Development. 140 (14), 2997-3007 (2013).
- Chen, Y., Schier, A. F. The zebrafish Nodal signal Squint functions as a morphogen. Nature. 411 (6837), 607-610 (2001).
- Ciruna, B., et al. Production of maternal-zygotic mutant zebrafish by germline replacement. Proceedings of the National Academy of Sciences of the United States of America. 99 (23), 14919-14924 (2002).
- Westerfield, M. . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio). 4th edn. , (2000).
- Kemp, H. A., Carmany-Rampey, A., Moens, C. Generating chimeric zebrafish embryos by transplantation. Journal of Visualized Experiments:JoVE. (29), e1394 (2009).
- Capek, D., Müller, P. Positional information and tissue scaling during development and regeneration. Development. 146 (24), 177709 (2019).
- Rogers, K. W., Bläßle, A., Schier, A. F., Müller, P. Measuring protein stability in living zebrafish embryos using fluorescence decay after photoconversion (FDAP). Journal of Visualized Experiments: JoVE. (95), e52266 (2015).
- Carvalho, L., Heisenberg, C. P. The yolk syncytial layer in early zebrafish development. Trends in Cell Biology. 20 (10), 586-592 (2010).
- Porazinski, S. R., Wang, H., Furutani-Seiki, M. Dechorionation of medaka embryos and cell transplantation for the generation of chimeras. Journal of Visualized Experiments: JoVE. (46), e2055 (2010).
- Centanin, L., Hoeckendorf, B., Wittbrodt, J. Fate restriction and multipotency in retinal stem cells. Cell Stem Cell. 9 (6), 553-562 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten