Method Article
Um dispositivo de transplante simples e eficaz para embriões de zebrafish
Neste Artigo
Resumo
Manipulações embriológicas como extirpação e transplante de células são ferramentas importantes para estudar o desenvolvimento precoce. Este protocolo descreve um dispositivo de transplante simples e eficaz para realizar essas manipulações em embriões de zebrafish.
Resumo
Manipulações embriológicas clássicas, como a remoção de células e o transplante de células dentro ou entre embriões, são técnicas poderosas para estudar processos complexos de desenvolvimento. Os embriões de zebrafish são idealmente adequados para essas manipulações, pois são facilmente acessíveis, relativamente grandes em tamanho e transparentes. No entanto, dispositivos previamente desenvolvidos para remoção de células e transplante são complicados de usar ou caros para comprar. Em contrapartida, o dispositivo de transplante aqui apresentado é econômico, fácil de montar e simples de usar. Neste protocolo, introduzimos primeiro o manuseio do dispositivo de transplante, bem como sua montagem a partir de peças comercial e amplamente disponíveis. Em seguida, apresentamos três aplicações para seu uso: geração de clones ectópicos para estudar dispersão de sinais de fontes localizadas, extirpação de células para produzir embriões reduzidos de tamanho e transplante de germes para gerar mutantes materno-zigóticos. Por fim, mostramos que a ferramenta também pode ser usada para manipulações embriológicas em outras espécies, como o medaka de peixe-arroz japonês.
Introdução
A partir dos experimentos clássicos de Mangold e Spemann que demonstraram a existência de um organizador instruindo a formação de um eixo embrionário1, o transplante de células entre embriões tornou-se uma técnica estabelecida para estudar o desenvolvimento embrionário2,3,4,5,6,7,8,9,10 . Uma configuração comumente usada para transplante consiste em uma seringa controlada por acionamento de micrometer, conectada a um suporte de micropipette através de tubos flexíveis e um reservatório cheio de óleo mineral12,13. Nesta configuração, o êmbolo da seringa é movido através de um parafuso. A pressão gerada dessa forma é transferida para a micropipette e usada para retirar células de um embrião e depositá-las em outra. No entanto, este dispositivo operado hidráuicamente consiste em muitas peças e é trabalhoso para montar do zero. Dispositivos semelhantes também podem ser adquiridos como um conjunto de trabalho completo, geralmente vendido como Microinjetores Manuais, e essas versões comerciais normalmente custam mais de US$ 1.500. Tanto na versão caseira quanto na versão comercial, a micropipette para manipulação de embriões é separada do dispositivo gerador de pressão (a seringa apertada a gás) através de tubos cheios de óleo. A manipulação da micropipette e o movimento do êmbolo, portanto, devem ser operados separadamente com diferentes mãos, reduzindo o rendimento e a utilidade. Além disso, os dispositivos são complicados para se preparar para o transplante, uma vez que o tubo precisa ser cuidadosamente preenchido com óleo, evitando a formação de bolhas. Aqui, descrevemos um dispositivo alternativo operado pneumaticamente para remoção e transplante de células que é barato, fácil de montar e simples de usar.
O dispositivo aqui apresentado compreende uma seringa de 25 μL a gás equipada com porta-micropipette e custa menos de 80 US$ ao todo. O dispositivo é facilmente montado inserindo o suporte de micropipette na seringa através do encaixe do bloqueio Luer (Figura 1A). O dispositivo é então montado diretamente em um micromanipulador, permitindo que o usuário controle tanto sua posição quanto a sucção com uma única mão diretamente no micromanipulador. Isso convenientemente deixa a outra mão livre para estabilizar e mover a antena de transplante contendo embriões doadores e host. O dispositivo funciona por sucção direta com ar e não precisa ser preenchido com óleo mineral. Devido às forças atraentes entre a água e as paredes da agulha de vidro, um grande movimento no êmbolo da seringa é traduzido em um movimento menor no nível da água dentro da agulha, desde que o nível da água esteja na extremidade afilada da agulha de vidro. Isso permite um controle preciso sobre o número de células aspiradas e a localização de sua inserção.
Para demonstrar a utilidade deste dispositivo, apresentamos três aplicações em embriões de zebrafish (Danio rerio). Primeiro, mostramos como gerar fontes localizadas de moléculas de sinalização secretadas, que podem ser usadas para estudar a formação de gradientes2,4,6. Aqui, embriões doadores são injetados com mRNA codificando uma molécula de sinalização fluorescente. As células doadoras rotuladas por fluorescência são então transplantadas para embriões hospedeiros do tipo selvagem onde a formação de um gradiente de sinal pode ser imageada e analisada. Em segundo lugar, descrevemos como o dispositivo pode ser usado para remover células por extirpação, a fim de gerar embriões reduzidos de tamanho5,13. Finalmente, mostramos como produzir robustamente mutantes materno-zigoóticos transplantando células carregando um repórter de células germinativas primordiais em embriões hospedeiros nos quais a linha de germes havia sido ablada6,10. No futuro, o dispositivo de transplante descrito aqui pode ser facilmente adaptado a outras manipulações embriológicas que requerem a remoção ou transplante de células.
Protocolo
1. Montagem e utilização do dispositivo de transplante
- Montando o dispositivo de transplante.
- Conecte a ponta Luer 25 μL de seringa a gás e um suporte de micropipette com o encaixe de bloqueio Luer para montar o dispositivo de transplante (Figura 1A).
NOTA: Molhar a ponta Luer com uma fina película de água pode ajudar a melhorar a conexão, mantendo as partes juntas através da adesão e coesão da água. - Monte o dispositivo diretamente em um micromanipulador manual (Figura 1B). O dispositivo pode ser controlado apenas com a mão dominante, liberando a outra mão para tarefas adicionais.
- Conecte a ponta Luer 25 μL de seringa a gás e um suporte de micropipette com o encaixe de bloqueio Luer para montar o dispositivo de transplante (Figura 1A).
- Preparando a agulha de transplante.
- Produza uma agulha de transplante puxando uma pipeta capilar de vidro (sem filamento) com um puxador de micropipette.
- Quebre a ponta da agulha o mais suavemente possível, pois as bordas afiadas aumentam a chance de coçar a gema durante o transplante, o que é fatal para o embrião.
NOTA: A ponta pode ser facilmente quebrada com uma lâmina de barbear de borda reta sob um estereótipo. No entanto, o uso de uma microforge permite gerar uma abertura precisa do tamanho desejado. Para a geração de origem ectópica, é apropriado um diâmetro externo de aproximadamente 50-60 μm. Para extirpações e transplante de germes, o diâmetro externo da agulha deve medir aproximadamente 80-90 μm para aumentar o número de células transplantadas. - Insira a agulha pronta para uso no dispositivo de transplante (Figura 1A).
- Usando o dispositivo de transplante.
- Coloque o micromanipulador com o dispositivo de transplante ao lado de um estereoscópio (Figura 1B).
- Retire o êmbolo e abaixe a agulha de transplante no prato de transplante preenchido com a solução de Ringer (ver passo 2.2.1) em um ângulo de 45° até que a ponta da agulha esteja imersa (Figura 1B). A água vai subir a agulha devido à ação capilar.
- Insira o êmbolo aproximadamente a meio caminho para liberar as soluções do Ringer, deixando apenas um pequeno volume de água na parte fina e afilada da agulha (Figura 1C).
NOTA: Esta é a posição neutra, e o nível da água deve ficar estável lá por um tempo (>20 min). Se o nível da água estiver instável, o ar está vazando; reconecte o encaixe do bloqueio Luer ou substitua a seringa. - Ao usar uma agulha de transplante pela primeira vez, cubra seu interior, elaborando gema de um embrião sacrificado e, em seguida, expulsando completamente o material da gema. O revestimento ajudará a reduzir a adesão das células ao vidro durante os procedimentos subsequentes.
- Posicione suavemente o embrião doador com a ajuda da agulha e, em seguida, posicione a agulha abrindo ortogonal à superfície do embrião (Figura 1D).
NOTA: A posição será diferente para diferentes ensaios. Para a geração de moléculas de sinalização ectópica e extirpações celulares, este será o topo do polo animal (Figura 1E); para transplante de germina, esta será a margem (Figura 1D,F). - Puxe lentamente e cuidadosamente o êmbolo para atrair as células para dentro da agulha.
NOTA: Se as células forem tomadas muito rapidamente, elas podem ser danificadas. Se feito corretamente, as células devem sair como uma coluna cilíndrica. Evite levar a gema para dentro da agulha, pois a gema transplantada é tóxica para o embrião hospedeiro. - Pare a sucção empurrando suavemente o êmbolo para baixo ligeiramente uma vez que o número desejado de células é atraído dentro Remova a agulha do embrião empurrando a agulha para o lado em um movimento curto e rápido. Deixe alguma solução ringer em ambos os lados da coluna celular, e restrinja as células à extremidade afilada da agulha (Figura 1C,D).
NOTA: O líquido na frente da coluna celular ajudará a forçar as células dos embriões hospedeiros ao depositar a coluna celular. - Limpe qualquer gema ou detritos celulares restantes movendo lentamente o êmbolo para cima e para baixo - enquanto a agulha permanece imersa - para lavar as células com a solução de Ringer. Se feito corretamente, as células não danificadas permanecerão juntas em uma coluna enquanto os detritos são lavados.
NOTA: Deve-se tomar muito cuidado durante esta etapa, pois o nível da água passará pela extremidade afilada da agulha. Isso causará um súbito fluxo de água, que pode ser usado para lavar as células. No entanto, uma vez que o nível da água tenha passado a extremidade afilada, o controle fino com o êmbolo será reduzido, e o êmbolo tem que ser movido mais lentamente e cuidadosamente. - Mova a antena de transplante com a mão não dominante para posicionar a agulha ortogonal para a superfície (polo animal ou margem) do embrião hospedeiro (Figura 1D-F).
- Aplique suavemente uma leve pressão e, em seguida, dê um movimento rápido e afiado para perfurar a camada envolvente do embrião hospedeiro. Tome cuidado para não coçar a gema com a agulha.
NOTA: Aplicar uma leve pressão no embrião apertando-o cuidadosamente contra as paredes do poço aumenta a tensão superficial do embrião e, assim, facilita o piercing da camada envolvente. - Uma vez que a agulha esteja dentro, empurre suavemente o êmbolo para extrusão a coluna das células no embrião enquanto retrai lentamente a agulha ao mesmo tempo (Figura 1D-F).
- Limpando a agulha de transplante.
- Enxágüe a agulha movendo o êmbolo para cima e para baixo enquanto a agulha está imersa em água desionizada.
NOTA: Se a agulha permanecer suja, enxágue-a com uma solução de hidróxido de sódio de 10 M antes de enxágüá-la novamente com água. - Armazene a agulha em uma caixa apropriada para uso adicional.
- Enxágüe a agulha movendo o êmbolo para cima e para baixo enquanto a agulha está imersa em água desionizada.
2. Gerando fontes ectópicas de moléculas secretas de sinalização em embriões de zebrafish
- Preparando os embriões de acolhimento e doador.
- Colete embriões recém-colocados acasalando zebrafish.
- Descorionato 1-cell estágio zebrafish embriões incubando até 100 embriões em 0,5 mg/mL de solução de pronase por aproximadamente 15 min em uma pequena placa de petri de vidro (uma descrição detalhada deste procedimento foi publicada por Rogers, K. W. et al.14).
NOTA: Alternativamente, os embriões também podem ser descorrioados no estágio mais alto pouco antes do transplante (etapa 2.2), mas isso requer que os embriões doadores injetados e embriões hospedeiros não injetados sejam descorrioados separadamente. - Submergir os embriões em meio de embrião em um béquer de 200 mL.
NOTA: Os embriões deschorioados de blastula e gastrula estágio são muito delicados. Sua gema exposta aderirá a superfícies plásticas e romperá após contato com o ar. Assim, eles devem permanecer completamente imersos em meio de embrião, transferidos com uma tubulação de vidro, e mantidos em pratos plásticos revestidos de agarose (1% em embrião médio) ou placas de petri de vidro. - Esvazie cuidadosamente a maior parte do meio do embrião e encha lentamente o béquer com meio de embrião fresco. A leve agitação causada desta forma facilitará a remoção dos acordes enfraquecidos. Repita esta etapa 2-3 vezes.
- Transfira os embriões descorrioados usando uma pipeta pasteur de vidro em um prato de injeção revestido de agarose.
NOTA: Flaming a ponta da pipeta pasteur de vidro expondo-a a uma chama de queimador Bunsen pode derreter e suavizar a borda, ajudando a evitar danos aos embriões. - Injete o mRNA codificando a proteína fluorescente marcada em um subconjunto de embriões (uma descrição detalhada deste procedimento foi publicada por Rogers, K. W. et al.14). Injete o mRNA na célula, não na gema, para uma expressão quase homogênea. Embriões injetados servirão como doadores, enquanto embriões não injetados servirão como hospedeiros.
NOTA: A quantidade e o tipo de mRNA injetado dependerá da molécula de sinalização que está sendo estudada e geralmente varia de 20 a 200 pg2,4,5,6 (mas pode ser até 1000 pg em certos casos4). - Transfira os embriões injetados para um prato de seis poços revestido de agarose recheado com meio de embrião. Incubar a 28 °C até que os embriões atinjam o estágio inicial da esfera.
- Células transplantando para gerar fontes ectópicas.
- Encha um prato de transplante (com poços individuais em forma de cunha triangular, consulte Tabela de Materiais) com a solução de Ringer (116 mM NaCl, 2,8 mM KCl, 1 mM CaCl2, 5 mM HEPES; armazene o tampão HEPES a 4 °C).
NOTA: O cálcio na solução de Ringer promove a adesão celular e ajuda o embrião a se curar do procedimento de transplante. - Transfira os embriões para o prato de transplante.
- Posicione os embriões do hospedeiro e doador em colunas alternadas, em cada caso com o polo animal orientado para a agulha de transplante.
- Realizar o transplante conforme descrito na seção 1.3. Para transplante de origem ectópica, pegue células de origem do topo do polo animal e deposite-as no mesmo local no embrião hospedeiro (Figura 1E).
NOTA: Lavar as células com a solução de Ringer conforme detalhado na etapa 1.3.8 é importante para a geração de fontes ectópicas para garantir que moléculas de sinalização já secretadas não sejam transportadas para o hospedeiro. Não transplante muitas células para garantir que a fonte não seja dispersa. Uma coluna de aproximadamente 80 μm de diâmetro e 100 μm de comprimento é apropriada para muitas aplicações. - Deixe o embrião hospedeiro ficar na solução de Ringer por 30 minutos a 1h para se recuperar.
- Examine se as células foram transplantadas com sucesso usando um estereótipo de fluorescência (Figura 2).
- Após a recuperação, transfira os embriões para uma placa de seis poços revestida de agarose cheia de meio de embrião e incuba-os a 28 °C.
- Encha um prato de transplante (com poços individuais em forma de cunha triangular, consulte Tabela de Materiais) com a solução de Ringer (116 mM NaCl, 2,8 mM KCl, 1 mM CaCl2, 5 mM HEPES; armazene o tampão HEPES a 4 °C).
3. Gerando embriões reduzidos pelo tamanho por extirpação celular
- Preparando embriões para extirpação.
- Coletar embriões recém-colocados de zebrafish do genótipo desejado.
- Incubar os embriões a 28 °C até chegarem ao estágio mais alto.
- Descorionato os embriões descritos nas etapas 2.1.2-2.1.5 quando os embriões atingem o estágio mais alto.
NOTA: Neste exemplo, a extirpação celular é realizada no estágio da esfera. Assim, os embriões são descorrioados aproximadamente 30 min a 1 h mais cedo.
- Opcional: Rotulando a camada sincicial da gema (YSL).
NOTA: Se desejar, injete dextrans fluorescentes no YSL antes de extirpar as células. Esta técnica permite determinar se o YSL permanece intacto após a remoção das células, o que é importante para a embriogênese normal15. Alternativamente, mRNAs ou proteínas sintetizadas in vitro também podem ser injetadas no YSL.- Use uma pipeta Pasteur para transferir os embriões descorrioados para um prato de injeção revestido de agarose cheio de água de embrião.
- Oriente os embriões lateralmente, com a margem de blastoderm apontando para a agulha de injeção (Figura 3A).
- Injete 0,5 nL de 1,5 μg/μL 10 kDa Alexa568-Dextran no YSL, visando uma região entre as células blastoderm e a gema a uma profundidade de cerca de um terço do diâmetro do embrião. Injete todos os embriões dentro de uma fileira.
NOTA: Como a agulha de injeção não precisa perfurar o acorde, uma abertura pequena (~4 μm) e afiada é vantajosa. - Gire os embriões em 180° de modo que o lado oposto da margem blastoderm esteja apontando para a agulha de injeção (Figura 3A).
- Injete mais 0,5 nL de 1,5 μg/μL 10 kDa Alexa568-Dextran no YSL conforme descrito na etapa 3.2.3, produzindo um volume total de injeção de 1 nL por embrião.
NOTA: A injeção de dois lados permite uma distribuição mais uniforme do dextran fluorescente dentro do YSL. - Examine o resultado da injeção sob um estereóscópio de fluorescência. Se feito corretamente, o sinal fluorescente será restrito ao YSL (Figura 3B) e não será visível no espaço intercelular do blastoderm.
- Células extirpantes
- Encha um prato de transplante com a solução de Ringer (ver passo 2.2.1).
- Transfira os embriões para o prato de transplante.
- Oriente os embriões com o polo animal em direção à agulha de transplante (Figura 3C).
- Remova cuidadosamente as células da região do polo animal, conforme descrito nas etapas 1.3.5-1.3.7, reduzindo assim o blastoderme ao tamanho desejado.
- Descarte as células removidas expulsando-as da agulha de transplante.
- Uma vez concluído o procedimento, permita que os embriões fiquem na solução de Ringer por 30 minutos a 1 h para se recuperarem.
- OPCIONAL: Examine a integridade do YSL sob um estereótipo de fluorescência (Figura 3D).
- Transfira os embriões para uma placa revestida de agarose cheia de meio de embrião e incuba-os a 28 °C.
4. Criação de mutantes materno-zigotic por transplante de germes
- Preparando embriões de acolhimento e doador.
- Colete embriões recém-colocados de zebrafish mutantes e selvagens. Embriões de zebrafish com fundo mutante servirão como doadores, enquanto embriões de zebrafish com fundo selvagem servirão como hospedeiros.
NOTA: O transplante de germes requer um alto número de embriões iniciais (~50 para doadores, ~500 para os anfitriões) para garantir um bom número de transplantes germeinos bem sucedidos que sobrevivem até a idade adulta. - Transfira os embriões para um prato de injeção revestido de agarose com meio de embrião usando uma pipeta Pasteur.
NOTA: As injeções são feitas antes da descorção para aumentar o rendimento. Agulhas para injeção através do acorde precisam ser contundentes e ter uma abertura maior (~10 μm) para evitar entupimento. - Injete os embriões doadores com 1 nL de 100 ng/μL mRNA codificando GFP com um nos1 3'UTR. Injete o mRNA na gema para aumentar o rendimento.
NOTA: O nos1 3'UTR estabilizará o mRNA nas células germinativas primordiais, fazendo com que as células germinativas sejam fortemente fluorescentes quando imagens de 1 dia após a fertilização10. - Injete os embriões hospedeiros com 1 nL de 0,33 mM (3 μg/μL) beco sem saída (dnd) morfolino. Injete o morfolino na gema para aumentar o rendimento.
NOTA: O dnd morpholino bloqueia a formação de células germinativas primordiais, o que garante que a germina do embrião hospedeiro será preenchida exclusivamente com células do doador após o transplante10. - Transfira os embriões injetados para placas de Petri de plástico com meio de embrião. Incubar a 28 °C até que os embriões atinjam o estágio mais alto.
- Descorionato os embriões descritos nas etapas 2.1.2-2.1.5 quando os embriões atingem o estágio mais alto.
- Colete embriões recém-colocados de zebrafish mutantes e selvagens. Embriões de zebrafish com fundo mutante servirão como doadores, enquanto embriões de zebrafish com fundo selvagem servirão como hospedeiros.
- Transplante de células germinativas
- Encha um prato de transplante com a solução de Ringer (ver passo 2.2.1).
- Transfira a esfera descorioada para embriões empáticos de cúpula para o prato de transplante.
- Posicione os embriões hospedeiros e embriões doadores em colunas alternadas para transplantar as células de um embrião doador para seis embriões hospedeiros diferentes. Isso aumenta a chance de que células germinativas de um determinado embrião hospedeiro sejam transplantadas com sucesso.
- Oriente os embriões com margem para a agulha de transplante e realize o transplante conforme descrito na seção 1.3. Para transplantes de germina (Figura 1D,F), pegue as células de origem da margem (onde as células germinativas primordiais estão localizadas) e deposite-as no mesmo local no embrião hospedeiro.
NOTA: Transplantar uma coluna grande (aproximadamente 80 μm de diâmetro e 600 μm de comprimento) aumentará a chance de obter um transplante germinal bem sucedido. - Deixe o embrião ficar na solução de Ringer por 30 minutos a 1 h para se recuperar quando o transplante estiver concluído.
NOTA: Se não se espera que todos os embriões doadores sejam mutantes homozigos - por exemplo, se resultam de um incross heterozigoso - eles precisam ser genótipados após o transplante para determinar o genótipo da futura germinação transplantada do hospedeiro. Neste caso, certifique-se de que as posições dos embriões do hospedeiro e doador não sejam misturadas durante o manuseio. - Use um estereóscópio de fluorescência para examinar se as células foram transplantadas com sucesso (Figura 4A,B).
- Transfira os embriões para uma placa revestida de 24 poços. Agrupar todos os embriões hospedeiros que receberam células do mesmo doador no mesmo poço e rotulá-los em conformidade. Incubar até o dia seguinte a 28 °C.
- Se necessário, transfira os embriões doadores para tiras pcr rotuladas para genotipagem.
- Triagem para transplantes germeinos bem sucedidos
- Trie os embriões hospedeiros para transplantes germeinos bem sucedidos sob um estereótipo de fluorescência aproximadamente 30 h pós-fertilização (hpf). As células germinativas são encontradas na ranhura acima da extensão da gema (Figura 4C).
NOTA: Experimentos típicos com o dispositivo e estratégia apresentados aqui terão uma taxa de sucesso de ~60%-80% para obter pelo menos um embrião hospedeiro que transporta células germinativas transplantadas por embrião doador. Um relatório anterior descreveu uma eficiência de ~10%. - Se aplicável, descarte embriões que receberam células de embriões doadores com um genótipo incorreto. Cultivar larvas com células germinativas transplantadas com sucesso até a idade adulta de acordo com as condições padrão de criação e seguindo diretrizes institucionais.
- Trie os embriões hospedeiros para transplantes germeinos bem sucedidos sob um estereótipo de fluorescência aproximadamente 30 h pós-fertilização (hpf). As células germinativas são encontradas na ranhura acima da extensão da gema (Figura 4C).
Resultados
O sucesso e a falha no uso do dispositivo de transplante para as três aplicações descritas acima podem ser facilmente avaliados por inspeção visual sob um estereomicroscope. Em transplantes bem sucedidos, o embrião deve parecer normal e semelhante em forma e clareza de gema a embriões não transplantados, sem grandes lágrimas no blastoderm. Se o embrião estiver visivelmente danificado (Figura 4B), ele não se desenvolverá normalmente. Idealmente, as células transplantadas expressando um marcador fluorescente devem aparecer como uma coluna contínua quando vistas sob um estereóscópio de fluorescência (Figura 2A, Figura 4A). Se a coluna estiver fragmentada, isso indica que as células foram arrastadas pela sucção na agulha de transplante ou que a deposição das células foi feita com muita força. Isso pode ser evitado movendo o êmbolo de forma mais lenta e suave.
Embora o dispositivo de transplante tenha sido usado principalmente em embriões de zebrafish nos estágios blastula5,6, transplante e extirpação celular funcionam tão bem para embriões descorados blastula-estágio do peixe-arroz japonês medaka (Oryzias latipes) (Figura 2B). Além da descorção do embrião, que foi descrita por Porazinski, S. R. et al.17, os mesmos procedimentos descritos acima podem ser seguidos.
No caso específico do transplante de germes, um bom transplante resultará em um embrião com uma longa coluna horizontal de células diretamente acima da margem da gema (Figura 4A). No entanto, se as células germinativas foram transplantadas com sucesso só pode ser avaliada no dia seguinte (Figura 4C-F) devido à expressão de fundo do GFP em estágios de blastula (Figura 1F). As células germinativas primordiais aparecerão como pequenas esferas fluorescentes na ranhura diretamente acima da extensão da gema (Figura 4C-E). A presença dessas células no local correto indica transplante de germe bem sucedido. Células com uma forma diferente não são células germinativas (por exemplo, células alongadas são tipicamente células musculares, Figura 4F). Além disso, se células germinativas primordiais forem encontradas fora do sulco, isso significa que elas falharam em migrar adequadamente, e não poderão contribuir para a germe do embrião. Finalmente, a morfologia geral dos embriões transplantados deve parecer semelhante aos embriões não transplantados (Figura 4D); a cauda não deve ser deformada, e a cabeça não deve ser encolhida ou olhos perdidos (Figura 4E). Esses defeitos geralmente resultam de concentrações excessivamente altas de morfolino ou de danos embriões durante o transplante. Experimentos de transplante de germinas descritos aqui normalmente resultarão em 1-2 de 6 embriões hospedeiros com células germinativas transplantadas com sucesso para 60%-80% dos embriões doadores, dependendo da experiência do experimentador. Assim, células de 40-50 embriões doadores homozigos precisam ser transplantadas em 200-300 embriões hospedeiros para criar aproximadamente 30 indivíduos com células germinativas mutantes.
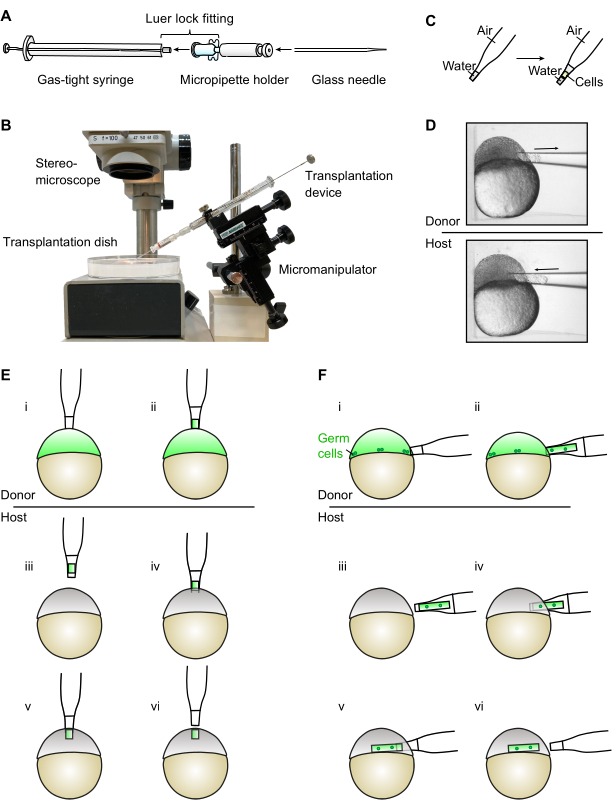
Figura 1: Montagem e uso do dispositivo de transplante. (A) O dispositivo de transplante é montado conectando uma seringa apertada a gás com um suporte de micropipette através do encaixe do bloqueio Luer. A agulha de vidro para transplante é então inserida no suporte de micropipette. (B) Fotografia do dispositivo de transplante montado montado em um micromanipulador (por favor, note que o fundo e as etiquetas foram removidos da imagem). (C) Ao usar o dispositivo de transplante, é importante garantir que o nível de água na agulha de transplante permaneça na extremidade afilada. (D) O dispositivo é usado sob um estereómico para retirar e inserir células de e para embriões teleost colocados em poços individuais de uma antena de transplante. (E) Para a geração de fontes ectópicas, as células são retiradas do polo animal de um embrião doador (i-ii) e transferidas para o polo animal de um embrião hospedeiro (iii-vi). (F) Para transplante de germe, um número maior de células é retirado da margem de um embrião doador (i-ii), onde as células germinativas estão localizadas. As células são então transferidas para a margem dos embriões hospedeiros (iii-vi). Clique aqui para ver uma versão maior desta figura.
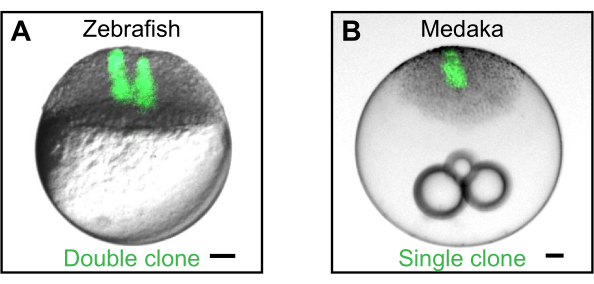
Figura 2: Geração de clones por transplante celular. (A) Exemplo de um clone duplo gerado pelo transplante sequencial de células fluorescentes (verde) de um doador de zebrafish em um embrião hospedeiro de zebrafish. Clones simples e duplos podem ser usados para estudar como moléculas de sinalização secretadas formam gradientes espesso estotemporais2,4,5,6. (B) Exemplo de um único clone gerado por células transplantadas de um doador de medaka transgênico expressante eGFP (Wimbledon)17 em um hospedeiro medaka do tipo selvagem. As barras de escala representam 100 μm. Clique aqui para ver uma versão maior desta figura.
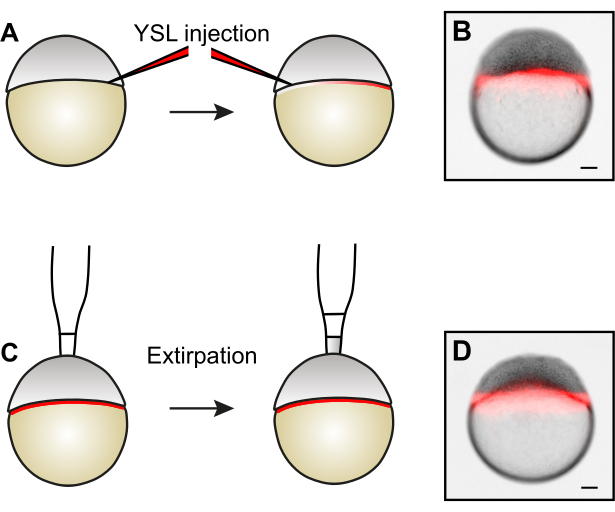
Figura 3: Gerando embriões reduzidos de tamanho por extirpação celular. (A) Antes de remover as células por extirpação, o YSL pode ser rotulado injetando corantes fluorescentes em dois lados opostos do YSL. (B) Exemplo de um embrião após a injeção de YSL. (C) Para gerar embriões reduzidos de tamanho, as células do polo animal são removidas por extirpation5. (D) Exemplo de um embrião após extirção celular. Note que o YSL permanece intacto. As barras de escala representam 100 μm. Clique aqui para ver uma versão maior desta figura.
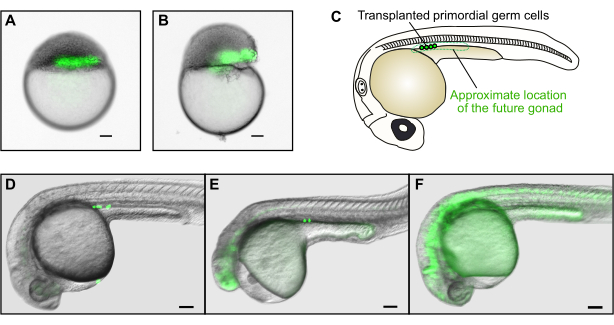
Figura 4: Transplante de germes. (A) Exemplo de um transplante bem sucedido de células doadoras (verde) na zona marginal do hospedeiro. (B) Exemplo de um transplante mal sucedido. A gema do embrião hospedeiro foi severamente danificada, e o embrião não será capaz de se desenvolver normalmente. (C) A 30 hpf, as células germinativas transplantadas com sucesso serão encontradas apenas no mesoderme gonadal na região anterior da extensão da gema. (D) Exemplo de um transplante bem-sucedido no qual várias células germinativas de doadores rotuladas por GFP povoaram a futura gnad do hospedeiro. (E) Exemplo de um transplante mal sucedido. Embora as células germinativas tenham atingido o mesoderme gonadal, o embrião hospedeiro é severamente deformado e não se desenvolverá normalmente. (F) Exemplo de um transplante mal sucedido. As células germinativas fluorescentes que não migraram para o local correto não repovoarão as gôngas. As barras de escala representam 100 μm. As imagens em D-F foram tiradas com uma ampliação total de aproximadamente 50x. Por favor, clique aqui para ver uma versão maior desta figura.
Discussão
O sucesso de um experimento de transplante depende fortemente das habilidades motoras finas do experimentador. Para realizar com sucesso os procedimentos, é necessária a prática. No entanto, o instrumento aqui apresentado é relativamente fácil de aprender e usar em comparação com outros no mercado, e, em geral, apenas alguns dias de prática são necessários.
O sucesso do procedimento de transplante pode ser aprimorado tomando várias precauções. Um passo é garantir que o micromanipulador seja de boa qualidade e capaz de uma operação suave. Adicionar um ocular com maior ampliação ao estereomicroscópio pode ajudar a posicionar precisamente a agulha em relação ao embrião. Usar zebrafish ou medaka bem-criado para adquirir embriões saudáveis e tomar cuidado para não danificar os embriões durante o manuseio (especialmente durante e após a etapa de descorção) também aumentará a taxa de sucesso.
Problemas com toxicidade atrasada podem ser mais difíceis de resolver. Se um embrião morrer após algumas horas - mas não imediatamente após o transplante - a gema pode ter sido danificada pela agulha (por exemplo, entrando no embrião muito profundamente), ou talvez as células foram ejetadas com muita força. A toxicidade retardada e a morte embrionária também podem resultar de gema ou detritos celulares injetados junto com as células doadoras; outra causa pode estar deteriorando o buffer HEPES na solução do Ringer. Esses problemas podem ser superados lavando as células (ver passo 1.3.8) ou simplesmente usando um lote fresco de tampão, respectivamente. Além disso, embriões hospedeiros deformados em experimentos de transplante de germes podem resultar de concentrações excessivamente altas de morfolino. É crucial usar morfolino suficiente para abltoar totalmente a linha germinal do hospedeiro, impedindo assim que essas células contribuam para a prole - mas, ao mesmo tempo, concentrações excessivamente altas de morfolino precisam ser evitadas. Quantidades consistentes de morfolino em todos os embriões hospedeiros injetados (algumas centenas em um experimento típico) são, portanto, a chave para o sucesso dos transplantes de germes. Isso pode ser ajudado complementando a mistura de injeção de morfolino com um corante rastreador facilmente visível14, que pode ser rastreado sob um estereoscópio de fluorescência para garantir que todos os embriões recebam o mesmo volume de injeção.
Os procedimentos descritos neste protocolo envolvem exclusivamente manipulações de células em zebrafish ou embriões medaka em estágio blastula, mas no futuro, provavelmente será possível adaptar o dispositivo a diferentes estágios e espécies alterando o diâmetro e a forma da agulha de transplante.
Divulgações
Os autores não têm conflitos de interesse para declarar.
Agradecimentos
Este projeto foi apoiado pela Sociedade Max Planck e recebeu financiamento do Conselho Europeu de Pesquisa (ERC) no âmbito do programa de pesquisa e inovação Horizon 2020 da União Europeia (acordo de subvenção nº 637840 (QUANTPATTERN) e acordo de concessão nº 863952 (ACE-OF-SPACE)).
Materiais
| Name | Company | Catalog Number | Comments |
| 1.0 mm glass capillary, ends cut without filament | To make the transplantation needle | ||
| 1.0 mm glass capillary, ends cut with filament | To make injection needles | ||
| 200 mL glass beaker | For embryo dechorionation | ||
| 24-well plastic plate | To be coated with agarose in order to incubate embryos | ||
| 5 cm diameter glass Petri dish | For embryo dechorionation | ||
| 6-well plastic plate | To be coated with agarose in order to incubate embryos | ||
| Agarose | To coat plastic dishes | ||
| dnd1 morpholino | Gene Tools | Sequence: GCTGGGCATCCATGTCTCCGAC CAT | |
| Embryo medium | 250 mg/L Instant Ocean salt, 1 mg/L methylene blue in reverse osmosis water adjusted to pH 7 with NaHCO3 | ||
| Fluorescence stereomicroscope with GFP/RFP filters and light source | To assess YSL injections and germ-line transplantations | ||
| Glass micropipette puller | Sutter Instrument Company | P-1000 | To make the transplantation needle |
| Glass pasteur pipette | Kimble Chase (via Fisher) | 63A53WT | For pipetting embryos; the tips can be flamed to smoothen out the edge |
| Incubator at 28 °C | For incubating zebrafish embryos | ||
| Luer tip 25 μL Hamilton syringe, 1700 series | Hamilton | Ref: 80201 | Part of the transplantation device |
| Manual micromanipulator with 3 axes of movement | Narishige | M-152 | For controlling the transplantation device |
| Manual pipetting pump | Bio-Tek | Cat. # 641 | For use with the glass pipettes to transfer embryos |
| Metal dissecting probe | For moving and rotating zebrafish embryos | ||
| Microforge | Narishige | MF2 | To make the transplantation needle |
| Microinjection apparatus | For injection of mRNA and morpholino into embryos | ||
| Microinjection molds, triangular grooves | Adaptive Science Tools | TU-1 | To prepare microinjection plates with agarose |
| Microinjection-molds, single wells | Adaptive Science Tools | PT-1 | To prepare transplantation plates with agarose |
| Micropipette holder with Luer fitting for a 1.0 mm glass capillary | World Precision Instruments | MPH6S10 | Part of the transplantation device |
| mMessage mMachine Sp6 transcription kit | Life Technologies | AM1340M | To generate capped mRNA for injection into embryos |
| Plasmid with GFP-nos1 3'UTR | Plasmid that can be transcriped to produce mRNA encoding GFP with the 3'UTR of nos1 | ||
| Plastic petri dish 100 mm | To be coated with agarose in order to make injection and transplantation dishes | ||
| Protease from Streptomyces griseus | Sigma | P5147 | For embryo dechorionation: Make a 5 mg/ml stock and use at 1 mg/ml to dechorionate embryos |
| Ringer’s solution | For 1 L: Add 6.78 g of NaCl, 0.22 g of KCl, 0.26 g of CaCl2 and 1.19 g of HEPES; then fill to 1 L; adjust pH to 7.2; sterilize by filtration | ||
| Stereomicroscope | For injection and transplantation |
Referências
- Spemann, H., Mangold, H. Induction of embryonic primordia by implantation of organizers from a different species. Archives for Microscopic Anatomy and Developmental Mechanics. 100 (3-4), 599-638 (1924).
- Müller, P., et al. Differential diffusivity of Nodal and Lefty underlies a reaction-diffusion patterning system. Science. 336 (6082), 721-724 (2012).
- Donovan, P., et al. Paracrine Activin-A signaling promotes melanoma growth and metastasis through immune evasion. Journal of Investigative Dermatology. 137 (12), 2578-2587 (2017).
- Pomreinke, A. P., et al. Dynamics of BMP signaling and distribution during zebrafish dorsal-ventral patterning. eLife. 6, 25861(2017).
- Almuedo-Castillo, M., et al. Scale-invariant patterning by size-dependent inhibition of Nodal signaling. Nature Cell Biology. 20, 1032-1042 (2018).
- Soh, G. H., Pomreinke, A. P., Müller, P. Integration of Nodal and BMP signaling by mutual signaling effector antagonism. Cell Reports. 31 (1), 107487(2020).
- Mahalwar, P., Walderich, B., Singh, A. P., Nüsslein-Volhard, C. Local reorganization of xanthophores fine-tunes and colors the striped pattern of zebrafish. Science. 345 (6202), 1362-1364 (2014).
- Frohnhöfer, H. G., Krauss, J., Maischein, H. M., Nüsslein-Volhard, C. Iridophores and their interactions with other chromatophores are required for stripe formation in zebrafish. Development. 140 (14), 2997-3007 (2013).
- Chen, Y., Schier, A. F. The zebrafish Nodal signal Squint functions as a morphogen. Nature. 411 (6837), 607-610 (2001).
- Ciruna, B., et al. Production of maternal-zygotic mutant zebrafish by germline replacement. Proceedings of the National Academy of Sciences of the United States of America. 99 (23), 14919-14924 (2002).
- Westerfield, M. The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio). 4th edn. , University of Oregon Press. (2000).
- Kemp, H. A., Carmany-Rampey, A., Moens, C. Generating chimeric zebrafish embryos by transplantation. Journal of Visualized Experiments:JoVE. (29), e1394(2009).
- Capek, D., Müller, P. Positional information and tissue scaling during development and regeneration. Development. 146 (24), 177709(2019).
- Rogers, K. W., Bläßle, A., Schier, A. F., Müller, P. Measuring protein stability in living zebrafish embryos using fluorescence decay after photoconversion (FDAP). Journal of Visualized Experiments: JoVE. (95), e52266(2015).
- Carvalho, L., Heisenberg, C. P. The yolk syncytial layer in early zebrafish development. Trends in Cell Biology. 20 (10), 586-592 (2010).
- Porazinski, S. R., Wang, H., Furutani-Seiki, M. Dechorionation of medaka embryos and cell transplantation for the generation of chimeras. Journal of Visualized Experiments: JoVE. (46), e2055(2010).
- Centanin, L., Hoeckendorf, B., Wittbrodt, J. Fate restriction and multipotency in retinal stem cells. Cell Stem Cell. 9 (6), 553-562 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados