Method Article
Un dispositif de transplantation simple et efficace pour les embryons de poisson zèbre
Dans cet article
Résumé
Les manipulations embryologiques telles que la disparition et la transplantation de cellules sont des outils importants pour étudier le développement précoce. Ce protocole décrit un dispositif de transplantation simple et efficace pour effectuer ces manipulations chez des embryons de poisson zèbre.
Résumé
Les manipulations embryologiques classiques, telles que l’élimination des cellules et la transplantation de cellules à l’intérieur ou entre les embryons, sont des techniques puissantes pour étudier des processus de développement complexes. Les embryons de poisson-zèbre sont parfaitement adaptés à ces manipulations car ils sont facilement accessibles, de taille relativement grande et transparents. Cependant, les dispositifs précédemment développés pour l’élimination et la transplantation de cellules sont lourds à utiliser ou coûteux à l’achat. En revanche, le dispositif de transplantation présenté ici est économique, facile à assembler et simple à utiliser. Dans ce protocole, nous introduisons d’abord la manipulation du dispositif de transplantation ainsi que son assemblage à partir de pièces commerciales et largement disponibles. Nous présentons ensuite trois applications pour son utilisation : la génération de clones ectopiques pour étudier la dispersion du signal à partir de sources localisées, la disparition de cellules pour produire des embryons de taille réduite et la transplantation germinale pour générer des mutants maternels-zygotiques. Enfin, nous montrons que l’outil peut également être utilisé pour des manipulations embryologiques chez d’autres espèces telles que le poisson de riz japonais medaka.
Introduction
À partir des expériences classiques de Mangold et Spemann qui ont démontré l’existence d’un organisateur instruisant la formation d’un axe embryonnaire1, la transplantation de cellules entre embryons est devenue une technique établie pour étudier le développement embryonnaire2,3,4,5,6,7,8,9,10 . Une configuration couramment utilisée pour la transplantation consiste en une seringue étanche aux gaz contrôlée par un micromètre et contrôlée par un lecteur reliée à un porte-micropipette à travers un tube flexible et un réservoir rempli d’huile minérale12,13. Dans cette configuration, le piston de la seringue est déplacé à travers une vis. La pression générée de cette manière est transférée à la micropipette et utilisée pour extraire les cellules d’un embryon et les déposer dans un autre. Cependant, ce dispositif à commande hydraulique se compose de nombreuses pièces et est laborieux à assembler à partir de zéro. Des appareils similaires peuvent également être achetés en tant qu’ensemble de travail complet, généralement vendus sous forme de micro-injecteurs manuels, et ces versions commerciales coûtent généralement plus de 1500 USD. Dans la version maison et la version commerciale, la micropipette pour la manipulation d’embryons est séparée du dispositif générateur de pression (la seringue étanche aux gaz) à travers un tube rempli d’huile. La manipulation de la micropipette et le mouvement du piston doivent donc être utilisés séparément avec des mains différentes, ce qui réduit le débit et l’utilité. De plus, les appareils sont encombrants à préparer pour la transplantation car le tube doit être soigneusement rempli d’huile tout en évitant la formation de bulles. Ici, nous décrivons un dispositif alternatif à commande pneumatique pour l’élimination et la transplantation de cellules qui est peu coûteux, facile à assembler et simple à utiliser.
L’appareil présenté ici comprend une seringue étanche aux gaz de 25 μL équipée d’un porte-micropipette et coûte moins de 80 US$ au total. L’appareil est facilement assemblé en insérant le porte-micropipette dans la seringue via le raccord de verrouillage Luer (Figure 1A). L’appareil est ensuite directement monté sur un micromanipulateur, ce qui permet à l’utilisateur de contrôler à la fois sa position et l’aspiration d’une seule main directement sur le micromanipulateur. Cela laisse commodément l’autre main libre pour stabiliser et déplacer le plat de transplantation contenant des embryons de donneurs et d’hôtes. L’appareil fonctionne par aspiration directe avec de l’air et n’a pas besoin d’être rempli d’huile minérale. En raison des forces d’attraction entre l’eau et les parois de l’aiguille en verre, un grand mouvement dans le piston de la seringue se traduit par un mouvement plus petit dans le niveau d’eau à l’intérieur de l’aiguille, tant que le niveau d’eau est dans l’extrémité effilée de l’aiguille en verre. Cela permet un contrôle précis du nombre de cellules aspirées et de l’emplacement de leur insertion.
Pour démontrer l’utilité de ce dispositif, nous présentons trois applications dans les embryons de poisson-zèbre (Danio rerio). Tout d’abord, nous montrons comment générer des sources localisées de molécules de signalisation sécrétées, qui peuvent être utilisées pour étudier la formation de gradient2,4,6. Ici, les embryons de donneurs sont injectés avec de l’ARNm codant pour une molécule de signalisation marquée par fluorescence. Les cellules donneuses marquées par fluorescence sont ensuite transplantées sur des embryons hôtes de type sauvage où la formation d’un gradient de signal peut être imagée et analysée. Deuxièmement, nous décrivons comment le dispositif peut être utilisé pour éliminer des cellules par extirpation afin de générer des embryons de taille réduite5,13. Enfin, nous montrons comment produire de manière robuste des mutants maternels-zygotiques en transplantant des cellules porteuses d’un rapporteur de cellules germinales primordiales dans des embryons hôtes dans lesquels la lignée germinale avait été ablation6,10. À l’avenir, le dispositif de transplantation décrit ici pourra être facilement adapté à d’autres manipulations embryologiques nécessitant le retrait ou la transplantation de cellules.
Protocole
1. Assemblage et utilisation du dispositif de transplantation
- Assemblage du dispositif de transplantation.
- Connectez la seringue étanche aux gaz Luer tip 25 μL et un porte-micropipette avec le raccord de verrouillage Luer pour assembler le dispositif de transplantation (Figure 1A).
REMARQUE: Mouiller la pointe Luer avec un mince film d’eau peut aider à améliorer la connexion en maintenant les pièces ensemble via l’adhérence et la cohésion de l’eau. - Montez le dispositif directement sur un micromanipulateur manuel (Figure 1B). L’appareil peut être contrôlé avec la main dominante seule, libérant l’autre main pour des tâches supplémentaires.
- Connectez la seringue étanche aux gaz Luer tip 25 μL et un porte-micropipette avec le raccord de verrouillage Luer pour assembler le dispositif de transplantation (Figure 1A).
- Préparation de l’aiguille de transplantation.
- Produire une aiguille de transplantation en tirant une pipette capillaire en verre (sans filament) avec un extracteur de micropipette.
- Cassez le bout de l’aiguille aussi doucement que possible, car les arêtes vives augmentent le risque de rayer le jaune lors de la transplantation, ce qui est fatal à l’embryon.
REMARQUE: La pointe peut être facilement cassée avec une lame de rasoir à bord droit sous un stéréomicroscope. Cependant, l’utilisation d’une microforge permet de générer une ouverture précise de la taille souhaitée. Pour la génération de sources ectopiques, un diamètre extérieur d’environ 50 à 60 μm est approprié. Pour les extirpations et la transplantation germinale, le diamètre extérieur de l’aiguille doit mesurer environ 80 à 90 μm pour augmenter le nombre de cellules transplantées. - Insérez l’aiguille prête à l’emploi dans le dispositif de transplantation (Figure 1A).
- Utilisation du dispositif de transplantation.
- Placez le micromanipulateur avec le dispositif de transplantation à côté d’un stéréomicroscope (Figure 1B).
- Retirez le piston et abaissez l’aiguille de transplantation dans le plat de transplantation rempli de la solution de Ringer (voir étape 2.2.1) à un angle de 45° jusqu’à ce que la pointe de l’aiguille soit immergée (Figure 1B). L’eau se précipitera vers le haut de l’aiguille en raison de l’action capillaire.
- Insérez le piston environ à mi-chemin pour rincer les solutions du Ringer, en ne laissant qu’un petit volume d’eau dans la partie mince et effilée de l’aiguille (Figure 1C).
REMARQUE: C’est la position neutre, et le niveau d’eau devrait y être stable pendant un certain temps (>20 min). Si le niveau d’eau est instable, l’air fuit; reconnectez le raccord de verrouillage Luer ou remplacez la seringue. - Lorsque vous utilisez une aiguille de transplantation pour la première fois, enduisez son intérieur en tirant le jaune d’un embryon sacrifié, puis en expulsant complètement le matériau du jaune. Le revêtement aidera à réduire l’adhérence des cellules au verre lors des procédures ultérieures.
- Positionnez doucement l’embryon donneur à l’aide de l’aiguille, puis positionnez l’aiguille orthogonale à la surface de l’embryon (Figure 1D).
REMARQUE: La position sera différente pour différents tests. Pour la génération de sources de molécules de signalisation ectopique et les extirpations cellulaires, il s’agira du sommet du pôle animal (figure 1E); pour la transplantation germinale, ce sera la marge (Figure 1D,F). - Tirez lentement et soigneusement le piston pour attirer les cellules dans l’aiguille.
REMARQUE: Si les cellules sont absorbées trop rapidement, elles peuvent être endommagées. Si cela est fait correctement, les cellules devraient sortir sous forme de colonne cylindrique. Évitez de prendre du jaune dans l’aiguille, car le jaune transplanté est toxique pour l’embryon hôte. - Arrêtez l’aspiration en poussant doucement le piston vers le bas une fois que le nombre souhaité de cellules est aspiré. Retirez l’aiguille de l’embryon en secouant l’aiguille sur le côté dans un mouvement court et rapide. Laissez une solution de Ringer de chaque côté de la colonne cellulaire et limitez les cellules à l’extrémité effilée de l’aiguille (Figure 1C,D).
REMARQUE: Le liquide devant la colonne cellulaire aidera à séparer les cellules des embryons hôtes lors du dépôt de la colonne cellulaire. - Éliminez tout jaune ou débris cellulaire restant en déplaçant lentement le piston de haut en bas - pendant que l’aiguille reste immergée - pour laver les cellules avec la solution de Ringer. Si cela est fait correctement, les cellules non endommagées resteront collées ensemble dans une colonne pendant que les débris sont emportés.
REMARQUE: Il faut faire très attention pendant cette étape car le niveau de l’eau augmentera au-delà de l’extrémité effilée de l’aiguille. Cela provoquera un afflux soudain d’eau, qui peut être utilisée pour laver les cellules. Cependant, une fois que le niveau d’eau a dépassé l’extrémité effilée, le contrôle fin avec le piston sera réduit et le piston devra être déplacé plus lentement et plus soigneusement. - Déplacez la boîte de transplantation avec la main non dominante pour positionner l’aiguille orthogonale à la surface (pôle ou marge de l’animal) de l’embryon hôte (figure 1D-F).
- Appliquez doucement une légère pression, puis donnez un mouvement rapide et brusque pour percer la couche enveloppante de l’embryon hôte. Veillez à ne pas rayer le jaune avec l’aiguille.
REMARQUE: L’application d’une légère pression sur l’embryon en le pressant soigneusement contre les parois du puits augmente la tension superficielle de l’embryon et facilite ainsi le perçage de la couche enveloppante. - Une fois l’aiguille à l’intérieur, poussez doucement le piston pour extruder la colonne de cellules dans l’embryon tout en rétractant lentement l’aiguille en même temps (Figure 1D-F).
- Nettoyage de l’aiguille de transplantation.
- Rincez l’aiguille en déplaçant le piston de haut en bas pendant que l’aiguille est immergée dans de l’eau désionisée.
REMARQUE: Si l’aiguille reste sale, rincez-la avec une solution d’hydroxyde de sodium de 10 M avant de la rincer à nouveau à l’eau. - Conservez l’aiguille dans une boîte appropriée pour une utilisation ultérieure.
- Rincez l’aiguille en déplaçant le piston de haut en bas pendant que l’aiguille est immergée dans de l’eau désionisée.
2. Générer des sources ectopiques de molécules de signalisation sécrétées dans les embryons de poisson zèbre
- Préparation des embryons de l’hôte et du donneur.
- Recueillez des embryons fraîchement pondus en accoupleant le poisson-zèbre.
- Déchorionate des embryons de poisson-zèbre au stade 1cellule en incubant jusqu’à 100 embryons dans 0,5 mg/mL de solution de pronase pendant environ 15 min dans une petite boîte de Petri en verre (une description détaillée de cette procédure a été publiée par Rogers, K. W. et al.14).
REMARQUE: Alternativement, les embryons peuvent également être déconionnés au stade élevé juste avant la transplantation (étape 2.2), mais cela nécessite que les embryons de donneur injectés et les embryons hôtes non injectés soient déconionnés séparément. - Immerger les embryons dans un milieu embryonnaire dans un bécher de 200 ml.
REMARQUE: Les embryons au stade de blastula et de gastrula décononnés sont très délicats. Leur jaune exposé adhère aux surfaces en plastique et se rompt au contact de l’air. Par conséquent, ils doivent rester complètement immergés dans un milieu embryonnaire, transférés avec une pipette en verre et maintenus dans des boîtes en plastique recouvertes d’agarose (1% dans un milieu embryonnaire) ou des boîtes de Petri en verre. - Videz soigneusement la majeure partie du milieu embryonnaire et remplissez lentement le bécher avec du milieu embryonnaire frais. La légère agitation provoquée de cette façon facilitera l’élimination des chorions affaiblis. Répétez cette étape 2 à 3 fois.
- Transférer les embryons décononnés à l’aide d’une pipette Pasteur en verre dans un récipient d’injection enrobé d’agarose.
REMARQUE: Flamber la pointe de la pipette Pasteur en verre en l’exposant à une flamme de brûleur Bunsen peut fondre et lisser le bord, aidant à prévenir les dommages aux embryons. - Injecter l’ARNm codant pour la protéine marquée par fluorescence dans un sous-ensemble d’embryons (une description détaillée de cette procédure a été publiée par Rogers, K. W. et al.14). Injectez l’ARNm dans la cellule, et non dans le jaune, pour une expression quasi homogène. Les embryons injectés serviront de donneurs, tandis que les embryons non injectés serviront d’hôtes.
REMARQUE: La quantité et le type d’ARNm injectés dépendront de la molécule de signalisation étudiée et varient généralement de 20 à 200 pg2,4,5,6 (mais peuvent atteindre 1000 pg dans certains cas4). - Transférer les embryons injectés dans un plat de six puits recouvert d’agarose rempli de milieu embryonnaire. Incuber à 28 °C jusqu’à ce que les embryons atteignent le stade précoce de la sphère.
- Transplanter des cellules pour générer des sources ectopiques.
- Remplir une boîte de transplantation (avec des puits triangulaires individuels en forme de coin, voir tableau des matériaux) avec la solution de Ringer (116 mM NaCl, 2,8 mM KCl, 1 mM CaCl2, 5 mM HEPES; stocker le tampon HEPES à 4 °C).
REMARQUE: Le calcium dans la solution de Ringer favorise l’adhésion cellulaire et aide l’embryon à guérir de la procédure de transplantation. - Transférez les embryons dans la boîte de transplantation.
- Positionner les embryons de l’hôte et du donneur dans des colonnes alternées, dans chaque cas avec le pôle animal orienté vers l’aiguille de transplantation.
- Effectuer la transplantation comme décrit à la rubrique 1.3. Pour la transplantation de source ectopique, prélever les cellules sources du haut du pôle animal et les déposer au même endroit dans l’embryon hôte (Figure 1E).
REMARQUE: Le lavage des cellules avec la solution de Ringer comme détaillé à l’étape 1.3.8 est important pour la génération de sources ectopiques afin de s’assurer que les molécules de signalisation déjà sécrétées ne sont pas transférées à l’hôte. Ne transplantez pas trop de cellules pour vous assurer que la source n’est pas dispersée. Une colonne d’environ 80 μm de diamètre et 100 μm de longueur convient à de nombreuses applications. - Laissez l’embryon hôte rester dans la solution de Ringer pendant 30 min à 1 h pour récupérer.
- Examiner si les cellules ont été transplantées avec succès à l’aide d’un stéréomicroscope à fluorescence (Figure 2).
- Après la récupération, transférer les embryons dans une plaque de six puits recouverte d’agarose remplie de milieu embryonnaire et les incuber à 28 °C.
- Remplir une boîte de transplantation (avec des puits triangulaires individuels en forme de coin, voir tableau des matériaux) avec la solution de Ringer (116 mM NaCl, 2,8 mM KCl, 1 mM CaCl2, 5 mM HEPES; stocker le tampon HEPES à 4 °C).
3. Génération d’embryons de taille réduite par extirpation cellulaire
- Préparation d’embryons en vue de leur disparition.
- Collectez des embryons fraîchement pondus de poissons-zèbres du génotype souhaité.
- Incuber les embryons à 28 °C jusqu’à ce qu’ils atteignent le stade élevé.
- Déchorionate les embryons comme décrit aux étapes 2.1.2-2.1.5 lorsque les embryons atteignent le stade supérieur.
Remarque : Dans cet exemple, l’extirpation de cellule est effectuée au stade de la sphère. En conséquence, les embryons sont décholonnés environ 30 min à 1 h plus tôt.
- Facultatif : Étiquetage de la couche syncytiale de jaune (YSL).
REMARQUE: Si vous le souhaitez, injectez du dextrans fluorescent dans le YSL avant d’extirper les cellules. Cette technique permet de déterminer si le YSL reste intact après l’ablation cellulaire, ce qui est important pour une embryogenèse normale15. Alternativement, des ARNm ou des protéines synthétisés in vitro peuvent également être injectés dans le YSL.- Utilisez une pipette Pasteur pour transférer les embryons décchorionés dans un récipient d’injection enrobé d’agarose rempli d’eau embryonnaire.
- Orientez les embryons latéralement, la marge du blastoderme pointant vers l’aiguille d’injection (Figure 3A).
- Injecter 0,5 nL de 1,5 μg/μL 10 kDa Alexa568-Dextran dans le YSL, en visant une région entre les cellules du blastoderme et le jaune à une profondeur d’environ un tiers du diamètre de l’embryon. Injecter tous les embryons dans une rangée.
REMARQUE: Étant donné que l’aiguille d’injection n’a pas besoin de percer le chorion, une ouverture petite (~ 4 μm) et nette est avantageuse. - Faites pivoter les embryons de 180° de sorte que le côté opposé de la marge du blastoderme pointe vers l’aiguille d’injection (Figure 3A).
- Injecter un autre 0,5 nL de 1,5 μg/μL 10 kDa Alexa568-Dextran dans le YSL comme décrit à l’étape 3.2.3, ce qui donne un volume d’injection total de 1 nL par embryon.
REMARQUE: L’injection de deux côtés permet une distribution plus uniforme du dextran fluorescent dans le YSL. - Examinez le résultat de l’injection sous un stéréomicroscope à fluorescence. Si cela est fait correctement, le signal fluorescent sera limité à l’YSL (Figure 3B) et ne sera pas visible dans l’espace intercellulaire du blastoderme.
- Cellules disparues
- Remplissez un plat de transplantation avec la solution de Ringer (voir étape 2.2.1).
- Transférez les embryons dans le plat de transplantation.
- Orienter les embryons avec le pôle animal vers l’aiguille de transplantation (Figure 3C).
- Retirez soigneusement les cellules de la région du pôle animal comme décrit aux étapes 1.3.5-1.3.7, réduisant ainsi le blastoderme à la taille souhaitée.
- Jetez les cellules retirées en les expulsant de l’aiguille de transplantation.
- Une fois la procédure terminée, laissez les embryons rester dans la solution de Ringer pendant 30 min à 1 h pour récupérer.
- FACULTATIF : Examiner l’intégrité du YSL sous un stéréomicroscope à fluorescence (Figure 3D).
- Transférer les embryons dans une plaque recouverte d’agarose remplie de milieu embryonnaire et les incuber à 28 °C.
4. Création de mutants maternels-zygotiques par transplantation germinale
- Préparation des embryons d’hôtes et de donneurs.
- Recueillez des embryons fraîchement pondus de poissons-zèbres mutants et sauvages. Les embryons de poisson-zèbre avec un fond mutant serviront de donneurs, tandis que les embryons de poisson-zèbre avec un fond de type sauvage serviront d’hôtes.
REMARQUE: La transplantation germinale nécessite un nombre élevé d’embryons de départ (~ 50 pour les donneurs, ~ 500 pour les hôtes) pour assurer un bon nombre de greffes germinales réussies qui survivent à l’âge adulte. - Transférer les embryons dans une boîte d’injection enrobée d’agarose avec un milieu embryonnaire à l’aide d’une pipette Pasteur.
REMARQUE: Les injections sont effectuées avant la déschorionation pour augmenter le débit. Les aiguilles pour injection à travers le chorion doivent être émoussées et avoir une plus grande ouverture (~ 10 μm) pour éviter le colmatage. - Injecter aux embryons donneurs 1 nL de 100 ng/μL d’ARNm codant pour GFP avec un UTR nos1 3'. Injectez l’ARNm dans le jaune pour augmenter le débit.
REMARQUE: Le nos1 3'UTR stabilisera l’ARNm dans les cellules germinales primordiales, ce qui rendra les cellules germinales fortement fluorescentes lorsqu’elles sont imagées 1 jour après la fécondation10. - Injecter aux embryons hôtes 1 nL de morpholino sans issue (dnd) de 0,33 mM (3 μg/μL). Injectez le morpholino dans le jaune pour augmenter le débit.
REMARQUE: Le morpholino dnd bloque la formation de cellules germinales primordiales, ce qui garantit que la lignée germinale de l’embryon hôte sera exclusivement peuplée de cellules du donneur après la transplantation10. - Transférer les embryons injectés dans des boîtes de Petri en plastique avec un milieu embryonnaire. Incuber à 28 °C jusqu’à ce que les embryons atteignent le stade élevé.
- Déchorionate les embryons comme décrit aux étapes 2.1.2-2.1.5 lorsque les embryons atteignent le stade supérieur.
- Recueillez des embryons fraîchement pondus de poissons-zèbres mutants et sauvages. Les embryons de poisson-zèbre avec un fond mutant serviront de donneurs, tandis que les embryons de poisson-zèbre avec un fond de type sauvage serviront d’hôtes.
- Transplantation de cellules germinales
- Remplissez un plat de transplantation avec la solution de Ringer (voir étape 2.2.1).
- Transférer les embryons de sphère décoronés au stade du dôme dans la boîte de transplantation.
- Positionnez les embryons hôtes et les embryons de donneurs dans des colonnes alternées pour transplanter les cellules d’un embryon donneur à six embryons hôtes différents. Cela augmente les chances que les cellules germinales d’un embryon hôte donné soient transplantées avec succès.
- Orienter les embryons avec la marge vers l’aiguille de transplantation et effectuer la transplantation comme décrit à la section 1.3. Pour les transplantations germinales (Figure 1D,F), prélevez les cellules sources de la marge (où se trouvent les cellules germinales primordiales) et déposez-les au même endroit dans l’embryon hôte.
REMARQUE: La transplantation d’une grande colonne (environ 80 μm de diamètre et 600 μm de longueur) augmentera les chances d’obtenir une greffe germinale réussie. - Laisser l’embryon rester dans la solution de Ringer pendant 30 min à 1 h pour récupérer une fois la transplantation terminée.
REMARQUE: Si tous les embryons de donneurs ne sont pas censés être des mutants homozygotes - par exemple, s’ils résultent d’un croisement hétérozygote - ils doivent être génotypés après la transplantation pour déterminer le génotype de la future lignée germinale transplantée de l’hôte. Dans ce cas, assurez-vous que les positions des embryons de l’hôte et du donneur ne sont pas mélangées lors de la manipulation. - Utilisez un stéréomicroscope à fluorescence pour examiner si les cellules ont été transplantées avec succès (Figure 4A,B).
- Transférer les embryons dans une plaque recouverte d’agarose de 24 puits. Regroupez tous les embryons hôtes qui ont reçu des cellules du même donneur dans le même puits et étiquetez-les en conséquence. Incubés jusqu’au lendemain à 28 °C.
- Si nécessaire, transférez les embryons du donneur dans des bandelettes PCR étiquetées pour le génotypage.
- Dépistage des greffes germinales réussies
- Dépister les embryons hôtes pour des greffes germinales réussies sous un stéréomicroscope à fluorescence environ 30 h après la fécondation (HPF). Les cellules germinales se trouvent au niveau de la rainure au-dessus de l’extension du jaune (Figure 4C).
REMARQUE: Les expériences typiques avec le dispositif et la stratégie présentés ici auront un taux de réussite d’environ 60% à 80% pour obtenir au moins un embryon hôte portant des cellules germinales transplantées par embryon donneur. Un rapport précédent décrivait une efficacité d’environ 10 %10. - S’il y a lieu, jeter les embryons qui ont reçu des cellules d’embryons de donneurs avec un génotype incorrect. Cultiver des larves avec des cellules germinales transplantées avec succès à l’âge adulte selon les conditions d’élevage standard et en suivant les directives institutionnelles.
- Dépister les embryons hôtes pour des greffes germinales réussies sous un stéréomicroscope à fluorescence environ 30 h après la fécondation (HPF). Les cellules germinales se trouvent au niveau de la rainure au-dessus de l’extension du jaune (Figure 4C).
Résultats
Le succès et l’échec dans l’utilisation du dispositif de transplantation pour les trois applications décrites ci-dessus peuvent facilement être évalués par inspection visuelle sous stéréomicroscope. Dans les transplantations réussies, l’embryon doit avoir l’air normal et similaire en forme et en clarté du jaune aux embryons non transplantés, sans grandes déchirures dans le blastoderme. Si l’embryon est visiblement endommagé (Figure 4B), il ne se développera pas normalement. Idéalement, les cellules transplantées exprimant un marqueur fluorescent devraient apparaître sous la forme d’une colonne continue lorsqu’elles sont visualisées sous un stéréomicroscope à fluorescence (Figure 2A, Figure 4A). Si la colonne est fragmentée, cela indique que les cellules ont été cisaillées par l’aspiration dans l’aiguille de transplantation ou que le dépôt des cellules a été fait trop vigoureusement. Cela peut être évité en déplaçant le piston plus lentement et plus doucement.
Bien que le dispositif de transplantation ait été principalement utilisé sur des embryons de poisson-zèbre au stade de blastula5,6, la transplantation et la disparition de cellules fonctionnent tout aussi bien pour les embryons de stade blastula décononnés du poisson de riz japonais medaka (Oryzias latipes) (Figure 2B). En dehors de la déséchorionation embryonnaire, qui a été décrite par Porazinski, S. R. et al.17, les mêmes procédures que celles décrites ci-dessus peuvent être suivies.
Dans le cas spécifique de la transplantation germinale, une bonne greffe aboutira à un embryon avec une longue colonne horizontale de cellules directement au-dessus de la marge du jaune (Figure 4A). Cependant, la question de savoir si les cellules germinales ont été transplantées avec succès ne peut être évaluée que le lendemain (figure 4C-F) en raison de l’expression de fond de la GFP aux stades de blastula (figure 1F). Les cellules germinales primordiales apparaîtront sous forme de petites sphères fluorescentes dans le sillon directement au-dessus de l’extension du jaune (Figure 4C-E). La présence de ces cellules au bon endroit indique une transplantation germinale réussie. Les cellules de forme différente ne sont pas des cellules germinales (p. ex., les cellules allongées sont généralement des cellules musculaires, figure 4F). De plus, si les cellules germinales primordiales se trouvent à l’extérieur du sillon, cela signifie qu’elles n’ont pas migré correctement et qu’elles ne pourront pas contribuer à la lignée germinale de l’embryon. Enfin, la morphologie générale des embryons transplantés devrait ressembler à celle des embryons non transplantés (figure 4D); la queue ne doit pas être déformée et la tête ne doit pas être rétrécie ou les yeux manquants (figure 4E). Ces défauts résultent généralement de concentrations excessivement élevées de morpholino ou de lésions embryonnaires lors de la transplantation. Les expériences de transplantation germinale décrites ici aboutiront généralement à 1-2 embryons hôtes sur 6 avec des cellules germinales transplantées avec succès pour 60% à 80% des embryons de donneurs, selon l’expérience de l’expérimentateur. Ainsi, les cellules de 40 à 50 embryons de donneurs homozygotes doivent être transplantées dans 200 à 300 embryons hôtes pour élever environ 30 individus avec des cellules germinales mutantes.
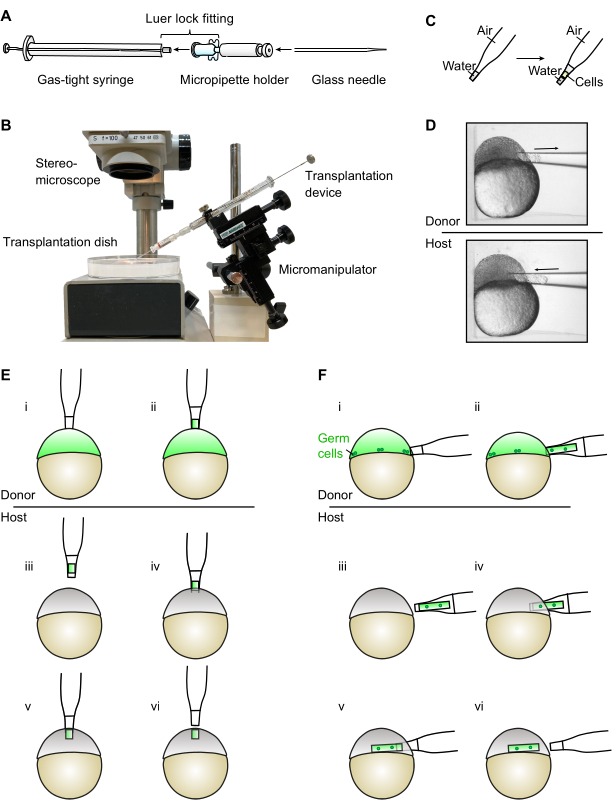
Figure 1 : Assemblage et utilisation du dispositif de transplantation. (A) Le dispositif de transplantation est assemblé en connectant une seringue étanche aux gaz avec un porte-micropipette via le raccord de verrouillage Luer. L’aiguille en verre pour la transplantation est ensuite insérée dans le support de la micropipette. (B) Photographie du dispositif de transplantation assemblé monté sur un micromanipulateur (veuillez noter que l’arrière-plan et les étiquettes ont été retirés de l’image). (C) Lors de l’utilisation du dispositif de transplantation, il est important de s’assurer que le niveau d’eau dans l’aiguille de transplantation reste à l’extrémité effilée. D) Le dispositif est utilisé sous stéréomicroscope pour prélever et insérer des cellules de et dans des embryons de téléostéens placés dans des puits individuels d’une boîte de transplantation. (E) Pour la génération de sources ectopiques, les cellules sont prélevées sur le pôle animal d’un embryon donneur (i-ii) et transférées dans le pôle animal d’un embryon hôte (iii-vi). (F) Pour la transplantation germinale, un plus grand nombre de cellules est prélevé dans la marge d’un embryon donneur (i-ii), où se trouvent les cellules germinales. Les cellules sont ensuite transférées dans la marge des embryons hôtes (iii-vi). Veuillez cliquer ici pour voir une version agrandie de cette figure.
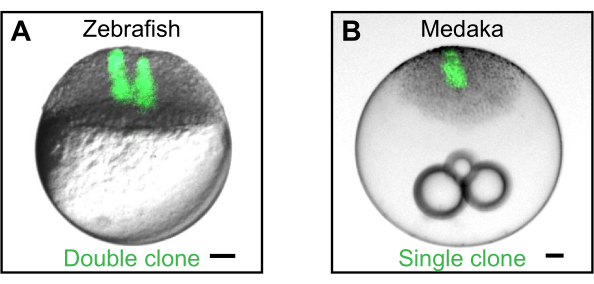
Figure 2: Génération de clones par transplantation cellulaire. (A) Exemple d’un double clone généré par transplantation séquentielle de cellules fluorescentes (vert) d’un donneur de poisson zèbre dans un embryon hôte de poisson-zèbre. Des clones simples et doubles peuvent être utilisés pour étudier comment les molécules de signalisation sécrétées forment des gradients spatio-temporels2,4,5,6. (B) Exemple d’un clone unique généré par la transplantation de cellules d’un donneur de medaka transgénique exprimant l’eGFP (Wimbledon)17 dans un hôte medaka de type sauvage. Les barres d’échelle représentent 100 μm. Veuillez cliquer ici pour afficher une version agrandie de cette figure.
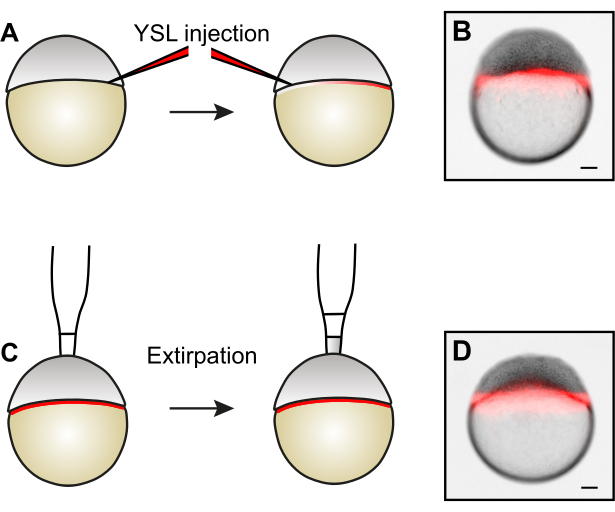
Figure 3 : Génération d’embryons de taille réduite par extirpation cellulaire. (A) Avant de prélever des cellules par extirpation, le YSL peut être marqué en injectant des colorants fluorescents dans deux côtés opposés du YSL. (B) Exemple d’embryon après injection de YSL. (C) Pour générer des embryons de taille réduite, les cellules du pôle animal sont retirées par extirpation5. D) Exemple d’embryon après disparition de cellule. Notez que le YSL reste intact. Les barres d’échelle représentent 100 μm. Veuillez cliquer ici pour afficher une version agrandie de cette figure.
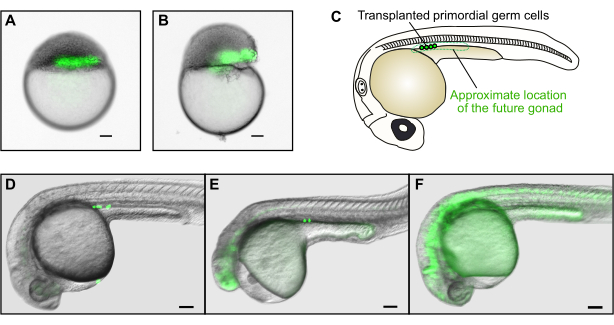
Figure 4 : Transplantation germinale. (A) Exemple de transplantation réussie de cellules donneuses (vert) dans la zone marginale de l’hôte. (B) Exemple d’une transplantation infructueuse. Le jaune de l’embryon hôte a été gravement endommagé et l’embryon ne pourra pas se développer normalement. (C) À 30 hpf, les cellules germinales transplantées avec succès se trouveront uniquement dans le mésoderme gonadique de la région antérieure de l’extension du jaune. (D) Exemple d’une transplantation réussie dans laquelle plusieurs cellules germinales de donneurs marquées GFP ont peuplé la future gonade de l’hôte. (E) Exemple d’une transplantation infructueuse. Bien que les cellules germinales aient atteint le mésoderme gonadique, l’embryon hôte est gravement déformé et ne se développera pas normalement. (F) Exemple d’une transplantation infructueuse. Les cellules germinales fluorescentes qui n’ont pas migré au bon endroit ne repeupleront pas les gonades. Les barres d’échelle représentent 100 μm. Les images en D-F ont été prises avec un grossissement total d’environ 50x. Veuillez cliquer ici pour voir une version plus grande de cette figure.
Discussion
Le succès d’une expérience de transplantation repose fortement sur la motricité fine de l’expérimentateur. Pour mener à bien les procédures, la pratique est nécessaire. Cependant, l’instrument présenté ici est relativement facile à apprendre et à utiliser par rapport à d’autres sur le marché et, en général, seulement quelques jours de pratique sont nécessaires.
Le succès de la procédure de transplantation peut être amélioré en prenant plusieurs précautions. Une étape consiste à s’assurer que le micromanipulateur est de bonne qualité et capable de fonctionner en douceur. L’ajout d’une oculaire avec un grossissement plus élevé au stéréomicroscope peut aider à positionner précisément l’aiguille par rapport à l’embryon. L’utilisation de poissons-zèbres ou de medaka bien reproducteurs pour acquérir des embryons sains et en prenant soin de ne pas endommager les embryons pendant la manipulation (en particulier pendant et après l’étape de déchorionation) augmentera également le taux de réussite.
Les problèmes de toxicité retardée peuvent être plus difficiles à résoudre. Si un embryon meurt après quelques heures - mais pas immédiatement après la transplantation - le jaune peut avoir été endommagé par l’aiguille (par exemple, en entrant trop profondément dans l’embryon), ou peut-être que les cellules ont été éjectées trop fort. Une toxicité retardée et la mort embryonnaire peuvent également résulter de l’injection de jaune ou de débris cellulaires avec les cellules donneuses; une autre cause peut être la détérioration du tampon HEPES dans la solution de Ringer. Ces problèmes peuvent être surmontés en lavant les cellules (voir étape 1.3.8) ou simplement en utilisant un nouveau lot de tampon, respectivement. En outre, les embryons hôtes déformés dans les expériences de transplantation germinale pourraient résulter de concentrations excessivement élevées de morpholino. Il est crucial d’utiliser suffisamment de morpholino pour ablation complète de la lignée germinale de type sauvage de l’hôte, empêchant ainsi ces cellules de contribuer à la progéniture - mais en même temps, des concentrations excessivement élevées de morpholino doivent être évitées. Des quantités constantes de morpholino sur tous les embryons hôtes injectés (quelques centaines dans une expérience typique) sont donc la clé du succès des transplantations germinales. Cela peut être facilité en complétant le mélange d’injection de morpholino avec un colorant traceur facilement visible14, qui peut être suivi sous un stéréomicroscope à fluorescence pour s’assurer que tous les embryons reçoivent le même volume d’injection.
Les procédures décrites dans ce protocole impliquent exclusivement des manipulations de cellules dans des embryons de poisson-zèbre ou de médaka au stade de blastula, mais à l’avenir, il sera probablement possible d’adapter le dispositif à différents stades et espèces en modifiant le diamètre et la forme de l’aiguille de transplantation.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à déclarer.
Remerciements
Ce projet a été soutenu par la Société Max Planck et a reçu un financement du Conseil européen de la recherche (CER) dans le cadre du programme de recherche et d’innovation Horizon 2020 de l’Union européenne (convention de subvention n° 637840 (QUANTPATTERN) et convention de subvention n° 863952 (ACE-OF-SPACE)).
matériels
| Name | Company | Catalog Number | Comments |
| 1.0 mm glass capillary, ends cut without filament | To make the transplantation needle | ||
| 1.0 mm glass capillary, ends cut with filament | To make injection needles | ||
| 200 mL glass beaker | For embryo dechorionation | ||
| 24-well plastic plate | To be coated with agarose in order to incubate embryos | ||
| 5 cm diameter glass Petri dish | For embryo dechorionation | ||
| 6-well plastic plate | To be coated with agarose in order to incubate embryos | ||
| Agarose | To coat plastic dishes | ||
| dnd1 morpholino | Gene Tools | Sequence: GCTGGGCATCCATGTCTCCGAC CAT | |
| Embryo medium | 250 mg/L Instant Ocean salt, 1 mg/L methylene blue in reverse osmosis water adjusted to pH 7 with NaHCO3 | ||
| Fluorescence stereomicroscope with GFP/RFP filters and light source | To assess YSL injections and germ-line transplantations | ||
| Glass micropipette puller | Sutter Instrument Company | P-1000 | To make the transplantation needle |
| Glass pasteur pipette | Kimble Chase (via Fisher) | 63A53WT | For pipetting embryos; the tips can be flamed to smoothen out the edge |
| Incubator at 28 °C | For incubating zebrafish embryos | ||
| Luer tip 25 μL Hamilton syringe, 1700 series | Hamilton | Ref: 80201 | Part of the transplantation device |
| Manual micromanipulator with 3 axes of movement | Narishige | M-152 | For controlling the transplantation device |
| Manual pipetting pump | Bio-Tek | Cat. # 641 | For use with the glass pipettes to transfer embryos |
| Metal dissecting probe | For moving and rotating zebrafish embryos | ||
| Microforge | Narishige | MF2 | To make the transplantation needle |
| Microinjection apparatus | For injection of mRNA and morpholino into embryos | ||
| Microinjection molds, triangular grooves | Adaptive Science Tools | TU-1 | To prepare microinjection plates with agarose |
| Microinjection-molds, single wells | Adaptive Science Tools | PT-1 | To prepare transplantation plates with agarose |
| Micropipette holder with Luer fitting for a 1.0 mm glass capillary | World Precision Instruments | MPH6S10 | Part of the transplantation device |
| mMessage mMachine Sp6 transcription kit | Life Technologies | AM1340M | To generate capped mRNA for injection into embryos |
| Plasmid with GFP-nos1 3'UTR | Plasmid that can be transcriped to produce mRNA encoding GFP with the 3'UTR of nos1 | ||
| Plastic petri dish 100 mm | To be coated with agarose in order to make injection and transplantation dishes | ||
| Protease from Streptomyces griseus | Sigma | P5147 | For embryo dechorionation: Make a 5 mg/ml stock and use at 1 mg/ml to dechorionate embryos |
| Ringer’s solution | For 1 L: Add 6.78 g of NaCl, 0.22 g of KCl, 0.26 g of CaCl2 and 1.19 g of HEPES; then fill to 1 L; adjust pH to 7.2; sterilize by filtration | ||
| Stereomicroscope | For injection and transplantation |
Références
- Spemann, H., Mangold, H. Induction of embryonic primordia by implantation of organizers from a different species. Archives for Microscopic Anatomy and Developmental Mechanics. 100 (3-4), 599-638 (1924).
- Müller, P., et al. Differential diffusivity of Nodal and Lefty underlies a reaction-diffusion patterning system. Science. 336 (6082), 721-724 (2012).
- Donovan, P., et al. Paracrine Activin-A signaling promotes melanoma growth and metastasis through immune evasion. Journal of Investigative Dermatology. 137 (12), 2578-2587 (2017).
- Pomreinke, A. P., et al. Dynamics of BMP signaling and distribution during zebrafish dorsal-ventral patterning. eLife. 6, 25861 (2017).
- Almuedo-Castillo, M., et al. Scale-invariant patterning by size-dependent inhibition of Nodal signaling. Nature Cell Biology. 20, 1032-1042 (2018).
- Soh, G. H., Pomreinke, A. P., Müller, P. Integration of Nodal and BMP signaling by mutual signaling effector antagonism. Cell Reports. 31 (1), 107487 (2020).
- Mahalwar, P., Walderich, B., Singh, A. P., Nüsslein-Volhard, C. Local reorganization of xanthophores fine-tunes and colors the striped pattern of zebrafish. Science. 345 (6202), 1362-1364 (2014).
- Frohnhöfer, H. G., Krauss, J., Maischein, H. M., Nüsslein-Volhard, C. Iridophores and their interactions with other chromatophores are required for stripe formation in zebrafish. Development. 140 (14), 2997-3007 (2013).
- Chen, Y., Schier, A. F. The zebrafish Nodal signal Squint functions as a morphogen. Nature. 411 (6837), 607-610 (2001).
- Ciruna, B., et al. Production of maternal-zygotic mutant zebrafish by germline replacement. Proceedings of the National Academy of Sciences of the United States of America. 99 (23), 14919-14924 (2002).
- Westerfield, M. . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio). 4th edn. , (2000).
- Kemp, H. A., Carmany-Rampey, A., Moens, C. Generating chimeric zebrafish embryos by transplantation. Journal of Visualized Experiments:JoVE. (29), e1394 (2009).
- Capek, D., Müller, P. Positional information and tissue scaling during development and regeneration. Development. 146 (24), 177709 (2019).
- Rogers, K. W., Bläßle, A., Schier, A. F., Müller, P. Measuring protein stability in living zebrafish embryos using fluorescence decay after photoconversion (FDAP). Journal of Visualized Experiments: JoVE. (95), e52266 (2015).
- Carvalho, L., Heisenberg, C. P. The yolk syncytial layer in early zebrafish development. Trends in Cell Biology. 20 (10), 586-592 (2010).
- Porazinski, S. R., Wang, H., Furutani-Seiki, M. Dechorionation of medaka embryos and cell transplantation for the generation of chimeras. Journal of Visualized Experiments: JoVE. (46), e2055 (2010).
- Centanin, L., Hoeckendorf, B., Wittbrodt, J. Fate restriction and multipotency in retinal stem cells. Cell Stem Cell. 9 (6), 553-562 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon