Method Article
Bildung von dispergierbaren Taohong Siwu Tabletten
In diesem Artikel
Zusammenfassung
Dieser Artikel beschreibt das Verfahren zur Formulierung und Zubereitung von Taohong Siwu, einer traditionellen chinesischen Medizin, als dispergierbare Tablette. Wir führten Einzelfaktor- und orthogonale Experimente durch, um die verschreibungspflichtigen Hilfsstoffe zu screenen, den Formulierungsprozess zu optimieren und dispergierbare Taohong Siwu-Tabletten herzustellen.
Zusammenfassung
Hier optimieren wir den Prozess zur Formulierung und Herstellung von dispergierbaren Taohong Siwu Tabletten und schaffen eine Grundlage für die Erweiterung ihrer klinischen Anwendung. Unter Verwendung der Dispersionsgleichmäßigkeit und der Zerfallszeit als Indizes für die Untersuchung verwendeten wir einen Ein-Faktor-Test, um die Hilfsstoffkategorien für Taohong Siwu-Tabletten abzugleichen und zu filtern. Die Formulierung wurde durch ein orthogonales Testdesign optimiert. Der Gehalt und die Auflösungsraten der wirksamen Substanzen in dispergierbaren Taohong Siwu-Tabletten, wenn sie mit optimierten Rezepten hergestellt wurden, wurden durch Ultrahochleistungsflüssigkeitschromatographie (UPLC) bestimmt und der optimale Zubereitungsprozess bestimmt.
Die optimale Zusammensetzung für dispergierbare Taohong Siwu-Tabletten war 17% Taohong Siwu-Extraktpulver, 1% Magnesiumstearat, 49% mikrokristalline Cellulose, 20% vernetztes Polyvinylpyrrolidon und 13% Natriumcarboxymethylstärke. Wenn dispergierbare Taohong Siwu-Tabletten durch direkte Kompression hergestellt wurden und das optimierte verschreibungspflichtige Pulver innerhalb von 3 Minuten gleichmäßig dispergiert wurde, erreichte die Auflösungsrate innerhalb von 50 Minuten mehr als 90%. Bei der Herstellung nach den optimierten Methoden zerfallen dispergierbare Taohong Siwu-Tabletten schnell in Wasser mit guter Dispersionsgleichmäßigkeit und kontrollierbarer Qualität.
Einleitung
Taohong Siwu Abkochung ist ein Rezept aus Pfirsichkernen, Färberdistel, Engelwurz, weißer Pfingstrose, Ligusticum chuanxiong und Rehmannia 1,2, das verwendet werden kann, um die Durchblutung zu fördern und Abschwellung und Schmerzen zu reduzieren 3,4. Frühere Forschungen haben ergeben, dass Taohong Siwu Tang schwer zu konservieren ist und leicht von Mehltau und anderen Faktoren beeinflusst wird. Darüber hinaus ist das üblicherweise verwendete klinische Abkochen unbequem zu transportieren, während das Abkochverfahren mühsam ist und Qualitätsschwankungen unterliegt. Daher ist es dringend erforderlich, eine neue Formulierung für Taohong Siwu-Tabletten zu entwickeln.
Dispergierbare Tabletten sind solche, die schnell in Wasser zerfallen und in gleichmäßigen Suspensionen verteilt werden können5. In der Traditionellen Chinesischen Medizin (TCM) wird die Hauptdroge in dispergierbaren Tabletten normalerweise aus den Rohstoffen des TCM-Pulvers, Extrakten und anderen geeigneten Hilfsstoffen hergestellt6. Im Vergleich zu herkömmlichen flüssigen Zubereitungen und gewöhnlichen Tabletten werden Dispersionstabletten als neue Darreichungsform schneller vom menschlichen Körper resorbiert, weisen eine bessere Stabilität auf, sind leicht einzunehmen und zu transportieren und weisen eine Reihe vorteilhafter Eigenschaften auf, wie z. B. schnellen Zerfall, hohe Bioverfügbarkeit und gute Dispersionsgleichmäßigkeit 7,8.
Die orthogonale Testentwurfsmethode verwendet eine orthogonale Tabelle, um die Testbedingungen wissenschaftlich auszuwählen, einen vernünftigen Testplan zu erstellen und dann die mathematischen Konzepte von Bereich und Varianz zu verwenden, um die Testergebnisse zu analysieren und einen optimalen Plan 9,10 zu generieren. In dieser Studie interessieren wir uns besonders für bestimmte Schlüsselmerkmale: die Gleichmäßigkeit der Dispersion, die Sauberkeit und die Vergleichbarkeit. Orthogonale Versuchspläne können auch angepasst werden, um ein fraktionelles und faktorielles Design zu integrieren. In der vorliegenden Studie verwenden wir ein orthogonales experimentelles Design, um die Hilfsstofftypen, Hilfsstoffverhältnisse und Arzneimittelbeladungsdaten für dispergierbare Taohong Siwu-Tabletten zu screenen und zu optimieren. Verglichen mit traditionellen Abkochungen der chinesischen Medizin sind die dispergierbaren Taohong Siwu-Tabletten, die nach der hier beschriebenen Methodik hergestellt werden, leicht einzunehmen, leicht zu konservieren und sehr resistent gegen Mehltau.
Protokoll
1. Herstellung des Taohong-Extrakts
- 39,6 g vorbereitete Rehmannia-Wurzel (Rehmannia glutinosa [Gaetn.] Libosch. ex Fisch. et Mey.), 29,7 g Pfirsichkern (Prunus persica [L.] Batsch), 19,8 g Färberdistel (Carthamus tinctorius L.), 29,7 g Angelika (Angelica sinensis [Oliv.] Diels), 29,7 g weiße Pfingstrosenwurzel (Cynanchum otophyllum Schneid) und 19,8 g Ligusticum chuanxiong (Ligusticum chuanxiong hort), insgesamt 168,3 g medizinische Materialien11, und geben Sie diese Zutaten in einen Abkochtopf.
- Führen Sie das Abkochen dreimal durch.
- Fügen Sie für jede Runde 1.683 ml Wasser hinzu und kochen Sie die Zutaten 1,5 Stunden lang.
- Kombinieren Sie das Filtrat und filtrieren Sie die resultierende Flüssigkeit mit Gaze. Konzentrieren Sie die Flüssigkeit in einem Rotationsverdampfer auf ein Endvolumen von 400 ml.
- Gießen Sie das Konzentrat gleichmäßig in eine Verdampfungsschale und legen Sie es in ein Wasserbad bei 90 °C, um das überschüssige Wasser zu trocknen.
- Legen Sie den eingedickten Extrakt in einen Vakuumtrockenschrank bei 85 °C und trocknen Sie ihn 8 h lang, um einen trockenen Extrakt zu erhalten.
- Anschließend den getrockneten Extrakt in einem Mörser zu Pulver mahlen und dann mit einem 80-Mesh-Sieb sieben.
HINWEIS: Der resultierende Trockenextrakt lag in Form eines rosa Kräuterpulvers vor, das die vier medizinischen Inhaltsstoffe enthielt.
2. Screening der Füllstoffe
- Verwenden Sie Laktose, vorverkleisterte Stärke und mikrokristalline Cellulose als Füllstoffe.
- Verwenden Sie vernetztes Polyvinylpyrrolidon (PVPP) als Sprengmittel und Magnesiumstearat als Schmiermittel.
HINWEIS: Es wurden drei Formeln verwendet, um Rezepte für Tests zu erstellen. - Bereiten Sie Formel 1 vor: 0,5 g medizinisches Pulver und 3,4 g mikrokristalline Cellulose (MCC) zur Herstellung des Füllstoffs und 1 g PVPP und 0,1 g Magnesiumstearat zur Herstellung des Gleitmittels.
- Bereiten Sie Formel 2 vor: 0,5 g medizinisches Pulver, 3,4 g vorgelatinierte Stärke als Füllstoff, 1 g PVPP als Sprengmittel und 0,1 g Magnesiumstearat als Schmiermittel.
- Bereiten Sie Formel 3 vor: 0,5 g medizinisches Pulver, 3,4 g Laktose als Füllstoff, 1 g PVPP als Sprengmittel und 0,1 g Magnesiumstearat als Schmiermittel.
- Mischen Sie jedes Rezept gründlich und passieren Sie ein 80-Mesh-Sieb. Geben Sie das gleichmäßig gemischte Pulver in eine einzelne Stanztablettenmaschine und stanzen Sie eine Tablette aus.
- Testen Sie jede Tablette einzeln. Die Tablette wird in ein Becherglas mit 1 l 37 °C destilliertem Wasser gegeben.
- Setzen Sie das Becherglas in ein Auflösungstester (Materialtabelle).
- Starten Sie den Auflösungstester und planen Sie die Reaktion. Wenn die Tabletten vollständig zerfallen sind, stoppen Sie den Timer und beobachten Sie, ob die Tabletten gleichmäßig verteilt sind.
HINWEIS: Wir haben die Zerfallszeit und die Gleichmäßigkeit der Dispersion als Indikatoren in den nachfolgenden Experimenten betrachtet. Die Daten, die sich aus jeder Verschreibung ergeben, sind in Tabelle 1 aufgeführt.
3. Auswahl des Sprengmittels
- Mischen Sie die drei Hilfsstoffe paarweise, um drei verschiedene Rezepte zu erstellen, und testen Sie die Kombinationen.
- Formulierung 1 mit PVPP und niedrig substituierter Hydroxypropylcellulose (L-HPC) (1:1) herstellen.
- Formulierung 2 mit L-HPC und Carboxymethylstärke-Natrium (CMS-NA) (1:1) herstellen.
- Bereiten Sie die Formulierung 3 mit PVPP und CMS-Na (1:1) vor.
- Mischen Sie jedes Rezept gründlich und passieren Sie ein 80-Mesh-Sieb. Geben Sie das gleichmäßig gemischte Pulver in eine einzelne Stanztablettenmaschine.
- Untersuchen Sie das Aussehen und die Form der Tabletten. Legen Sie die Tabletten auf einen weißen Hintergrund und beobachten Sie, ob das Erscheinungsbild der Farbe gleichmäßig ist. Messen Sie die Zerfallszeit gemäß den Schritten 2.7-2.9.
HINWEIS: Die Ergebnisse sind in Tabelle 2 dargestellt.
4. Optimierung der Füllstoff- und Sprengmitteldosierung
- Optimieren Sie die spezifische Dosierung der Füllstoffe (Schritt 2) und Sprengmittel (Schritt 4), indem Sie ein orthogonales Experiment mit der Dosierung von mikrokristalliner Cellulose als Faktor A, der Dosierung von vernetztem Polyvinylpyrrolidon als Faktor B, der Dosierung von Natriumcarboxymethylcellulose als Faktor C und dem Blindfehler als Faktor D durchführen.
- Die Hilfsstoffe sind gemäß Tabelle 3 vorzubereiten. Wiegen Sie die Hilfsstoffe separat und mischen Sie die drei Formulierungen gleichmäßig.
- Die Formulierungen werden durch ein Sieb mit einem Siebdurchmesser von 0,18 mm geführt.
- Pressen Sie die Formulierungen in Tabletten. Messen Sie die Zerfallszeit gemäß den Schritten 2.7-2.9.
ANMERKUNG: Tabelle 3 und Tabelle 4 zeigen die Anordnung auf Faktorebene und die Anordnung der orthogonalen Experimente. - Importieren Sie die erhaltenen Daten zur Datenanalyse in eine Tabellenkalkulationssoftware.
HINWEIS: Tabelle 5 zeigt die Ergebnisse der Varianzanalyse und Abbildung 1 zeigt die Trends für jeden Testindex.
5. Screening der Drogenbelastung
HINWEIS: Nach den Füllstoff- und Sprengstofftests wurden die optimalen Gehalte an mikrokristalliner Cellulose, vernetztem Polyvinylpyrrolidon, Natriumcarboxymethylstärke und Magnesiumstearat auf 4,4 g, 1,8 g, 1,2 g bzw. 0,1 g bestimmt.
- Bereiten Sie unter Beibehaltung des relativen Gehalts an Füllstoff, Sprengstoff und Schmiermittel Rezept 1 mit 1 g medizinischem Pulver, Rezept 2 mit 1,5 g medizinischem Pulver, Rezept 3 mit 2 g medizinischem Pulver und Rezept 4 mit 2,5 g medizinischem Pulver vor.
- Mischen Sie das Pulver, das Füllmittel, das Sprengmittel und das Schmiermittel, die in jeder Verschreibung verwendet werden, gründlich und passieren Sie ein 80-Maschen-Sieb.
- Drücken Sie auf die Tabletten und legen Sie eine Tablette in den Zerfallszeittester.
- Starten Sie das Instrument und die Zeit; Stoppen Sie den Timer, nachdem sich das Tablet vollständig aufgelöst hat.
HINWEIS: Der Verschreibungsplan ist in Tabelle 6 aufgeführt.
6. Qualitätsbewertung der Taohong Siwu Dispergiertabletten
- Bewertung des Aussehens
HINWEIS: Gemäß den Anforderungen der Ausgabe 2020 der Allgemeinen Regel 010112 des chinesischen Arzneibuchs sollte das Aussehen der Tablette vollständig und glatt sein und die Farbe sollte einheitlich sein.- Wählen Sie nach dem Zufallsprinzip sechs Stücke aus jeder der drei Chargen aus, um zu beobachten, ob die Oberfläche des Dispersionsblatts glatt und die Farbe gleichmäßig ist.
- Gewichtsvariation
- Nehmen Sie zur Bewertung des Nassgewichts 20 Tabletten aus jeder Charge und bestimmen Sie das Gesamtgewicht genau. Bestimmen Sie das durchschnittliche Tablettengewicht.
- Wiegen Sie jede Tablette einzeln.
- Vergleichen Sie das Gewicht jeder Tablette mit dem Durchschnittsgewicht.
HINWEIS: Die Differenz zwischen dem Durchschnittsgewicht und dem Gewicht einer einzelnen Tablette sollte 0,30 g ± 7,5% nicht überschreiten. Der Gewichtsunterschied sollte den von zwei Tabletten nicht überschreiten, und das Gewicht einer einzelnen Tablette sollte den Grenzwert um den Faktor eins überschreiten.
- Desintegrations- und Dispergiergleichmäßigkeitstests
HINWEIS: Gemäß den Bestimmungen der Allgemeinen Regel 0921 des chinesischen Arzneibuchs12 haben wir die Zerfallszeit für jede Tablettencharge bestimmt.- Hängen Sie eine Gondel an eine Halterung mit der Edelstahlwelle am oberen Ende. Tauchen Sie das Gerät in ein 1-Liter-Becherglas und stellen Sie die Position der Gondel so ein, dass das Sieb 25 mm vom Boden des Becherglases entfernt ist, wenn es auf seinen tiefsten Punkt fällt.
- Füllen Sie das Becherglas mit Wasser mit einer Temperatur von 37 °C ± 1 °C und stellen Sie die Höhe des Wasserspiegels so ein, dass sich das Sieb 15 mm unter der Wasseroberfläche befindet, wenn die Gondel ihren höchsten Punkt erreicht. Stellen Sie sicher, dass die Oberseite der Gondel zu keinem Zeitpunkt in Lösung getaucht ist.
- Nehmen Sie sechs Tabletten aus jeder Testcharge und legen Sie sie in ein Glasröhrchen in die Gondel.
- Aktivieren Sie den Dissolution-Tester.
HINWEIS: Jede Tablette muss innerhalb von 15 Minuten vollständig zerfallen sein. - Wenn eine Tablette nicht vollständig zerfallen ist, nehmen Sie weitere sechs Tabletten zum erneuten Test. Alle Tabletten müssen den erforderlichen Vorschriften entsprechen.
7. Charakterisierung
- Chromatographische Bedingungen
- Verwenden Sie eine chromatographische Säule mit einer Säule von 2,1 mm x 100 mm (z. B. ACQUITY UPLC BEH C18 1,7 μm).
- Verwenden Sie eine mobile Phase aus 100% Acetonitril (A) und 0,5% wässriger Phosphorsäurelösung (B).
- Verwenden Sie für die Gradientenelution das folgende Elutionsprogramm: 0-4 min (10%-30%), 4-10 min (30%-60%), 10-15 min (60%-85%), 15-17 min (85%-50%) %), 17-20 min (50%-110%), 20-22 min (10%-10%).
- Verwenden Sie eine Flussrate von 0,2 ml/min, eine Detektionswellenlänge von 260 nm, eine Säulentemperatur von 30 °C und ein Injektionsvolumen von 2 μl.
- Vorbereitung der Lösung
- Bereiten Sie eine Amygdalin-Referenzlösung vor. Das Amygdalin wird in Methanol in einer Konzentration von 0,2 mg·ml−1 gelöst.
- Bereiten Sie eine Testlösung vor.
- Für jede Probe werden fünf Tabletten mit einem Mörser zerkleinert und in einen 25-ml-Messkolben mit 25 ml 80%igem Methanol gegeben.
- Jede Probe wird 30 Minuten lang bei 150 W und 40 kHz mit Ultraschall beschallt, um sie aufzulösen.
- Kühlen Sie jede Probe auf Raumtemperatur ab und fügen Sie dann 80% Methanol zu einem Gesamtvolumen von 25 ml hinzu.
- Zum Schluss filtrieren Sie die Probe mit einer mikroporösen Membran (0,22 μm). Verwenden Sie das Substrat als Produkt zum Testen.
- Lineare Beziehungsanalyse
- Nehmen Sie 1 ml der Referenzlösung und filtrieren Sie mit einer mikroporösen Filtermembran (0,22 μm).
- 0,5 μl, 1 μl, 1,5 μl, 2 μl, 2,5 μl und 3 μl der Referenzlösung werden in die Chromatographiesäule überführt und die Chromatographie wie in Abschnitt 7.1 beschrieben durchgeführt.
- Injizieren Sie die Probe und notieren Sie den Peakbereich.
- Führen Sie eine lineare Regression durch, wobei die Peakfläche (y) und das Injektionsvolumen (x) als Variablen verwendet werden.
ANMERKUNG: Die erhaltene Regressionsgleichung war y = 18115x − 2386,6 (R² = 0,9993), was darauf hinweist, dass Amygdalin eine gute lineare Beziehung im Bereich von 0,0492-0,3101 mg aufweist. Abbildung 2 zeigt die Standardkurve.
- Präzisionsprüfung
- 2 μl der Referenzlösung (hergestellt wie in Abschnitt 5.2.1 beschrieben) werden sechsmal hintereinander in den Chromatographen injiziert.
- Notieren Sie den Spitzenbereich und berechnen Sie den Wert der relativen Standardabweichung (RSD).
HINWEIS: Der gemessene RSD-Wert für die Peakfläche von Amygdalin betrug 2,7%, was darauf hindeutet, dass das Instrument eine gute Präzision aufwies.
- Experimente zur Wiederholbarkeit
- Um die Wiederholbarkeit zu bewerten, mahlen Sie 30 Dispersionstabletten zu einem feinen Pulver und mischen Sie die resultierenden Pulver miteinander.
- Teilen Sie das gepoolte Pulver in sechs Chargen mit einem Gewicht von jeweils ca. 1 g.
- Bereiten Sie die Testlösung wie in Abschnitt 7.2.2 beschrieben vor.
- Injizieren Sie 2 μl jeder Probe, notieren Sie die Peakfläche und berechnen Sie den RSD-Wert.
ANMERKUNG: Der gemessene RSD-Wert für die Spitzenfläche betrug 1,8 %, was darauf hindeutet, dass die Methode eine gute Wiederholbarkeit aufwies.
- Stabilitäts-Experimente
- Injizieren Sie mit derselben Testlösung 2 μl Lösung nach 0 h, 2 h, 4 h, 6 h, 8 h, 12 h und 14 h.
- Notieren Sie den Spitzenbereich und berechnen Sie den RSD-Wert.
HINWEIS: Der gemessene RSD-Wert der Peakfläche von Amygdalin betrug 2,8%, was darauf hinweist, dass die Testlösung bei Raumtemperatur 24 h lang stabil war.
- Prüfung der Probenrückgewinnung
- Sechs Proben von Dispersionstabletten werden entnommen und Testlösungen nach dem in Abschnitt 7.2.2 beschriebenen Verfahren hergestellt.
- 1 ml der Kontrollsubstanz wird in dieselbe Injektionsflasche gegeben, der Probeninhalt gemäß den in Abschnitt 7.1 beschriebenen Bedingungen gemessen und die Wiederfindungsrate berechnet.
HINWEIS: Die Analyse zeigte, dass die mittlere Wiederfindungsrate von Amygdalin (n = 6) 101% und der RSD-Wert 2,8% betrug, was darauf hindeutet, dass die Methode eine gute Genauigkeit aufwies.
- Bestimmung des Probeninhalts
- Zur Herstellung von Testlösungen nach dem in Abschnitt 7.2.2 beschriebenen Verfahren sind drei Chargen dispergierbarer Tabletten zu verwenden.
- Von jeder Probe werden 2 μl unter den in Abschnitt 7.1 beschriebenen chromatographischen Bedingungen injiziert.
- Zeichnen Sie den Spitzenbereich auf und messen Sie den Inhalt.
ANMERKUNG: Der durchschnittliche Gehalt an Amygdalin in den drei Chargen dispergierbarer Tabletten betrug 0,257 mg / Tablette.
- Bestimmung der Auflösung
- Nehmen Sie sechs Chargen dispergierbarer Tabletten und messen Sie die Auflösungsgeschwindigkeit gemäß der Kleinbechermethode zur Auflösungsbestimmung, die in der Ausgabe 2020 des chinesischen Arzneibuchs12 beschrieben ist.
- Verwenden Sie 0,1 M Salzsäure (250 ml) als Auflösungsmedium und führen Sie die Prüfung bei 37 °C ± 0,5 °C und 100 U/min für 50 Minuten durch.
- Führen Sie die Proben sofort durch eine mikroporöse Membran (0,22 μm).
- Injektion und Prüfung gemäß den in Abschnitt 7.1 beschriebenen chromatographischen Bedingungen.
- Notieren Sie die Spitzenfläche und die Auflösungsrate.
ANMERKUNG: Die Auflösungsraten der sechs Probenchargen betrugen 98 %, 99 %, 96 %, 97 %, 97 % bzw. 98 %.
Ergebnisse
In dieser Studie verwendeten wir eine traditionelle Methode zur Herstellung von flüssigen Extrakten aus Taohong Siwu-Abkochung und stellten ein Kräuterpulver durch Konzentration und Trocknen her. Indem wir das Kräuterpulver, das Sprengmittel und das Schmiermittel unverändert ließen, untersuchten wir r-Laktose, vorverkleisterte Stärke und mikrokristalline Cellulose als Füllstoffe, um die Zerfallszeit zu bestimmen. Obwohl die Zerfallszeit mit Laktose als Sprengmittel besser war als die mit vorverkleisterter Stärke und mikrokristalliner Cellulose, entsprachen die Härte und Oberflächenbeschaffenheit nicht den geforderten Standards; Daher wurde mikrokristalline Cellulose als Füllstoff gewählt.
Um ein geeignetes Sprengmittel auszuwählen, haben wir drei Rezepte mit demselben Kräuterpulver, Füllstoff und Gleitmittel festgelegt: Rezept 1 (vernetztes Polyvinylpyrrolidon und niedrig substituierte Hydroxypropylcellulose), Rezept 2 (niedrig substituierte Hydroxypropylcellulose und Natriumcarboxymethylstärke) und Rezept 3 (vernetztes Polyvinylpyrrolidon und Natriumcarboxymethylstärke); Das Verhältnis betrug jeweils 1:1. Unter Verwendung von Aussehen, Zerfallszeit und Dispersionsgleichmäßigkeit als Inspektionsindikatoren stellten wir fest, dass die kombinierte Zerfallszeit und Dispersionsgleichmäßigkeit von vernetztem Polyvinylpyrrolidon und Natrium optimal war. Als nächstes führten wir orthogonale Tests durch, um den optimalen Füllstoff- und Sprengmittelgehalt zu ermitteln. Die besten Ergebnisse wurden mit 4,4 g mikrokristalliner Cellulose (MCC, Faktor A), 1,8 g vernetztem Polyvinylpyrrolidon (PVPP, Faktor B) und 1,2 g Natriumcarboxymethylstärke (CMS-Na, Faktor C) erzielt. Nachdem wir die optimale Dosierung und die optimalen Anteile von Füllstoff und Sprengstoff identifiziert hatten, identifizierten wir als nächstes die optimale Menge an Kräuterpulver, indem wir die Zerfallszeit, die Dispersionsgleichmäßigkeit und die Härte verschiedener Anteile untersuchten. Abbildung 3 zeigt, dass die vier Verschreibungen die Bewertung der Dispersionsgleichmäßigkeit bestanden haben. Bei einer größeren Medikamentenbelastung beobachteten wir jedoch eine längere Zerfallszeit und eine Verringerung des Geschirrs. Die endgültige Verschreibung wurde als 1,5 g medizinisches Pulver, 4,4 g mikrokristalline Cellulose, 1,8 g vernetztes Polyvinylpyrrolidon, 1,2 g Natriumcarboxymethylstärke und 0,1 g Magnesiumstearat identifiziert. Die endgültige Spezifikation betrug 0,30 g pro Tablette und vier Tabletten pro Verabreichung (dreimal täglich); Dies entsprach 1,068 g der Rohdroge.
Die Bestimmung des Gehalts und die Auflösungstests zeigten, dass der Gehalt an Amygdalin in jeder dispergierbaren Tablette 0,257 mg betrug. Im Auflösungstest betrugen die Auflösungsraten der sechs Chargen dispergierbarer Tabletten nach 50 min 98 %, 99 %, 96 %, 97 %, 97 % bzw. 98 %, was darauf hindeutet, dass die Auflösungsrate der dispergierbaren Taohong Siwu-Tabletten gut war.

Abbildung 1: Der mittlere Trend für die Testindizes. Das durchschnittliche Trenddiagramm für die Testindikatoren. Faktor A in der Abbildung ist der Gehalt an Taohong Siwu-Medizinpulver, Faktor B ist der Gehalt an PVPP, Faktor C ist der Gehalt an CMS-Na und Faktor D ist die Blindfehlergruppe. Die Zahlen in jedem Faktor repräsentieren unterschiedliche Inhalte (siehe Tabelle 3 für Details). Der Wert auf der y-Achse stellt den K-Wert dar, und niedrigere K-Werte weisen auf bessere Ergebnisse hin. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
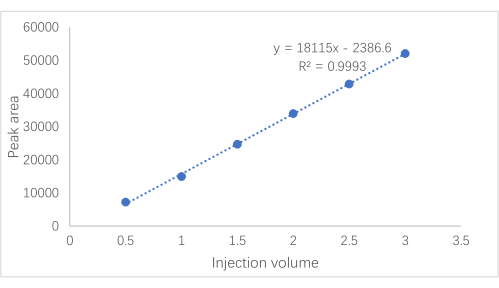
Abbildung 2: Laetrile-Standardkurve. Die Standardkurve von Amygdalin, wobei die x-Achse das Injektionsvolumen und die y-Achse den Peakbereich darstellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
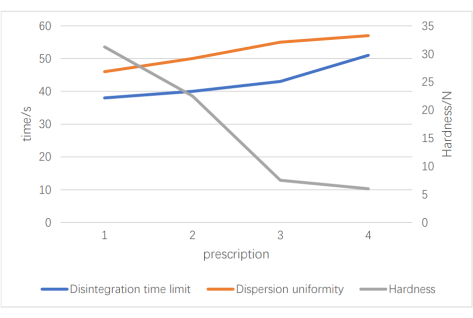
Abbildung 3: Ergebnisse des Drug-Load-Screenings. Diese Abbildung zeigt die Ergebnisse der Arzneimittelbelastung; Die linke y-Achse ist die Zeit, die rechte y-Achse ist die Härte und die vier Rezepte auf der x-Achse repräsentieren unterschiedliche Medikamentenladevolumina. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
| Seriennummer | medizinisches Pulver (g) | PVPP (g) | MCC (g) | vorverkleisterte Stärke (g) | Laktose (g) | Zerfallszeit(en) | Äußeres |
| 1 | 0.5 | 1 | 3.4 | 26 | sauber | ||
| 2 | 0.5 | 1 | 3.4 | 54 | sauber | ||
| 3 | 0.5 | 1 | 3.4 | 16 | gemeinsam |
Tabelle 1: Ergebnisse der Füllstoffauswahl. Der Hauptarzneimittelgehalt und die PVPP-Dosierung in den drei Verschreibungen blieben unverändert; Verschreibung 1 verwendete MCC als Füllstoff, Verschreibung 2 verwendete vorverkleisterte Stärke als Füllstoff und Verschreibung 3 verwendete Laktose als Füllstoff. Von diesen hatte Laktose als Füllstoff die kürzeste Zerfallszeit, aber der Glanz entsprach nicht dem Standard.
| Verschreibung von Sprengmitteln | Äußeres | Zerfallszeit(en) | Gleichmäßigkeit der Dispersion (en) |
| PVPP+L-HPC | sauber | 39 | 39 |
| L-HPC+CMS-NA | sauber | 40 | 52 |
| PVPP+CMS-Na | sauber | 42 | 40 |
Tabelle 2: Sprengmittel-Kombinationssiebung. Unter Bedingungen, bei denen Hauptwirkstoff und Füllstoff unverändert blieben, wurden verschiedene Sprengmittelkombinationen hinsichtlich ihrer Zerfallszeitgrenze und Dispersionsgleichmäßigkeit getestet. Verschreibung 1 war PVPP + L-HPC, Verschreibung 2 war L-HPC + CMS-Na und Verschreibung 3 war PVPP + CMS-Na, unter denen die Kombination von PVPP + CMS-Na die kürzeste Zerfallszeit aufwies.
| Niveau | A (g) | B (g) | C (g) | D (g) |
| 1 | 3.4 | 0.6 | 0.4 | leer |
| 2 | 4.4 | 1.2 | 0.8 | leer |
| 3 | 5.4 | 1.8 | 1.2 | leer |
Tabelle 3: Faktorstufen für orthogonale Versuchspläne. Die Dosierung des Hauptmedikaments jeder Verschreibung blieb unverändert. Faktor A ist die Dosierung des Füllstoffs MCC, Faktor B ist die Dosierung von PVPP, Faktor C ist die Dosierung von CMS-Na und Faktor D ist der Blindfehler.
| Nummerierung | A (g) | B (g) | C (g) | D (leer) | Zerfallszeit(en) |
| 1 | 1 | 1 | 1 | 1 | 69 |
| 2 | 1 | 2 | 2 | 2 | 123 |
| 3 | 1 | 3 | 3 | 3 | 40 |
| 4 | 2 | 1 | 2 | 3 | 43 |
| 5 | 2 | 2 | 3 | 1 | 31 |
| 6 | 2 | 3 | 1 | 2 | 39 |
| 7 | 3 | 1 | 3 | 2 | 78 |
| 8 | 3 | 2 | 1 | 3 | 59 |
| 9 | 3 | 3 | 2 | 1 | 34 |
| K1 | 232 | 190 | 167 | 134 | |
| K2 | 113 | 213 | 200 | 240 | |
| K3 | 171 | 113 | 149 | 142 | |
| K1 | 77.333 | 66.333 | 55.667 | 44.667 | |
| K2 | 37.667 | 71 | 66.667 | 80 | |
| K3 | 57 | 37.667 | 49.667 | 47.333 | |
| R | 39.667 | 33.333 | 17 | 35.333 | |
| primär und sekundär | RA>RD>RB>RC |
Tabelle 4: Orthogonale Versuchsanordnung und Versuchsergebnisse.
| Quelle der Varianz | Summe der quadrierten Abweichungen | Freiheitsgrade | Mittleres Quadrat | F-Wert | Hervorspringen |
| Ein | 236.667 | 2 | 1180.333 | 1.016 | >0,05 |
| B | 1828.667 | 2 | 914.333 | 0.787 | >0,05 |
| C | 446 | 2 | 223 | 0.192 | >0,05 |
| D (Fehler) | 2322.667 | 2 | 1161.333 |
Tabelle 5: Ergebnisse der Varianzanalyse.
| Rezept | Medizinisches Pulver (g) | MCC (g) | PVPP (g) | CMS-Na (g) | Magnesiumstearat (g) |
| 1 | 1 | 4.4 | 1.8 | 1.2 | 0.1 |
| 2 | 1.5 | 4.4 | 1.8 | 1.2 | 0.1 |
| 3 | 2 | 4.4 | 1.8 | 1.2 | 0.1 |
| 4 | 2.5 | 4.4 | 1.8 | 1.2 | 0.1 |
Tabelle 6: Formulierungen der Arzneimittelbeladung. Die Dosierung von MCC, PVPP und CMS-Na für jede Verschreibung blieb unverändert. Die Dosierung des Hauptmedikaments in Verschreibung 1 betrug 1 g, in Verschreibung 2 1,5 g, in Verschreibung 3 2 g und in Verschreibung 4 2,5 g.
| Chargennummer | Äußeres | Durchschnittliches Blechgewicht (g) | Gewichtsunterschied (g) | Durchschnittliche Härte (N) | Zerfallszeit(en) | Gleichmäßigkeit der Dispersion (en) |
| 20220710 | sauber | 0.1978 | qualifiziert | 22 | 39 | 43 |
| 20220711 | sauber | 0.186 | qualifiziert | 21 | 35 | 41 |
| 20220712 | sauber | 0.1948 | qualifiziert | 18 | 29 | 32 |
Tabelle 7: Qualitätsbewertung für die dispergierbaren Taohong Siwu Tabletten. Für die drei Probenchargen wurden eine Analyse des Aussehens, eine Analyse des Durchschnittsgewichts, eine Prüfung der Gewichtsdifferenz, eine Prüfung der Härteprüfung, eine Prüfung der Zerfallszeit und eine Prüfung der Gleichmäßigkeit der Dispersion durchgeführt.
Diskussion
In dieser Studie testeten wir die Wirkung der Dosierung von Füllstoffen, Sprengmitteln und medizinischen Pulvern auf die Zerfallszeit und die Dispersionsgleichmäßigkeit von dispergierbaren Tabletten unter Verwendung eines orthogonalen Designs. Wir stellten fest, dass sich die bevorzugte Formulierung schnell auflöste. Bei der Auswahl des am besten geeigneten Füllstoffs stellten wir fest, dass Laktose zwar die kürzeste Zerfallszeit aufwies, die Härte dieser Tabletten jedoch nicht ausreichte. Darüber hinaus war die Oberfläche der Tabletten nicht glatt genug, und es gab Hinweise auf Pulververlust und lose Tabletten. Als solche erfüllte Laktose nicht die Anforderungen an einen geeigneten Füllstoff; Daher haben wir uns für mikrokristalline Cellulose als optimalen Füllstoff entschieden. Mikrokristalline Cellulose ist ein Polymer in Form von Pulver oder kurzen Stäbchen mit starker Fließfähigkeit und ohne faserige Struktur13. Darüber hinaus ist mikrokristalline Cellulose geruchlos, ungiftig, leicht zersetzbar und nicht reaktiv mit Arzneimitteln. Dieses Polymer ist ein wichtiger Hilfsstoff in der pharmazeutischen Industrie und kann Arzneimittelkomponenten effizient verbinden, um die Arzneimittelformungzu fördern 14. Darüber hinaus kann dieses Polymer die Zersetzung von Arzneimittelkomponenten erleichtern und gleichzeitig die Arzneimittelstärke verbessern und wird hauptsächlich als Hilfsstoff, Füllstoff oder Wirkstofffreisetzungsmodifikator für die Herstellung von Arzneimitteltabletten, Arzneimittelgranulaten und Arzneimittelkapseln15,16 verwendet.
Sprengmittel haben gute Wasseraufnahme- und Quelleigenschaften und können die gleichmäßige Dispersion von Dispersionstabletten in Wasser fördern. Gegenwärtig sind die am häufigsten verwendeten Sprengmittel in Dispersionstabletten L-HPC, vernetztes PVPP und CMS-Na17. In diesem Experiment zeigte die Kombination von vernetztem PVPP und CMS-Na die kürzeste Zerfallszeit. Die meisten dispergierbaren Tabletten verwenden zwei oder mehr Sprengmittel. Kombinationen von Sprengmitteln können den Desintegrationseffekt verbessern und die Kosten senken18. Beim Screening der Medikamentenbeladung stellten wir fest, dass mit zunehmender Medikamentenbeladung die Härte der Tabletten abnahm; Diese Wirkung kann mit der Art des Arzneistoffpulvers19 zusammenhängen. Schließlich wurde der Prozess zur Herstellung der Dispersionstabletten (mit vier Zutaten) durch die Formulierung optimiert. Es folgte die Indizierung der Zerfallszeit und der Dispergiergleichmäßigkeit. Die endgültigen Bestandteile waren medizinisches Pulver (17 %), mikrokristalline Cellulose (49 %), vernetztes Polyvinylpyrrolidon (20 %), Natriumcarboxymethylstärke (13 %) und Magnesiumstearat (1 %).
Im Vergleich zu Abkochungen der traditionellen chinesischen Medizin können dispergierbare Tabletten gute therapeutische Wirkungen mit hoher Bioverfügbarkeit, guter Stabilität und einfacher Portabilität ausüben, insbesondere bei Patienten, die Schwierigkeiten haben, Abkochungen einzunehmen und Schwierigkeiten beim Schlucken haben20,21. In der traditionellen chinesischen Medizin ist die Hauptdroge in dispergierbaren Tabletten normalerweise keine einzelne Verbindung; Vielmehr besteht das Medikament aus einer komplexen Mischung von Inhaltsstoffen. Darüber hinaus haben solche Pulver eine relativ hohe Viskosität und sind in der Regel in der Lage, Feuchtigkeit aufzunehmen. Gewöhnliche Tabletten, die chinesisches Kräutermedizinpulver als Hauptarzneimittel enthalten, sind mit einer Vielzahl von Problemen verbunden, darunter eine lange Zerfallszeit und eine schlechte Dispersionsgleichmäßigkeit, die die heilende Wirkung beeinflussen. Daher haben wir in der vorliegenden Forschung eine neue Formulierung, dispergierbare Tabletten, für den Taohong Siwu-Sud entwickelt, um die mit traditionellen Abkochungen verbundenen Probleme zu lösen, wodurch das Anwendungsspektrum erweitert und die Absorption im Körper gefördertwird 22. In dieser Forschung haben wir ein trockenes Pulver aus medizinischen Materialien extrahiert, indem wir die Wasserextraktionsmethode angewendet haben. Traditionelle Abkochmethoden beinhalten komplexe Inhaltsstoffe, die entsprechend den wirksamen Komponenten und den Eigenschaften der Wirkstoffe extrahiert werden können. Weiterhin kann der Gehalt der Wirkstoffe in Dispersionstabletten erhöht werden. Die Abtrennung von Verunreinigungen in medizinischen Materialien und die Konservierung ihrer Wirkstoffe ist ein Problem, das bei der Herstellung sorgfältig berücksichtigt werden sollte. Es ist auch wichtig, günstige Bedingungen für die Herstellung nachfolgender dispergierbarer Tabletten zu schaffen. Traditionelle Abkochungen wie der Taohong Siwu-Sud haben im Allgemeinen einen hohen Zuckergehalt. Kräuterpulver können leicht so hergestellt werden, dass sie Feuchtigkeit aufnehmen. Daher ist es wichtig, beim Trocknen während der Zubereitung Vorsichtsmaßnahmen zu treffen. Darüber hinaus sollten die fertigen Tabletten feuchtigkeitsbeständig sein.
Es sei darauf hingewiesen, dass diese Studie nur eine Indexkomponente in den Experimenten zur Inhaltsbestimmung untersuchte; Dies stellt eine bemerkenswerte Einschränkung dieser Studie dar, obwohl unsere Arbeit eine wichtige Grundlage für nachfolgende eingehende Forschung bietet. Die Umwandlung eines Suds von Taohong Siwu in eine dispergierbare Tablette, die für Patienten bequem, praktischer und praktikabler ist, steht auch im Einklang mit den sich entwickelnden Trends in der traditionellen chinesischen Medizin.
Offenlegungen
Die Autoren erklären keine Interessenkonflikte.
Danksagungen
Diese Forschung wurde unterstützt von der National Natural Science Foundation of China (Grant No. 82074059), dem Open Fund for Key Laboratory des Xin'an Medical Ministry of Education, der Anhui University of Traditional Chinese Medicine (Nr. 2022XAYX07), dem vom Anhui Provincial Key Laboratory of Traditional Chinese Medicine Compound Open Fund finanzierten Projekt (Nr. 2019AKLCMF03), dem Academic Leader Reserve Candidate Funding Project der Provinz Anhui (Nr. 2022H287), und das Schlüsselprojekt für Gesundheitsforschung der Provinz Anhui (AHWJ2022a013)
Materialien
| Name | Company | Catalog Number | Comments |
| Acetonitrile | OCEANPAK | A22T0218 | |
| Carboxymethyl starch sodium | Maclean | C12976293 | |
| Crosslinked Polyvinylpyrrolidone | Maclean | C12976293 | |
| Disintegration time limit tester | Tianjin Guoming Pharmaceutical Equipment Co., Ltd. | BJ-2 | |
| Electric heating constant temperature drying oven | Shanghai Sanfa Scientific Instrument Co., Ltd. | DHG-9202·2 | |
| Electric thermostatic water bath | Shanghai Sanfa Scientific Instrument Co., Ltd. | DK-S24 | |
| Electronic Balance | Sartorius Scientific Instruments (Beijing) Co., Ltd. | SQP | |
| Intelligent Dissolution Tester | Tianda Tianfa Technology Co., Ltd. | ZRS-8L | |
| Lactose | Maclean | C12942141 | |
| Low-Substituted Hydroxypropyl Cellulose | Anhui Shanhe Pharmaceutical Excipients Co., Ltd. | 190219 | |
| Magnesium stearate | Maclean | C12894996 | |
| Methyl Alcohol | TEDIA High Purity Solvents | 22075365 | |
| Microcrystalline cellulose | Maclean | 13028716 | |
| Single punch tablet machine | Nantong Shengkaia Machinery Co., Ltd. | TDP-2A | |
| Tablet hardness tester | Shanghai Huanghai Drug Testing Instrument Co., Ltd. | YPJ-200B | |
| Taohong Siwu Soup Extract | self made | ||
| Taoren, Honghua, etc. traditional Chinese medicine | The First Affiliated Hospital of Anhui University of Chinese Medicine | ||
| Waters Acquity H-Class Ultra High Liquid Chromatography |
Referenzen
- Wang, J. Y., et al. Effects of Erchen decoction and Taohong Siwu decoction on Nox4/NF-κB/HIF-1αsignaling pathway in aorta of ApoE~(-/-) atherosclerosis mice. China Journal of Traditional Chinese Medicine and Pharmacy. , (2019).
- Aslani, A., Ghasemi, A., Esfahani, S. K. Design, formulation and physicochemical evaluation of dimenhydrinate orally disintegrating tablets. Galen Medical Journal. 7, 936 (2018).
- Chen, K. X., Jiang, H. L., Luo, X. M., Shen, J. H. Drug discovery in post-genome era: Trend and practice. Chinese Journal of Natural Medicines. 2, 257-260 (2004).
- Wang, M., Liu, Z., Hu, S., Duan, X., Han, L. Taohong Siwu decoction ameliorates ischemic stroke injury via suppressing pyroptosis. Frontiers in Pharmacology. 11, 590453 (2020).
- Xin, R. H., Liang, G., Zheng, J. F. Design and content determination of Genhuang dispersible tablet herbal formulation. Pakistan Journal of Pharmaceutical Sciences. 30, 655-661 (2017).
- Yulin, D., Junxue, P., Rong, L., Jianlin, Y. Comparison of oral preparations of Chinese medicine dispersible tablets and traditional Chinese medicine. Chinese Journal of Ethnomedicine and Ethnopharmacy. 26 (8), 63-65 (2017).
- Yinghua, X., et al. Study on albendazole dispersible tablets based on solubilization effect. Journal of Hebei University of Science and Technology. 42 (6), 619-626 (2021).
- Mengzhu, Y., Kai, Y., Yi, H. Study on the prescription optimization and dissolution of Baicalin Dispersible Tablets. China Medical Herald. 10 (1), 122-123 (2013).
- Zhongan, X., et al. Introduction to the orthogonal experimental design method. Sci-Tech Information Development & Economy. (5), 1005 (2002).
- Liu Ruijiang, Z. Y., Chongwei, W., Jian, T. Study on the design and analysis methods of orthogonal experiment. Experimental Technology and Management. 27 (9), 4 (2010).
- Xianchun, D. Based on network pharmacology and transcriptomics to explore the main material basis and mechanism of ThaoHongSiWu Decoction in treating ischemic stroke. Anhui University of Chinese Medicine. , (2019).
- Pharmacopoeia Commission of the Ministry of Health of the People's Republic of China. . Pharmacopoeia of the People's Republic of China. , (2020).
- Jiaqiang, Y., et al. Research progress on preparation and application of microcrystalline cellulose. China Pulp & Paper Industry. 42 (10), 8-13 (2021).
- Nakamura, S., Tanaka, C., Yuasa, H., Sakamoto, T. Utility of microcrystalline cellulose for improving drug content uniformity in tablet manufacturing using direct powder compression. AAPS PharmSciTech. 20 (4), 151 (2019).
- Jinbao, L., et al. Effect of alkali pretreatment on preparation of microcrystalline cellulose. China Pulp & Paper. 39 (01), 26-32 (2020).
- Nsor-Atindana, J., et al. Functionality and nutritional aspects of microcrystalline cellulose in food. Carbohydrate Polymers. 172, 159-174 (2017).
- Wang, C., et al. Formulation and evaluation of nanocrystalline cellulose as a potential disintegrant. Carbohydrate Polymers. 130, 275-279 (2015).
- Huba, K., István, A. Drug excipients. Current Medicinal Chemistry. 13 (21), 2535-2563 (2006).
- Ping, Z., Jie, G. Talking about some problems of hardness and disintegration in traditional Chinese medicine tablets. Science and Wealth. 6 (181), 181 (2020).
- Pabari, R. M., McDermott, C., Barlow, J., Ramtoola, Z. Stability of an alternative extemporaneous captopril fast-dispersing tablet formulation versus an extemporaneous oral liquid formulation. Clinical Therapeutics. 34 (11), 2221-2229 (2012).
- Fini, A., Bergamante, V., Ceschel, G. C., Ronchi, C., de Moraes, C. A. F. Fast dispersible/slow releasing ibuprofen tablets. European Journal of Pharmaceutics and Biopharmaceutics. 69 (1), 335-341 (2008).
- Meidan, W. Study on compound Rhodiola relieving physical fatigue dispersible tablets. Jilin University. , (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten