Method Article
Linderung von Arthrose bei Mäusen mit Silber-Nanopartikeln
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Hier wird ein Protokoll für die Verwendung von Silbernanopartikeln vorgestellt, um die akuten Symptome von Typ-II-Kollagenase-induzierten Arthrose-Mäusen, einschließlich Synovialentzündung, Synovialhyperplasie, Gefäßhyperplasie usw., wirksam zu lindern.
Zusammenfassung
Die Kniearthrose (KOA) ist eine der am häufigsten auftretenden degenerativen Erkrankungen der Gelenke bei Menschen über 45 Jahren. Derzeit gibt es keine wirksamen Therapeutika für KOA, und die einzige Endpunktstrategie ist die Knietotalendoprothetik (TKA). daher ist KOA mit wirtschaftlichen Belastungen und gesellschaftlichen Kosten verbunden. Die Entzündungsreaktion des Immunsystems ist an der Entstehung und Entwicklung von KOA beteiligt. Wir haben bereits ein Mausmodell für KOA mit Typ-II-Kollagen etabliert. Eine Hyperplasie des Synovialgewebes war im Modell vorhanden, zusammen mit einer großen Anzahl infiltrierter Entzündungszellen. Silbernanopartikel haben eine erhebliche entzündungshemmende Wirkung und werden häufig in der Tumortherapie und der chirurgischen Verabreichung von Medikamenten eingesetzt. Daher haben wir die therapeutischen Effekte von Silbernanopartikeln in einem Kollagenase II-induzierten KOA-Modell untersucht. Die experimentellen Ergebnisse zeigten, dass Silbernanopartikel die Synovialhyperplasie und die Infiltration von Neutrophilen in das Synovialgewebe signifikant reduzierten. Daher demonstriert diese Arbeit die Identifizierung einer neuartigen Strategie für OA und liefert eine theoretische Grundlage, um das Fortschreiten von KOA zu verhindern.
Einleitung
Die Kniearthrose (KOA) ist eine der häufigsten Formen der Arthrose und beinhaltet einen komplexen Krankheitsprozess im gesamten Synovialgelenk1. Da die Weltbevölkerung allmählich altert, nimmt die Inzidenz von KOA erheblich zu. Anhaltende Schmerzen im Kniegelenk veranlassen Patienten mit KOA häufig, sich in ärztliche Behandlung zu begeben. Die Ätiologie der Schmerzen bei KOA kann mit der Entzündungsreaktion, der Synovialhyperplasie und der Knorpeldegeneration zusammenhängen2. Das Synoviumgewebe besteht aus zwei Arten von Zellen: Synovialfibroblasten und Makrophagen 3,4,5. Synovialfibroblasten produzieren Synovialflüssigkeit. Synovialmakrophagen befinden sich normalerweise in der Inaktivität und werden durch die Entzündungsreaktion aktiviert. Eine anfängliche Entzündung der Gelenkinnenhaut verursacht Schmerzen im Kniegelenk6.
Die entzündliche Immunantwort des Synoviumgewebes spielt eine entscheidende Rolle bei der Pathogenese von KOA. Frühere Studien haben bestätigt, dass es bei KOA Entzündungsreaktionen im Synoviumgewebe gibt, die als Synovitis bekannt sind, und dass der Synovitisgrad der KOA eng mit der Entzündungszellinfiltration des Synoviumgewebes zusammenhängt 7,8,9. Synovitis ist eine Entzündungsreaktion der Synovial, und ihre pathologischen Merkmale sind die Proliferation von Synovialzellen, die Bildung neuer Gefäße und die Infiltration von Entzündungszellen 5,10,11.
Das Ziel der KOA-Behandlung ist es, die Entzündungsreaktion der Gelenkinnenhaut zu lindern und das Fortschreiten der Krankheit zu verzögern. Derzeit sind die wichtigsten klinischen Medikamente zur Behandlung von KOA nichtsteroidale Antirheumatika (NSAR); Sie weisen jedoch erhebliche Nebenwirkungen auf, wie z. B. Nephrotoxizität12,13. Intraartikuläre Glukokortikoid-Injektionen sind eine weitere Option zur Behandlung von KOA; Das Glukokortikoid breitet sich jedoch schnell aus und könnte durch den Gelenkerguss schnell verstoffwechselt werden. In der Zwischenzeit sollten Diabetiker mit zugrunde liegender Hyperglykämie bei laufenden Steroidinjektionen vorsichtig sein14. Zusammenfassend lässt sich sagen, dass es keine verfügbare medikamentöse therapeutische Strategie für KOA gibt. Daher ist die Erforschung neuer Medikamente zur Behandlung von KOA äußerst dringlich.
Die Größe von Silbernanopartikeln beträgt weniger als 100 nm. Aufgrund ihrer ausgeprägten entzündungshemmenden, antibakteriellen und antioxidativen Wirkung werden sie in verschiedenen Bereichen des Gesundheitswesens und der Medizin eingesetzt, z. B. bei der Wundheilung und bei Verbrennungen15,16. Sie werden auch bei der gezielten Verabreichung von Medikamenten, der medizinischen Bildgebung und der molekularen Diagnostik eingesetzt17. Silber (Ag) hat eine stärkere entzündungshemmende und antibakterielle Wirkung als andere Metallnanopartikel wie Kupfer (Cu), Zink (Zn) und Eisen (Fe)15. Silbernanopartikel, eine neue Art von Nanomaterial, haben ein breites Spektrum und starke antimikrobielle Eigenschaften. Eine frühere Studie ergab, dass Silbernanopartikel in Verbrennungs- und Peritonitis-Mausmodellen18,19 die Produktion von Entzündungsfaktoren wirksam hemmen und die Wundheilung fördern können. Eine frühere Studie zeigte auch, dass Silbernanopartikel die Heilung von diabetischen Wunden verbessern, indem sie die Synthese von Wachstumsfaktoren und die Kollagenablagerung fördern20.
Basierend auf der entzündungshemmenden Wirkung von Silbernanopartikeln wollten wir Silbernanopartikel zur Behandlung von Typ-II-Kollagen-induzierter KOA bei Mäusen einsetzen. Die Ergebnisse deuten darauf hin, dass die Anzahl der entzündlichen Infiltrationszellen des Synovialgelenks bei Mäusen mit dieser Behandlung signifikant reduziert wurde. Die Ergebnisse deuteten auch darauf hin, dass Silbernanopartikel die Symptome von KOA bei Mäusen signifikant lindern könnten. Daher kann die Anwendung von Silbernanopartikeln die Entwicklung neuer Behandlungsoptionen für klinische KOA unterstützen.
Protokoll
Alle Tierarbeiten wurden vom Animal Ethical and Welfare Committee (AEWC) des Guangzhou Forevergen Medical Laboratory Animal Center genehmigt (2018-0186).
1. Etablierung des KOA-Mausmodells
- Halten Sie BALB/c-Mäuse (18-24 g; 12-14 Wochen alt) in einer Umgebung mit 70 % Luftfeuchtigkeit und 26 °C mit einem Hell-Dunkel-Zyklus von 12 Stunden. Für dieses Experiment wurden die Tiere im Guangzhou Forevergen Medical Laboratory Animal Center gehalten.
- Verwenden Sie Typ-II-Kollagen, um ein KOA-Mausmodell zu erstellen, wie zuvor beschrieben21. Führen Sie die intraartikuläre Injektion wie unten beschrieben durch.
- 2% Natrium-Pentobarbital (40 mg/kg) für die Anästhesie und Buprenorphin (0,05 mg/kg, subkutane Injektion) für die Analgesie anwenden. Fixieren Sie dann die Gliedmaßen der Maus mit dem Klebeband, entfernen Sie die Haare mit dem Rasierer und desinfizieren Sie sie dreimal mit einem abwechselnden Peeling von 0,1 % Jodophor und Alkohol.
- Tragen Sie sterile Handschuhe und verwenden Sie eine sterile Schere, um die Haut, das Unterhautgewebe und das Infrapatellaband nacheinander freizulegen. Halten Sie den Inzisionsbereich unter 0,5 cm.
HINWEIS: Eine Heizdecke wurde verwendet, um die Körpertemperatur der Mäuse während der Operation aufrechtzuerhalten. - Verwenden Sie eine 1-ml-Insulinspritze, um 10 U 30 mg/kg (0,4 mg/ml) Typ-II-Kollagenase in die Gelenkhöhle (unter dem Ligamentum infrapatellaris) zu injizieren22.
HINWEIS: Der Winkel zwischen der Nadel und der Haut sollte ca. 15° betragen; Dann sollte die Richtung der Nadel geändert und die Nadel ganz zurückgezogen werden. - Nach der Injektion vernähen Sie zuerst das Unterhautgewebe und dann die Haut. Sterilisieren Sie den Nahtbereich mit 0,1 % Jodophor. Setzen Sie die Mäuse nach dem Aufwachen aus der Narkose separat in die einzeln belüfteten Käfige (IVCs).
2. Synthese von Silbernanopartikeln
ANMERKUNG: Die Herstellung von Silbernanopartikeln wurde bereits ausführlichbeschrieben 19. Der gesamte Formulierungsprozess wird auf Eis durchgeführt. Nach der Zubereitung wird das Gemisch bei 4 °C gelagert; Ansonsten verfestigt sich das Gemisch bei Raumtemperatur leicht.
- Geben Sie insgesamt 400 μl Kollagen Typ I (4 mg/ml) in ein 1,5 ml Mikrozentrifugenröhrchen und legen Sie es auf Eis.
- Geben Sie insgesamt 200 μl phosphatgepufferte Kochsalzlösung (PBS) zu dem oben genannten Kollagen, mischen Sie die Lösung gut und legen Sie sie auf Eis.
- Zum Schluss fügen Sie 400 μl Silbernanopartikel zu der obigen Lösung hinzu und mischen Sie dann ausreichend. Die Endkonzentration der Nanopartikellösung beträgt 1 mM.
HINWEIS: Der mittlere Durchmesser der Silbernanopartikel reicht von 5 nm bis 15 nm23. Dies wurde durch Elektronenmikroskopie bestätigt.
3. Silber-Nanopartikel-Behandlung von Typ-II-Kollagenase-induzierten KOA-Mäusen
- Entfernen Sie die Typ-II-Kollagenase-induzierten KOA-Mäuse 1 Woche später aus ihren Käfigen und injizieren Sie ihnen Silbernanopartikel. Injizieren Sie die Silbernanopartikel einmal pro Woche und sammeln Sie die Proben 30 Tage später.
- Injizieren Sie insgesamt 2 % Natrium-Pentobarbital (Dosis: 2 ml/kg) zur Anästhesie über eine intraperitoneale Injektion und fixieren Sie dann die Haut, bereiten Sie sie vor und sterilisieren Sie sie, wie in Schritt 1.2 beschrieben.
- Tragen Sie sterile Handschuhe und verwenden Sie eine sterile Schere, um die Haut, das Unterhautgewebe und die Kniebänder nacheinander freizulegen.
- Verwenden Sie eine 1-ml-Insulinspritze und führen Sie mit der Nadel in einem Winkel von 15° in die Gelenkhöhle ein. Injizieren Sie langsam etwa 20 μl der Silber-Nanopartikel-Kollagenmischung und ziehen Sie die Nadel24 langsam zurück.
- Das Unterhautgewebe und die Haut nacheinander vernähen und sterilisieren. Setzen Sie die Mäuse nach dem Aufwachen aus der Narkose separat in einzeln belüftete Käfige (IVC).
- Führen Sie diese Injektion der Silber-Nanopartikel-Kollagenmischung (20 μl) viermal in einer Häufigkeit von einmal pro Woche durch.
HINWEIS: Die Mäuse, die mit der Silber-Nanopartikel-Kollagenmischung behandelt wurden, sollten in Einzelkäfigen gehalten werden. Mäusekämpfe können auftreten, wenn sie zusammen gehalten werden, und dies würde die Versuchsergebnisse beeinträchtigen. Während der Injektion kommt es zu einem Spannungsgefühl, wenn die Nadel die Gelenkhöhle erreicht, und nach der Injektion kommt es zu einer Schwellung im Kniegelenk. Durch die Kombination dieser beiden Methoden kann der Forscher sicherstellen, dass das Medikament erfolgreich in das Kniegelenk injiziert wurde.
4. Entnahme des Kniegelenks und des Synovialgewebes
- Töten Sie die Mäuse mit Kohlendioxid-Erstickungsmittel oder einem anderen Protokoll, das von der zuständigen Tierethikkommission genehmigt wurde.
- Sterilisieren und sezieren Sie die Haut und das Unterhautgewebe nacheinander und legen Sie das Kniegelenk vollständig frei.
- Entnehmen Sie die Kniegelenke, einschließlich des Oberschenkelknochens und des Schienbeins, und entfernen Sie das Muskelgewebe.
- Sammeln Sie das Kniegelenksgewebe, einschließlich des Oberschenkelknochens, des Schienbeins und des umgebenden Weichgewebes (Band und Kapsula), in 10 % Formalin zur Konservierung und Fixierung.
5. Hämatoxylin-Eosin-Färbung
- Nach der nächtlichen Fixierung werden die Schnitte in Paraffin eingebettet und das in Paraffin eingebettete Gewebe mit einem Mikrotom in eine Dicke von 0,4 μm geschnitten. Verwenden Sie die vorbereiteten Schnitte für die weitere Färbung (Hämatoxylin-Eosin-Färbung, Safranin O/Fast Green und immunhistochemische (IHC) Färbung).
- Die Abschnitte werden zweimal mit Xylol entparaffiniert, nacheinander für jeweils 5 Minuten in 100 %, 95 %, 80 % und 70 % Ethanol eingeweicht und rehydriert.
- Die Abschnitte werden 5 Minuten lang mit Hämatoxylin (0,1 g/100 ml) gefärbt und dann 10 s lang direkt in 1 % HCl und 1 Minute lang in Eosin (0,5 g/100 ml) gegeben.
- Beobachten Sie die histopathologischen Veränderungen der Synovialis unter dem Mikroskop.
6. Safranin O/Fast Grün
- Betten Sie das Gewebe in Paraffin ein und bereiten Sie die histologischen Schnitte wie in Schritt 5.1 beschrieben vor.
- Entparaffinieren Sie die Abschnitte zweimal mit Xylol und rehydrieren Sie sie mit einer Ethanolreihe (z. B. 100 %, 95 %, 80 % und 70 % Ethanol in destilliertem Wasser, jeweils 5 Minuten lang).
- Färben Sie die vorbereiteten Abschnitte mit dem Hämatoxylin und waschen Sie sie dreimal mit PBS für jeweils 2 Minuten.
- Unterscheiden Sie die Abschnitte mit Salzsäurealkohol und waschen Sie sie dreimal für jeweils 2 Minuten mit PBS.
- Tauchen Sie die Schnitte 5-10 Minuten lang in eine 0,02%ige Fast-Green-Färbelösung, gefolgt von einer 0,1%igen Safranin-O-Färbung für 1-2 Minuten.
- Differenzieren Sie die Abschnitte mit 1%iger Essigsäure, gefolgt von PBS-Wäsche.
- Erkennen und analysieren Sie die Faserknorpelbildung in den Schnitten.
7. Immunhistochemische (IHC) Färbung
- Das Gewebe wird in Paraffin eingebettet und die histologischen Schnitte wie in Schritt 5.1 beschrieben vorbereitet.
- Entparaffinieren Sie die Abschnitte zweimal mit Xylol und rehydrieren Sie sie mit einer Ethanolreihe (z. B. 100 %, 95 %, 80 % und 70 % Ethanol in destilliertem Wasser, jeweils 5 Minuten lang). Tauchen Sie die Abschnitte in Tris-EDTA-Puffer (10 mM Tris-Base, 1 mM EDTA-Lösung; pH 9,0) und erhitzen Sie sie 10 Minuten lang in einem Mikrowellenherd bei 95 °C, um die Antigengewinnung durchzuführen.
- Die Abschnitte werden 10 Minuten lang einer 3%igen Wasserstoffperoxidlösung ausgesetzt, um die endogene Peroxidase zu entfernen.
- Behandeln Sie die Abschnitte mit 5% Ziegenserum, um eine unspezifische Bindung zu blockieren.
- Die verdünnten Primärantikörper (1:1.000 Verdünnung) gegen CD177 zugeben und über Nacht bei 4 °C inkubieren. Waschen Sie die Partien dann dreimal mit PBS.
- Tränken Sie die Schnitte mit PBS und inkubieren Sie die Schnitte mit dem entsprechenden Sekundärantikörper (HRP-konjugiertes Polymer-Anti-Kaninchen-System) für 30 Minuten bei Raumtemperatur.
- Führen Sie die Visualisierung der IHC-Färbung unter Verwendung von 3,3'-Diaminobenzidin (DAB) als Chromogen durch.
- Betrachten Sie die Schnitte unter einem Mikroskop und analysieren Sie die aufgenommenen Bilder.
Ergebnisse
Das KOA-Mausmodell wurde mittels Typ-II-Kollagenase induziert. Beginnend 1 Woche nach der Modellinduktion wurde die hergestellte Silber-Nanopartikel-Kollagenmischung 4 Wochen lang einmal pro Woche in die Gelenkhöhle injiziert (Abbildung 1). Die Gewichte der Mäuse in jeder Gruppe wurden täglich beobachtet und aufgezeichnet. Die Ergebnisse zeigten, dass das durchschnittliche Körpergewicht der KOA-Mäuse signifikant niedriger war als das der Mäuse in der normalen Kontrollgruppe. Das durchschnittliche Körpergewicht der Mäuse in der Typ-II-Kollagenase + AgNPs-Gruppe war jedoch höher als bei den KOA-Mäusen, obwohl dieser Unterschied statistisch nicht signifikant war (Abbildung 2). Nach 30 Tagen wurde den Mäusen das Synovialgewebe der Kniegelenke entnommen und einer pathologischen Untersuchung unterzogen. Die Hyperplasie, die vaskuläre Proliferation, die entzündliche Infiltration der Synovia und die Knorpelschädigung wurden analysiert 5,10,11. Die Ergebnisse zeigten, dass die Synovialdicke der Mäuse in der KOA-Gruppe im Vergleich zur normalen Kontrollgruppe signifikant höher war. In der Gruppe, die mit der Silber-Nanopartikel-Kollagenmischung behandelt wurde, war die Dicke der Synovialmembran im Vergleich zur KOA-Gruppe reduziert (Abbildung 3). Es gab eine vaskuläre Hyperplasie in der Synoviala der KOA-Mäuse im Vergleich zur normalen Kontrollgruppe, und die vaskuläre Hyperplasie war in der Synoviala der Mäuse, die mit der Silber-Nanopartikel-Kollagenmischung behandelt wurden, signifikant reduziert (Abbildung 4). Die Ergebnisse der Safranin-O-Färbung zeigten, dass die Knorpelmatrix von KOA-Mäusen zerstört war, während die Mäuse, die mit der Silber-Nanopartikel-Kollagenmischung behandelt wurden, eine signifikant bessere Knorpelmatrix aufwiesen (Abbildung 5). Die morphologischen Merkmalswerte in jeder Gruppe wurden wie zuvor beschriebenbewertet 22. Die Ergebnisse waren wie folgt: 0 ± 0 für die Kochsalzgruppe, 7 ± 0,63 für die Typ-II-Kollagengruppe und 4,2 ± 1,17 für die Typ-II-Kollagenase + AgNPs-Gruppe (Abbildung 6). CD177 ist ein wichtiger neutrophiler Marker25. CD177 wird unter normalen Bedingungen in 40%-60% der Neutrophilen exprimiert. Die Expression von CD177 in neutrophilen Granulozyten steigt jedoch während einer akuten Entzündung deutlich an. Die Ergebnisse der IHC-Färbung zeigten, dass die infiltrierten Neutrophilen in der Synovialregion in der Gruppe, die mit AgNPs behandelt wurde, im Vergleich zur KOA-Gruppe signifikant reduziert waren (Abbildung 7), was darauf hindeutet, dass die Behandlung mit AgNPs die Symptome von KOA verbessern könnte.
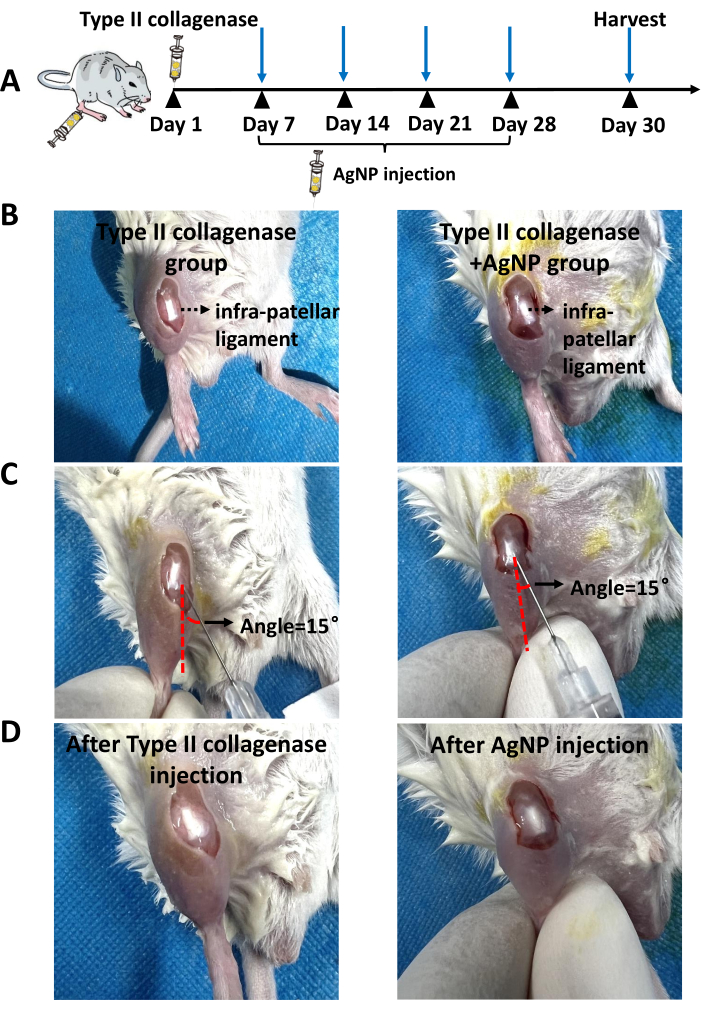
Abbildung 1: Injektionsstelle. (A) Repräsentative Bilder der Typ-II-Kollagenase-Injektion. (B) Repräsentative Bilder nach der Typ-II-Kollagenase-Injektion. (C) Repräsentative Bilder der Injektion einer Silber-Nanopartikel-Kollagenmischung im KOA-Mausmodell. (D) Repräsentative Bilder nach der Injektion einer Silber-Nanopartikel-Kollagenmischung in den KOA-Modellmäusen. Die rot gestrichelte Linie stellt die Linie dar, die parallel zu den Kniebändern der Maus verläuft. Der schwarze Pfeil stellt den Winkel zwischen der Insulinspritzennadel und der Haut dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Veränderungen des Körpergewichts der Mäuse in jeder Gruppe. Dieses Panel zeigt das durchschnittliche Gewicht der Mäuse in jeder Gruppe zu verschiedenen Zeitpunkten; Die x-Achse gibt die Anzahl der Tage nach der Injektion von Typ-II-Kollagenase an, und die y-Achse zeigt die Faltenänderung des Körpergewichts an. Kochsalzgruppe (n = 7), Kollagenasegruppe Typ II (n = 5), Kollagenase Typ II + AgNPs-Gruppe (n = 5). *p < 0,05. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Hämatoxylin-Eosin (H&E)-Färbung, die eine Synovialhyperplasie darstellt. Das Synovialgewebe in jeder Gruppe von Mäusen wurde 30 Tage nach der Operation gesammelt, fixiert, geschnitten und mit H&E gefärbt. Die Doppelpfeile stellen die detektierte Synovialdicke dar. Maßstabsleiste = 0,1 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Repräsentatives Bild der perisynovialen Gefäßhyperplasie. Die Pfeile zeigen die Gefäße an. Maßstabsleiste = 0,05 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Safranin-O-Färbung des Kniegelenks in jeder Gruppe von Mäusen. Maßstabsleiste = 0,2 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Morphologische Merkmalswerte in jeder Gruppe. Das Synovialgewebe wurde verwendet, um den morphologischen Merkmalswert für die Mäuse in jeder Gruppe zu messen. Fünf Gewebeschnitte in jeder Gruppe wurden ausgewählt, um den Grad der Hyperplasie/Vergrößerung der Zellschicht der Synovialschleimhaut, den Grad der Neutrophileninfiltration im Synovialgewebe und den Grad der Aktivierung des Synovialstromas zu analysieren (Tabelle 1). Als Endergebnis wurde der Durchschnittswert verwendet. **p < 0,01 und ***p < 0,001 mit einem Student's t-Test für jede Kohorte im Vergleich zur unbehandelten KOA-Gruppe. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7: Immunhistochemische Färbung eines neutrophilen Markers im Synovialgewebe in jeder Gruppe von Mäusen. Immunhistochemische Färbungen wurden verwendet, um die Expression des neutrophilen Markers CD177 im Synovialgewebe der Mäuse in jeder Gruppe nachzuweisen. Die Pfeile zeigen Neutrophile an. Maßstabsleiste = 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Tabelle 1: Scoring morphologischer Merkmale. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
Silbernanopartikel zeigen entzündungshemmende, antibakterielle, antioxidative und immunmodulatorische Wirkungen, was bedeutet, dass sie Zellen und Gewebe vor Schäden schützen könnten, indem sie die Produktion reaktiver Sauerstoffspezies reduzieren26. Einige Forscher sind besorgt über die Toxizität von Silbernanopartikeln27. Die Toxizität von Silbernanopartikeln steht in direktem Zusammenhang mit dem Vorhandensein von freien Silberionen. Aufgrund der nanoskaligen Größe von Silbernanopartikeln können sie Biomoleküle, Zellen und menschliche Organe leicht stören 15,28,29. Mehrere Studien haben berichtet, dass Silbernanopartikel oxidativen Stress induzieren und die mitochondriale Funktion in menschlichen Zellen beeinträchtigen können30. Darüber hinaus kann Ag in menschlichen Organen, insbesondere in Leber und Milz, nach dem Einsatz großer Mengen von Silbernanopartikeln nachgewiesen werden. Forscher haben auch berichtet, dass Silbernanopartikel die Fähigkeit haben, die Blut-Hirn-Schranke durch transsynaptischen Transport zu überwinden und sich im Gehirn anzureichern31. Ein systematischer Bericht über die Biotoxizität von Silbernanopartikeln wurde nicht erstellt, obwohl einige Forscher die Sicherheit von Silbernanopartikeln anerkennen32.
In dieser Studie haben wir eine Silber-Nanopartikel-Kollagenmischung hergestellt. In der Tat ist die Dauer von Silbernanopartikeln in menschlichem Gewebe kurz, aber die Dauer von Silbernanopartikeln kann verlängert werden, wenn sie mit einer Kollagenmischung aufgetragen werden. Dadurch wird nicht nur das Trauma, sondern auch die Dosis der Medikamente reduziert. In Anbetracht der Toxizität von Silbernanopartikeln betrug die Dosis der in dieser Studie verwendeten Silbernanopartikel 30 mg/kg, was mit früheren Untersuchungen übereinstimmt33.
Einige wichtige Überlegungen zum Versuchsbetrieb sind folgende. Typ-II-Kollagenase sollte nach der Zubereitung bei −20 °C gelagert werden, um einen Abbau durch enzymatische Spaltung zu verhindern. Die Herstellung der Silber-Nanopartikel-Kollagenmischung muss kontinuierlich auf dem Eis bei Raumtemperatur durchgeführt werden, da die Silber-Nanopartikel-Kollagenmischung schnell zu einem halbfesten Gel wird und dann nicht zur Injektion verwendet werden kann. Die Lösung sollte nach der Zubereitung bei 4 °C gelagert werden. Für die intraartikuläre Verabreichung sollte eine 1-ml-Insulinspritze mit einer kleineren Nadel gewählt werden, die das Auslaufen der injizierten Arzneimittel wirksam verhindern könnte. Die Nadel sollte in einem Winkel von 15° eingeführt werden, um die Silber-Nanopartikel-Kollagenmischung zu injizieren. Wenn die Nadel nicht widerstandsfähig ist, bedeutet dies, dass die Nadel die Kniegelenkshöhle erreicht hat. Nach der Injektion sollte der Winkel der Injektion geändert und die Nadel langsam zurückgezogen werden, um ein Auslaufen des injizierten Arzneimittels zu vermeiden.
In dieser Studie verbesserten Silbernanopartikel effektiv die Symptome der Typ-II-Kollagenase-induzierten KOA bei Mäusen und zeigten die entzündungshemmende Wirkung von Silbernanopartikeln. Mehrere Studien haben über das Vorhandensein von Apoptose in Zellen berichtet, die in vitro mit Silbernanopartikeln inkubiert wurden 34,35,36. Die Verringerung der Synovialhyperplasie könnte durch die Silbernanopartikel verursacht worden sein, da sie an der Beeinträchtigung der mitochondrialen Funktion beteiligt sind, oder diese Ergebnisse könnten durch reaktive Sauerstoffspezies vermittelt worden sein. Eine vaskuläre Hyperplasie wurde in der Synovialis von Mäusen in der KOA-Modellgruppe beobachtet. Es war möglich, dass Chemokine während dieses Prozesses Neutrophile aus den Blutgefäßen in das Synovialgewebe trieben und dass der Entzündungsschub dazu führte, dass die Zellen mehr Sauerstoff verbrauchten, was zu einer Gefäßhyperplasie führte. Daher sind weitere Experimente erforderlich, um die Zuverlässigkeit dieser Hypothese zu beweisen. Diese Studie liefert theoretische Vorteile für die Erforschung der Behandlung von klinischer KOA. In zukünftigen Studien wollen wir die Methode des vorderen Kreuzbandes (ACL) mit der chemisch induzierten KOA-Modellmethode kombinieren, um die Wirkung von Silbernanopartikeln zu beobachten. Die experimentellen Ergebnisse zeigen, dass Silbernanopartikel die Infiltration von Entzündungszellen in der Synovialis bei KOA-Mäusen signifikant verringern können, aber die Mechanismen dieses Effekts müssen noch weiter untersucht werden, um die Pathogenese von KOA zu entschlüsseln.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Diese Arbeit wurde von der Natural Science Foundation der Provinz Guangdong (Nummer: 2019A1515010209) und dem Science and Technology Project der Stadt Guangzhou, China (Nummer: 202102010164) finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| 1 mL insulin syringe | BD | 305932 | None |
| CD177 Polyclonal Antibody | ThermoFisher Scientific | PA5-98759 | None |
| Chloral hydrate | Sigma-Aldrich | 302-17-0 | None |
| DAB | MCE | HY-15912 | None |
| Eosin | Beyotime Biotechnology | C0109 | None |
| Formalin | Sigma-Aldrich | HT501128 | None |
| Hematoxylin | Beyotime Biotechnology | C0107 | None |
| Light Microscopy | Leica | DM500 | None |
| Silver nanoparticle | Wolcacvi | S-10-20 | Store product in the dark at 4°C |
| Safranine O-Fast Green FCF Cartilage Stain Kit | Solarbio | 90-15-3 | None |
| Type II collagen | Sigma-Aldrich | C6885-500mg | None |
Referenzen
- Kuyinu, E. L., Narayanan, G., Nair, L. S., Laurencin, C. T. Animal models of osteoarthritis: Classification, update, and measurement of outcomes. Journal of Orthopaedic Surgery and Research. 11, 19(2016).
- Kraus, V. B., Blanco, F. J., Englund, M., Karsdal, M. A., Lohmander, L. S. Call for standardized definitions of osteoarthritis and risk stratification for clinical trials and clinical use. Osteoarthritis and Cartilage. 23 (8), 1233-1241 (2015).
- Smith, M. D. The normal synovium. Open Rheumatology Journal. 5, 100-106 (2011).
- de Sousa, E. B., Casado, P. L., Moura, N. V., Duarte, M. E., Aguiar, D. P. Synovial fluid and synovial membrane mesenchymal stem cells: Latest discoveries and therapeutic perspectives. Stem Cell Research and Therapy. 5 (5), 112(2014).
- Scanzello, C. R., Goldring, S. R. The role of synovitis in osteoarthritis pathogenesis. Bone. 51 (2), 249-257 (2012).
- Glyn-Jones, S., et al. Osteoarthritis. Lancet. 386 (9991), 376-387 (2015).
- Roemer, F. W., et al. Presence of MRI-detected joint effusion and synovitis increases the risk of cartilage loss in knees without osteoarthritis at 30-month follow-up: The MOST study. Annals of Rheumatic Diseases. 70 (10), 1804-1809 (2011).
- Furman, B. D., et al. Articular ankle fracture results in increased synovitis, synovial macrophage infiltration, and synovial fluid concentrations of inflammatory cytokines and chemokines. Arthritis and Rheumatology. 67 (5), 1234-1239 (2015).
- Ayral, X., Pickering, E. H., Woodworth, T. G., Mackillop, N., Dougados, M. Synovitis: A potential predictive factor of structural progression of medial tibiofemoral knee osteoarthritis -- Results of a 1 year longitudinal arthroscopic study in 422 patients. Osteoarthritis and Cartilage. 13 (5), 361-367 (2005).
- Henrotin, Y., Lambert, C., Richette, P. Importance of synovitis in osteoarthritis: Evidence for the use of glycosaminoglycans against synovial inflammation. Seminars in Arthritis and Rheumatism. 43 (5), 579-587 (2014).
- Liu-Bryan, R. Synovium and the innate inflammatory network in osteoarthritis progression. Current Rheumatology Reports. 15 (5), 323(2013).
- Towheed, T., Shea, B., Wells, G., Hochberg, M. Analgesia and non-aspirin, non-steroidal anti-inflammatory drugs for osteoarthritis of the hip. Cochrane Database of Systematic Reviews. (2), (2000).
- Co, C. M., et al. Click chemistry-based pre-targeting cell delivery for cartilage regeneration. Regenerative Biomaterials. 8 (3), (2021).
- Oo, W. M., Liu, X., Hunter, D. J. Pharmacodynamics, efficacy, safety and administration of intra-articular therapies for knee osteoarthritis. Expert Opinion on Drug Metabolism and Toxicology. 15 (12), 1021-1032 (2019).
- Morozova, O. V. Silver nanostructures: Limited sensitivity of detection, toxicity and anti-inflammation effects. International Journal of Molecular Sciences. 22 (18), 9928(2021).
- He, M., et al. A pH-responsive mesoporous silica nanoparticles-based drug delivery system with controlled release of andrographolide for OA treatment. Regenerative Biomaterials. 8 (4), (2021).
- Samuel, M. S., Jose, S., Selvarajan, E., Mathimani, T., Pugazhendhi, A. Biosynthesized silver nanoparticles using Bacillus amyloliquefaciens; Application for cytotoxicity effect on A549 cell line and photocatalytic degradation of p-nitrophenol. Journal of Photochemistry and Photobiology B. 202, 111642(2020).
- Liu, X., et al. Silver nanoparticles mediate differential responses in keratinocytes and fibroblasts during skin wound healing. ChemMedChem. 5 (3), 468-475 (2010).
- Tian, J., et al. Topical delivery of silver nanoparticles promotes wound healing. ChemMedChem. 2 (1), 129-136 (2007).
- Vendidandala, N. R., et al. Gallocatechin-silver nanoparticle impregnated cotton gauze patches enhance wound healing in diabetic rats by suppressing oxidative stress and inflammation via modulating the Nrf2/HO-1 and TLR4/NF-kappaB pathways. Life Sciences. 286, 120019(2021).
- Kikuchi, T., Sakuta, T., Yamaguchi, T. Intra-articular injection of collagenase induces experimental osteoarthritis in mature rabbits. Osteoarthritis and Cartilage. 6 (3), 177-186 (1998).
- Lorenz, J., Grässel, S. Experimental osteoarthritis models in mice. Methods in Molecular Biology. 1194, 401-419 (2014).
- Zhao, Z., et al. Design and synthesis of Ag NPs/chitosan-starch nano-biocomposite as a modern anti-human malignant melanoma drug. International Journal of Biological Macromolecules. 236, 123823(2023).
- Ahmed, E., et al. Decellularized extracellular matrix-rich hydrogel-silver nanoparticle mixture as a potential treatment for acute liver failure model. Journal of Biomedical Materials Research Part A. 108 (12), 2351-2367 (2020).
- Bai, M., et al. CD177 modulates human neutrophil migration through activation-mediated integrin and chemoreceptor regulation. Blood. 130 (19), 2092-2100 (2017).
- Singh, D., Chaudhary, D., Kumar, V., Verma, A. Amelioration of diethylnitrosamine (DEN) induced renal oxidative stress and inflammation by Carissa carandas embedded silver nanoparticles in rodents. Toxicology Reports. 8, 636-645 (2021).
- Singh, N., et al. NanoGenotoxicology: The DNA damaging potential of engineered nanomaterials. Biomaterials. 30 (23-24), 3891-3914 (2009).
- Noronha, V. T., et al. Silver nanoparticles in dentistry. Dental Materials. 33 (10), 1110-1126 (2017).
- Ahamed, M., Alsalhi, M. S., Siddiqui, M. K. Silver nanoparticle applications and human health. Clinica Chimica Acta. 411 (23-24), 1841-1848 (2010).
- Palacios-Hernandez, T., et al. cellular uptake and apoptotic responses in human coronary artery endothelial cells exposed to ultrasmall superparamagnetic iron oxide nanoparticles. Journal of Applied Toxicology. 40 (7), 918-930 (2020).
- Lebda, M. A., et al. Potential role of alpha-lipoic acid and Ginkgo biloba against silver nanoparticles-induced neuronal apoptosis and blood-brain barrier impairments in rats. Life Sciences. 212, 251-260 (2018).
- Yin, I. X., et al. The antibacterial mechanism of silver nanoparticles and its application in dentistry. International Journal of Nanomedicine. 15, 2555-2562 (2020).
- Kim, Y. S., et al. Subchronic oral toxicity of silver nanoparticles. Particle and Fibre Toxicology. 7, 20(2010).
- Pascarelli, N. A., et al. Effects of gold and silver nanoparticles in cultured human osteoarthritic chondrocytes. Journal of Applied Toxicology. 33 (12), 1506-1513 (2013).
- Braydich-Stolle, L. K., et al. Silver nanoparticles disrupt GDNF/Fyn kinase signaling in spermatogonial stem cells. Toxicological Sciences. 116 (2), 577-589 (2010).
- Eom, H. J., Choi, J. p38 MAPK activation, DNA damage, cell cycle arrest and apoptosis as mechanisms of toxicity of silver nanoparticles in Jurkat T cells. Environmental Science and Technology. 44 (21), 8337-8342 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten