Method Article
Améliorer l’arthrose chez la souris à l’aide de nanoparticules d’argent
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Voici un protocole d’utilisation de nanoparticules d’argent pour améliorer efficacement les symptômes aigus des souris arthrosiques induites par la collagénase de type II, notamment l’inflammation synoviale, l’hyperplasie synoviale, l’hyperplasie vasculaire, etc.
Résumé
L’arthrose du genou (KOA) est l’une des maladies dégénératives des articulations les plus fréquemment rencontrées chez les personnes de plus de 45 ans. À l’heure actuelle, il n’existe aucun traitement efficace pour le KOA, et la seule stratégie de point final est l’arthroplastie totale du genou (ATG) ; par conséquent, le KOA est associé à des fardeaux économiques et à des coûts sociétaux. La réponse inflammatoire immunitaire est impliquée dans l’apparition et le développement de KOA. Nous avons précédemment établi un modèle murin de KOA en utilisant du collagène de type II. Une hyperplasie du tissu synovial était présente dans le modèle, ainsi qu’un grand nombre de cellules inflammatoires infiltrées. Les nanoparticules d’argent ont des effets anti-inflammatoires substantiels et ont été largement utilisées dans le traitement des tumeurs et l’administration de médicaments chirurgicaux. Par conséquent, nous avons évalué les effets thérapeutiques des nanoparticules d’argent dans un modèle KOA induit par la collagénase II. Les résultats expérimentaux ont montré que les nanoparticules d’argent réduisaient significativement l’hyperplasie synoviale et l’infiltration de neutrophiles dans le tissu synovial. Par conséquent, ce travail démontre l’identification d’une nouvelle stratégie pour l’arthrose et fournit une base théorique pour prévenir la progression de l’AOC.
Introduction
L’arthrose du genou (KOA) est l’une des formes les plus fréquentes d’arthrose et implique un processus pathologique complexe dans l’ensemble de l’articulation synoviale1. Alors que la population mondiale vieillit progressivement, l’incidence de l’AOC augmente considérablement. Une douleur constante dans l’articulation du genou incite généralement les patients atteints de KOA à consulter un médecin. L’étiologie de la douleur dans KOA peut être liée à la réponse inflammatoire, à l’hyperplasie synoviale et à la dégénérescence du cartilage2. Les tissus synoviaux sont composés de deux types de cellules : les fibroblastes synoviaux et les macrophages 3,4,5. Les fibroblastes synoviaux produisent du liquide synovial. Les macrophages synoviaux sont normalement dormants et sont activés par la réponse inflammatoire. L’inflammation initiale de la synoviale provoque des douleurs articulaires du genou6.
La réponse immunitaire inflammatoire du tissu synovial joue un rôle crucial dans la pathogenèse du KOA. Des études antérieures ont confirmé qu’il existe des réponses inflammatoires dans les tissus synoviaux dans le KOA, connues sous le nom de synovite, et le degré de synovite du KOA est étroitement lié à l’infiltration cellulaire inflammatoire des tissus synovaux 7,8,9. La synovite est une réaction inflammatoire de la synoviale et ses caractéristiques pathologiques sont la prolifération des cellules synoviales, la formation de nouveaux vaisseaux et l’infiltration de cellules inflammatoires 5,10,11.
L’objectif du traitement KOA est de soulager la réaction inflammatoire de la synoviale et de retarder la progression de la maladie. À l’heure actuelle, les principaux médicaments cliniques pour le traitement de la KOA sont les anti-inflammatoires non stéroïdiens (AINS) ; Cependant, ils présentent des effets secondaires importants, tels que la néphrotoxicité12,13. Les injections intra-articulaires de glucocorticoïdes sont une autre option pour traiter le KOA ; Cependant, le glucocorticoïde se propage rapidement et pourrait être rapidement métabolisé par l’épanchement articulaire. Pendant ce temps, les patients diabétiques présentant une hyperglycémie sous-jacente doivent être prudents quant aux injections de stéroïdes en cours14. En résumé, il n’existe pas de stratégie thérapeutique médicamenteuse pour le KOA. Par conséquent, l’exploration de nouveaux médicaments pour le traitement du KOA est extrêmement urgente.
La taille des nanoparticules d’argent est inférieure à 100 nm. En raison de leurs effets anti-inflammatoires, antibactériens et antioxydants importants, ils ont été largement utilisés dans divers aspects des soins de santé et de la médecine, tels que la cicatrisation des plaies et les brûlures15,16. Ils sont également utilisés dans l’administration ciblée de médicaments, l’imagerie médicale et le diagnostic moléculaire17. L’argent (Ag) a une action anti-inflammatoire et antibactérienne plus importante que d’autres nanoparticules métalliques, telles que le cuivre (Cu), le zinc (Zn) et le fer (Fe)15. Les nanoparticules d’argent, un nouveau type de nanomatériau, ont des propriétés antimicrobiennes puissantes et à large spectre. Une étude antérieure a révélé que dansles modèles de brûlures et de péritonite, les nanoparticules d’argent pouvaient inhiber efficacement la production de facteurs inflammatoires et favoriser la cicatrisation des plaies. Une étude antérieure a également démontré que les nanoparticules d’argent amélioraient la cicatrisation des plaies diabétiques en favorisant la synthèse des facteurs de croissance et le dépôt de collagène20.
Sur la base des effets anti-inflammatoires des nanoparticules d’argent, nous avons cherché à utiliser des nanoparticules d’argent pour traiter le KOA induit par le collagène de type II chez la souris. Les résultats ont suggéré que le nombre de cellules d’infiltration inflammatoires de l’articulation synoviale chez la souris était significativement réduit avec ce traitement. Les résultats ont également suggéré que les nanoparticules d’argent pourraient soulager de manière significative les symptômes du KOA chez la souris. Par conséquent, l’application de nanoparticules d’argent peut soutenir le développement de nouvelles options de traitement pour le KOA clinique.
Protocole
Tous les travaux sur les animaux ont été approuvés par le Comité d’éthique et de bien-être des animaux (AEWC) du Guangzhou Forevergen Medical Laboratory Animal Center (2018-0186).
1. Mise en place du modèle de souris KOA
- Maintenir les souris BALB/c (18-24 g ; 12-14 semaines) dans un environnement avec 70% d’humidité et à 26 °C avec un cycle lumière/obscurité de 12 h. Pour cette expérience, les animaux ont été gardés dans le centre animalier de laboratoire médical Guangzhou Forevergen.
- Utilisez du collagène de type II pour établir un modèle de souris KOA comme décrit précédemment21. Effectuez l’injection intra-articulaire comme décrit ci-dessous.
- Appliquer du pentobarbital de sodium à 2 % (40 mg/kg) pour l’anesthésie et de la buprénorphine (0,05 mg/kg, injection sous-cutanée) pour l’analgésie. Ensuite, fixez les membres de la souris avec le ruban adhésif, enlevez les poils avec le rasoir et désinfectez avec un gommage alterné d’iodophor à 0,1% et d’alcool trois fois.
- Portez des gants stériles et utilisez des ciseaux stériles pour exposer séquentiellement la peau, le tissu sous-cutané et le ligament sous-patellaire. Gardez la zone d’incision en dessous de 0,5 cm.
REMARQUE : Une couverture chauffante a été utilisée pour maintenir la température corporelle des souris pendant l’opération. - À l’aide d’une seringue à insuline de 1 mL, injecter 10 U de collagénase de type II à 30 mg/kg (0,4 mg/mL) dans la cavité articulaire (sous le ligament sous-patellaire)22.
REMARQUE : L’angle entre l’aiguille et la peau doit être d’environ 15° ; Ensuite, la direction de l’aiguille doit être changée et l’aiguille doit être retirée complètement. - Après l’injection, suturez d’abord le tissu sous-cutané, puis la peau. Stérilisez la zone de suture avec de l’iodophore à 0,1 %. Placez les souris dans les cages ventilées individuellement (IVC) séparément après leur réveil de l’anesthésie.
2. Synthèse de nanoparticules d’argent
REMARQUE : La préparation des nanoparticules d’argent a été décrite précédemment en détail19. L’ensemble du processus de formulation est réalisé sur glace. Après préparation, le mélange est conservé à 4 °C ; sinon, le mélange se solidifie facilement à température ambiante.
- Ajouter un total de 400 μL de collagène de type I (4 mg/mL) dans un tube de microcentrifugation de 1,5 mL et placer sur de la glace.
- Ajoutez un total de 200 μL de solution saline tamponnée au phosphate (PBS) au collagène ci-dessus, mélangez bien la solution et placez-la sur de la glace.
- Enfin, ajoutez 400 μL de nanoparticules d’argent à la solution ci-dessus, puis mélangez suffisamment. La concentration finale de la solution nanoparticulaire est de 1 mM.
REMARQUE : Le diamètre moyen des nanoparticules d’argent varie de 5 nm à 15 nm23. Cela a été confirmé par microscopie électronique.
3. Traitement aux nanoparticules d’argent des souris KOA induites par la collagénase de type II
- Retirez les souris KOA induites par la collagénase de type II de leurs cages 1 semaine plus tard et injectez-leur des nanoparticules d’argent. Injectez les nanoparticules d’argent une fois par semaine et collectez les échantillons 30 jours plus tard.
- Injecter un total de pentobarbital de sodium à 2 % (dose : 2 mL/kg) pour l’anesthésie par injection intrapéritonéale, puis fixer, préparer la peau et stériliser comme décrit aux étapes 1.2.
- Portez des gants stériles et utilisez des ciseaux stériles pour exposer séquentiellement la peau, le tissu sous-cutané et les ligaments du genou.
- Utilisez une seringue à insuline de 1 ml et entrez dans la cavité articulaire à un angle de 15° avec l’aiguille. Injectez lentement environ 20 μL du mélange de collagène à nanoparticules d’argent et retirez lentement l’aiguille24.
- Suturez le tissu sous-cutané et la peau à tour de rôle, et stérilisez. Placez les souris dans des cages ventilées individuellement (IVC) séparément après leur réveil de l’anesthésie.
- Effectuez cette injection du mélange de collagène de nanoparticules d’argent (20 μL) quatre fois à une fréquence d’une fois par semaine.
REMARQUE : Les souris traitées avec le mélange de collagène de nanoparticules d’argent doivent être gardées dans des cages individuelles. Les souris peuvent se battre lorsqu’elles sont maintenues ensemble, ce qui affecterait les résultats expérimentaux. Pendant l’injection, il y aura une sensation de tension lorsque l’aiguille atteindra la cavité articulaire, et un gonflement se produira dans l’articulation du genou après l’injection. La combinaison de ces deux méthodes permet au chercheur de s’assurer que le médicament a été injecté avec succès dans l’articulation du genou.
4. Prélèvement de l’articulation du genou et du tissu synovial
- Sacrifiez les souris avec une asphyxie au dioxyde de carbone ou tout autre protocole approuvé par le comité d’éthique animale compétent.
- Stérilisez et disséquez la peau et le tissu sous-cutané de manière séquentielle et exposez complètement l’articulation du genou.
- Prélevez les articulations du genou, y compris le fémur et le tibia, et retirez les tissus musculaires.
- Prélever les tissus articulaires du genou, y compris le fémur, le tibia et les tissus mous environnants (ligament et capsule), dans du formol à 10 % pour la conservation et la fixation.
5. Coloration à l’hématoxyline-éosine
- Après la fixation pendant la nuit, enrobez les sections de paraffine et utilisez un microtome pour couper le tissu enrobé de paraffine en 0,4 μm d’épaisseur. Utilisez les sections préparées pour une coloration ultérieure (coloration à l’hématoxyline-éosine, Safranin O/Fast Green et coloration immunohistochimique (IHC)).
- Déparaffinez les sections deux fois avec du xylène, faites-les tremper dans de l’éthanol à 100 %, 95 %, 80 % et 70 % en séquence pendant 5 minutes chacune, puis réhydratez-les.
- Colorer les sections avec de l’hématoxyline (0,1 g/100 mL) pendant 5 min, puis placer directement dans du HCl à 1 % pendant 10 s et de l’éosine (0,5 g/100 mL) pendant 1 min.
- Observer les changements histopathologiques de la synoviale au microscope.
6. Safranin O/Fast Green
- Incorporez le tissu dans de la paraffine et préparez les coupes histologiques comme décrit à l’étape 5.1.
- Déparaffinez les sections deux fois avec du xylène et réhydratez-les avec une série d’éthanol (par exemple, de l’éthanol à 100 %, 95 %, 80 % et 70 % dans de l’eau distillée, chacune pendant 5 minutes).
- Teindre les sections préparées avec l’hématoxyline et les laver avec du PBS trois fois pendant 2 min chacune.
- Différenciez les sections avec de l’alcool d’acide chlorhydrique et lavez-les avec du PBS trois fois pendant 2 min chacune.
- Immergez les sections dans une solution de coloration Fast Green à 0,02 % pendant 5 à 10 minutes, suivie d’une coloration à 0,1 % de safranine O pendant 1 à 2 minutes.
- Différenciez les sections avec de l’acide acétique à 1 %, suivi d’un lavage au PBS.
- Détecter et analyser la formation de fibrocartilage dans les sections.
7. Coloration immunohistochimique (IHC)
- Incorporez le tissu dans de la paraffine et préparez les coupes histologiques comme décrit à l’étape 5.1.
- Déparaffinez les sections deux fois avec du xylène et réhydratez-les avec une série d’éthanol (par exemple, de l’éthanol à 100 %, 95 %, 80 % et 70 % dans de l’eau distillée, chacune pendant 5 minutes). Plonger les lames dans un tampon Tris-EDTA (10 mM de base Tris, 1 mM de solution EDTA ; pH 9,0) et chauffer dans un four à micro-ondes à 95 °C pendant 10 min pour effectuer le prélèvement de l’antigène.
- Exposez les sections à une solution de peroxyde d’hydrogène à 3 % pendant 10 minutes pour éliminer la peroxydase endogène.
- Traitez les sections avec 5% de sérum de chèvre pour bloquer la liaison non spécifique.
- Ajouter les anticorps primaires dilués (dilution 1 :1 000) contre CD177 et incuber pendant la nuit à 4 °C. Ensuite, lavez les sections avec du PBS trois fois.
- Trempez les sections avec du PBS et incubez les sections avec l’anticorps secondaire approprié (système anti-lapin polymère conjugué HRP) pendant 30 minutes à température ambiante.
- Effectuez la visualisation de la coloration IHC en utilisant la 3,3'-diaminobenzidine (DAB) comme chromogène.
- Visualisez les coupes au microscope et analysez les images acquises.
Résultats
Le modèle murin KOA a été induit à l’aide de la collagénase de type II. À partir d’une semaine après l’induction du modèle, le mélange de collagène de nanoparticules d’argent préparé a été injecté dans la cavité articulaire une fois par semaine pendant 4 semaines (Figure 1). Les poids des souris de chaque groupe ont été observés et enregistrés quotidiennement. Les résultats ont montré que le poids corporel moyen des souris KOA était significativement inférieur à celui des souris du groupe témoin normal. Cependant, le poids corporel moyen des souris du groupe collagénase de type II + AgNPs était plus élevé que celui des souris KOA, bien que cette différence ne soit pas statistiquement significative (Figure 2). Après 30 jours, les tissus synoviaux des articulations du genou ont été prélevés sur les souris et soumis à un examen pathologique. L’hyperplasie, la prolifération vasculaire, l’infiltration inflammatoire de la synoviale et les lésions cartilagineuses ont été analysées 5,10,11. Les résultats ont montré que l’épaisseur synoviale des souris du groupe KOA était significativement plus élevée que celle du groupe témoin normal. Dans le groupe traité avec le mélange de collagène nanoparticulaire d’argent, l’épaisseur de la membrane synoviale a été réduite par rapport au groupe KOA (Figure 3). Il y avait une hyperplasie vasculaire dans la synoviale des souris KOA par rapport au groupe témoin normal, et l’hyperplasie vasculaire a été significativement réduite dans la synoviale des souris traitées avec le mélange de collagène de nanoparticules d’argent (Figure 4). Les résultats de la coloration Safranin-O ont montré que la matrice cartilagineuse des souris KOA était détruite, tandis que les souris traitées avec le mélange de collagène à nanoparticules d’argent présentaient une matrice cartilagineuse significativement meilleure (Figure 5). Les scores des caractéristiques morphologiques dans chaque groupe ont été évalués comme décrit précédemment22. Les résultats étaient les suivants : 0 ± 0 pour le groupe salin, 7 ± 0,63 pour le groupe collagène de type II et 4,2 ± 1,17 pour le groupe collagénase de type II + AgNPs (Figure 6). CD177 est un marqueur majeur des neutrophiles25. Le CD177 est exprimé dans 40 à 60 % des neutrophiles dans des conditions normales. Cependant, l’expression de CD177 dans les neutrophiles augmente de manière significative au cours de l’inflammation aiguë. Les résultats de la coloration IHC ont démontré que les neutrophiles infiltrés dans la région synoviale étaient significativement réduits dans le groupe traité avec des AgNPs par rapport au groupe KOA (Figure 7), ce qui suggère que le traitement par AgNPs pourrait améliorer les symptômes de KOA.
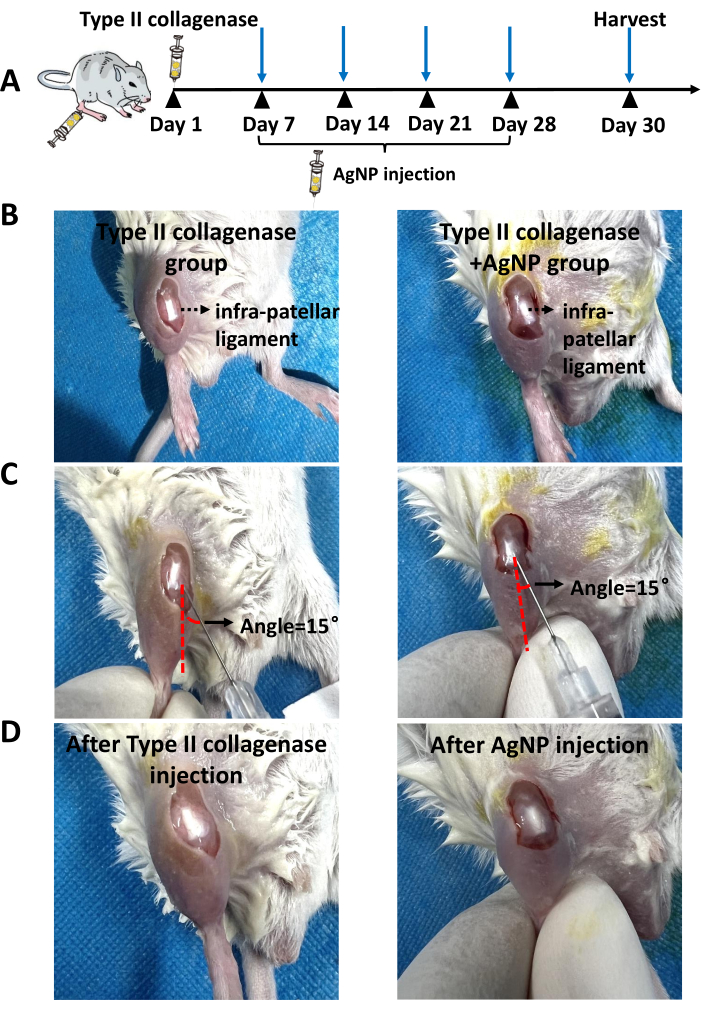
Figure 1 : Emplacement de l’injection. (A) Images représentatives de l’injection de collagénase de type II. (B) Images représentatives après l’injection de collagénase de type II. (C) Images représentatives de l’injection du mélange de collagène nanoparticulaire d’argent dans le modèle murin KOA. (D) Images représentatives après l’injection du mélange de collagène nanoparticulaire d’argent chez les souris modèles KOA. La ligne pointillée rouge représente la ligne parallèle aux ligaments du genou de la souris. La flèche noire représente l’angle entre l’aiguille de la seringue à insuline et la peau. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Changements de poids corporel des souris dans chaque groupe. Ce panneau montre le poids moyen des souris dans chaque groupe à différents moments ; l’axe des abscisses indique le nombre de jours après l’injection de collagénase de type II, et l’axe des ordonnées indique le changement de pli du poids corporel. Groupe salin (n = 7), groupe collagénase de type II (n = 5), groupe collagénase de type II + AgNPs (n = 5). *p < 0,05. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Coloration de l’hématoxyline-éosine (H&E) représentant l’hyperplasie synoviale. Les tissus synoviaux de chaque groupe de souris ont été collectés, fixés, sectionnés et colorés avec H&E 30 jours après la chirurgie. Les doubles flèches représentent l’épaisseur synoviale détectée. Barre d’échelle = 0,1 mm. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Image représentative de l’hyperplasie vasculaire périsynoviale. Les flèches indiquent les navires. Barre d’échelle = 0,05 mm. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Coloration à la safranine-O de l’articulation du genou chez chaque groupe de souris. Barre d’échelle = 0,2 mm. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Scores des caractéristiques morphologiques dans chaque groupe. Le tissu synovial a été utilisé pour mesurer le score des caractéristiques morphologiques des souris de chaque groupe. Cinq coupes de tissu dans chaque groupe ont été sélectionnées pour analyser le degré d’hyperplasie / élargissement de la couche cellulaire de la muqueuse synoviale, le degré d’infiltration des neutrophiles dans le tissu synovial et le degré d’activation du stroma synovial (tableau 1). La valeur moyenne a été utilisée comme note finale. **p < 0,01 et ***p < 0,001 avec un test t de Student pour chaque cohorte par rapport au groupe KOA non traité. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 7 : Coloration immunohistochimique d’un marqueur neutrophile dans le tissu synovial chez chaque groupe de souris. La coloration immunohistochimique a été utilisée pour détecter l’expression du marqueur neutrophile CD177 dans le tissu synovial des souris de chaque groupe. Les flèches indiquent les neutrophiles. Barre d’échelle = 100 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1 : Notation des caractéristiques morphologiques. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
Les nanoparticules d’argent présentent des effets anti-inflammatoires, antibactériens, antioxydants et immunomodulateurs, ce qui signifie qu’elles pourraient protéger les cellules et les tissus contre les dommages en réduisant la production d’espèces réactives de l’oxygène26. Certains chercheurs s’inquiètent de la toxicité des nanoparticules d’argent27. La toxicité des nanoparticules d’argent est directement liée à la présence d’ions d’argent libres. En raison de la taille nanométrique des nanoparticules d’argent, elles pourraient facilement interférer avec les biomolécules, les cellules et les organes humains 15,28,29. Plusieurs études ont rapporté que les nanoparticules d’argent pourraient induire un stress oxydatif et altérer la fonction mitochondriale dans les cellules humaines30. De plus, l’Ag peut être détecté dans les organes humains, en particulier dans le foie et la rate, après l’utilisation de grandes quantités de nanoparticules d’argent. Les chercheurs ont également rapporté que les nanoparticules d’argent ont la capacité de traverser la barrière hémato-encéphalique via le transport transsynaptique et de s’accumuler dans le cerveau31. Un rapport systématique sur la biotoxicité des nanoparticules d’argent n’a pas été réalisé, bien que certains chercheurs reconnaissent l’innocuité des nanoparticules d’argent32.
Dans cette étude, nous avons préparé un mélange de collagène de nanoparticules d’argent. En effet, la durée des nanoparticules d’argent dans les tissus humains est brève, mais la durée des nanoparticules d’argent peut être prolongée lorsqu’elles sont appliquées avec un mélange de collagène ; Cela réduit non seulement le traumatisme, mais aussi la dose de médicaments. Compte tenu de la toxicité des nanoparticules d’argent, la dose de nanoparticules d’argent appliquée dans cette étude était de 30 mg/kg, conformément aux recherches antérieures33.
Voici quelques considérations essentielles de l’opération expérimentale. La collagénase de type II doit être conservée à −20 °C après la préparation pour éviter la dégradation due au clivage enzymatique. La préparation du mélange de collagène de nanoparticules d’argent doit être effectuée sur la glace en continu à température ambiante car le mélange de collagène de nanoparticules d’argent devient rapidement un gel semi-solide et ne peut alors pas être utilisé pour l’injection. La solution doit être conservée à 4 °C après préparation. Une seringue à insuline de 1 mL munie d’une aiguille plus petite doit être choisie pour l’administration intra-articulaire, ce qui pourrait prévenir efficacement la fuite des médicaments injectés. L’aiguille doit être insérée à un angle de 15° pour injecter le mélange de collagène de nanoparticules d’argent. Lorsque l’aiguille n’est pas résistante, cela indique que l’aiguille a atteint la cavité articulaire du genou. Après l’injection, l’angle d’injection doit être modifié et l’aiguille doit être retirée lentement pour éviter les fuites du médicament injecté.
Dans cette étude, les nanoparticules d’argent ont efficacement amélioré les symptômes du KOA induit par la collagénase de type II chez la souris, démontrant l’effet anti-inflammatoire des nanoparticules d’argent. Plusieurs études ont rapporté la présence d’apoptose dans des cellules incubées in vitro avec des nanoparticules d’argent 34,35,36. La réduction de l’hyperplasie synoviale pourrait avoir été causée par les nanoparticules d’argent en raison de leur implication dans l’altération de la fonction mitochondriale, ou ces résultats peuvent avoir été médiés par des espèces réactives de l’oxygène. Une hyperplasie vasculaire a été observée dans la synoviale des souris du groupe modèle KOA. Il était possible que les chimiokines aient conduit les neutrophiles des vaisseaux sanguins vers le tissu synovial au cours de ce processus et que l’explosion d’inflammation ait amené les cellules à consommer plus d’oxygène, conduisant ainsi à une hyperplasie vasculaire. Par conséquent, d’autres expériences sont nécessaires pour prouver la fiabilité de cette hypothèse. Cette étude apporte des avantages théoriques à la recherche sur le traitement de la KOA clinique. Dans de futures études, nous visons à combiner la méthode du ligament croisé antérieur (LCA) avec la méthode du modèle KOA induit chimiquement pour observer l’effet des nanoparticules d’argent. Les résultats expérimentaux montrent que les nanoparticules d’argent peuvent diminuer de manière significative l’infiltration des cellules inflammatoires dans la synoviale chez les souris KOA, mais les mécanismes de cet effet doivent encore faire l’objet d’études plus approfondies, ce qui pourrait démêler la pathogenèse de KOA.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Ces travaux ont été financés par la Fondation des sciences naturelles de la province du Guangdong (numéro : 2019A1515010209) et le projet scientifique et technologique de la ville de Guangzhou, en Chine (numéro : 202102010164).
matériels
| Name | Company | Catalog Number | Comments |
| 1 mL insulin syringe | BD | 305932 | None |
| CD177 Polyclonal Antibody | ThermoFisher Scientific | PA5-98759 | None |
| Chloral hydrate | Sigma-Aldrich | 302-17-0 | None |
| DAB | MCE | HY-15912 | None |
| Eosin | Beyotime Biotechnology | C0109 | None |
| Formalin | Sigma-Aldrich | HT501128 | None |
| Hematoxylin | Beyotime Biotechnology | C0107 | None |
| Light Microscopy | Leica | DM500 | None |
| Silver nanoparticle | Wolcacvi | S-10-20 | Store product in the dark at 4°C |
| Safranine O-Fast Green FCF Cartilage Stain Kit | Solarbio | 90-15-3 | None |
| Type II collagen | Sigma-Aldrich | C6885-500mg | None |
Références
- Kuyinu, E. L., Narayanan, G., Nair, L. S., Laurencin, C. T. Animal models of osteoarthritis: Classification, update, and measurement of outcomes. Journal of Orthopaedic Surgery and Research. 11, 19 (2016).
- Kraus, V. B., Blanco, F. J., Englund, M., Karsdal, M. A., Lohmander, L. S. Call for standardized definitions of osteoarthritis and risk stratification for clinical trials and clinical use. Osteoarthritis and Cartilage. 23 (8), 1233-1241 (2015).
- Smith, M. D. The normal synovium. Open Rheumatology Journal. 5, 100-106 (2011).
- de Sousa, E. B., Casado, P. L., Moura, N. V., Duarte, M. E., Aguiar, D. P. Synovial fluid and synovial membrane mesenchymal stem cells: Latest discoveries and therapeutic perspectives. Stem Cell Research and Therapy. 5 (5), 112 (2014).
- Scanzello, C. R., Goldring, S. R. The role of synovitis in osteoarthritis pathogenesis. Bone. 51 (2), 249-257 (2012).
- Glyn-Jones, S., et al. Osteoarthritis. Lancet. 386 (9991), 376-387 (2015).
- Roemer, F. W., et al. Presence of MRI-detected joint effusion and synovitis increases the risk of cartilage loss in knees without osteoarthritis at 30-month follow-up: The MOST study. Annals of Rheumatic Diseases. 70 (10), 1804-1809 (2011).
- Furman, B. D., et al. Articular ankle fracture results in increased synovitis, synovial macrophage infiltration, and synovial fluid concentrations of inflammatory cytokines and chemokines. Arthritis and Rheumatology. 67 (5), 1234-1239 (2015).
- Ayral, X., Pickering, E. H., Woodworth, T. G., Mackillop, N., Dougados, M. Synovitis: A potential predictive factor of structural progression of medial tibiofemoral knee osteoarthritis -- Results of a 1 year longitudinal arthroscopic study in 422 patients. Osteoarthritis and Cartilage. 13 (5), 361-367 (2005).
- Henrotin, Y., Lambert, C., Richette, P. Importance of synovitis in osteoarthritis: Evidence for the use of glycosaminoglycans against synovial inflammation. Seminars in Arthritis and Rheumatism. 43 (5), 579-587 (2014).
- Liu-Bryan, R. Synovium and the innate inflammatory network in osteoarthritis progression. Current Rheumatology Reports. 15 (5), 323 (2013).
- Towheed, T., Shea, B., Wells, G., Hochberg, M. Analgesia and non-aspirin, non-steroidal anti-inflammatory drugs for osteoarthritis of the hip. Cochrane Database of Systematic Reviews. (2), (2000).
- Co, C. M., et al. Click chemistry-based pre-targeting cell delivery for cartilage regeneration. Regenerative Biomaterials. 8 (3), (2021).
- Oo, W. M., Liu, X., Hunter, D. J. Pharmacodynamics, efficacy, safety and administration of intra-articular therapies for knee osteoarthritis. Expert Opinion on Drug Metabolism and Toxicology. 15 (12), 1021-1032 (2019).
- Morozova, O. V. Silver nanostructures: Limited sensitivity of detection, toxicity and anti-inflammation effects. International Journal of Molecular Sciences. 22 (18), 9928 (2021).
- He, M., et al. A pH-responsive mesoporous silica nanoparticles-based drug delivery system with controlled release of andrographolide for OA treatment. Regenerative Biomaterials. 8 (4), (2021).
- Samuel, M. S., Jose, S., Selvarajan, E., Mathimani, T., Pugazhendhi, A. Biosynthesized silver nanoparticles using Bacillus amyloliquefaciens; Application for cytotoxicity effect on A549 cell line and photocatalytic degradation of p-nitrophenol. Journal of Photochemistry and Photobiology B. 202, 111642 (2020).
- Liu, X., et al. Silver nanoparticles mediate differential responses in keratinocytes and fibroblasts during skin wound healing. ChemMedChem. 5 (3), 468-475 (2010).
- Tian, J., et al. Topical delivery of silver nanoparticles promotes wound healing. ChemMedChem. 2 (1), 129-136 (2007).
- Vendidandala, N. R., et al. Gallocatechin-silver nanoparticle impregnated cotton gauze patches enhance wound healing in diabetic rats by suppressing oxidative stress and inflammation via modulating the Nrf2/HO-1 and TLR4/NF-kappaB pathways. Life Sciences. 286, 120019 (2021).
- Kikuchi, T., Sakuta, T., Yamaguchi, T. Intra-articular injection of collagenase induces experimental osteoarthritis in mature rabbits. Osteoarthritis and Cartilage. 6 (3), 177-186 (1998).
- Lorenz, J., Grässel, S. Experimental osteoarthritis models in mice. Methods in Molecular Biology. 1194, 401-419 (2014).
- Zhao, Z., et al. Design and synthesis of Ag NPs/chitosan-starch nano-biocomposite as a modern anti-human malignant melanoma drug. International Journal of Biological Macromolecules. 236, 123823 (2023).
- Ahmed, E., et al. Decellularized extracellular matrix-rich hydrogel-silver nanoparticle mixture as a potential treatment for acute liver failure model. Journal of Biomedical Materials Research Part A. 108 (12), 2351-2367 (2020).
- Bai, M., et al. CD177 modulates human neutrophil migration through activation-mediated integrin and chemoreceptor regulation. Blood. 130 (19), 2092-2100 (2017).
- Singh, D., Chaudhary, D., Kumar, V., Verma, A. Amelioration of diethylnitrosamine (DEN) induced renal oxidative stress and inflammation by Carissa carandas embedded silver nanoparticles in rodents. Toxicology Reports. 8, 636-645 (2021).
- Singh, N., et al. NanoGenotoxicology: The DNA damaging potential of engineered nanomaterials. Biomaterials. 30 (23-24), 3891-3914 (2009).
- Noronha, V. T., et al. Silver nanoparticles in dentistry. Dental Materials. 33 (10), 1110-1126 (2017).
- Ahamed, M., Alsalhi, M. S., Siddiqui, M. K. Silver nanoparticle applications and human health. Clinica Chimica Acta. 411 (23-24), 1841-1848 (2010).
- Palacios-Hernandez, T., et al. cellular uptake and apoptotic responses in human coronary artery endothelial cells exposed to ultrasmall superparamagnetic iron oxide nanoparticles. Journal of Applied Toxicology. 40 (7), 918-930 (2020).
- Lebda, M. A., et al. Potential role of alpha-lipoic acid and Ginkgo biloba against silver nanoparticles-induced neuronal apoptosis and blood-brain barrier impairments in rats. Life Sciences. 212, 251-260 (2018).
- Yin, I. X., et al. The antibacterial mechanism of silver nanoparticles and its application in dentistry. International Journal of Nanomedicine. 15, 2555-2562 (2020).
- Kim, Y. S., et al. Subchronic oral toxicity of silver nanoparticles. Particle and Fibre Toxicology. 7, 20 (2010).
- Pascarelli, N. A., et al. Effects of gold and silver nanoparticles in cultured human osteoarthritic chondrocytes. Journal of Applied Toxicology. 33 (12), 1506-1513 (2013).
- Braydich-Stolle, L. K., et al. Silver nanoparticles disrupt GDNF/Fyn kinase signaling in spermatogonial stem cells. Toxicological Sciences. 116 (2), 577-589 (2010).
- Eom, H. J., Choi, J. p38 MAPK activation, DNA damage, cell cycle arrest and apoptosis as mechanisms of toxicity of silver nanoparticles in Jurkat T cells. Environmental Science and Technology. 44 (21), 8337-8342 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon