Method Article
Migliorare l'osteoartrite nei topi usando nanoparticelle d'argento
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Di seguito è presentato un protocollo per l'utilizzo di nanoparticelle d'argento per migliorare efficacemente i sintomi acuti dei topi di osteoartrite indotta da collagenasi di tipo II, tra cui infiammazione sinoviale, iperplasia sinoviale, iperplasia vascolare, ecc.
Abstract
L'artrosi del ginocchio (KOA) è una delle malattie degenerative delle articolazioni più comunemente riscontrate nelle persone di età superiore ai 45 anni. Attualmente, non ci sono terapie efficaci per KOA e l'unica strategia end-point è l'artroplastica totale del ginocchio (TKA); pertanto, la KOA è associata a oneri economici e costi sociali. La risposta immunitaria infiammatoria è coinvolta nella comparsa e nello sviluppo di KOA. In precedenza abbiamo stabilito un modello murino di KOA utilizzando collagene di tipo II. L'iperplasia del tessuto sinoviale era presente nel modello, insieme a un gran numero di cellule infiammatorie infiltrate. Le nanoparticelle d'argento hanno notevoli effetti antinfiammatori e sono state ampiamente utilizzate nella terapia tumorale e nella somministrazione chirurgica di farmaci. Pertanto, abbiamo valutato gli effetti terapeutici delle nanoparticelle d'argento in un modello KOA indotto dalla collagenasi II. I risultati sperimentali hanno mostrato che le nanoparticelle d'argento hanno ridotto significativamente l'iperplasia sinoviale e l'infiltrazione di neutrofili nel tessuto sinoviale. Quindi, questo lavoro dimostra l'identificazione di una nuova strategia per l'OA e fornisce una base teorica per prevenire il progresso della KOA.
Introduzione
L'artrosi del ginocchio (KOA) è una delle forme più frequenti di artrosi e comporta un complesso processo patologico nell'intera articolazione sinoviale1. Con il graduale invecchiamento della popolazione mondiale, l'incidenza di KOA sta aumentando notevolmente. Il dolore costante nell'articolazione del ginocchio spinge comunemente i pazienti con KOA a cercare un trattamento medico. L'eziologia del dolore nella KOA può essere correlata alla risposta infiammatoria, all'iperplasia sinoviale e alla degenerazione della cartilagine2. I tessuti sinoviali sono composti da due tipi di cellule: fibroblasti sinoviali e macrofagi 3,4,5. I fibroblasti sinoviali producono liquido sinoviale. I macrofagi sinoviali sono normalmente dormienti e vengono attivati dalla risposta infiammatoria. L'infiammazione iniziale della sinovia provoca dolore all'articolazione del ginocchio6.
La risposta immunitaria infiammatoria del tessuto sinovia svolge un ruolo cruciale nella patogenesi del KOA. Studi precedenti hanno confermato che ci sono risposte infiammatorie nei tessuti della sinovia nella KOA, note come sinovite, e il grado di sinovite della KOA è strettamente correlato all'infiltrazione delle cellule infiammatorie dei tessuti della sinovia 7,8,9. La sinovite è una reazione infiammatoria della sinovia e le sue caratteristiche patologiche sono la proliferazione delle cellule sinoviali, la formazione di nuovi vasi e l'infiltrazione di cellule infiammatorie 5,10,11.
L'obiettivo del trattamento con KOA è quello di alleviare la reazione infiammatoria della sinovia e ritardare la progressione della malattia. Attualmente, i principali farmaci clinici per il trattamento della KOA sono i farmaci antinfiammatori non steroidei (FANS); tuttavia, presentano effetti collaterali significativi, come la nefrotossicità12,13. Le iniezioni intra-articolari di glucocorticoidi sono un'altra opzione per il trattamento della KOA; Tuttavia, il glucocorticoide si diffonde rapidamente e potrebbe essere rapidamente metabolizzato dal versamento articolare. Nel frattempo, i pazienti diabetici con iperglicemia sottostante dovrebbero essere cauti riguardo alle iniezioni di steroidi in corso14. In sintesi, non esiste una strategia terapeutica farmacologica disponibile per KOA. Pertanto, l'esplorazione di nuovi farmaci per il trattamento della KOA è estremamente urgente.
La dimensione delle nanoparticelle d'argento è inferiore a 100 nm. Grazie ai loro importanti effetti antinfiammatori, antibatterici e antiossidanti, sono stati ampiamente utilizzati in vari aspetti dell'assistenza sanitaria e della medicina, come la guarigione delle ferite e le ustioni15,16. Sono anche utilizzati nella somministrazione mirata di farmaci, nell'imaging medico e nella diagnosi molecolare17. L'argento (Ag) ha una maggiore azione antinfiammatoria e antibatterica rispetto ad altre nanoparticelle metalliche, come il rame (Cu), lo zinco (Zn) e il ferro (Fe)15. Le nanoparticelle d'argento, un nuovo tipo di nanomateriale, hanno potenti proprietà antimicrobiche ad ampio spettro. Uno studio precedente ha scoperto che nei modelli murini di ustioni e peritonite18,19, le nanoparticelle d'argento potrebbero inibire efficacemente la produzione di fattori infiammatori e promuovere la guarigione delle ferite. Uno studio precedente ha anche dimostrato che le nanoparticelle d'argento hanno migliorato la guarigione delle ferite diabetiche promuovendo la sintesi di fattori di crescita e la deposizione di collagene20.
Sulla base degli effetti antinfiammatori delle nanoparticelle d'argento, abbiamo mirato a utilizzare le nanoparticelle d'argento per trattare il KOA indotto dal collagene di tipo II nei topi. I risultati hanno suggerito che il numero di cellule di infiltrazione infiammatoria dell'articolazione sinoviale nei topi è stato significativamente ridotto con questo trattamento. I risultati hanno anche suggerito che le nanoparticelle d'argento potrebbero alleviare significativamente i sintomi del KOA nei topi. Pertanto, l'applicazione di nanoparticelle d'argento può supportare lo sviluppo di nuove opzioni terapeutiche per la KOA clinica.
Protocollo
Tutto il lavoro sugli animali è stato approvato dall'Animal Ethical and Welfare Committee (AEWC) del Guangzhou Forevergen Medical Laboratory Animal Center (2018-0186).
1. Creazione del modello murino KOA
- Mantenere i topi BALB/c (18-24 g; 12-14 settimane) in un ambiente con il 70% di umidità e a 26 °C con un ciclo luce/buio di 12 ore. Per questo esperimento, gli animali sono stati mantenuti nel Guangzhou Forevergen Medical Laboratory Animal Center.
- Utilizzare il collagene di tipo II per stabilire un modello murino KOA come descritto in precedenza21. Eseguire l'iniezione intra-articolare come descritto di seguito.
- Applicare pentobarbital al 2% di sodio (40 mg/kg) per l'anestesia e buprenorfina (0,05 mg/kg, iniezione sottocutanea) per l'analgesia. Quindi, fissare gli arti del topo con il nastro adesivo, rimuovere i peli con il rasoio e disinfettare con uno scrub alternato di iodoforo allo 0,1% e alcol tre volte.
- Indossare guanti sterili e utilizzare forbici sterili per esporre in sequenza la pelle, il tessuto sottocutaneo e il legamento infrarotuleo. Mantenere l'area dell'incisione al di sotto di 0,5 cm.
NOTA: Una coperta riscaldante è stata utilizzata per mantenere la temperatura corporea dei topi durante l'operazione. - Utilizzare una siringa da insulina da 1 mL per iniettare 10 U di collagenasi di tipo II da 30 mg/kg (0,4 mg/mL) nella cavità articolare (sotto il legamento infrarotuleo)22.
NOTA: L'angolo tra l'ago e la pelle deve essere di circa 15°; Quindi, la direzione dell'ago deve essere cambiata e l'ago deve essere ritirato del tutto. - Dopo l'iniezione, suturare prima il tessuto sottocutaneo e poi la pelle. Sterilizzare l'area di sutura con iodoforo allo 0,1%. Posizionare i topi nelle gabbie ventilate singolarmente (IVC) separatamente dopo che si sono svegliati dall'anestesia.
2. Sintesi di nanoparticelle d'argento
NOTA: La preparazione delle nanoparticelle d'argento è stata descritta in precedenza in dettaglio19. L'intero processo di formulazione viene eseguito su ghiaccio. Dopo la preparazione, la miscela viene conservata a 4 °C; in caso contrario, la miscela solidifica facilmente a temperatura ambiente.
- Aggiungere un totale di 400 μL di collagene di tipo I (4 mg/mL) in una provetta da microcentrifuga da 1,5 mL e mettere su ghiaccio.
- Aggiungere un totale di 200 μL di soluzione salina tamponata con fosfato (PBS) al collagene di cui sopra, mescolare bene la soluzione e metterla sul ghiaccio.
- Infine, aggiungere 400 μL di nanoparticelle d'argento alla soluzione di cui sopra, quindi mescolare a sufficienza. La concentrazione finale della soluzione di nanoparticelle è di 1 mM.
NOTA: Il diametro medio delle nanoparticelle d'argento varia da 5 nm a 15 nm23. Ciò è stato confermato dalla microscopia elettronica.
3. Trattamento con nanoparticelle d'argento di topi KOA indotti da collagenasi di tipo II
- Rimuovere i topi KOA indotti dalla collagenasi di tipo II dalle loro gabbie 1 settimana dopo e iniettarli con nanoparticelle d'argento. Iniettare le nanoparticelle d'argento una volta alla settimana e raccogliere i campioni 30 giorni dopo.
- Iniettare un totale di pentobarbital di sodio al 2% (dose: 2 ml/kg) per l'anestesia tramite un'iniezione intraperitoneale, quindi fissare, preparare la pelle e sterilizzare come descritto nei passaggi 1.2.
- Indossare guanti sterili e utilizzare forbici sterili per esporre in sequenza la pelle, il tessuto sottocutaneo e i legamenti del ginocchio.
- Utilizzare una siringa da insulina da 1 mL ed entrare nella cavità articolare con un angolo di 15° con l'ago. Iniettare lentamente circa 20 μL della miscela di collagene di nanoparticelle d'argento ed estrarre lentamente l'ago24.
- Suturare il tessuto sottocutaneo e la pelle a turno e sterilizzare. Metti i topi in gabbie ventilate individualmente (IVC) separatamente dopo che si sono svegliati dall'anestesia.
- Eseguire questa iniezione della miscela di collagene di nanoparticelle d'argento (20 μL) quattro volte con una frequenza di una volta alla settimana.
NOTA: I topi trattati con la miscela di collagene di nanoparticelle d'argento devono essere tenuti in gabbie individuali. I combattimenti tra topi possono verificarsi quando vengono mantenuti insieme, e questo influenzerebbe i risultati sperimentali. Durante l'iniezione, ci sarà una sensazione di tensione quando l'ago raggiunge la cavità articolare e si verifica gonfiore nell'articolazione del ginocchio dopo l'iniezione. La combinazione di questi due metodi consente al ricercatore di garantire che il farmaco sia stato iniettato con successo nell'articolazione del ginocchio.
4. Prelievo dell'articolazione del ginocchio e del tessuto sinoviale
- Sacrificare i topi con asfissia da anidride carbonica o qualsiasi altro protocollo approvato dal comitato etico animale competente.
- Sterilizzare e sezionare la pelle e il tessuto sottocutaneo in sequenza ed esporre completamente l'articolazione del ginocchio.
- Prelevare le articolazioni del ginocchio, compresi il femore e la tibia, e rimuovere i tessuti muscolari.
- Raccogliere i tessuti articolari del ginocchio, tra cui il femore, la tibia e i tessuti molli circostanti (legamento e capsula), in formalina al 10% per la conservazione e la fissazione.
5. Colorazione ematossilina-eosina
- Dopo la fissazione durante la notte, incorporare le sezioni con paraffina e utilizzare un microtomo per tagliare il tessuto incluso in paraffina con uno spessore di 0,4 μm. Utilizzare le sezioni preparate per un'ulteriore colorazione (colorazione ematossilina-eosina, Safranina O/Fast Green e colorazione immunoistochimica (IHC)).
- Deparaffinare le sezioni due volte con xilene, immergere in etanolo al 100%, 95%, 80% e 70% in sequenza per 5 minuti ciascuna e reidratare.
- Colorare le sezioni con ematossilina (0,1 g/100 mL) per 5 minuti, quindi applicare direttamente HCl all'1% per 10 secondi ed eosina (0,5 g/100 mL) per 1 minuto.
- Osservare le alterazioni istopatologiche della sinovia al microscopio.
6. Safranina O/Verde veloce
- Incorporare il tessuto in paraffina e preparare le sezioni istologiche come descritto al punto 5.1.
- Deparaffinare le sezioni due volte con xilene e reidratarle con una serie di etanolo (come etanolo al 100%, 95%, 80% e 70% in acqua distillata, ciascuna per 5 minuti).
- Colorare le sezioni preparate con l'ematossilina e lavarle con PBS tre volte per 2 minuti ciascuna.
- Differenziare le sezioni con alcool acido cloridrico e lavarle con PBS tre volte per 2 minuti ciascuna.
- Immergere le sezioni in una soluzione colorante Fast Green allo 0,02% per 5-10 minuti, seguita da una colorazione con Safranina O allo 0,1% per 1-2 minuti.
- Differenziare le sezioni con acido acetico all'1%, seguito da lavaggio PBS.
- Rilevare e analizzare la formazione di fibrocartilagine nelle sezioni.
7. Colorazione immunoistochimica (IHC)
- Incorporare il tessuto in paraffina e preparare le sezioni istologiche come descritto al punto 5.1.
- Deparaffinare le sezioni due volte con xilene e reidratarle con una serie di etanolo (come etanolo al 100%, 95%, 80% e 70% in acqua distillata, ciascuna per 5 minuti). Immergere le sezioni in tampone Tris-EDTA (10 mM di base Tris, 1 mM di soluzione EDTA; pH 9,0) e riscaldare in forno a microonde a 95 °C per 10 minuti per eseguire il recupero dell'antigene.
- Esporre le sezioni a una soluzione di perossido di idrogeno al 3% per 10 minuti per rimuovere la perossidasi endogena.
- Trattare le sezioni con siero di capra al 5% per bloccare il legame aspecifico.
- Aggiungere gli anticorpi primari diluiti (diluizione 1:1.000) contro CD177 e incubare per una notte a 4°C. Quindi, lavare le sezioni con PBS tre volte.
- Immergere le sezioni con PBS e incubare le sezioni con l'anticorpo secondario appropriato (sistema anti-coniglio polimerico coniugato HRP) per 30 minuti a temperatura ambiente.
- Eseguire la visualizzazione della colorazione IHC utilizzando la 3,3'-diamminobenzidina (DAB) come cromogeno.
- Visualizzare le sezioni al microscopio e analizzare le immagini acquisite.
Risultati
Il modello murino KOA è stato indotto utilizzando la collagenasi di tipo II. A partire da 1 settimana dopo l'induzione del modello, la miscela di collagene di nanoparticelle d'argento preparata è stata iniettata nella cavità articolare una volta alla settimana per 4 settimane (Figura 1). I pesi dei topi in ciascun gruppo sono stati osservati e registrati quotidianamente. I risultati hanno mostrato che il peso corporeo medio dei topi KOA era significativamente inferiore a quello dei topi del gruppo di controllo normale. Tuttavia, il peso corporeo medio dei topi nel gruppo collagenasi di tipo II + AgNPs era più alto rispetto ai topi KOA, sebbene questa differenza non fosse statisticamente significativa (Figura 2). Dopo 30 giorni, i tessuti sinoviali delle articolazioni del ginocchio sono stati prelevati dai topi e sottoposti ad esame patologico. Sono state analizzate l'iperplasia, la proliferazione vascolare, l'infiltrazione infiammatoria della sinovia e il danno alla cartilagine 5,10,11. I risultati hanno mostrato che lo spessore sinoviale dei topi nel gruppo KOA era significativamente più alto rispetto al gruppo di controllo normale. Nel gruppo trattato con la miscela di collagene di nanoparticelle d'argento, lo spessore della membrana sinoviale è stato ridotto rispetto al gruppo KOA (Figura 3). C'era iperplasia vascolare nella sinovia dei topi KOA rispetto al normale gruppo di controllo e l'iperplasia vascolare era significativamente ridotta nella sinovia dei topi trattati con la miscela di collagene di nanoparticelle d'argento (Figura 4). I risultati della colorazione Safranina-O hanno mostrato che la matrice cartilaginea dei topi KOA è stata distrutta, mentre i topi trattati con la miscela di collagene di nanoparticelle d'argento hanno mostrato una matrice cartilaginea significativamente migliore (Figura 5). I punteggi delle caratteristiche morfologiche in ciascun gruppo sono stati valutati come descritto in precedenza22. I risultati sono stati i seguenti: 0 ± 0 per il gruppo salino, 7 ± 0,63 per il gruppo collagene di tipo II e 4,2 ± 1,17 per il gruppo collagenasi di tipo II + AgNPs (Figura 6). CD177 è un importante marcatore di neutrofili25. CD177 è espresso nel 40%-60% dei neutrofili in condizioni normali. Tuttavia, l'espressione di CD177 nei neutrofili aumenta significativamente durante l'infiammazione acuta. I risultati della colorazione IHC hanno dimostrato che i neutrofili infiltrati nella regione sinoviale erano significativamente ridotti nel gruppo trattato con AgNP rispetto al gruppo KOA (Figura 7), il che suggerisce che il trattamento con AgNP potrebbe migliorare i sintomi di KOA.
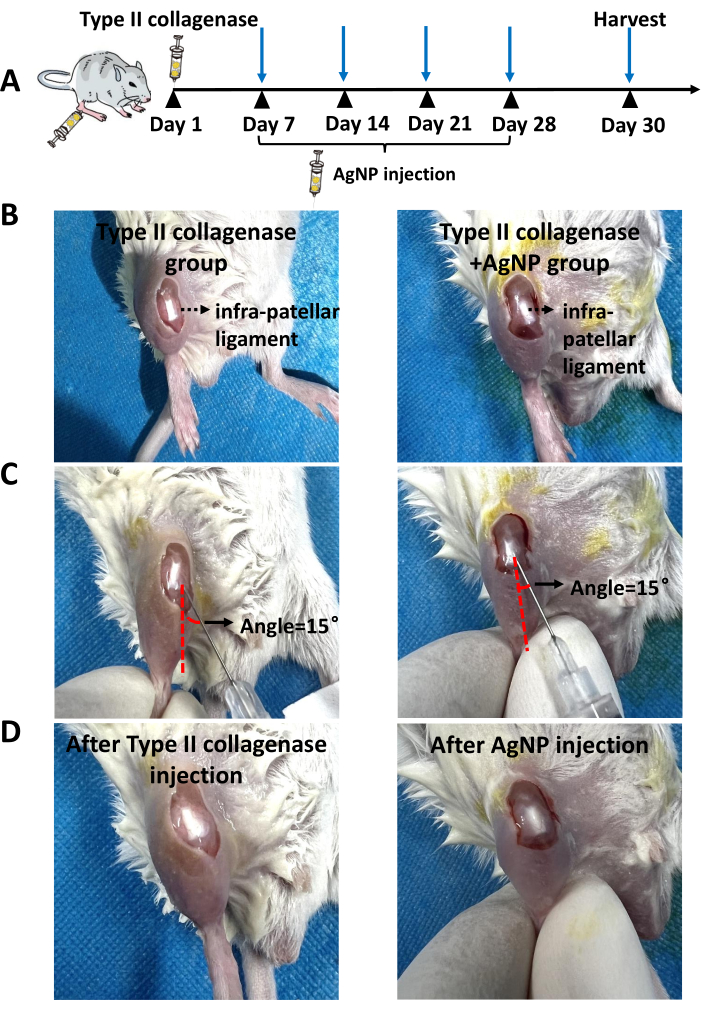
Figura 1: Posizione dell'iniezione. (A) Immagini rappresentative dell'iniezione di collagenasi di tipo II. (B) Immagini rappresentative dopo l'iniezione di collagenasi di tipo II. (C) Immagini rappresentative dell'iniezione di miscela di collagene di nanoparticelle d'argento nel modello murino KOA. (D) Immagini rappresentative dopo l'iniezione di miscela di collagene di nanoparticelle d'argento nei topi modello KOA. La linea tratteggiata rossa rappresenta la linea parallela ai legamenti del ginocchio del topo. La freccia nera rappresenta l'angolo tra l'ago della siringa da insulina e la pelle. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Variazioni del peso corporeo dei topi in ciascun gruppo. Questo pannello mostra il peso medio dei topi in ciascun gruppo in diversi punti temporali; l'asse x indica il numero di giorni dopo l'iniezione di collagenasi di tipo II e l'asse y indica il cambiamento di piega del peso corporeo. Gruppo salino (n = 7), gruppo collagenasi di tipo II (n = 5), gruppo collagenasi di tipo II + gruppo AgNPs (n = 5). *p < 0,05. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Colorazione ematossilina-eosina (H&E) che rappresenta l'iperplasia sinoviale. I tessuti sinoviali in ciascun gruppo di topi sono stati raccolti, fissati, sezionati e colorati con H&E a 30 giorni dall'intervento chirurgico. Le doppie frecce rappresentano lo spessore sinoviale rilevato. Barra della scala = 0,1 mm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Immagine rappresentativa dell'iperplasia vascolare perisinoviale. Le frecce indicano le imbarcazioni. Barra della scala = 0,05 mm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: Colorazione con safranina-O dell'articolazione del ginocchio in ciascun gruppo di topi. Barra della scala = 0,2 mm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 6: Punteggi delle caratteristiche morfologiche in ciascun gruppo. Il tessuto sinoviale è stato utilizzato per misurare il punteggio delle caratteristiche morfologiche per i topi di ciascun gruppo. Cinque sezioni di tessuto in ciascun gruppo sono state selezionate per analizzare il grado di iperplasia/allargamento dello strato cellulare del rivestimento sinoviale, il grado di infiltrazione dei neutrofili nel tessuto sinoviale e il grado di attivazione dello stroma sinoviale (Tabella 1). Il valore medio è stato utilizzato come punteggio finale. **p < 0,01 e ***p < 0,001 con un t-test di Student per ciascuna coorte rispetto al gruppo KOA non trattato. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 7: Colorazione immunoistochimica per un marcatore di neutrofili nel tessuto sinoviale in ciascun gruppo di topi. La colorazione immunoistochimica è stata utilizzata per rilevare l'espressione del marcatore neutrofilo CD177 nel tessuto sinoviale dei topi di ciascun gruppo. Le frecce indicano i neutrofili. Barra della scala = 100 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Tabella 1: Punteggio delle caratteristiche morfologiche. Clicca qui per scaricare questa tabella.
Discussione
Le nanoparticelle d'argento mostrano effetti antinfiammatori, antibatterici, antiossidanti e immunomodulatori, il che significa che potrebbero proteggere le cellule e i tessuti dai danni riducendo la produzione di specie reattive dell'ossigeno26. Alcuni ricercatori sono preoccupati per la tossicità delle nanoparticelle d'argento27. La tossicità delle nanoparticelle d'argento è direttamente correlata alla presenza di ioni d'argento liberi. A causa delle dimensioni su scala nanometrica delle nanoparticelle d'argento, potrebbero facilmente interferire con biomolecole, cellule e organi umani 15,28,29. Diversi studi hanno riportato che le nanoparticelle d'argento potrebbero indurre stress ossidativo e compromettere la funzione mitocondriale nelle cellule umane30. Inoltre, l'Ag può essere rilevato negli organi umani, in particolare nel fegato e nella milza, dopo l'uso di grandi quantità di nanoparticelle d'argento. I ricercatori hanno anche riferito che le nanoparticelle d'argento hanno la capacità di attraversare la barriera emato-encefalica attraverso il trasporto transsinaptico e accumularsi nel cervello31. Non è stata condotta una relazione sistematica sulla biotossicità delle nanoparticelle d'argento, sebbene alcuni ricercatori riconoscano la sicurezza delle nanoparticelle d'argento32.
In questo studio, abbiamo preparato una miscela di collagene di nanoparticelle d'argento. In effetti, il periodo di durata delle nanoparticelle d'argento nei tessuti umani è breve, ma il periodo di durata delle nanoparticelle d'argento può essere prolungato se applicate con una miscela di collagene; Questo non solo riduce il trauma ma anche la dose dei farmaci. Considerando la tossicità delle nanoparticelle d'argento, la dose di nanoparticelle d'argento applicata in questo studio è stata di 30 mg/kg, in linea con la ricerca precedente33.
Di seguito sono riportate alcune considerazioni fondamentali sull'operazione sperimentale. La collagenasi di tipo II deve essere conservata a -20 °C dopo la preparazione per prevenire la degradazione dovuta alla scissione enzimatica. La preparazione della miscela di collagene di nanoparticelle d'argento deve essere effettuata sul ghiaccio continuamente a temperatura ambiente perché la miscela di collagene di nanoparticelle d'argento diventa rapidamente un gel semisolido e quindi non può essere utilizzata per l'iniezione. La soluzione deve essere conservata a 4 °C dopo la preparazione. Per la somministrazione intra-articolare deve essere scelta una siringa da insulina da 1 mL con un ago più piccolo, che potrebbe prevenire efficacemente la fuoriuscita dei farmaci iniettati. L'ago deve essere inserito con un angolo di 15° per iniettare la miscela di collagene di nanoparticelle d'argento. Quando l'ago non è resistente, ciò indica che l'ago ha raggiunto la cavità dell'articolazione del ginocchio. Dopo l'iniezione, l'angolo dell'iniezione deve essere modificato e l'ago deve essere ritirato lentamente per evitare perdite del farmaco iniettato.
In questo studio, le nanoparticelle d'argento hanno migliorato efficacemente i sintomi della KOA indotta dalla collagenasi di tipo II nei topi, dimostrando l'effetto antinfiammatorio delle nanoparticelle d'argento. Diversi studi hanno riportato la presenza di apoptosi in cellule incubate in vitro con nanoparticelle d'argento 34,35,36. La riduzione dell'iperplasia sinoviale potrebbe essere stata causata dalle nanoparticelle d'argento a causa del loro coinvolgimento nella compromissione della funzione mitocondriale, oppure questi risultati potrebbero essere stati mediati da specie reattive dell'ossigeno. L'iperplasia vascolare è stata osservata nella sinovia dei topi nel gruppo modello KOA. Era possibile che le chemochine guidassero i neutrofili dai vasi sanguigni al tessuto sinoviale durante questo processo e che l'esplosione dell'infiammazione inducesse le cellule a consumare più ossigeno, portando così all'iperplasia vascolare. Pertanto, sono necessari ulteriori esperimenti per dimostrare l'affidabilità di questa ipotesi. Questo studio fornisce benefici teorici per la ricerca sul trattamento della KOA clinica. In studi futuri, miriamo a combinare il metodo del legamento crociato anteriore (ACL) con il metodo del modello KOA indotto chimicamente per osservare l'effetto delle nanoparticelle d'argento. I risultati sperimentali mostrano che le nanoparticelle d'argento possono ridurre significativamente l'infiltrazione di cellule infiammatorie nella sinovia nei topi KOA, ma i meccanismi di questo effetto necessitano ancora di ulteriori studi, che potrebbero svelare la patogenesi del KOA.
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Questo lavoro è stato finanziato dalla Natural Science Foundation della provincia del Guangdong (Numero: 2019A1515010209) e dal Progetto Scienza e Tecnologia della città di Guangzhou, Cina (Numero: 202102010164).
Materiali
| Name | Company | Catalog Number | Comments |
| 1 mL insulin syringe | BD | 305932 | None |
| CD177 Polyclonal Antibody | ThermoFisher Scientific | PA5-98759 | None |
| Chloral hydrate | Sigma-Aldrich | 302-17-0 | None |
| DAB | MCE | HY-15912 | None |
| Eosin | Beyotime Biotechnology | C0109 | None |
| Formalin | Sigma-Aldrich | HT501128 | None |
| Hematoxylin | Beyotime Biotechnology | C0107 | None |
| Light Microscopy | Leica | DM500 | None |
| Silver nanoparticle | Wolcacvi | S-10-20 | Store product in the dark at 4°C |
| Safranine O-Fast Green FCF Cartilage Stain Kit | Solarbio | 90-15-3 | None |
| Type II collagen | Sigma-Aldrich | C6885-500mg | None |
Riferimenti
- Kuyinu, E. L., Narayanan, G., Nair, L. S., Laurencin, C. T. Animal models of osteoarthritis: Classification, update, and measurement of outcomes. Journal of Orthopaedic Surgery and Research. 11, 19(2016).
- Kraus, V. B., Blanco, F. J., Englund, M., Karsdal, M. A., Lohmander, L. S. Call for standardized definitions of osteoarthritis and risk stratification for clinical trials and clinical use. Osteoarthritis and Cartilage. 23 (8), 1233-1241 (2015).
- Smith, M. D. The normal synovium. Open Rheumatology Journal. 5, 100-106 (2011).
- de Sousa, E. B., Casado, P. L., Moura, N. V., Duarte, M. E., Aguiar, D. P. Synovial fluid and synovial membrane mesenchymal stem cells: Latest discoveries and therapeutic perspectives. Stem Cell Research and Therapy. 5 (5), 112(2014).
- Scanzello, C. R., Goldring, S. R. The role of synovitis in osteoarthritis pathogenesis. Bone. 51 (2), 249-257 (2012).
- Glyn-Jones, S., et al. Osteoarthritis. Lancet. 386 (9991), 376-387 (2015).
- Roemer, F. W., et al. Presence of MRI-detected joint effusion and synovitis increases the risk of cartilage loss in knees without osteoarthritis at 30-month follow-up: The MOST study. Annals of Rheumatic Diseases. 70 (10), 1804-1809 (2011).
- Furman, B. D., et al. Articular ankle fracture results in increased synovitis, synovial macrophage infiltration, and synovial fluid concentrations of inflammatory cytokines and chemokines. Arthritis and Rheumatology. 67 (5), 1234-1239 (2015).
- Ayral, X., Pickering, E. H., Woodworth, T. G., Mackillop, N., Dougados, M. Synovitis: A potential predictive factor of structural progression of medial tibiofemoral knee osteoarthritis -- Results of a 1 year longitudinal arthroscopic study in 422 patients. Osteoarthritis and Cartilage. 13 (5), 361-367 (2005).
- Henrotin, Y., Lambert, C., Richette, P. Importance of synovitis in osteoarthritis: Evidence for the use of glycosaminoglycans against synovial inflammation. Seminars in Arthritis and Rheumatism. 43 (5), 579-587 (2014).
- Liu-Bryan, R. Synovium and the innate inflammatory network in osteoarthritis progression. Current Rheumatology Reports. 15 (5), 323(2013).
- Towheed, T., Shea, B., Wells, G., Hochberg, M. Analgesia and non-aspirin, non-steroidal anti-inflammatory drugs for osteoarthritis of the hip. Cochrane Database of Systematic Reviews. (2), (2000).
- Co, C. M., et al. Click chemistry-based pre-targeting cell delivery for cartilage regeneration. Regenerative Biomaterials. 8 (3), (2021).
- Oo, W. M., Liu, X., Hunter, D. J. Pharmacodynamics, efficacy, safety and administration of intra-articular therapies for knee osteoarthritis. Expert Opinion on Drug Metabolism and Toxicology. 15 (12), 1021-1032 (2019).
- Morozova, O. V. Silver nanostructures: Limited sensitivity of detection, toxicity and anti-inflammation effects. International Journal of Molecular Sciences. 22 (18), 9928(2021).
- He, M., et al. A pH-responsive mesoporous silica nanoparticles-based drug delivery system with controlled release of andrographolide for OA treatment. Regenerative Biomaterials. 8 (4), (2021).
- Samuel, M. S., Jose, S., Selvarajan, E., Mathimani, T., Pugazhendhi, A. Biosynthesized silver nanoparticles using Bacillus amyloliquefaciens; Application for cytotoxicity effect on A549 cell line and photocatalytic degradation of p-nitrophenol. Journal of Photochemistry and Photobiology B. 202, 111642(2020).
- Liu, X., et al. Silver nanoparticles mediate differential responses in keratinocytes and fibroblasts during skin wound healing. ChemMedChem. 5 (3), 468-475 (2010).
- Tian, J., et al. Topical delivery of silver nanoparticles promotes wound healing. ChemMedChem. 2 (1), 129-136 (2007).
- Vendidandala, N. R., et al. Gallocatechin-silver nanoparticle impregnated cotton gauze patches enhance wound healing in diabetic rats by suppressing oxidative stress and inflammation via modulating the Nrf2/HO-1 and TLR4/NF-kappaB pathways. Life Sciences. 286, 120019(2021).
- Kikuchi, T., Sakuta, T., Yamaguchi, T. Intra-articular injection of collagenase induces experimental osteoarthritis in mature rabbits. Osteoarthritis and Cartilage. 6 (3), 177-186 (1998).
- Lorenz, J., Grässel, S. Experimental osteoarthritis models in mice. Methods in Molecular Biology. 1194, 401-419 (2014).
- Zhao, Z., et al. Design and synthesis of Ag NPs/chitosan-starch nano-biocomposite as a modern anti-human malignant melanoma drug. International Journal of Biological Macromolecules. 236, 123823(2023).
- Ahmed, E., et al. Decellularized extracellular matrix-rich hydrogel-silver nanoparticle mixture as a potential treatment for acute liver failure model. Journal of Biomedical Materials Research Part A. 108 (12), 2351-2367 (2020).
- Bai, M., et al. CD177 modulates human neutrophil migration through activation-mediated integrin and chemoreceptor regulation. Blood. 130 (19), 2092-2100 (2017).
- Singh, D., Chaudhary, D., Kumar, V., Verma, A. Amelioration of diethylnitrosamine (DEN) induced renal oxidative stress and inflammation by Carissa carandas embedded silver nanoparticles in rodents. Toxicology Reports. 8, 636-645 (2021).
- Singh, N., et al. NanoGenotoxicology: The DNA damaging potential of engineered nanomaterials. Biomaterials. 30 (23-24), 3891-3914 (2009).
- Noronha, V. T., et al. Silver nanoparticles in dentistry. Dental Materials. 33 (10), 1110-1126 (2017).
- Ahamed, M., Alsalhi, M. S., Siddiqui, M. K. Silver nanoparticle applications and human health. Clinica Chimica Acta. 411 (23-24), 1841-1848 (2010).
- Palacios-Hernandez, T., et al. cellular uptake and apoptotic responses in human coronary artery endothelial cells exposed to ultrasmall superparamagnetic iron oxide nanoparticles. Journal of Applied Toxicology. 40 (7), 918-930 (2020).
- Lebda, M. A., et al. Potential role of alpha-lipoic acid and Ginkgo biloba against silver nanoparticles-induced neuronal apoptosis and blood-brain barrier impairments in rats. Life Sciences. 212, 251-260 (2018).
- Yin, I. X., et al. The antibacterial mechanism of silver nanoparticles and its application in dentistry. International Journal of Nanomedicine. 15, 2555-2562 (2020).
- Kim, Y. S., et al. Subchronic oral toxicity of silver nanoparticles. Particle and Fibre Toxicology. 7, 20(2010).
- Pascarelli, N. A., et al. Effects of gold and silver nanoparticles in cultured human osteoarthritic chondrocytes. Journal of Applied Toxicology. 33 (12), 1506-1513 (2013).
- Braydich-Stolle, L. K., et al. Silver nanoparticles disrupt GDNF/Fyn kinase signaling in spermatogonial stem cells. Toxicological Sciences. 116 (2), 577-589 (2010).
- Eom, H. J., Choi, J. p38 MAPK activation, DNA damage, cell cycle arrest and apoptosis as mechanisms of toxicity of silver nanoparticles in Jurkat T cells. Environmental Science and Technology. 44 (21), 8337-8342 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon