Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Optimierung der Aufbereitungstechnik für Tiebangchui mit Zanba auf Basis von CRITIC in Kombination mit der Box-Behnken Response Surface Methode
In diesem Artikel
Zusammenfassung
Das vorliegende Protokoll beschreibt eine effiziente und standardmäßige Entgiftungsverarbeitungsmethode für Zanba-Pfannengerichte Tiebangchui unter Verwendung von CRITIC in Kombination mit der Box-Behnken-Response-Surface-Methode.
Zusammenfassung
Die getrocknete Wurzel von Aconitum pendulum Busch., auf Chinesisch Tiebangchui (TBC) genannt, ist eine der bekanntesten tibetischen Arzneimittel. Es ist ein weit verbreitetes Kraut im Nordwesten Chinas. Viele Fälle von Vergiftungen sind jedoch aufgrund der intensiven Toxizität von TBC und der Tatsache, dass seine therapeutischen und toxischen Dosen ähnlich sind, aufgetreten. Daher ist es eine dringende Aufgabe, eine sichere und wirksame Methode zur Verringerung der Toxizität zu finden. Eine Recherche in den Klassikern der tibetischen Medizin zeigt, dass die Verarbeitungsmethode von TBC, die mit Zanba gebraten wird, in der "Verarbeitungsspezifikation der tibetischen Medizin der Provinz Qinghai" (2010) festgehalten wurde. Die konkreten Verarbeitungsparameter sind jedoch noch nicht klar. Ziel dieser Studie ist es daher, die Verarbeitungstechnologie von Zanba-Pfannengerichten zu optimieren und zu standardisieren.
Zunächst wurde ein Ein-Faktor-Experiment zu vier Faktoren durchgeführt: der Schichtdicke von TBC, der Menge an Zanba, der Verarbeitungstemperatur und der Zeit. Mit Monoester- und Diesteralkaloidgehalten in Zanba-gerührtem TBC als Indizes wurde CRITIC in Kombination mit der Box-Behnken-Response-Surface-Methode verwendet, um die Verarbeitungstechnologie von Zanba-gerührtem TBC zu optimieren. Die optimierten Verarbeitungsbedingungen von Zanba-Pfannengerichten waren eine TBC-Scheibendicke von 2 cm, dreimal mehr Zanba als TBC, eine Verarbeitungstemperatur von 125 °C und 60 Minuten Pfannengericht. Diese Studie ermittelte die optimierten und standardisierten Verarbeitungsbedingungen für die Verwendung von Zanba-Pfannen-TBC und lieferte damit eine experimentelle Grundlage für die sichere klinische Anwendung und industrielle Herstellung von Zanba-Pfannen-TBC.
Einleitung
Die getrocknete Wurzel von Aconitum pendulum Busch und A. flavum Hand.-Mazz., eine der bekanntesten tibetischen Arzneimittel, wird auf Chinesisch Tiebangchui (TBC) genannt 1,2. Die getrockneten Wurzeln von TBC sind hilfreich, um Kälte und Wind zu vertreiben, Schmerzen zu lindern und Schock zu lindern. Es wurde im ersten Band der "Arzneimittelstandards (Tibetische Medizin) des Gesundheitsministeriums der Volksrepublik China" festgehalten, in dem es heißt, dass die getrockneten Wurzeln von TBC häufig zur Behandlung von rheumatoider Arthritis, Prellungen und anderen Erkältungskrankheiten verwendet werden3. Die klinische therapeutische Dosis von TBC ist jedoch ähnlich wie die toxische Dosis, und es wurde häufig über Vergiftungen oder Todesfälle aufgrund unsachgemäßer Anwendung berichtet4. Daher ist die Verringerung der Toxizität und die Erhaltung der Wirksamkeit von TBC im Laufe der Jahre zu einem Forschungsschwerpunkt geworden.
In der tibetischen Medizin ist die Verarbeitung eine der effektivsten Methoden, um die Toxizität von TBC abzuschwächen. Gemäß "Verarbeitungsspezifikation der tibetischen Medizin der Provinz Qinghai (2010)" sollten die Originalkräuter (TBC) in einen Eisentopf gegeben und mit Zanba gebraten werden, bis die Zanba gelb wird, danach wird Zanba entfernt und die Kräuter an der Luft getrocknet 5,6. Es wurden jedoch keine spezifischen Prozessparameter dokumentiert, was die Kontrolle der Verarbeitungstechnologie und der Qualität von Zanba-Pfannengerichten erschwert. Die CRITIC-Methode ist eine objektive Gewichtungsmethode, die Unschärfe und Subjektivität vermeiden und die Objektivität des Wiegens von7 verbessern kann. Die Box-Behnken-Antwortflächenmethode kann die Wechselwirkung zwischen den einzelnen Faktoren durch Polynomanpassung8 direkt widerspiegeln. Die Kombination der Box-Behnken-Antwortfläche und der CRITIC-Methode wird häufig verwendet, um die Verarbeitungstechnologie zu optimieren, um das optimierte Verarbeitungsprotokoll 9,10 zu erhalten. In dieser Arbeit wurden ein Monoester-Diterpenoid-Alkaloid (MDA) (Benzoylaconitin) und zwei Diester-Diterpenoid-Alkaloide (DDAs) (Aconitin, 3-Desoxyaconitin) als Bewertungsindizes verwendet. CRITIC in Kombination mit der Box-Behnken-Response-Surface-Methode wurde angewendet, um die Verarbeitungstechnologie von Zanba-gerührtem TBC zu optimieren und eine Standardverarbeitungsmethode für den klinisch sicheren Einsatz zu etablieren.
Access restricted. Please log in or start a trial to view this content.
Protokoll
Die Zanba-gerührte TBC-Verarbeitungsmethode wurde von CRITIC in Kombination mit der Box-Behnken-Response-Surface-Methode optimiert und standardisiert. Benzoylaconitein, Aconitin und 3-Desoxyaconitin wurden während dieses Verfahrens als Bewertungsindizes verwendet.
1. Vorbereitung der Probenlösung
- Bereiten Sie die Stammlösung der Referenzsubstanz vor. Wiegen Sie genau 9,94 mg Benzoylaconiten, 8,49 mg Aconitin und 6,25 mg 3-Desoxyaconitin (Materialtabelle) auf einer elektronischen Analysenwaage ab und geben Sie sie in einen 10-ml-Messkolben. Fügen Sie dann 0,05%ige Salzsäure-Methanollösung hinzu, um die Feststoffe aufzulösen und das Volumen auf 10 ml zu erhöhen. Zum Schluss wird das Gemisch gut geschüttelt, um die Referenzsubstanz-Stammlösung mit Massenkonzentrationen von 0,9940 mg/ml Benzoylaconiten, 0,8490 mg/ml Aconitin und 0,6250 mg/ml 3-Desoxyaconitin zu erhalten.
VORSICHT: Salzsäure ist ein stark korrosives Material11. Verwenden Sie einen geeigneten Schutz, z. B. Handschuhe, einen Laborkittel, eine Schutzbrille und einen Abzug. - Bereiten Sie die Testprobenlösung vor.
- Wiegen Sie 2 g Zanba-gebratenes TBC-Pulver in einem Erlenmeyerkolben ab.
- Bereiten Sie Zanba-Pfannengerichte zu, indem Sie 30 g TBC (2 cm) und 90 g Zanba wiegen und in die vorgeheizte Pfannengerichtsmaschine geben. Stellen Sie die Zeit und Temperatur der Pfannenrührmaschine auf 40 min bzw. 140 °C ein. Stellen Sie die Maschine so ein, dass die Verarbeitung abgeschlossen ist.
- Verwenden Sie eine Hochgeschwindigkeits-Zerkleinerungsmaschine, um das Zanba-gebratene TBC separat in Pulverproben zu mahlen, die durch ein Sieb mit 50 Maschen (0,355 mm) passieren können.
- 3 ml Ammoniaklösung und 50 ml einer gemischten Lösung aus Isopropylalkohol und Ethylacetat (ein Verhältnis von 1:1 v/v) werden in den obigen Erlenmeyerkolben gegeben, basierend auf früheren Studien12,13.
Anmerkungen: Zur Herstellung der Ammoniaklösung werden 40 ml konzentrierte Ammoniaklösung in einen 100-ml-Messkolben gegeben und mit gereinigtem Wasser in die Messleitung gefüllt. Ergreifen Sie geeignete Schutzmaßnahmen, wenn Sie konzentrierte Ammoniaklösung verwenden, da diese einen starken Geruch hat. - Wiegen Sie die obige Probe und den Erlenmeyerkolben und notieren Sie das Gewicht. Ultraschall für 30 min (Spannung: 220 V, Frequenz: 40 kHz).
HINWEIS: Aconitin-Alkaloide werden durch Hitze leicht zersetzt. Daher muss die Temperatur der Ultraschallextraktion unter 25 °C liegen. - Wiegen Sie die Probe und den Erlenmeyerkolben nach der Ultraschallextraktion.
- Das verlorene Gewicht wird durch Zugabe einer Mischung aus Isopropylalkohol und Ethylacetat (Verhältnis 1:1 v/v) ausgeglichen.
- Filtern Sie die Probenlösung. 25 ml des Filtrats werden mit einem Rotationsverdampfer bei 40 °C zur Trockne verdampft.
- Lösen Sie den Rückstand auf, indem Sie 5 ml 0,05%ige Salzsäure-Methanol-Lösung hinzufügen, die Lösung durch einen 0,2-μm-Spritzenvorsatzfilter filtern und durch Hochleistungsflüssigkeitschromatographie (HPLC) analysieren.
- Wiegen Sie 2 g Zanba-gebratenes TBC-Pulver in einem Erlenmeyerkolben ab.
- Bereiten Sie eine gemischte Referenzlösung her, die 0,1988 mg/ml Benzoylaconiten, 0,0509 mg/ml Aconitin und 0,0938 mg/ml 3-Desoxyaconitin enthält.
HINWEIS: Jeder Standard (0,9940 mg Benzoylaconitin, 0,2545 mg Aconitin und 0,4690 mg 3-Desoxyaconitin) wird in einem 5-ml-Messkolben in 0,05%igem Salzsäuremethanol als Lösungsmedium gelöst. - 0,04 M Ammoniumacetatpuffer werden hergestellt, indem 6,16 g Ammoniumacetat (Materialtabelle) in 2 l Reinstwasser (mobile Phase A) gelöst werden. Stellen Sie den pH-Wert mit Ammoniak auf 8,50 ein.
ACHTUNG: Ammoniak ist ein gefährlicher Stoff. Verwenden Sie einen geeigneten Schutz, z. B. Handschuhe, einen Laborkittel, eine Schutzbrille und einen Abzug. - Filtern Sie 2 l hochreines 100% Acetonitril (mobile Phase B) und entgasen Sie es.
ACHTUNG: Acetonitril ist ein gefährlicher Stoff13. Verwenden Sie einen geeigneten Schutz, z. B. Handschuhe, einen Laborkittel, eine Schutzbrille und einen Abzug.
2. Chromatographischer Zustand
- Injizieren Sie 10 μl der vorbehandelten Probenlösungen in ein HPLC-System mit binären Pumpen. Verwenden Sie ein HPLC-System mit einer ODS-3-Säule (5 μm x 4,6 mm x 250 mm; bei 30 °C) mit den mobilen Phasen A und B für die MDA- und DDA-Trennung. Injizieren Sie jede Probe dreimal zur technischen Replikation.
- Programmieren Sie die Methode wie in Tabelle 1 für die Spalte ODS-3 gezeigt. Stellen Sie eine Flussrate von 1,0 ml/min und die Detektionswellenlänge auf 235 nm ein.
- Zeichnen Sie die Peakbereiche jeder Zielverbindung auf.
HINWEIS: Details zu den Instrumenten finden Sie in der Materialtabelle.
3. Prüfung der Anpassungsfähigkeit des Systems
HINWEIS: Siehe Abschnitt 2 für die chromatographischen Bedingungen zur Durchführung der Schritte 3.1-3.5.
- Untersuchen Sie die lineare Beziehung zwischen der Konzentrations- und der Peakfläche.
- Bereiten Sie verschiedene Konzentrationen - 19,88, 39,76, 59,64, 159,04, 198,80 und 497,00 μg/ml - Benzoylaconitinlösung vor.
- Bereiten Sie verschiedene Konzentrationen - 8,49, 16,98, 25,47, 33,96, 50,94 und 169,80 μg/ml - Aconitinlösung vor.
- Bereiten Sie verschiedene Konzentrationen - 1,875, 12,50, 37,50, 62,50, 93,75 und 125,00 μg/ml - 3-Desoxyaconitin-Lösung vor.
- Injizieren Sie die oben genannten Referenzlösungen von niedriger Massenkonzentration zu hoher Massenkonzentration und zeichnen Sie die Peakbereiche auf.
- Erhalten Sie drei lineare Regressionsgleichungen aus dem Diagramm der Referenzlösungskonzentration (μg/L) gegen die Peakfläche.
HINWEIS: Stellen Sie sicher, dass die Konzentrationen von Benzoylaconitin, Aconitin und 3-Desoxyaconitin innerhalb des linearen Bereichs dieser Standardkurve liegen.
- Führen Sie Präzisionstests durch, indem Sie kontinuierlich sechs Wiederholungen von 10 μl der Probenlösung in das HPLC-System injizieren und die Proben unter den gleichen HPLC-Bedingungen wie in Abschnitt 2 beschrieben ausführen. Notieren Sie die Spitzenbereiche von Benzoylaconiten, Aconitin und 3-Desoxyaconiten.
- Führen Sie Stabilitätstestexperimente durch, indem Sie 10 μl der vorbereiteten Probenlösung injizieren, und bestimmen Sie die Peakbereiche nach 0 h, 2 h, 4 h, 8 h, 12 h und 24 h.
HINWEIS: Die Peakbereiche werden automatisch vom referenzierten HPLC-System aufgezeichnet. Diese Zeitpunkte basieren auf einschlägiger Literatur15,16,17. - Führen Sie den Reproduzierbarkeitstest durch, indem Sie dieselbe Charge von Zanba-gerührtem TBC verwenden, um sechs Testprobenlösungen parallel gemäß der Methode in Schritt 1.2 herzustellen. Injizieren Sie 10 μl jeder Probe in das HPLC-System und führen Sie die Proben wie in Abschnitt 2 beschrieben aus.
HINWEIS: Die Reproduzierbarkeit wurde durch den Vergleich der Konzentrationsunterschiede zwischen den sechs Proben bewertet. - Führen Sie das Wiederherstellungsexperiment durch, indem Sie sechs Portionen derselben Charge von Zanba-gebratenem TBC für die Testlösung vorbereiten. Fügen Sie dann ~100 % der Referenzsubstanz jeder Indexkomponente in sechs Portionen der Testlösung hinzu, um die Wiederfindungsrate zu berechnen. Injizieren Sie diese Proben (10 μl) unter den gleichen Bedingungen wie in Abschnitt 2 beschrieben in das HPLC-System und berechnen Sie die Wiederfindungsrate anhand von Gleichung (1):
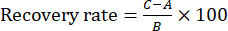 (1)
(1)
ANMERKUNG: In Gleichung (1) ist A die Menge der Komponente, die in der Prüflösung gemessen werden soll, B ist die Menge der zugesetzten Referenzsubstanz und C ist der gemessene Wert der Lösung, die die Referenzsubstanz und die Zanba-Pfanne gebratene TBC-Probe enthält.
4. Einfaktor-Experimente
- Vergleich der Schichtdicke
- Bereiten Sie fünf Gruppen für Tests mit jeweils 30 g TBC vor, wobei die Dicke der TBC 0,5, 1, 2, 3 bzw. 4 cm beträgt. Wiegen Sie eine Menge Zanba, die dreimal so viel ist wie die von TBC (90 g).
HINWEIS: TBC ist giftig. Verwenden Sie einen geeigneten Schutz wie Handschuhe, einen Laborkittel, eine Schutzbrille und einen Abzug und seien Sie während des Schneidvorgangs vorsichtig. Durch das Vorexperiment wurde festgestellt, dass die dreifache Menge an Zanba für einen vollständigen Kontakt zwischen TBC und Zanba erforderlich ist. Daher wählte die Studie im formalen Versuchsdesign die dreifache Menge an Zanba aus, um die Schichtdicke zu untersuchen. - Stellen Sie die Temperatur und die Zeit der automatischen Pfannenrührmaschine auf 140 °C bzw. 40 min ein.
- Geben Sie ~30 g TBC und 90 g Zanba in die Maschine, nachdem die automatische Pfannengerichtsmaschine auf die eingestellte Temperatur aufgeheizt ist.
- Bereiten Sie die Beispiellösungen vor, indem Sie Schritt 1.2 ausführen. Berechnen Sie die Gehalte der MDA und DDAs in verschiedenen Verarbeitungsprodukten gemäß der Standardkurve (Tabelle 2). Berechnen Sie die Gesamtpunktzahl basierend auf den Ergebnissen mit der CRITIC-Methode in Abschnitt 6.
- Vergleichen Sie auf diese Weise die Mengen an Zanba sowie Verarbeitungstemperaturen und -zeiten, um die Bedingungen zu optimieren.
- Bereiten Sie fünf Gruppen für Tests mit jeweils 30 g TBC vor, wobei die Dicke der TBC 0,5, 1, 2, 3 bzw. 4 cm beträgt. Wiegen Sie eine Menge Zanba, die dreimal so viel ist wie die von TBC (90 g).
- Vergleich der Menge an Zanba
- Führen Sie fünf Gruppen von Tests mit jeweils 30 g TBC (2 cm) durch, wobei die Menge an Zanba ein-, zwei-, drei-, vier- bzw. fünfmal so viel wie TBC beträgt.
- Schalten Sie die Pfannengerichtsmaschine für die Verarbeitung ein. Stellen Sie die Zeit und die Temperatur der Pfannenmaschine auf 40 min und 140 °C ein.
- Bereiten Sie die Beispiellösungen vor, indem Sie Schritt 1.2 ausführen. Berechnen Sie den Gehalt der MDA und DDAs in verschiedenen Verarbeitungsprodukten gemäß der Standardkurve (Tabelle 2). Berechnen Sie die Gesamtpunktzahl basierend auf den Ergebnissen mit der CRITIC-Methode in Abschnitt 6.
- Vergleich der Verarbeitungstemperatur
- Führen Sie fünf Testgruppen mit jeweils 30 g TBC (2 cm) und 90 g Zanba durch.
- Schalten Sie die Pfannengerichtsmaschine für die Verarbeitung ein. Stellen Sie die Verarbeitungstemperatur auf 100 °C, 120 °C, 140 °C, 160 °C und 180 °C ein. Stellen Sie die Bearbeitungszeit auf 40 Minuten ein.
HINWEIS: In Vorexperimenten wurde festgestellt, dass die Geschwindigkeit der Zanba-Vergilbung sehr gering ist, wenn die Verarbeitungstemperatur unter 100 °C liegt, und dass Zanba leicht zu brennen ist und schwarz wird, wenn die Temperatur zu hoch ist (über 180 °C). Daher wurden 100 °C und 180 °C als Minimal- bzw. Maximalwerte der Temperatur während der Verarbeitung festgelegt. - Bereiten Sie die Beispiellösungen vor, indem Sie Schritt 1.2 ausführen. Zeichnen Sie die Spitzenbereiche der MDA und DDAs auf. Berechnen Sie den Gehalt der MDA und DDAs in verschiedenen Verarbeitungsprodukten gemäß der Standardkurve (Tabelle 2). Berechnen Sie die Gesamtpunktzahl basierend auf den Ergebnissen mit der CRITIC-Methode in Abschnitt 6.
HINWEIS: Das Experiment beinhaltet hohe Temperaturen von 160 °C und 180 °C. Achten Sie während des Experiments auf die Sicherheit gemäß den Sicherheitsvorschriften des Labors.
- Vergleich der Bearbeitungszeit
- Führen Sie fünf Testgruppen mit jeweils 30 g TBC (2 cm) und 90 g Zanba durch.
- Schalten Sie die Pfannengerichtsmaschine für die Verarbeitung ein. Stellen Sie die Verarbeitungszeit auf 20, 40, 60, 80 und 100 Minuten ein. Stellen Sie die Temperatur auf 140 °C ein.
- Bereiten Sie die Beispiellösungen vor, indem Sie der Beschreibung in Schritt 1.2 folgen. Zeichnen Sie die Spitzenbereiche der MDA und DDAs auf. Berechnen Sie die Qualität der MDA und DDAs in verschiedenen Verarbeitungsprodukten gemäß der Standardkurve (Tabelle 2). Berechnen Sie die Gesamtpunktzahl basierend auf den Ergebnissen mit der CRITIC-Methode in Abschnitt 6.
5. Optimierung der Verarbeitungstechnologie von Zanba-gerührtem TBC mit Hilfe der Response-Surface-Methodik (RSM)
- Box-Behnken Response-Oberflächengestaltung
- Bestimmen Sie den Bereich der Schichtdicke (A, 1-3 cm), die Menge an Zanba (B, 2-4x), die Verarbeitungstemperatur (C, 100-140 °C) und die Verarbeitungszeit (D, 40-80 min) durch Vorversuche mit Einfaktortests (Schritt 4.1-4.4).
HINWEIS: Die kodierten Werte von vier Variablen und ihre Stufen sind in Tabelle 3 dargestellt. Drei Stufen jeder Variablen wurden als -1, 0 und 1 codiert.
- Bestimmen Sie den Bereich der Schichtdicke (A, 1-3 cm), die Menge an Zanba (B, 2-4x), die Verarbeitungstemperatur (C, 100-140 °C) und die Verarbeitungszeit (D, 40-80 min) durch Vorversuche mit Einfaktortests (Schritt 4.1-4.4).
- Verwenden Sie Software, um die Matrix zu generieren und die Modelle der Antwortfläche zu analysieren.
HINWEIS: Die Screenshots für die Softwarenutzung sind in der Zusatzdatei 1 aufgeführt.- Verwenden Sie ein Box-Behnken-Design mit drei Stufen und vier Faktoren, das aus 24 Experimenten besteht (wie in dieser Studie), und messen Sie fünf Wiederholungen (Durchlaufreihenfolge 1, 9, 14, 16 und 25), um die reine Fehlersumme der Quadrate zu berechnen (Tabelle 4). Legen Sie die umfassende Punktzahl (Y) als Antwort fest (Schritte 1-4, Ergänzungsdatei 1).
- Klicken Sie auf der Startseite auf Neues Design (Schritt 1, Ergänzungsdatei 1) und im linken Bereich der Seite Design auf Response Surface | Box-Behnken und stellen Sie die Parameter der vier Faktoren in der Tabelle ein (Schritt 2, Ergänzungsdatei 1).
- Klicken Sie auf Weiter (Schritt 2, Ergänzende Datei 1), legen Sie die Namen der Antwort fest und klicken Sie auf Fertig stellen (Schritt 3, Ergänzende Datei 1).
- Generieren Sie den Entwurf der Antwortfläche mit dem obigen Vorgang (Schritt 4, Ergänzungsdatei 1).
- Verwenden Sie ein Box-Behnken-Design mit drei Stufen und vier Faktoren, das aus 24 Experimenten besteht (wie in dieser Studie), und messen Sie fünf Wiederholungen (Durchlaufreihenfolge 1, 9, 14, 16 und 25), um die reine Fehlersumme der Quadrate zu berechnen (Tabelle 4). Legen Sie die umfassende Punktzahl (Y) als Antwort fest (Schritte 1-4, Ergänzungsdatei 1).
- Schließen Sie das Experiment basierend auf den 29 Szenarien ab, die für die Oberfläche der Antwortvariablen entworfen wurden.
- Bereiten Sie die Beispiellösungen vor, indem Sie Schritt 1.2 ausführen.
- Zeichnen Sie die Spitzenbereiche der MDA und DDAs auf.
HINWEIS: Die Peakbereiche werden automatisch vom referenzierten HPLC-System aufgezeichnet. - Berechnen Sie die Qualität der MDA und DDAs in den verschiedenen Verarbeitungsprodukten.
- Berechnen Sie die Gesamtpunktzahl basierend auf den Ergebnissen mit der CRITIC-Methode in Schritt 6.
HINWEIS: Die spezifische Methode wird in Schritt 6 veranschaulicht. - Geben Sie die erhaltene Gesamtpunktzahl von 29 Versuchen in den Computer ein und analysieren Sie sie mit der referenzierten Software (Schritt 5, Ergänzungsdatei 1).
- Führen Sie die statistische Validierung der Polynomgleichungen und Antwortflächenanalysen durch, die in 3D-Modelldiagrammen über die Software aufgetragen werden (Schritte 6-8, Ergänzungsdatei 1).
- Klicken Sie im linken Navigationsbereich unter Analyse (+) auf Y, und klicken Sie dann im Fenster Konfigurieren auf Analyse starten (Schritt 6, Ergänzende Datei 1).
- Klicken Sie im oberen Menü auf ANOVA und sehen Sie sich die Ergebnistabelle mit der Varianzanalyse an (Schritt 7, Ergänzungsdatei 1).
- Klicken Sie im oberen Menü auf Modelldiagramme und dann auf 3D-Oberfläche , um die Diagramme der Antwortoberfläche zu erhalten, die die Auswirkungen der Verarbeitungsparameter auf die synthetischen Werte widerspiegeln (Schritt 8, Ergänzungsdatei 1).
- Führen Sie die Validierung des Antwortflächenmodells in dreifacher Ausführung unter den vorhergesagten optimalen Bedingungen durch (Schritt 9, Ergänzungsdatei 1), um die Stabilität der Verarbeitungstechnologie zu überprüfen. Klicken Sie im linken Navigationsbereich unter Optimierung auf Numerisch Klicken Sie dann im oberen Menü auf Lösungen. Beachten Sie die prognostizierten optimalen Bedingungen.
6. Evaluierung des Modells
HINWEIS: Dieser Schritt ist nach Abschluss jedes Einzelfaktor-Experiments oder Antwortflächenexperiments durchzuführen. Nach Abschluss jedes Experiments (z. B. Vergleich der Schichtdicke) wird der Gehalt der MDA und DDAs in den verschiedenen Proben gemessen, um fünf Datensätze gemäß Schritt 1.2 und Abschnitt 2 zu erhalten. Die Daten sind in der Ergänzungstabelle S1 dargestellt.
- Dimensionslose Verarbeitung des Index
HINWEIS: In diesem Schritt wird der Messwert (Xij) in einen dimensionslosen relativen Wert umgewandelt, so dass der Wert jedes Index auf dem gleichen Mengenniveau liegt. Dieser Vorgang kann eine umfassende Analyse und einen Vergleich von Indikatoren in verschiedenen Einheiten oder Größenordnungenvon 18 ermöglichen. Zur Veranschaulichung wurden für die unten gezeigten Berechnungen Werte für die Schichtdicke verwendet (Ergänzungstabelle S1).- Standardisieren Sie den Inhalt des MDA (erhalten Sie yMDA; MDA bezieht sich auf Benzoylaconiten) unter Verwendung der Formel in Gl. (2).
HINWEIS: Der Index "i" steht für einen von vier Faktoren, und die Schichtdicke ist der erste untersuchte Faktor. Daher ist der Wert von i gleich 1. Der Index "j" steht für jede Ebene von Faktoren; Wenn also die Schichtdicke die erste Ebene (0,5 cm) ist, ist j gleich 1; Wenn die Scheibendicke die fünfte Ebene (4 cm) ist, ist j gleich 5. Die Gehalte an MDA (Xij) in der verarbeiteten TBC mit Mächtigkeiten von 0,5, 1, 2, 3 und 4 cm betrugen 0,9693, 1,0876, 1,3940, 1,4185 bzw. 1,3614 mg/g. Somit ist x j, max 1,4185 und x j,min ist 0,9693.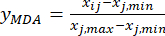 (2)
(2)
So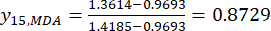
Dabei ist Xij der gemessene Gehalt der MDA des Experiments im i-ten Faktor und auf der j-ten Ebene; xj, min ist der Mindestgehalt des MDA in dieser Gruppe von Experimenten; und xj, max ist der maximale Gehalt der MDA in dieser Gruppe von Experimenten. Somit ist i = 1, 2, ..., m und j = 1, 2, ..., n.
HINWEIS: Daher sind die standardisierten Werte des MDA 0,0000, 0,2634, 0,9455, 1,0000 und 0,8729 unter Verwendung von Gl. (2). - Standardisieren Sie den Gesamtinhalt der DDAs (erhalten Sie yDDAs; DDAs bezieht sich auf Aconitin und 3-Desoxyaconiten) unter Verwendung der Formel in Gl. (3).
ANMERKUNG: i ist einer von vier Faktoren, und j ist jede Stufe der Faktoren; Xij ist der gemessene Gehalt der DDAs des Experiments im i-ten Faktor und auf der j-ten Ebene; xj, min ist der Mindestgehalt der DDAs in diesem Gruppenexperiment von Daten; und xj, max ist der maximale Gehalt der DDAs in diesem Gruppenexperiment von Daten. Auf diese Weise sind i = 1, 2, ..., m und j = 1, 2, ..., n. Die Gehalte der DDAs (Xij) in der verarbeiteten TBC mit Mächtigkeiten von 0,5, 1, 2, 3 und 4 cm betrugen 0,3492, 0,2692, 0,2962, 0,5354, 0,5124 mg/g. Somit ist x j, max 0,5354 und x j,min ist 0,2692.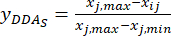 (3)
(3)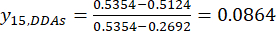
HINWEIS: Die standardisierten Werte sind 0,6995, 1,0000, 0,8986, 0,0000 und 0,0864 mit Gl. (3).
- Standardisieren Sie den Inhalt des MDA (erhalten Sie yMDA; MDA bezieht sich auf Benzoylaconiten) unter Verwendung der Formel in Gl. (2).
- Berechnen Sie die entsprechende Kontrastintensität (S i), den Konflikt (δ i), die Information (C i) und das Indexgewicht (W i) nach Gl. (4) bis (7) bzw.19,20.
ANMERKUNG: i = 1, 2, ..., m. yij sind die standardisierten Daten des MDA- oder DDA-Inhalts des Experiments im i-ten Faktor und auf der j-ten Ebene.- Um die Kontrastintensität abzuschätzen, berechnen Sie zunächst den durchschnittlichen MDA-Wert.
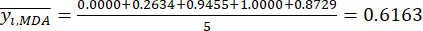
Wo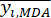 ist der Durchschnittswert des MDA.
ist der Durchschnittswert des MDA.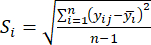 (4)
(4)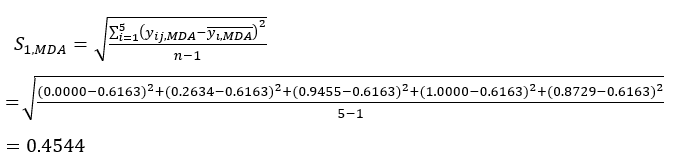
- Um den Konfliktwert zu berechnen, schätzen Sie zunächst den Korrelationskoeffizienten γij mit der Funktion KORREL in Excel21.
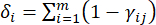 (5)
(5)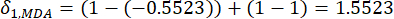
- Berechnen Sie die Informationswerte wie folgt.
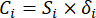 (6)
(6)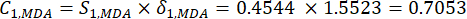
HINWEIS: Ähnlich verhält es sich mit C1, DDAS = 0,7210 - Berechnen Sie die Indexgewichtung wie folgt.
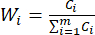 (7)
(7)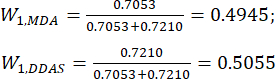
HINWEIS: Daher wurden die Gewichtskoeffizienten der MDA und DDAs im Vergleich der Schichtdicke mit 0,4945 bzw. 0,5055 festgelegt.
- Um die Kontrastintensität abzuschätzen, berechnen Sie zunächst den durchschnittlichen MDA-Wert.
- Berechnen Sie die umfassenden Werte der Schichtdicken.
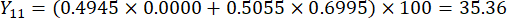
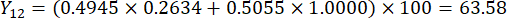
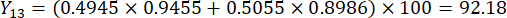
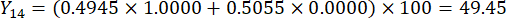
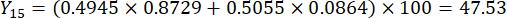
HINWEIS: Y13 ist der Maximalwert. Daher ist der beste Parameter für die Schnittdicke die dritte Stufe - 2 cm.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
In dieser Studie hatte der verwendete Elutionsgradient eine gute Auflösung (Abbildung 1) für die drei Indexkomponenten in Zanba-gerührter TBC, wie nach wiederholtem Debuggen bestimmt. Die drei Indexkomponenten in Zanba-gerührtem TBC wiesen eine gute lineare Beziehung innerhalb eines bestimmten Konzentrationsbereichs auf (Tabelle 2). Die Präzision (Tabelle 5), die Stabilität (Tabelle 6), die Wiederholbarkeit (Tabelle 7) und die Probenrückgewinnung (
Access restricted. Please log in or start a trial to view this content.
Diskussion
TBC ist ein wichtiges tibetisches Arzneimittel mit der Wirkung, Kälte zu vertreiben und Schmerzen zu lindern. Es wird in China seit Tausenden von Jahren hauptsächlich zur Behandlung von traumatischen Verletzungen und rheumatischer Arthralgie eingesetzt24,25,26. Diterpenoidalkaloide sind sowohl aktive als auch toxische Bestandteile von TBC27,28,29
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Diese Arbeit wurde finanziell unterstützt von der National Natural Science Foundation of China (Nr. 82130113), der China Postdoctoral Science Foundation (Nr. 2021MD703800), der Science Foundation for Youths of Science & Technology Department der Provinz Sichuan (Nr. 2022NSFSC1449) und dem Forschungsförderungsprogramm "Xinglin Scholars" der Chengdu University of Traditional Chinese Medicine (Nr. 2022NSFSC1449) BSH2021009).
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| 3-Deoxyaconitine | Chengdu Desite Biotechnology Co., Ltd. | DST221109-033 | |
| Aconitine | Chengdu Desite Biotechnology Co., Ltd. | DSTDW000602 | |
| Ammonium acetate | Tianjin Kermel Chemical Reagent Co., Ltd | Chromatographic grade | |
| Benzoylaconitine | Chengdu Desite Biotechnology Co., Ltd. | DSTDB005502 | |
| Design-Expert software | Stat-Ease, Inc., Minneapolis, MN, USA | version 13.0 | |
| Electronic analytical balance | Shanghai Liangping Instruments Co., Ltd. | FA1004 | |
| High performance liquid chromatography | SHIMADZU Co., Ltd. | LC-20A | |
| High-speed smashing machine | Beijing Zhongxing Weiye Instrument Co., Ltd. | FW-100 | |
| Millipore filter | Tianjin Jinteng Experimental Equipment Co., Ltd | φ13 0.22 Nylon66 | |
| stir-Fry machine | Changzhou Maisi Machinery Co., Ltd | Type 5 | |
| Tiebangchui | Gannan Baicao Biotechnology Development Co., Ltd | 20211012 | |
| Ultra pure water systemic | RephiLe Bioscience, Ltd. | Genie G | |
| Ultrasonic cleansing machine | Ningbo Xinyi Ultrasonic Equipment Co., Ltd | SB2200 | |
| Zanba | 27 Chuanzang Road, Ganzi County | - |
Referenzen
- Li, C. Y., et al. Aconitum pendulum and Aconitum flavum: A narrative review on traditional uses, phytochemistry, bioactivities and processing methods. Journal of Ethnopharmacology. 292, 115216(2022).
- Wang, J., Meng, X. H., Chai, T., Yang, J. L., Shi, Y. P. Diterpenoid alkaloids and one lignan from the roots of Aconitum pendulum Busch. Natural Products and Bioprospecting. 9 (6), 419-423 (2019).
- Yu, L., et al. Traditional Tibetan medicine: therapeutic potential in rheumatoid arthritis. Frontiers In Pharmacology. 13, 938915(2022).
- Zhao, R., et al. One case of ventricular arrhythmia caused by poisoning of traditional Chinese medicine Aconitum pendulum Busch. Journal of People's Military Medical. 61 (4), 346-348 (2018).
- Qinghai Medical Products Administration. Processing specification of Tibetan medicine of Qinghai province. Qinghai Nationalities Publishing House. , 96-97 (2010).
- Li, J., et al. Comparison of three objective weighting methods to optimize the extraction process of Jianwei Chupi granules. Journal of Guangdong Pharmaceutical University. 38 (6), 91-97 (2022).
- Feng, Z. G., et al. Processing methods and the underlying detoxification mechanisms for toxic medicinal materials used by ethnic minorities in China: A review. Journal of Ethnopharmacology. 305, 116126(2023).
- Hsu, Y. T., Su, C. S. Application of Box-Behnken design to investigate the effect of process parameters on the microparticle production of ethenzamide through the rapid expansion of the supercritical solutions process. Pharmaceutics. 12 (1), 42(2020).
- Cheng, F., et al. Optimization of the baked drying technology of Cinnamomi Ramulus based on CRITIC combined with box-behnken response surface method. Journal of Chinese Medicinal Materials. 2022 (8), 1838-1842 (2022).
- Huang, X., et al. Optimization of microwave processing technology for carbonized Gardenia jasminoides by Box-Behnken response surface methodology based on CRITIC weighted evaluation. Chinese Herbal Medicines. 48 (6), 1133-1138 (2017).
- Elling, U., et al. Derivation and maintenance of mouse haploid embryonic stem cells. Nature Protocols. 14 (7), 1991-2014 (2019).
- Gu, J., Wang, Y. P., Ma, X. Simultaneous determinnation of three diester diterpenoid alkaloids in the toots of Aconiti flavi et penduli by HPLC method. Chinese Pharmaceutical Affairs. 28 (6), 618-621 (2014).
- Zhang, Y., Fu, X. UPLC simultaneous determination of six esteric alkaloids components in Aconitum Flaram Hand.Mazz. Asia-Pacific Traditional Medicine. 16 (5), 62-65 (2020).
- Rumachik, N. G., Malaker, S. A., Paulk, N. K. VectorMOD: Method for bottom-up proteomic characterization of rAAV capsid post-translational modifications and vector impurities. Frontiers In Immunology. 12, 657795(2021).
- Wang, Y. J., Tao, P., Wang, Y. Attenuated structural transformation of aconitine during sand frying process and antiarrhythmic effect of its converted products. Evidence-Based Complementary and Alternative Medicine. 2021, 7243052(2021).
- Wang, H. P., Zhang, Y. B., Yang, X. W., Zhao, D. Q., Wang, Y. P. Rapid characterization of ginsenosides in the roots and rhizomes of Panax ginseng by UPLC-DAD-QTOF-MS/MS and simultaneous determination of 19 ginsenosides by HPLC-ESI-MS. Journal of Ginseng Research. 40 (4), 382-394 (2016).
- vander Leeuw, G., et al. Pain and cognitive function among older adults living in the community. Journals of Gerontology Series A. Biological Sciences and Medical Sciences. 71 (3), 398-405 (2016).
- Lao, D., Liu, R., Liang, J. Study on plasma metabolomics for HIV/AIDS patients treated by HAART based on LC/MS-MS. Frontiers in Pharmacology. 13, 885386(2022).
- Li, Y., et al. Evaluation of the effectiveness of VOC-contaminated soil preparation based on AHP-CRITIC-TOPSIS model. Chemosphere. 271, 129571(2021).
- Zhong, S., Chen, Y., Miao, Y. Using improved CRITIC method to evaluate thermal coal suppliers. Scientific Reports. 13 (1), 195(2023).
- Lewis, N. S., et al. Magnetically levitated mesenchymal stem cell spheroids cultured with a collagen gel maintain phenotype and quiescence. Journal of Tissue Engineering. 8, (2017).
- Chinese Pharmacopoeia Committee. Pharmacopoeia of the People's Republic of China. 4, Chinese Medical Science and Technology Press. (2020).
- Li, G., et al. Effect of response surface methodology-optimized ultrasound-assisted pretreatment extraction on the composition of essential oil released from tribute citrus peels. Frontiers in Nutrition. 9, 840780(2022).
- Liu, X. F., et al. Hezi inhibits Tiebangchui-induced cardiotoxicity and preserves its anti-rheumatoid arthritis effects by regulating the pharmacokinetics of aconitine and deoxyaconitine. Journal of Ethnopharmacology. 302, 115915(2023).
- Smolen, J. S., et al. Rheumatoid arthritis. Nature Reviews.Disease Primers. 4, 18001(2018).
- Wang, F., et al. C19-norditerpenoid alkaloids from Aconitum szechenyianum and their effects on LPS-activated NO production. Molecules. 21 (9), 1175(2016).
- Wang, B., et al. Study on the alkaloids in Tibetan medicine Aconitum pendulum Busch by HPLC-MSn combined with column chromatography. Journal of Chromatographic Science. 54 (5), 752-758 (2016).
- Liu, S., et al. A review of traditional and current methods used to potentially reduce toxicity of Aconitum roots in Traditional Chinese Medicine. Journal of Ethnopharmacology. 207, 237-250 (2017).
- Qiu, Z. D., et al. Online discovery of the molecular mechanism for directionally detoxification of Fuzi using real-time extractive electrospray ionization mass spectrometry. Journal of Ethnopharmacology. 277, 114216(2021).
- El-Shazly, M., et al. Use, history, and liquid chromatography/mass spectrometry chemical analysis of Aconitum. Journal of Food and Drug Analysis. 24 (1), 29-45 (2016).
- Chan, T. Y. K. Aconitum alkaloid poisoning because of contamination of herbs by aconite roots. Phytotherapy Research. 30 (1), 3-8 (2016).
- Guo, L., et al. Exploring microbial dynamics associated with flavours production during highland barley wine fermentation. Food Research International. 130, 108971(2020).
- Guo, T. L., Horvath, C., Chen, L., Chen, J., Zheng, B. Understanding the nutrient composition and nutritional functions of highland barley (Qingke): A review. Trends in Food Science & Technology. 103, 109-117 (2020).
- Wu, H., et al. Anti-myocardial infarction effects of Radix Aconiti Lateralis Preparata extracts and their influence on small molecules in the heart using matrix-assisted laser desorption/ionization-mass spectrometry imaging. International Journal of Molecular Sciences. 20 (19), 4837(2019).
- Huang, G., et al. Study on cardiotoxicity and mechanism of "Fuzi" extracts based on metabonomics. International Journal of Molecular Sciences. 19 (11), 3506(2018).
- Li, S. L., et al. An insight into current advances on pharmacology, pharmacokinetics, toxicity and detoxification of aconitine. Biomedicine & Pharmacotherapy. 151, 113115(2022).
- Xie, Y., et al. Optimization of processing technology of braised Rehmanniae Raidx based on multiple indexes and response surface technology and correlation between components and color. Journal of Chinese Traditional Medicine. 47 (18), 4927-4937 (2022).
- Yang, X. Q., Xu, W., Xiao, C. P., Sun, J., Feng, Y. Z. Study on processing technology of Atractylodes chinensis with rice water and its pharmacodynamics of anti-diarrhea. Chinese Herbal Medicines. 53 (1), 78-86 (2022).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten