È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Ottimizzazione della tecnologia di elaborazione per Tiebangchui con Zanba basata su CRITIC combinato con il metodo della superficie di risposta Box-Behnken
In questo articolo
Riepilogo
Il presente protocollo descrive un metodo di elaborazione di disintossicazione efficiente e standard per Zanba-stir-fried Tiebangchui utilizzando CRITIC combinato con il metodo della superficie di risposta Box-Behnken.
Abstract
La radice essiccata del pendolo di Aconito Busch., chiamata Tiebangchui (TBC) in cinese, è una delle medicine tibetane più famose. È un'erba ampiamente utilizzata nel nord-ovest della Cina. Tuttavia, molti casi di avvelenamento si sono verificati a causa dell'intensa tossicità del TBC e perché le sue dosi terapeutiche e tossiche sono simili. Pertanto, trovare un metodo sicuro ed efficace per ridurne la tossicità è un compito urgente. Una ricerca attraverso i classici della medicina tibetana mostra che il metodo di lavorazione del TBC saltato in padella con Zanba è stato registrato nella "Specifica di lavorazione della medicina tibetana della provincia del Qinghai (2010)". Tuttavia, i parametri di elaborazione specifici non sono ancora chiari. Pertanto, questo studio mira a ottimizzare e standardizzare la tecnologia di lavorazione di Zanba-stir-fried TBC.
In primo luogo, è stato condotto un esperimento a fattore singolo su quattro fattori: lo spessore della fetta di TBC, la quantità di Zanba, la temperatura di lavorazione e il tempo. Con il contenuto di alcaloidi monoestere e diestere in TBC Zanba-stir-fried come indici, CRITIC combinato con il metodo della superficie di risposta Box-Behnken è stato utilizzato per ottimizzare la tecnologia di lavorazione di Zanba-stir-fried TBC. Le condizioni di lavorazione ottimizzate di Zanba-stir-fried TBC erano uno spessore della fetta TBC di 2 cm, tre volte più Zanba di TBC, una temperatura di lavorazione di 125 °C e 60 minuti di frittura. Questo studio ha determinato le condizioni di lavorazione ottimizzate e standard per l'utilizzo di TBC Zanba-stir-fried, fornendo così una base sperimentale per l'uso clinico sicuro e la produzione industriale di TBC Zanba-stir-fried.
Introduzione
La radice essiccata del pendolo di Aconito Busch e A. flavum Hand.-Mazz., una delle più famose medicine tibetane, è chiamata Tiebangchui (TBC) in cinese 1,2. Le radici essiccate di TBC sono utili per dissipare il freddo e il vento, ridurre il dolore e calmare lo shock. È stato registrato nel primo volume di "Drug Standards (Tibetan Medicine) of the Ministry of Health of the People's Republic of China", che afferma che le radici secche di TBC sono comunemente usate per trattare l'artrite reumatoide, lividi e altre malattie del raffreddore3. Tuttavia, la dose terapeutica clinica di TBC è simile alla sua dose tossica e sono stati frequentemente riportati episodi di avvelenamento o morte a causa di un uso improprio4. Pertanto, ridurre la tossicità e preservare l'efficacia del TBC è diventato un punto caldo della ricerca nel corso degli anni.
Nella medicina tibetana, l'elaborazione è uno dei metodi più efficaci per attenuare la tossicità della TBC. Secondo "Specifiche di lavorazione della medicina tibetana della provincia del Qinghai (2010)", le erbe originali (TBC) devono essere poste in una pentola di ferro e saltate in padella con Zanba fino a quando la Zanba diventa gialla, dopo di che la Zanba viene rimossa e le erbe vengono essiccate all'aria 5,6. Tuttavia, non sono stati documentati parametri di processo specifici, il che rende difficile il controllo della tecnologia di lavorazione e della qualità del TBC Zanba-saltato. Il metodo CRITIC è un metodo di peso oggettivo che può evitare la fuzzificazione e la soggettività e migliorare l'obiettività del peso7. Il metodo della superficie di risposta Box-Behnken può riflettere direttamente l'interazione tra ciascun fattore attraverso il raccordo polinomiale8. La combinazione della superficie di risposta Box-Behnken e del metodo CRITIC è comunemente utilizzata per ottimizzare la tecnologia di elaborazione per acquisire il protocollo di elaborazione ottimizzato 9,10. In questo articolo, un alcaloide monoestere-diterpenoide (MDA) (benzoilaconitina) e due alcaloidi diestere-diterpenoidi (DDA) (aconitina, 3-deossiaconitina) sono stati utilizzati come indici di valutazione. CRITIC combinato con il metodo della superficie di risposta Box-Behnken è stato applicato per ottimizzare la tecnologia di lavorazione di Zanba-stir-salted TBC e stabilire un metodo di elaborazione standard per l'uso clinico sicuro.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Il metodo di lavorazione TBC Zanba-stir-fried è stato ottimizzato e standardizzato da CRITIC combinato con il metodo della superficie di risposta Box-Behnken. Benzoylaconitina, aconitina e 3-deossiaconitina sono stati utilizzati come indici di valutazione durante questa procedura.
1. Preparazione della soluzione campione
- Preparare la soluzione madre della sostanza di riferimento. Pesare con precisione 9,94 mg di benzoilenicotina, 8,49 mg di aconitina e 6,25 mg di 3-deossiaconitina (Tabella dei materiali) su una bilancia analitica elettronica e metterli in un matraccio tarato da 10 ml. Quindi, aggiungere una soluzione di metanolo acido cloridrico allo 0,05% per sciogliere i solidi e portare il volume a 10 ml. Infine, agitare bene la miscela per ottenere la soluzione madre della sostanza di riferimento con concentrazioni di massa di 0,9940 mg/mL di benzoilacenina, 0,8490 mg/ml di aconitina e 0,6250 mg/ml di 3-deossiaconitina.
ATTENZIONE: L'acido cloridrico è un materiale altamente corrosivo11. Utilizzare una protezione adeguata, come guanti, camice da laboratorio, occhiali e una cappa aspirante. - Preparare la soluzione del campione di prova.
- Pesare 2 g di polvere TBC saltata in padella Zamba in un matraccio conico.
- Preparare la TBC saltata in padella Zanba pesando 30 g di TBC (2 cm) e 90 g di Zanba e aggiungendoli nella macchina preriscaldata saltata in padella. Impostare il tempo e la temperatura della macchina per saltare in padella rispettivamente su 40 minuti e 140 °C. Impostare la macchina per completare l'elaborazione.
- Utilizzare una frantumatrice ad alta velocità per macinare separatamente il TBC saltato in padella Zamba in campioni di polvere che possono passare attraverso un setaccio da 50 maglie (0,355 mm).
- Aggiungere 3 mL di soluzione di ammoniaca e 50 mL di una soluzione mista di alcool isopropilico e acetato di etile (un rapporto di 1:1 v/v) nel matraccio conico di cui sopra, in base agli studi precedenti12,13.
NOTA: Per preparare la soluzione di ammoniaca, aggiungere 40 ml di soluzione concentrata di ammoniaca in un matraccio tarato da 100 mL e riempire con acqua purificata fino alla linea di misurazione. Adottare misure protettive appropriate quando si utilizza una soluzione di ammoniaca concentrata in quanto ha un forte odore. - Pesare il campione e il matraccio conico di cui sopra e registrare il peso. Ultrasuoni per 30 min (tensione: 220 V, frequenza: 40 kHz).
NOTA: Gli alcaloidi aconitini sono facilmente decomposti dal calore. Pertanto, la temperatura dell'estrazione ad ultrasuoni deve essere inferiore a 25 ° C. - Pesare il campione e il matraccio conico dopo l'estrazione ad ultrasuoni.
- Compensare il peso perso aggiungendo una miscela di alcool isopropilico e acetato di etile (rapporto di 1:1 v/v).
- Filtrare la soluzione campione. Evaporare 25 mL di filtrato fino all'essiccazione utilizzando un evaporatore rotante a 40 °C.
- Sciogliere il residuo aggiungendo 5 ml di soluzione di metanolo acido cloridrico allo 0,05%, filtrare la soluzione attraverso un filtro a siringa da 0,2 μm e analizzarla eseguendo la cromatografia liquida ad alte prestazioni (HPLC).
- Pesare 2 g di polvere TBC saltata in padella Zamba in un matraccio conico.
- Preparare una soluzione di riferimento mista contenente 0,1988 mg/mL di benzoilaconitina, 0,0509 mg/mL di aconitina e 0,0938 mg/mL di 3-deossiaconitina.
NOTA: Ogni standard (0,9940 mg di benzoilaconitina, 0,2545 mg di aconitina e 0,4690 mg di 3-deossiaconitina) viene sciolto in un matraccio tarato da 5 mL in metanolo acido cloridrico allo 0,05% come mezzo di dissoluzione. - Preparare un tampone di acetato di ammonio 0,04 M sciogliendo 6,16 g di acetato di ammonio (tabella dei materiali) in 2 L di acqua ultrapura (fase mobile A). Regolare il pH a 8,50 usando ammoniaca.
ATTENZIONE: L'ammoniaca è un materiale pericoloso. Utilizzare una protezione adeguata, come guanti, camice da laboratorio, occhiali e una cappa aspirante. - Filtrare 2 L di acetonitrile ultrapuro al 100% (fase mobile B) e degasarlo.
ATTENZIONE: L'acetonitrile è un materiale pericoloso13. Utilizzare una protezione adeguata, come guanti, camice da laboratorio, occhiali e una cappa aspirante.
2. Stato cromatografico
- Iniettare 10 μL delle soluzioni campione pretrattate in un sistema HPLC con pompe binarie. Utilizzare un sistema HPLC che impiega una colonna ODS-3 (5 μm x 4,6 mm x 250 mm; funzionante a 30 °C) con fasi mobili A e B per la separazione MDA e DDA. Iniettare ogni campione tre volte per la replica tecnica.
- Programmare il metodo come illustrato nella tabella 1 per la colonna ODS-3. Impostare una portata di 1,0 mL/min e la lunghezza d'onda di rilevamento su 235 nm.
- Registra le aree di picco di ogni composto target.
NOTA: I dettagli degli strumenti sono disponibili nella tabella dei materiali.
3. Test di adattabilità del sistema
NOTA: Fare riferimento alla sezione 2 per le condizioni cromatografiche per eseguire i passaggi 3.1-3.5.
- Studiare la relazione lineare tra la concentrazione e l'area del picco.
- Preparare varie concentrazioni - 19,88, 39,76, 59,64, 159,04, 198,80 e 497,00 μg / ml - di soluzione di benzoilicinaconitina.
- Preparare varie concentrazioni - 8,49, 16,98, 25,47, 33,96, 50,94 e 169,80 μg / ml - di soluzione di aconitina.
- Preparare varie concentrazioni - 1,875, 12,50, 37,50, 62,50, 93,75 e 125,00 μg / ml - di soluzione di 3-deossiaconitina.
- Iniettare le soluzioni di riferimento di cui sopra da bassa concentrazione di massa ad alta concentrazione di massa e registrare le aree di picco.
- Ottenere tre equazioni di regressione lineare dal grafico della concentrazione della soluzione di riferimento (μg/L) rispetto all'area del picco.
NOTA: Assicurarsi che le concentrazioni di benzoilaconitina, aconitina e 3-deossiaconitina rientrino nell'intervallo lineare di questa curva standard.
- Eseguire prove di precisione iniettando continuamente sei ripetizioni di 10 μL della soluzione campione nel sistema HPLC ed eseguire i campioni nelle stesse condizioni HPLC descritte nella sezione 2. Registrare le aree di picco di benzoilaconitina, aconitina e 3-deossiaconitina.
- Eseguire esperimenti di prova di stabilità iniettando 10 μL della soluzione campione preparata e determinare le aree di picco dopo 0 h, 2 h, 4 h, 8 h, 12 h e 24 h.
NOTA: le aree di picco vengono registrate automaticamente dal sistema HPLC di riferimento. Questi punti temporali erano basati sulla letteratura pertinente15,16,17. - Eseguire la prova di riproducibilità prelevando lo stesso lotto di TBC Zanba-saltati in padella per preparare sei soluzioni campione di prova in parallelo secondo il metodo indicato al punto 1.2. Iniettare 10 μL di ciascun campione nel sistema HPLC ed eseguire i campioni come descritto nel paragrafo 2.
NOTA: La riproducibilità è stata valutata confrontando le differenze di concentrazione tra i sei campioni. - Eseguire l'esperimento di recupero preparando sei porzioni dello stesso lotto di TBC Zanba-saltati in padella per la soluzione di prova. Quindi, aggiungere ~ 100% della sostanza di riferimento di ciascun componente indice in sei porzioni della soluzione di prova per calcolare il tasso di recupero. Iniettare questi campioni (10 μL) nel sistema HPLC nelle stesse condizioni descritte nella sezione 2 e calcolare la velocità di recupero utilizzando l'equazione (1):
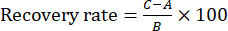 (1)
(1)
NOTA: Nell'Eq. (1), A è la quantità del componente da misurare nella soluzione campione, B è la quantità di sostanza di riferimento aggiunta e C è il valore misurato della soluzione che contiene la sostanza di riferimento e il campione TBC Zanba-saltato.
4. Esperimenti a fattore singolo
- Confronto dello spessore della fetta
- Preparare cinque gruppi per i test, ciascuno con 30 g di TBC, in cui lo spessore del TBC è rispettivamente di 0,5, 1, 2, 3 e 4 cm. Pesare una quantità di Zanba tre volte superiore a quella di TBC (90 g).
NOTA: TBC è tossico. Utilizzare una protezione adeguata, come guanti, camice da laboratorio, occhiali e una cappa aspirante, e prestare attenzione durante il processo di taglio. Attraverso il pre-esperimento, è stato scoperto che tre volte la quantità di Zanba era necessaria per un contatto completo tra TBC e Zanba. Pertanto, nel disegno sperimentale formale, lo studio ha selezionato tre volte la quantità di Zanba durante l'esame dello spessore della fetta. - Impostare la temperatura e il tempo della macchina automatica per friggere rispettivamente a 140 °C e 40 minuti.
- Aggiungere ~30 g di TBC e 90 g di Zanba nella macchina dopo che la macchina automatica per saltare in padella si è riscaldata fino alla temperatura impostata.
- Preparare le soluzioni di esempio seguendo il passaggio 1.2. Calcolare il contenuto degli MDA e degli DDA in diversi prodotti di trasformazione secondo la curva standard (tabella 2). Calcola il punteggio completo in base ai risultati tramite il metodo CRITIC nella sezione 6.
- In questo modo, confrontare le quantità di Zanba, nonché le temperature e i tempi di lavorazione per l'ottimizzazione delle condizioni.
- Preparare cinque gruppi per i test, ciascuno con 30 g di TBC, in cui lo spessore del TBC è rispettivamente di 0,5, 1, 2, 3 e 4 cm. Pesare una quantità di Zanba tre volte superiore a quella di TBC (90 g).
- Confronto della quantità di Zanba
- Eseguire cinque gruppi di test, ciascuno con 30 g di TBC (2 cm), in cui la quantità di Zanba è una, due, tre, quattro e cinque volte più di TBC, rispettivamente.
- Accendere la macchina per friggere per l'elaborazione. Impostare il tempo e la temperatura della macchina per saltare in padella a 40 minuti e 140 °C.
- Preparare le soluzioni di esempio seguendo il passaggio 1.2. Calcolare il contenuto di MDA e DDA in diversi prodotti di trasformazione secondo la curva standard (tabella 2). Calcola il punteggio completo in base ai risultati tramite il metodo CRITIC nella sezione 6.
- Confronto della temperatura di lavorazione
- Eseguire cinque gruppi di test, ciascuno con 30 g di TBC (2 cm) e 90 g di Zanba.
- Accendere la macchina per friggere per l'elaborazione. Impostare la temperatura di lavorazione su 100 °C, 120 °C, 140 °C, 160 °C e 180 °C. Impostare il tempo di elaborazione su 40 min.
NOTA: Attraverso pre-esperimenti, è stato riscontrato che la velocità di ingiallimento di Zanba è molto bassa quando la temperatura di lavorazione è inferiore a 100 °C, e Zanba è facile da bruciare e diventare nero se la temperatura è troppo alta (superiore a 180 °C). Pertanto, 100 °C e 180 °C sono stati impostati come valori minimi e massimi di temperatura durante la lavorazione, rispettivamente. - Preparare le soluzioni di esempio seguendo il passaggio 1.2. Registrare le aree di picco di MDA e DDA. Calcolare il contenuto di MDA e DDA in diversi prodotti di trasformazione secondo la curva standard (tabella 2). Calcola il punteggio completo in base ai risultati tramite il metodo CRITIC nella sezione 6.
NOTA: L'esperimento prevede temperature elevate di 160 °C e 180 °C. Prestare attenzione alla sicurezza durante l'esperimento, secondo il codice di sicurezza del laboratorio.
- Confronto dei tempi di elaborazione
- Eseguire cinque gruppi di test, ciascuno con 30 g di TBC (2 cm) e 90 g di Zanba.
- Accendere la macchina per friggere per l'elaborazione. Impostare il tempo di elaborazione su 20, 40, 60, 80 e 100 min. Impostare la temperatura su 140 °C.
- Preparare le soluzioni campione seguendo la descrizione al punto 1.2. Registrare le aree di picco di MDA e DDA. Calcolare la qualità degli MDA e delle DDA in diversi prodotti di lavorazione secondo la curva standard (Tabella 2). Calcola il punteggio completo in base ai risultati tramite il metodo CRITIC nella sezione 6.
5. Ottimizzazione della tecnologia di elaborazione di Zanba-stir-fried TBC utilizzando la metodologia della superficie di risposta (RSM)
- Design della superficie di risposta Box-Behnken
- Determinare l'intervallo di spessore della fetta (A, 1-3 cm), la quantità di Zanba (B, 2-4x), la temperatura di lavorazione (C, 100-140 °C) e il tempo di lavorazione (D, 40-80 min) mediante esperimenti preliminari utilizzando test a fattore singolo (fase 4.1-4.4).
NOTA: i valori codificati di quattro variabili e i relativi livelli sono mostrati nella tabella 3. Tre livelli di ogni variabile sono stati codificati come -1, 0 e 1.
- Determinare l'intervallo di spessore della fetta (A, 1-3 cm), la quantità di Zanba (B, 2-4x), la temperatura di lavorazione (C, 100-140 °C) e il tempo di lavorazione (D, 40-80 min) mediante esperimenti preliminari utilizzando test a fattore singolo (fase 4.1-4.4).
- Utilizzare il software per generare la matrice e analizzare i modelli di superficie di risposta.
NOTA: le schermate per l'utilizzo del software sono mostrate nel file supplementare 1.- Utilizzare un progetto Box-Behnken a tre livelli a quattro fattori composto da 24 esperimenti (come fatto in questo studio) e misurare cinque repliche (ordine di esecuzione 1, 9, 14, 16 e 25) per calcolare la somma degli errori puri dei quadrati (Tabella 4). Impostare il punteggio completo (Y) come risposta (passaggi 1-4, file supplementare 1).
- Nella home page, fare clic su Nuova progettazione (passaggio 1, File supplementare 1) e nel riquadro sinistro della pagina Progettazione , fare clic su Superficie di risposta | Box-Behnken e impostare i parametri dei quattro fattori nella tabella (passo 2, file supplementare 1).
- Fare clic su Avanti (passaggio 2, File supplementare 1), impostare i nomi delle risposte e fare clic su Fine (passaggio 3, File supplementare 1).
- Generare il progetto della superficie di risposta mediante l'operazione precedente (passaggio 4, file supplementare 1).
- Utilizzare un progetto Box-Behnken a tre livelli a quattro fattori composto da 24 esperimenti (come fatto in questo studio) e misurare cinque repliche (ordine di esecuzione 1, 9, 14, 16 e 25) per calcolare la somma degli errori puri dei quadrati (Tabella 4). Impostare il punteggio completo (Y) come risposta (passaggi 1-4, file supplementare 1).
- Completa l'esperimento in base ai 29 scenari progettati per la superficie di risposta.
- Preparare le soluzioni di esempio seguendo il passaggio 1.2.
- Registrare le aree di picco di MDA e DDA.
NOTA: le aree di picco vengono registrate automaticamente dal sistema HPLC di riferimento. - Calcola la qualità degli MDA e dei DDA nei diversi prodotti di lavorazione.
- Calcola il punteggio completo in base ai risultati tramite il metodo CRITIC nel passaggio 6.
NOTA: il metodo specifico è illustrato nel passaggio 6. - Inserire il punteggio completo ottenuto di 29 prove nel computer e analizzarlo utilizzando il software di riferimento (passaggio 5, file supplementare 1).
- Eseguire la validazione statistica delle equazioni polinomiali e delle analisi delle superfici di risposta tracciate nei grafici del modello 3D attraverso il software (passaggi 6-8, file supplementare 1).
- Nel riquadro di spostamento sinistro, in Analisi (+), fare clic su Y, quindi fare clic su Avvia analisi nella finestra Configura (passaggio 6, File supplementare 1).
- Fare clic su ANOVA nel menu in alto e osservare la tabella dei risultati che mostra l'analisi della varianza (passo 7, file supplementare 1).
- Nel menu in alto, fare clic su Grafici modello e quindi su Superficie 3D per ottenere i grafici della superficie di risposta che riflettono gli effetti dei parametri di elaborazione sui punteggi sintetici (passaggio 8, File supplementare 1).
- Eseguire la convalida del modello della superficie di risposta in triplice copia nelle condizioni ottimali previste (passo 9, file supplementare 1) per verificare la stabilità della tecnologia di elaborazione. Nel riquadro di spostamento a sinistra, sotto Ottimizzazione, fare clic su Numerico Quindi, nel menu in alto, fare clic su Soluzioni. Osservare le condizioni ottimali previste.
6. Valutazione del modello
NOTA: questo passaggio deve essere eseguito dopo il completamento di ogni esperimento a fattore singolo o esperimento sulla superficie di risposta. Dopo che ogni esperimento (ad esempio, il confronto dello spessore della fetta) è stato completato, il contenuto di MDA e DDA nei diversi campioni viene misurato per ottenere cinque set di dati, secondo il passaggio 1.2 e la sezione 2. I dati sono riportati nella tabella supplementare S1.
- Elaborazione adimensionale dell'indice
NOTA: questo passo trasforma il valore misurato (Xij) in un valore relativo adimensionale, in modo che il valore di ciascun indice sia allo stesso livello di quantità. Questa operazione può facilitare l'analisi completa e il confronto di indicatori in diverse unità o ordini di grandezza18. A scopo illustrativo, per i calcoli illustrati sono stati utilizzati i valori dello spessore della fetta (tabella supplementare S1).- Standardizzare il contenuto dell'MDA (ottenere yMDA; MDA si riferisce alla benzoilaconitina) utilizzando la formula in Eq. (2).
NOTA: l'indice "i" rappresenta uno dei quattro fattori e lo spessore della sezione è il primo fattore esaminato. Quindi, il valore di i è uguale a 1. L'indice "j" rappresenta ogni livello di fattori; Pertanto, quando lo spessore della fetta è il primo livello (0,5 cm), J è uguale a 1; Quando lo spessore della fetta è il quinto livello (4 cm), j è uguale a 5. Il contenuto di MDA (Xij) nel TBC trattato con spessori di 0,5, 1, 2, 3 e 4 cm era rispettivamente 0,9693, 1,0876, 1,3940, 1,4185 e 1,3614 mg / g. Quindi, x j, max è 1,4185 e xj, min è 0,9693.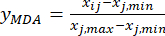 (2)
(2)
Così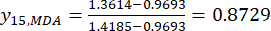
Qui, Xij è il contenuto misurato dell'MDA dell'esperimento nell'i-esimo fattore e al j-esimo livello; xj, min è il contenuto minimo dell'MDA in questo gruppo di esperimenti; e xj, max è il contenuto massimo dell'MDA in questo gruppo di esperimenti. Quindi, i = 1, 2, ..., m e j = 1, 2, ..., n.
NOTA: Pertanto, i valori standardizzati dell'MDA sono 0,0000, 0,2634, 0,9455, 1,0000 e 0,8729 utilizzando Eq. (2). - Standardizzare il contenuto totale delle DDA (ottenere yDDA; DDA si riferisce all'aconitina e alla 3-deossiaconitina) utilizzando la formula in Eq. (3).
NOTA: i è uno dei quattro fattori, e j è ogni livello dei fattori; Xij è il contenuto misurato delle DDA dell'esperimento nel fattore i-esimo e al livello j-esimo; xj, min è il contenuto minimo dei DDA in questo esperimento di gruppo di dati; e xj, max è il contenuto massimo dei DDA in questo esperimento di gruppo di dati. In questo modo, i = 1, 2, ..., m e j = 1, 2, ..., n. Il contenuto delle DDA (Xij) nel TBC trattato con spessori di 0,5, 1, 2, 3 e 4 cm era rispettivamente 0,3492, 0,2692, 0,2962, 0,5354, 0,5124 mg/g. Quindi, x j, max è 0,5354 e xj, min è 0,2692.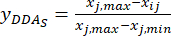 (3)
(3)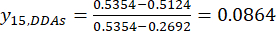
Nota : i valori standardizzati sono 0,6995, 1,0000, 0,8986, 0,0000 e 0,0864 utilizzando Eq. (3).
- Standardizzare il contenuto dell'MDA (ottenere yMDA; MDA si riferisce alla benzoilaconitina) utilizzando la formula in Eq. (2).
- Calcola l'intensità di contrasto corrispondente (S i), il conflitto (δ i), le informazioni (C i) e il peso dell'indice (W i) in base agli Eq. (4) a (7), rispettivamente19,20.
NOTA: i = 1, 2, ..., m. yij è il dato standardizzato del contenuto MDA o DDA dell'esperimento nel fattore i-esimo e al livello j-esimo.- Per stimare l'intensità del contrasto, calcolare innanzitutto il valore medio di MDA.
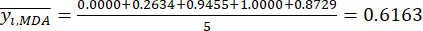
Dove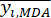 è il valore medio dell'MDA.
è il valore medio dell'MDA.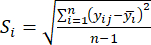 (4)
(4)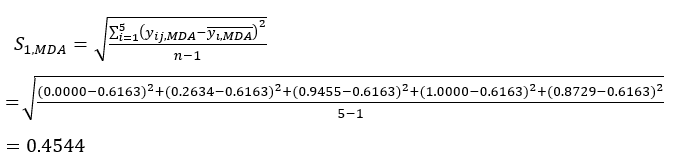
- Per calcolare il valore del conflitto, stimare innanzitutto il coefficiente di correlazione γij utilizzando la funzione CORRELAZIONE in Excel21.
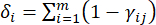 (5)
(5)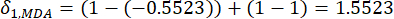
- Calcolare i valori delle informazioni come segue.
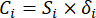 (6)
(6)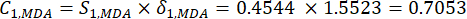
Nota : allo stesso modo, C1, DDAS = 0,7210 - Calcolare il peso dell'indice come segue.
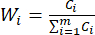 (7)
(7)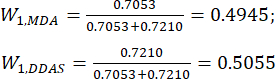
NOTA: Pertanto, i coefficienti di peso degli MDA e dei DDA rispetto allo spessore della fetta sono stati stabiliti rispettivamente come 0,4945 e 0,5055.
- Per stimare l'intensità del contrasto, calcolare innanzitutto il valore medio di MDA.
- Calcolate i punteggi completi degli spessori delle sezioni.
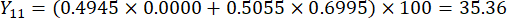
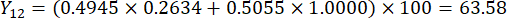
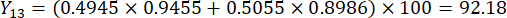
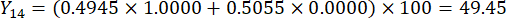
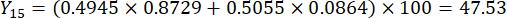
Nota : Y13 è il valore massimo. Pertanto, il miglior parametro di taglio degli spessori è il terzo livello - 2 cm.
Access restricted. Please log in or start a trial to view this content.
Risultati
In questo studio, il gradiente di eluizione utilizzato ha avuto una buona risoluzione (Figura 1) per i tre componenti dell'indice in TBC Zanba-stir-saltato, come determinato dopo ripetuti debug. Le tre componenti dell'indice nel TBC Zanba-stir-fried avevano una buona relazione lineare all'interno di uno specifico intervallo di concentrazione (Tabella 2). La precisione (Tabella 5), la stabilità (Tabella 6), la ripetibilità (Tabella 7) e il recupero del camp...
Access restricted. Please log in or start a trial to view this content.
Discussione
TBC è un'importante medicina tibetana con gli effetti di dissipare il freddo e alleviare il dolore. È stato usato principalmente per trattare lesioni traumatiche e artralgie reumatiche in Cina per migliaia di anni24,25,26. Gli alcaloidi diterpenoidi sono ingredienti attivi e tossici di TBC27,28,29. I principali effetti tossici degli a...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto finanziariamente dalla National Natural Science Foundation of China (n. 82130113), dalla China Postdoctoral Science Foundation (n. 2021MD703800), dalla Science Foundation for Youths of Science & Technology Department della provincia del Sichuan (n. 2022NSFSC1449) e dal programma di promozione della ricerca "Xinglin Scholars" dell'Università di Chengdu di medicina tradizionale cinese (No. BSH2021009).
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| 3-Deoxyaconitine | Chengdu Desite Biotechnology Co., Ltd. | DST221109-033 | |
| Aconitine | Chengdu Desite Biotechnology Co., Ltd. | DSTDW000602 | |
| Ammonium acetate | Tianjin Kermel Chemical Reagent Co., Ltd | Chromatographic grade | |
| Benzoylaconitine | Chengdu Desite Biotechnology Co., Ltd. | DSTDB005502 | |
| Design-Expert software | Stat-Ease, Inc., Minneapolis, MN, USA | version 13.0 | |
| Electronic analytical balance | Shanghai Liangping Instruments Co., Ltd. | FA1004 | |
| High performance liquid chromatography | SHIMADZU Co., Ltd. | LC-20A | |
| High-speed smashing machine | Beijing Zhongxing Weiye Instrument Co., Ltd. | FW-100 | |
| Millipore filter | Tianjin Jinteng Experimental Equipment Co., Ltd | φ13 0.22 Nylon66 | |
| stir-Fry machine | Changzhou Maisi Machinery Co., Ltd | Type 5 | |
| Tiebangchui | Gannan Baicao Biotechnology Development Co., Ltd | 20211012 | |
| Ultra pure water systemic | RephiLe Bioscience, Ltd. | Genie G | |
| Ultrasonic cleansing machine | Ningbo Xinyi Ultrasonic Equipment Co., Ltd | SB2200 | |
| Zanba | 27 Chuanzang Road, Ganzi County | - |
Riferimenti
- Li, C. Y., et al. Aconitum pendulum and Aconitum flavum: A narrative review on traditional uses, phytochemistry, bioactivities and processing methods. Journal of Ethnopharmacology. 292, 115216(2022).
- Wang, J., Meng, X. H., Chai, T., Yang, J. L., Shi, Y. P. Diterpenoid alkaloids and one lignan from the roots of Aconitum pendulum Busch. Natural Products and Bioprospecting. 9 (6), 419-423 (2019).
- Yu, L., et al. Traditional Tibetan medicine: therapeutic potential in rheumatoid arthritis. Frontiers In Pharmacology. 13, 938915(2022).
- Zhao, R., et al. One case of ventricular arrhythmia caused by poisoning of traditional Chinese medicine Aconitum pendulum Busch. Journal of People's Military Medical. 61 (4), 346-348 (2018).
- Qinghai Medical Products Administration. Processing specification of Tibetan medicine of Qinghai province. Qinghai Nationalities Publishing House. , 96-97 (2010).
- Li, J., et al. Comparison of three objective weighting methods to optimize the extraction process of Jianwei Chupi granules. Journal of Guangdong Pharmaceutical University. 38 (6), 91-97 (2022).
- Feng, Z. G., et al. Processing methods and the underlying detoxification mechanisms for toxic medicinal materials used by ethnic minorities in China: A review. Journal of Ethnopharmacology. 305, 116126(2023).
- Hsu, Y. T., Su, C. S. Application of Box-Behnken design to investigate the effect of process parameters on the microparticle production of ethenzamide through the rapid expansion of the supercritical solutions process. Pharmaceutics. 12 (1), 42(2020).
- Cheng, F., et al. Optimization of the baked drying technology of Cinnamomi Ramulus based on CRITIC combined with box-behnken response surface method. Journal of Chinese Medicinal Materials. 2022 (8), 1838-1842 (2022).
- Huang, X., et al. Optimization of microwave processing technology for carbonized Gardenia jasminoides by Box-Behnken response surface methodology based on CRITIC weighted evaluation. Chinese Herbal Medicines. 48 (6), 1133-1138 (2017).
- Elling, U., et al. Derivation and maintenance of mouse haploid embryonic stem cells. Nature Protocols. 14 (7), 1991-2014 (2019).
- Gu, J., Wang, Y. P., Ma, X. Simultaneous determinnation of three diester diterpenoid alkaloids in the toots of Aconiti flavi et penduli by HPLC method. Chinese Pharmaceutical Affairs. 28 (6), 618-621 (2014).
- Zhang, Y., Fu, X. UPLC simultaneous determination of six esteric alkaloids components in Aconitum Flaram Hand.Mazz. Asia-Pacific Traditional Medicine. 16 (5), 62-65 (2020).
- Rumachik, N. G., Malaker, S. A., Paulk, N. K. VectorMOD: Method for bottom-up proteomic characterization of rAAV capsid post-translational modifications and vector impurities. Frontiers In Immunology. 12, 657795(2021).
- Wang, Y. J., Tao, P., Wang, Y. Attenuated structural transformation of aconitine during sand frying process and antiarrhythmic effect of its converted products. Evidence-Based Complementary and Alternative Medicine. 2021, 7243052(2021).
- Wang, H. P., Zhang, Y. B., Yang, X. W., Zhao, D. Q., Wang, Y. P. Rapid characterization of ginsenosides in the roots and rhizomes of Panax ginseng by UPLC-DAD-QTOF-MS/MS and simultaneous determination of 19 ginsenosides by HPLC-ESI-MS. Journal of Ginseng Research. 40 (4), 382-394 (2016).
- vander Leeuw, G., et al. Pain and cognitive function among older adults living in the community. Journals of Gerontology Series A. Biological Sciences and Medical Sciences. 71 (3), 398-405 (2016).
- Lao, D., Liu, R., Liang, J. Study on plasma metabolomics for HIV/AIDS patients treated by HAART based on LC/MS-MS. Frontiers in Pharmacology. 13, 885386(2022).
- Li, Y., et al. Evaluation of the effectiveness of VOC-contaminated soil preparation based on AHP-CRITIC-TOPSIS model. Chemosphere. 271, 129571(2021).
- Zhong, S., Chen, Y., Miao, Y. Using improved CRITIC method to evaluate thermal coal suppliers. Scientific Reports. 13 (1), 195(2023).
- Lewis, N. S., et al. Magnetically levitated mesenchymal stem cell spheroids cultured with a collagen gel maintain phenotype and quiescence. Journal of Tissue Engineering. 8, (2017).
- Chinese Pharmacopoeia Committee. Pharmacopoeia of the People's Republic of China. 4, Chinese Medical Science and Technology Press. (2020).
- Li, G., et al. Effect of response surface methodology-optimized ultrasound-assisted pretreatment extraction on the composition of essential oil released from tribute citrus peels. Frontiers in Nutrition. 9, 840780(2022).
- Liu, X. F., et al. Hezi inhibits Tiebangchui-induced cardiotoxicity and preserves its anti-rheumatoid arthritis effects by regulating the pharmacokinetics of aconitine and deoxyaconitine. Journal of Ethnopharmacology. 302, 115915(2023).
- Smolen, J. S., et al. Rheumatoid arthritis. Nature Reviews.Disease Primers. 4, 18001(2018).
- Wang, F., et al. C19-norditerpenoid alkaloids from Aconitum szechenyianum and their effects on LPS-activated NO production. Molecules. 21 (9), 1175(2016).
- Wang, B., et al. Study on the alkaloids in Tibetan medicine Aconitum pendulum Busch by HPLC-MSn combined with column chromatography. Journal of Chromatographic Science. 54 (5), 752-758 (2016).
- Liu, S., et al. A review of traditional and current methods used to potentially reduce toxicity of Aconitum roots in Traditional Chinese Medicine. Journal of Ethnopharmacology. 207, 237-250 (2017).
- Qiu, Z. D., et al. Online discovery of the molecular mechanism for directionally detoxification of Fuzi using real-time extractive electrospray ionization mass spectrometry. Journal of Ethnopharmacology. 277, 114216(2021).
- El-Shazly, M., et al. Use, history, and liquid chromatography/mass spectrometry chemical analysis of Aconitum. Journal of Food and Drug Analysis. 24 (1), 29-45 (2016).
- Chan, T. Y. K. Aconitum alkaloid poisoning because of contamination of herbs by aconite roots. Phytotherapy Research. 30 (1), 3-8 (2016).
- Guo, L., et al. Exploring microbial dynamics associated with flavours production during highland barley wine fermentation. Food Research International. 130, 108971(2020).
- Guo, T. L., Horvath, C., Chen, L., Chen, J., Zheng, B. Understanding the nutrient composition and nutritional functions of highland barley (Qingke): A review. Trends in Food Science & Technology. 103, 109-117 (2020).
- Wu, H., et al. Anti-myocardial infarction effects of Radix Aconiti Lateralis Preparata extracts and their influence on small molecules in the heart using matrix-assisted laser desorption/ionization-mass spectrometry imaging. International Journal of Molecular Sciences. 20 (19), 4837(2019).
- Huang, G., et al. Study on cardiotoxicity and mechanism of "Fuzi" extracts based on metabonomics. International Journal of Molecular Sciences. 19 (11), 3506(2018).
- Li, S. L., et al. An insight into current advances on pharmacology, pharmacokinetics, toxicity and detoxification of aconitine. Biomedicine & Pharmacotherapy. 151, 113115(2022).
- Xie, Y., et al. Optimization of processing technology of braised Rehmanniae Raidx based on multiple indexes and response surface technology and correlation between components and color. Journal of Chinese Traditional Medicine. 47 (18), 4927-4937 (2022).
- Yang, X. Q., Xu, W., Xiao, C. P., Sun, J., Feng, Y. Z. Study on processing technology of Atractylodes chinensis with rice water and its pharmacodynamics of anti-diarrhea. Chinese Herbal Medicines. 53 (1), 78-86 (2022).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon