Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Primaria células epiteliales bronquiales Cultivada a partir de explantes
En este artículo
Resumen
A continuación se describe un método detallado para el cultivo de primaria células epiteliales bronquiales humanas a partir de explantes de tejido humano vías respiratorias bronquiales incluyendo el crecimiento diferenciado en una interfase aire-líquido. Este método proporciona una fuente abundante de células primarias para investigar el papel del epitelio de las vías respiratorias en la salud pulmonar y la enfermedad humanas.
Resumen
Células epiteliales bronquiales humanas son necesarios para los modelos de celulares de la enfermedad y para investigar el efecto de los excipientes y agentes farmacológicos sobre la función y estructura de las células epiteliales humanas. A continuación se describe en detalle el método de cultivo de células del epitelio bronquial de las vías aéreas bronquiales tejido que es recogido por el cirujano en el momento de la cirugía pulmonar (por ejemplo, el cáncer de pulmón o una cirugía de reducción de volumen pulmonar). Con la aprobación de la ética y el consentimiento informado, el cirujano obtiene lo que se necesita para la patología y nos proporciona una parte bronquial que está alejado de las áreas afectadas. El tejido se utiliza como fuente de explantes que se pueden utilizar para el cultivo de células epiteliales bronquiales primarias en la cultura. Segmentos bronquial 0,5-1cm de longitud y 1 cm de diámetro ≤ se enjuagan con EBSS frío y tejidos del parénquima se elimina el exceso. Los segmentos son a cielo abierto y picado en 2-3mm
Protocolo
Humanos segmentos bronquial proporcionar una fuente abundante de células epiteliales bronquiales primarias. En este artículo se describe un protocolo para el crecimiento y la expansión del epitelio bronquial humano (HBe) de las células recién aisladas de los segmentos bronquiales humanos. Este protocolo consta de cinco secciones:
- Revestimiento y rascarse las placas de 100 mm Cultura
- Preparación de explantes de tejido bronquial
- Los trasplantes de tejido bronquial
- Paso de las células HBE
- Crecimiento de las células ciliadas en HBE transwells
Antes de empezar Tenga en cuenta que todos los pasos se realizan en la Cabina de Seguridad Biológica (CSB), salvo indicación contraria. Por favor, asegúrese de tener todos los materiales necesarios para este procedimiento. Por favor, lea los materiales, reactivos y la sección de Preparación y asegúrese de que usted tiene aséptica (es decir, en una cabina de seguridad biológica o BSC) preparó el siguiente:
Revestimiento de la solución madre: la fibronectina (10 mg / ml), BSA (10 mg / ml) y colágeno (30 mg / ml) en solución salina balanceada de Earle s (EBSS, estéril).
Medio de cultivo: DMEM / HAM F-12 con aditivos, antibióticos, antimicóticos (1%) y SFB (1%)
La disociación de soluciones: tripsina / EDTA solución madre y DMEM/F-12 con FBS (10%)
1. Revestimiento y rascarse las placas de 100 mm Cultura: Los explantes se sembraron en placas de cultivo de 100 mm. Para empezar, las placas de recubrimiento cultura 100mm con una solución de revestimiento. Esto debe hacerse en el BSC, mantener todo estéril.
- Colocar placas de cultivo estéril de 100 mm y la solución de revestimiento (colágeno / fibronectina / BSA) en el BSC.
- Pipetear 2,0 ml de solución de recubrimiento en una placa de 100 mm.
- Giran en torno a la capa de la base de la placa. Asegúrese de que la solución de revestimiento que cubre la base de la placa de manera uniforme.
- Pipeta la solución remanente y utilizarlo para cubrir una placa de 100 mm de segundo. Repita el procedimiento para tantas placas como sea necesario. El número de placas necesarias varía según el número de explantes de tejidos.
- Asegúrese de que la solución de revestimiento que cubre las bases de las placas de manera uniforme como se ha demostrado.
- Se cubren las placas con sus tapas. Permita que los platos se sequen en la incubadora durante 1-2 horas y se aspira el exceso de solución antes de su uso para los explantes de tejido bronquial. Sin usar las placas de cultivo recubiertas se pueden colocar en una bolsa estéril, sellados y almacenados a 4 ° C para su uso posterior (se pueden almacenar hasta un mes en la nevera). Llevar a temperatura ambiente antes de su uso.
- Rociar pequeñas tijeras, bisturí, pinzas y con el 70% de etanol y poner en BSC. Cero las placas con revestimiento, presionando firmemente con el bisturí para formar pequeños profunda s X (por lo menos 4). Si el cero no es lo suficientemente profundo, trozos de tejido no se asentará en las crestas y flotará.
2. Preparación de explantes de tejido bronquial
El uso de tejido bronquial obtenido dentro de 24-36 horas después de la cirugía. Mantener el tejido en el hielo en EBSS hasta que esté listo para su uso.
- Fuera del BSC: Coloque el tejido en una placa de Petri. Enjuague el aislado muestras de tejidos humanos bronquial a fondo en EBSS.
- Diseccionar el exceso de tejido circundante.
- Cortar las piezas bronquial.
- Llevar el tejido en el BSC y la transferencia en una placa de 100 mm estériles de cultivo de tejidos con el frío DMEM/HamF12 + 1% antibiótico / antimicótico.
- Use las tijeras pequeñas afilado para cortar el tejido en 2.3 mm 3 piezas.
- Coloque un pedazo de tejido cortado en el centro de cada X con unas pinzas y presione suavemente.
- Deje que las piezas de tejido (explantes) se adhieren a la placa durante unos segundos, y luego suavemente agregar 10 ml de medio completo (DMEM/HamF12 + aditivos 1% antibiótico / antimicótico FBS + 1%). Si el tejido flota después de agregar los medios de comunicación, el uso de fórceps para empujar el tejido en las crestas de las X o hacer una nueva X. Puede ser necesario hacer nuevos s X si los bordes no son lo suficientemente profundas.
- Coloque las placas en la incubadora y los medios de comunicación cambian cada 3-4 días.
- Tejido está listo para el trasplante cuando suficientes células epiteliales han crecido alrededor de explantes de tejidos para cubrir 1-2cm áreas. Esto toma aproximadamente 4 semanas.
3. Los trasplantes de tejido bronquial
- Use 100 mm placas recubiertas y se rascó. Dado que algunos explantes de tejidos podría no tener éxito, el número de placas depende de la cantidad de piezas de tejido que se transplante. Si está utilizando placas que previamente han sido recubiertas y se almacenan a 4 ° C, llevar a temperatura ambiente antes de su uso.
- Con unas pinzas, cuidadosamente recogida de tejido de la placa original y el lugar en el centro de la X s en la nueva placa, y presione suavemente. Tejidos sin consecuencia debe ser desechada.
- Deje que los tejidos se adhieran a la placa durante unos segundos, añadir los medios de comunicación e incubar el oído como se describelier de explantes (2.7-2.9).
4. Paso del epitelio bronquial humano (HBe), las células
- Descongele los 2 ml de solución madre de tripsina / EDTA para cada placa de cultivo de tejidos de 100 mm. Diluir acciones con 6 ml de PBS estéril 0,01 (es decir, añadir 2 ml de solución madre a 6 ml de PBS (concentración final de la tripsina es de 250 mg / ml y de EDTA es de 100 ug / ml).
- Después de mudarse a explantes de una nueva placa, aspirar los medios de comunicación de las placas con 1-2cm de los anillos de las células.
- Añadir 8 ml de caliente diluida Tripsina / EDTA solución a cada placa de 100 mm y el lugar en la incubadora (37 ° C) durante 3-15 minutos. Compruebe con frecuencia, dejando a la tripsina por mucho tiempo puede dañar las células.
- Verifique las placas con un microscopio para asegurarse la mayoría de las células se han levantado. Células redondas y separar, como se muestra.
- Añadir 8 ml de FBS calentado un 10% en los medios de comunicación por placa para desactivar la solución de tripsina / EDTA.
- Combinar los volúmenes de todas las placas en un tubo (o tubos separados, si los diferentes tejidos). Recuento de células con un hemocitómetro.
- Centrifugar a 100 g durante 5 minutos. Un pellet de células se forman en la base del tubo.
- Vuelva a suspender el sedimento celular en medio completo (DMEM / Ham F12 + todos los aditivos + 1% antibiótico-antimicótico + 1% de SFB) a la concentración celular deseada.
- Lugar cada 2-3 millones de células por frasco T75 y añadir los medios de comunicación completo si es necesario. Incubar los medios de comunicación y el cambio cada 3-4 semanas. Las células crecen a sub-confluencia (80-90%) en frascos T75 en aproximadamente 4 semanas. Las células deben ser levantadas y ampliado o utilizado en sub-confluencia para evitar la senescencia.
5. Crecimiento ciliado epitelio bronquial humano (HBe) en las células transwells.
Primaria células epiteliales obtenidas de explantes de tejidos / trasplante, se puede ampliar hasta tres veces, y luego se usa. Una densidad de siembra de 50.000 a 100.000 células por cm 2 se recomienda 1,2. Promueve una mayor densidad de más rápido diferenciación.
Nota: Preparar una suspensión de células y medir su cantidad. Vuelva a suspender en el medio a 1 millón de células por 2 ml.
- Comenzar con la preparación de las membranas permeables de la transwells de pre-incubación de las inserciones de cultivo celular (DMEM / Ham F12) antes de su uso. Este paso es necesario con estas células sensibles y ayudará a la adhesión celular.
- Use los 6,5 mm insertos que se ajusten a las 24 y las placas y múltiples.
- Añadir medio a ambos lados de la membrana (por 6,5 mm inserta utilizar 0,6 ml en la parte inferior, de 0,1 ml en la parte superior). Incubar 1 hora en cultivo celular incubadora.
- Retire con cuidado (aspirar) el medio de ambos lados de la membrana a partir del volumen basal en primer lugar.
Cuidadosamente los medios: la membrana puede ser muy delicado, por medio de una pipeta por el lado de la inserción de la cultura, el uso de la cantidad indicada. No hacerlo resultará en pérdidas en los medios de comunicación a otros pozos.
- Las células de semillas después de pre-incubación de Apoyo permeable
- Pipeta cuidadosamente la suspensión de su celda en la parte apical de la membrana: para los pozos de 6,5 mm, añadir 0,1 ml de suspensión celular (es decir, 50.000 células) de la parte apical de la membrana.
- Pipeta de 0,6 ml en medio de la parte basal de la membrana.
- Alimentar a las células de los lados apical y basal durante 10 días para establecer una cultura bien diferenciadas: medio de intercambio de dos veces por semana utilizando el método demostrado:
- Retire el volumen basal primero
- Reemplazar el volumen apical (0,1 ml medio)
- Añadir 0,6 ml de medio de la parte basal de la membrana.
Este método promueve la unión de las células de la membrana y evita que las células están expuestas al aire durante largos períodos de tiempo (cambio de los medios de comunicación rápido y volver a poner en la incubadora). - Crear una interfase aire-líquido (ALI) en el día 10 por la eliminación del medio apical, a continuación, reemplazar el 0,6 ml de medio en la parte basal de la membrana.
- Mantener las células en la LPA durante 6 semanas, los medios cambian dos veces por semana. Las células ciliadas comenzarán a aparecer cuatro semanas después de la creación de la LPA. Células lograr una diferenciación en las células ciliadas uniforme 6 semanas después de la creación de la LPA.
Materiales de preparación:
1. Preparación de la solución de revestimiento de archivo (hacer esto en el BSC):
Primaria células epiteliales bronquiales humanas crecen bien en superficies recubiertas con fibronectina / BSA / colágeno 3. La solución madre se utiliza para revestimiento de 100 mm y placas de cultivo de tejidos para trasplante de explante y las culturas como se describió anteriormente. También la solución de revestimiento se puede utilizar para cubreobjetos abrigo para acelerar la adhesión celular, los cubreobjetos se pueden utilizar para inmunoticción experimentos.
- Fibronectina (1mg/ml solución stock): Use F2006-2 mg de Sigma. Disolver 2 mg en 2mls de solución salina balanceada estéril Earle s (EBSS, Sigma 28 888), el filtro con filtro de 0,2 micras jeringa en el Gabinete de Seguridad Biológica (CSB). 1 ml Conservar en el congelador a -20 ° C para su uso posterior, y el uso de 1 ml para la preparación de un 100 ml de solución de recubrimiento.
- BSA (1mg/ml solución stock): Use Sigma A4919-1g. Pesar 20 mg de BSA y se disuelven en 20 ml estéril EBSS, filtro con filtro de 0,2 micras jeringa en el BSC. Alícuotas en viales de 1 ml y guárdelos en el congelador a -20 ° C hasta que se necesite. Use 1 ml de acciones para hacer 100 ml de solución de recubrimiento.
- . Solución de colágeno de valores (siempre que el 0,1% o 1mg/ml de Sigma C8919) Nota: abierto sólo en el BSC y el cierre hermético, antes de regresar a la nevera. Utilice 3 ml de caldo para hacer 100 ml de solución de recubrimiento.
- Revestimiento de la solución madre: En el BSC: añadir colágeno 3mls (1mg/ml) a 1 ml de fibronectina (1mg/ml) y 1 ml de BSA (1mg/ml), más 95 ml EBSS (estéril). Mezclar bien y alícuotas en viales de 2 ml y almacenar en el congelador a -20 ° C hasta que se necesite. Las concentraciones finales en la solución de revestimiento de valores: la fibronectina (10 mg / ml), BSA (10 mg / ml) y colágeno (30 mg / ml) en EBSS.
2. Preparación del medio de cultivo (preparación en el BSC): Media consiste en DMEM / HAM F-12 de Sigma con extracto de pituitaria bovina (15 mg / ml) y el factor de crecimiento epidérmico (10 ng / ml) con otros aditivos, como se indica a continuación. Antibiótico / antimicótico (1%) y SFB (1%) se añadió recientemente cada vez que se cambia el medio de cultivo. Este medio fue compilado mediante la revisión de varios métodos que se describen las culturas las vías respiratorias de las células epiteliales 3-9. Nuestro medio está diseñado para un óptimo crecimiento de las células epiteliales bronquiales.
- Extracto de pituitaria bovina (BPE solución madre 1mg/ml): Sigma P1476 (2,5 ml de solución de 14mg/ml BPE estéril y filtrada): Diluir 2,5 ml de acciones (14mg/ml) a una concentración final de 1mg/ml. es decir, añadir 2,5 ml de archivo BPE a 32,5 ml de EBSS estéril para un stock de 1mg/ml. Dividir en partes alícuotas de 7,5 ml (4 tubos de 7,5 ml alícuotas y un tubo de alícuota de 5 ml). Después de la dilución, almacenar alícuotas a -20 ° C hasta que se necesite. El almacenamiento prolongado del producto reconstituido y los ciclos de congelación y descongelación no son recomendables.
- Factor de crecimiento epidérmico (EGF 10 mg / ml de solución stock): Sigma E9644-0.2mg. Reconstituir el contenido (0,2 mg) en 20 ms de 0,2 mm de ácido acético 10 mM filtrado que contiene 0,1% de BSA (es decir, se disuelven 20 mg de BSA en 20 ml de ácido acético 10 mM y el filtro se utilizan para reconstruir FEAG). Alícuota en alícuotas de 0,5 ml y guárdelos en el congelador a -20. Use 100μl de 100 ml de medio.
- Epinefrina (5mg/ml solución stock): Sigma E1635. Disolver 10 mg en 2 ml de ácido clorhídrico 1M filtrado (HCl), alícuotas en viales de 50 l y la congelación (-20 ° C).
- Insulina (2mg/ml solución stock): Sigma I6634 50mg. Disolver 50 mg en 25 ml de filtrado (filtro de 0.2μm) HCl diluido (1 mm). Alícuotas en viales 1.25ml.
- Tranferrin Humanos (50 mg / ml de solución stock): Sigma T8158 de 100 mg. Disolver 100 mg en 2 ml DH20 (filtrado con filtro de 0,2 micras). Alícuota de 100μl cada uno (0,5 ml en ampollas).
- Triyodo-L-tironina (1mg/ml solución stock): Sigma T6397 de 100 mg. Disolver 100 mg en 100 ml de 1M HCl filtrada. Alícuota en alícuotas de 1 ml. 0,5 ml de alícuota en alícuotas 10μl.
- Hydorcortisone (5mg/ml solución stock):. Sigma H0888 Pesar 100 mg y se disuelven en 20 ml de etanol filtrado de imágenes de stock 5mg/ml. Alícuota de los viales de 1 ml. Divide un 1 ml (5mg/ml) a 50μl alícuotas (0,5 ml viales).
- El ácido retinoico (1mg/ml solución de archivo, se diluye a 0.01mg/ml cuando se usa): Sigma R2625 100mg). Disolver 100 mg en 10 ml de etanol. Divide a alícuotas de 1.0 ml. Divide (1 ml) vial de 50 tubos de 20μl cada uno. Congelar a -20 ° C. Tomar un vial 20μl y diluir a 2000μl con los medios de comunicación para una población de 0.01mg/ml cuando sea necesario.
- Solución de albúmina de suero bovino, esterilizada por filtración de cultivo celular, probado: Sigma A8412. Guarde la solución en el frío (4 ° C) hasta que se necesite. Abierto sólo en el BSC.
- Antibiótico-antimicótico, Sigma A5955: alícuota de 1 ml de volumen y se congelan a -20 ° C hasta que se necesite. Uso en el 1% concentración final en el medio.
- SFB, Sigma F1015: Desactivar SFB a 50 ° C durante 30 minutos. Dejar enfriar en el BSC. Alícuota de 1 ml en viales estériles y 10 ml. Uso en el 1% concentración final en medio de cultivo y el 10% de concentración final en los medios de comunicación para neutralizar la tripsina / EDTA.
- Constitución del medio de cultivo:
Para500 ml de medio DMEM/HamF12 uso:- 1 tubo de BPE (7,5 ml cada una de 1mg/ml) para una concentración final de 15μg/ml.
- 1 tubo de EGF (0,5 ml de 10μg/ml) para una concentración final de 10ng/ml.
- 1 tubo de epinefrina (50μl de 5mg/ml) para una concentración final de 0.5μg/ml.
- 1 frasco de insulina (1.25ml de 2mg/ml) para una concentración final de 5μg/ml.
- 1 vial de transferrina (100μl de 50mg/ml) para una concentración final de 10μg/ml.
- 5 l de triyodo-L-tironina (a 1mg/ml) para una concentración final de 10ng/ml.
- 1 vial de hidrocortisona (50μl de 5mg/ml) para una concentración final de 0.5μg/ml.
- 5 l de ácido retinoico diluido a 0.01mg/ml para una concentración final de 0.1ng/ml.
- 10 l solución de albúmina de suero bovino para una concentración final de 1.5μg/ml
3. Preparación de las soluciones de disociación:
- Preparación de la solución madre de tripsina / EDTA: disolver 100 mg de tripsina (Sigma T9935 a 100 mg) y 40 mg de EDTA (Sigma E6758) en 500 ml de PBS 0,01 M (Sigma E6758). . Alícuotas en viales de 2 ml y almacenar en el congelador a -20 ° C dilución de la solución: Añadir 2 ml de solución madre a 6 ml de PBS (concentración final de la tripsina es de 250 mg / ml y de EDTA es de 100 ug / ml).
- Solución para detener las reacciones enzimáticas: Preparar fresca 10% de SFB en los medios de comunicación en el BSC: añadir 1 ml de FBS a 9 ml de medios (DMEM / Ham F-12). Por cada placa de 100 mm use 8 ml de calentar 10% de SFB para neutralizar 8 ml de la solución de la disociación.
4. Requisitos especiales:
- Cuando el cultivo de células epiteliales, lo que necesita para mantener todo limpio y desinfectado. Todos los reactivos utilizados para el cultivo celular debe ser estéril o filtrada con un filtro de 0.2μm. Preparación de los materiales y los aditivos se debe hacer en una cabina de seguridad biológica (BSC). Además de los medios de comunicación o el cambio de los medios de comunicación se debe hacer en un BSC.
- Recoger el cabello de distancia, una gorra desechable si está disponible, y use una bata de laboratorio y guantes.
- Mantenga todas las superficies de trabajo libres de obstáculos. Limpie las superficies de trabajo con etanol al 70% entre las operaciones y permitir un mínimo de 15 minutos entre el manejo de las diferentes culturas.
- Etiqueta de todos los reactivos y las botellas de los medios de comunicación, incluirá la fecha de recepción y la fecha de preparación.
- Examine las culturas y los medios de comunicación regularmente por evidencia de contaminación bacteriana o fúngica grave.
- Prueba de regularidad para micoplasma (si es necesario)
- Calentamiento medio de cultivo a 37 ° C antes de cambiar los medios de comunicación en las células.
- Antibióticos / antimicóticos y FBS debe estar recién añadido al medio.
- Cambio de medio por lo menos cada 3-4 días. No permita que las células permanezcan a temperatura ambiente durante un tiempo largo. Cambiar los medios de comunicación y devuelva de inmediato a la incubadora.
Los resultados representativos:
Características de la cultura y la morfología de las células epiteliales bronquiales
Microscopía de las células epiteliales bronquiales cepillado de los segmentos bronquiales para el cultivo, antes de cultivar, demostró las tiras de las células epiteliales ciliadas tanto y no ciliadas que indica un epitelio normal (Figura 1, Suplemento 1). Inmunotinción de los preparativos citospina de las células de los explantes y las células sembradas en cubreobjetos reveló que todas las células fueron positivas para las citoqueratinas específicas del epitelio (Figura 3). Culturas con éxito a partir de explantes de tejido bronquial se produjeron en 8 de los 9 tejidos, como uno de los cultivos de explantes se infectó. Los anillos de las células epiteliales alcanzó 2.1 cm de radio en 3-4 semanas (Figura 2a). Explantes se cultivaron con éxito otra vez hasta 6 veces. En todas las culturas con éxito, no había evidencia de migración de las células dentro de las 48 horas de haber comenzado el trasplante (figura 2b). Las células tenían un aspecto de adoquín que es distinto para estas células epiteliales, como se muestra en las figuras 2, 4, 5 y 6. Sub-cultivos de células bronquiales mostró inmunotinción uniforme positivas para citoqueratina y E-cadherina. Inmunotinción con anticuerpos específicos frente a otros tipos de células no mostraron ningún indicio de contaminación de los cultivos de fibroblastos, mesenchymal células, o endotelial (α-SMA, vimentina y CD31: PECAM-1 manchas, respectivamente) (Figura 5). Las células cultivadas en las membranas de poliéster permeable (transwells) con aire-líquido interfaz diferenciada en epitelio ciliado como se muestra en la Figura 6. Grabaciones de vídeo representante de las células epiteliales bronquiales crecido en transwells demostrar un epitelio diferenciado con cilios (Suplemento 2).
Características de las culturas humanas de las células epiteliales bronquiales prueba se muestran en la Tabla 1. La mediana de tiempo hasta el primer pase (P1) fue de 4 semanas, y el rendimiento medio fue de 15,1 ± 2,75 millones de células (n = 9 tejidos). La viabilidad de las células de los explantes y en P1 se evaluó mediante la exclusión del azul tripano, y fue consistentemente alta (99%) en estos cultivos bronquiales. Sub-cultivos de células de los cultivos de explantes de cada tejido se agruparon tras el paso primero para su uso posterior. El número de células significa recuperar a partir de explantes fue significativamente mayor que la cultura posterior paso (cada 2 millones de células a partir de P1 dado P2: 6,75 ± 2,4 millones de células, tejidos n = 5). Una cultura P2 fue descartado como la morfología no era típica de las células epiteliales (Figura 7). Del mismo modo, otros dos pasajes (P2 y P3) de diferentes tejidos (Figura 7b) fueron descartados.
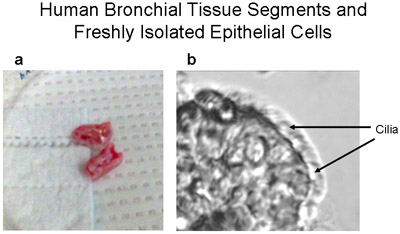
Figura 1 segmentos de tejido humano bronquial y una banda recién aisladas del epitelio de las células ciliadas y no ciliadas. (A) imagen del Representante de los derechos humanos segmentos de tejido bronquial - ~ 1-2cm de largo y <1 cm de diámetro a utilizar para cultivos primarios de células epiteliales bronquiales humanas. (B) Una franja de células epiteliales bronquiales cepillado bronquial del segmento demuestra las células epiteliales ciliadas tanto y no ciliadas, 320X de aumento. Vídeo de células con cilios se presenta como un suplemento.
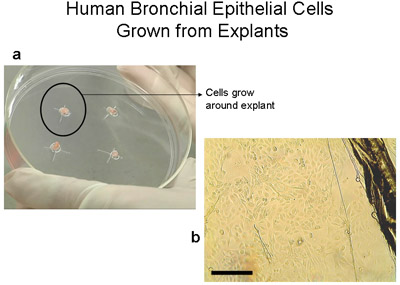
Figura 2 células epiteliales bronquiales crecido a partir de explantes de 100 mm de placas de cultivo tisular. a) la placa de 100 mm con 2-3Mm3 tejido. Tenga en cuenta el anillo de células de alrededor de 1-2cm que se hace visible a simple vista después de 3-4 semanas. b) la imagen del borde del tejido explante y las células epiteliales que migran desde el explante, bar = 100μm. Explantes trasladado a un trasplante de la nueva placa se. Los explantes se pueden trasplantar hasta 6 veces.
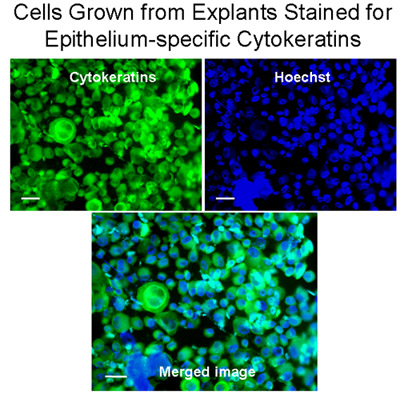
Figura 3 Las células cultivadas a partir de explantes teñidos para epitelio-específicos citoqueratinas. Cytospins de células de los explantes fueron teñidas para las citoqueratinas (verde) con el anticuerpo monoclonal anti-Pan citoqueratina-FITC (mezcla) que reconoce humanos citoqueratinas 1, 4, 5, 6, 8, 10, 13, 18 y 19. Los núcleos se tiñeron con Hoechst tinción (azul). La imagen combinada demuestra que las células bronquiales crecido a partir de explantes fueron principalmente las células epiteliales, Bar = 20μm.
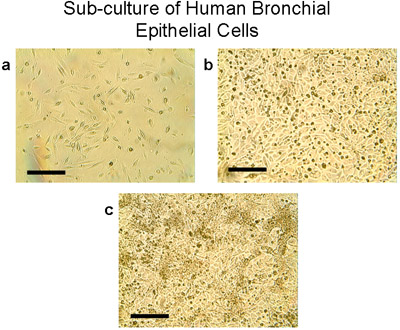
Figura 4 sub-cultura de las células epiteliales bronquiales. a) Uso de tripsina / EDTA, las células de los explantes y trasplantes que se levanten de las placas de 100 mm, se contaron y cabeza de serie en 2-3 millones de células por frasco T75. Las células crecen a sub-confluencia (80-90%) en frascos T75 en días 28-30 (b, c). Tenga en cuenta la morfología típica de adoquines de las células epiteliales, Bar = 100μm.
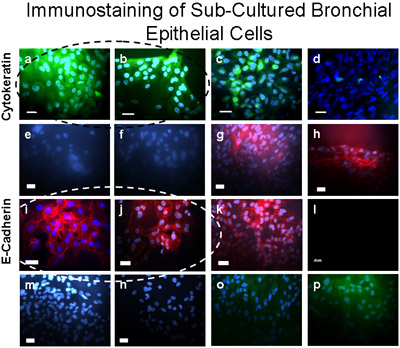
Figura 5 sub-cultivos de células bronquiales fueron verificadas como inmunotinción del epitelio de usar. Estas células teñidas positivo (verde) para citoqueratina-FITC (a, b), un control positivo para citoqueratina-FITC se muestra en las células epiteliales A549 (c) y un control negativo se demuestra en los fibroblastos (d). Cultivos de células bronquiales teñidas positivo (rojo oscuro) para E-Cadherin/Alexa Fluor 594 (i, j), y no se mancha de α-SMA-Cy3 (e, f), vimentina / TRITC (m), ni CD31 (PECAM -1/FITC) (o) indica que no hay contaminación de los principales cultivos de células del epitelio bronquial con el músculo liso, mesenquimales o células endoteliales, respectivamente. Control positivo (rojo oscuro) para E-Cadherin/Alexa Fluor 594 se demuestra en las células epiteliales A549 (k). Control positivo de α-SMA-Cy3 (rojo) se demuestra en los fibroblastos (g, h). Los controles secundarios de anticuerpos se muestran en las células epiteliales bronquiales de Alexa Fluor 594 (l), conejo anti-ratón TRITC (n) y el burro de cabra anti-FITC (p). Bar = 20μm.
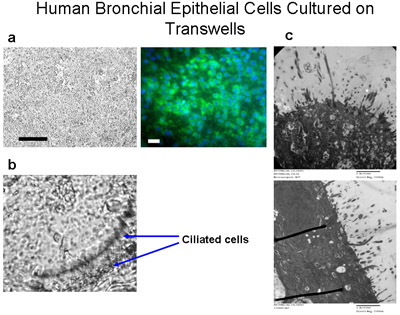
Figura 6 Las células del epitelio bronquial cultivadas en transwells. Las células ciliadas se cultivan en las membranas de poliéster permeable (6,5 mm de diámetro) a una densidad de siembra de 50.000 cells por pozo (a) Bar = 100μm. Inmunotinción de las células cultivadas en transwells con citoqueratina-FITC (verde) y DAPI (azul) demuestra que estas células son las células epiteliales, principalmente, Bar = 20μm. Las células se cultivan sumergido en los medios de comunicación durante 10 días, los medios de comunicación se alimenta desde la parte inferior sólo por otro 4-6 semanas para crear un ALI hasta que los cilios se cultivan como se muestra en (b) ampliación de 160x,. Ver Suplemento 2 videos de cilios. (C) las imágenes TEM muestran un crecimiento cilios de las culturas ALI a las 6 semanas, aumento = 150000x.
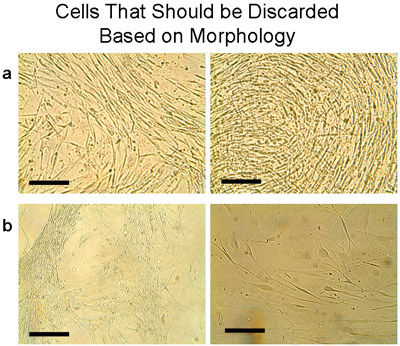
Figura 7 Ejemplo de las células que deben ser desechados sobre la base de la morfología. Estas células suelen aparecer cuando el tejido ha sido trasplantado en muchas ocasiones. Tenga en cuenta que tanto las células y los trasplantes deben ser desechados. a) Las células se obtuvieron de una placa con los trasplantes que se cultivaron 6 veces y se colocaron en un frasco T75. Dentro de una semana las células mostraban una morfología diferente que no representan el aspecto de adoquín de las células epiteliales. En cambio, delgada células alargadas crecían densamente. b) Más ejemplos de células que no se mezclarán con las células del epitelio normal, pero debe ser desechada. Bar = 100μm.
Tabla 1: Características de las culturas humanas de las células epiteliales bronquiales
| Tasa de éxito (# de los tejidos) | 08/09 (88,8%) |
| Tiempo de media (rango) de P1 (semanas) | 4 (3-5) |
| Media (SEM) no celular. en P1 | 15,1 (2,75) x 10 6 |
| Media (SEM) la viabilidad en P1 | 99% (2%) |
| (P1 = primer paso) | |
Suplemento 1 muestra una franja de ciliadas y no ciliadas células epiteliales bronquiales cepillado de un segmento bronquial humano utilizados para trasplantes, 320X de aumento. Haga clic aquí para el Suplemento de un vídeo.
Suplemento 2 diferenciadas las células epiteliales bronquiales crecido en una interfase aire-líquido. Videos (2a y 2b) muestran cilios, ampliación de 160X y 320X respectivamente. Haga clic aquí para el vídeo 2A Suplemento. Haga clic aquí para el vídeo 2B Suplemento.
Discusión
En este estudio se presentan métodos detallados para la cultura y la expansión de la enseñanza primaria humanos células epiteliales bronquiales. Hemos demostrado cómo los explantes y el trasplante de tejido bronquial, cultivadas en los medios de comunicación que promueven el crecimiento de las células epiteliales, pueden proporcionar una fuente continua de las células epiteliales de las vías respiratorias humanas para los estudios de la no-diferenciados modelos celulares (sumergido) y diferenciado (cultivados e...
Agradecimientos
Los autores están muy agradecidos con el Dr. Richard Inculet para proporcionar los tejidos bronquiales. Junta de Ética de Investigación aprobaciones se obtuvieron de Salud de San José Hamilton y la Universidad de Western Ontario / Londres Centro de Ciencias de la Salud (Dr. David McCormack), Tejidos y Comité de Archivos del Departamento de Patología. También agradecemos a Ernie Spitzer (Microscopía Electrónica de la Universidad McMaster) para proporcionar TEM de nuestras culturas ALI, y Farkas Daniela para proporcionar algunos de los materiales necesarios para la inmunotinción. Este trabajo fue financiado por una subvención plazo de bloques de la Sociedad Torácica de Ontario, el Dr. Asma Yaghi fue apoyado por una beca FSORC, Salud de San José, Hamilton, Ontario, Canadá.
Materiales
Otros requisitos: incubadora, del gabinete de seguridad biológica (BSC), centrífuga, las placas de 100 mm de la cultura, tubos estériles (15 ml, 50 ml y 2 ml), puntas de pipeta, bisturí y hojas, pequeñas tijeras afiladas, batas y guantes. Estas se pueden obtener de sus proveedores preferidos.
Referencias
- Phillips, J. Growing Cells on Transwell Inserts - Tips and Techniques [Internet]. Corning Life Sciences, Technical Resources, Online Training. , (2008).
- Turi, J. L. Oxidative stress activates anion exchange protein 2 and AP-1 in airway epithelial cells. Am J Physiol Lung Cell Mol. Physiol. 283, L791-L798 (2002).
- Lechner, J. F., Haugen, A., McClendon, I. A., Pettis, E. W. Clonal growth of normal adult human bronchial epithelial cells in a serum-free medium. In Vitro. 18, 633-642 (1982).
- Yoshisue, H. Characterization of ciliated bronchial epithelium 1, a ciliated cell-associated gene induced during mucociliary differentiation. Am. J. Respir. Cell Mol. Biol. 31, 491-500 (2004).
- Wetering, S. v. a. n. Regulation of secretory leukocyte proteinase inhibitor (SLPI) production by human bronchial epithelial cells: increase of cell-associated SLPI by neutrophil elastase. J. Investig. Med. 48, 359-366 (2000).
- Tristram, D. A., Hicks, W., Hard, R. Respiratory syncytial virus and human bronchial epithelium. Arch. Otolaryngol. Head Neck Surg. 124, 777-783 (1998).
- Mattinger, C., Nyugen, T., Schafer, D., Hormann, K. Evaluation of serum-free culture conditions for primary human nasal epithelial cells. Int. J. Hyg. Environ. Health. 205, 235-238 (2002).
- Freshney, R. I., Freshney, R. I. . Culture of epithelial cells. , 1-23 (1992).
- Freshney, R. I., Freshney, R. I. Normal human bronchial epithelial cell cultures in Culture of specialized cells series. Culture of epithelial cells. , 181-196 (1992).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados