Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Первичные человеческие бронхиальные эпителиальные клетки, выращенных из эксплантов
Резюме
Здесь мы опишем подробную метод выращивания первичных человеческих бронхиальных эпителиальных клеток из эксплантатов человека бронхиальной ткани дыхательных путей, в том числе дифференцированного роста на воздух-жидкость. Этот метод обеспечивает богатый источник первичных клеток для исследования роли дыхательных путей эпителия в области здоровья человека легких и болезней.
Аннотация
Человек бронхиальные эпителиальные клетки необходимы для клеточной модели заболевания и исследовать влияние вспомогательных веществ и фармакологических агентов на функции и структуру человеческого эпителиальных клеток. Здесь мы подробно описать метод выращивания бронхиальных эпителиальных клеток бронхиальной ткани дыхательных путей, которые собирают хирург во времена легочной хирургии (например, рак легких или легкие сокращения объема операции). С этикой утверждения и информированное согласие, хирург берет то, что нужно для патологии и дает нам бронхиальной часть, удаленного от больных областях. Ткани затем используется в качестве источника эксплантов, которые можно использовать для выращивания первичной бронхиальной эпителиальных клеток в культуре. Бронхиальная сегментов примерно 0,5-1см долго и ≤ 1 см в диаметре промыть холодной EBSS и избыток паренхиматозной ткани удаляется. Сегменты разрезать и фарш на 2-3мм
протокол
Бронхиальная человек сегменты обеспечивают обильным источником первичной бронхиальной эпителиальных клеток. В этой статье мы расскажем протокол для роста и расширения прав бронхиального эпителия (HBE) клетки свежевыделенных человека бронхиальных сегментов. Этот протокол состоит из пяти разделов:
- Покрытие и царапин 100мм пластины культуры
- Подготовка Бронхиальная эксплантатов ткани
- Бронхиальная трансплантации тканей
- Прохождение HBE Клетки
- Рост ресничных клеток HBE на Transwells
Прежде чем начать Обратите внимание, что все шаги делаются в БИОЛОГИЧЕСКИЕ КАБИНЕТА БЕЗОПАСНОСТИ (BSC), если не указано иное. Пожалуйста, убедитесь, что все материалы, необходимые для этой процедуры. Пожалуйста, прочитайте материалы, реагенты и подготовка раздел и убедитесь, что у вас есть асептически (т.е. в биологических Кабинет безопасности или BSC) подготовила следующее:
Покрытие маточного раствора: фибронектина (10 мкг / мл), BSA (10 мкг / мл) и коллагена (30 мкг / мл) в сбалансированном солевом растворе Эрла с (EBSS, стерильные).
Культура среда: DMEM / Хэма F-12 с добавками, противогрибковым антибиотикам (1%) и FBS (1%)
Диссоциация решения: трипсина / ЭДТА маточного раствора и DMEM/F-12 с FBS (10%)
1. Покрытие и царапин 100мм пластины Культура: эксплантаты будут покрыты в 100 мм пластин культуры. Начните с покрытием 100 мм пластин культуры с покрытием решение. Это должно быть сделано в BSC, держите все стерильно.
- Место стерильной 100 мм пластин культуры и раствор для покрытия (коллаген / фибронектина / BSA) в BSC.
- Пипетка 2,0 мл раствора для покрытия в 100 мм пластины.
- Swirl вокруг, чтобы покрыть основание пластины. Убедитесь, что раствор для покрытия охватывает база пластины равномерно.
- Внесите оставшиеся решение и использовать его, чтобы покрыть вторым 100мм пластины. Повторите столько пластин по мере необходимости. Количество пластин определяется в зависимости от числа ткани эксплантов.
- Убедитесь, что раствор для покрытия охватывает основы пластин равномерно, как показано.
- Обложка пластин с их обложки. Разрешить пластин сушить в инкубаторе в течение 1-2 часов и аспирации избыточного раствор перед использованием при бронхиальной эксплантатов ткани. Неиспользованные пластинками, покрытыми культуры могут быть помещены в стерильные мешок; опечатаны и храниться при температуре 4 ° C для дальнейшего использования (может храниться до месяца, в холодильнике). Довести до комнатной температуры перед использованием.
- Спрей чистые небольшие острые ножницы, скальпель, пинцет и с 70% этанола и ввести в BSC. Царапинам покрытие пластин, нажав крепко скальпель для формирования глубоких небольших X с (по крайней мере 4). Если царапины не достаточно глубоко, ткани куски не придет в хребтах и поплывет.
2. Подготовка Бронхиальная эксплантатов ткани
Используйте бронхиальной ткани, полученной в течение 24-36 часов после операции. Держите ткани на льду в EBSS до готовности к использованию.
- За пределами BSC: Поместите ткань в чашке Петри. Промыть изолированных человека бронхиальной образцов ткани тщательно EBSS.
- Рассеките лишний окружающие ткани.
- Разрежьте бронхиальной штук.
- Принесите ткани в BSC и передачи в стерильный 100мм пластины культуры ткани с холодной DMEM/HamF12 + 1% антибиотик / противогрибковым.
- Используйте резкие небольшие ножницы, чтобы вырезать ткань на 2-3 мм 3 шт.
- Разместите один кусок вырезать ткань в центре каждого X пинцетом и слегка прижмите.
- Пусть ткани штук (эксплантов) придерживаются пластину в течение нескольких секунд, а затем осторожно добавить 10 мл полной среды (DMEM/HamF12 + добавки +1% антибиотик / противогрибковым + 1% FBS). Если ткань плывет после добавления средства массовой информации, использование щипцов, чтобы подтолкнуть ткани в хребтов X или сделать новую X. Это может быть необходимо, чтобы сделать новый X с, если хребты не достаточно глубоко.
- Место пластин в инкубатор и изменение средств массовой информации каждые 3-4 дня.
- Ткани готовы к пересадке, когда достаточное эпителиальные клетки росли вокруг ткани эксплантов для покрытия 1-2см областях. Это занимает около 4 недель.
3. Бронхиальная трансплантации тканей
- Используйте 100 мм с покрытием и поцарапал пластин. Так как некоторые ткани эксплантов не может быть успешным, количество пластин зависит от того, сколько кусочков ткани вы пересадки. При использовании пластин, которые ранее были покрыты и хранили при 4 ° С, доводят до комнатной температуры перед использованием.
- Использование щипцов, тщательно подобрать ткань от исходной пластине и место в центре X с в новую пластинку, и слегка прижмите. Ткани с результатом не должна быть отброшена.
- Давайте ткани придерживаться пластину в течение нескольких секунд, добавить средства массовой информации и инкубировать, как описано ухоLier для эксплантов (2,7-2,9).
4. Прохождение человеческого эпителия бронхов (HBE) клеток
- Оттепель 2 мл трипсина / ЭДТА маточного раствора для каждой пластины 100 мм культуры ткани. Развести акции с 6 мл стерильного 0,01 М PBS (то есть добавить 2 мл исходного раствора до 6 мл PBS (конечная концентрация трипсина составляет 250 мкг / мл и для ЭДТА составляет 100 мкг / мл).
- После переезда эксплантов на новую пластинку, аспирация средств массовой информации из пластин с 1-2см кольцами клеток.
- Добавить 8 мл подогретой разбавленный трипсин / ЭДТА решение для каждой пластины 100 мм и поместить в инкубатор (37 ° С) в течение 3-15 минут. Проверить часто, оставляя трипсина слишком долго может привести к повреждению клеток.
- Проверьте пластины под микроскопом, чтобы убедиться, что большинство клеток были сняты. Клетки будут окружить и отделить, как показано на рисунке.
- Добавить 8 мл подогретой 10% FBS в СМИ на чашку для инактивации трипсина / ЭДТА раствором.
- Комбинат объемов всех пластин в одну трубу (или отдельных труб при различных тканей). Граф клеток с использованием hemacytometer.
- Центрифуга на 100 г в течение 5 минут. Осадок клеток образуют у основания трубы.
- Повторное приостановить осадок клеток в полной среде (DMEM / Хэма F12 + все добавки + 1% антибиотик противогрибкового + 1% FBS) до желаемой концентрации клеток.
- Место каждого 2-3 млн. клеток на T75 колбу и добавить полную СМИ по мере необходимости. Инкубируйте и изменение средств массовой информации каждые 3-4 недели. Клетки растут к югу от слияния (80-90%) в T75 колбы в течение 4 недель. Клетки должны быть отменены и расширена или использована на суб-слияния, чтобы предотвратить старение.
5. Рост Ресничные правам эпителия бронхов (HBE) клеток на Transwells.
Первичные эпителиальные клетки, выращенные из ткани эксплантаты / трансплантации, может быть расширена до трех раз, а затем использоваться. Плотности посева от 50000 до 100000 клеток на см 2 рекомендуется 1,2. Более высокая плотность способствует более быстрому дифференциации.
Примечание: Подготовка суспензии клеток и измерить их количество. Повторное приостановить в культуральной среде на 1 млн. клеток на 2 мл.
- Начните с подготовки мембран из transwells путем предварительной инкубации вставками культуре клеток со средней (DMEM / Хэма F12) перед использованием. Этот шаг необходим, с этими чувствительными клетками и поможет ячейки привязанности.
- Используйте 6,5 мм вставки, которые вписываются в 24 и кустовых пластин.
- Добавить среды по обе стороны мембраны (для 6,5 мм вставки использования 0.6ml на дно, 0,1 мл на вершине). Инкубируйте 1 час в культуре клеток инкубатора.
- Осторожно снимите (аспирация) среда с обеих сторон мембраны, начиная с базальной том.
Осторожно означает: мембрана может быть легко повреждены, поэтому пипетки средний вниз сторона культуры вставки, использование объема рекомендуется. Невыполнение этого требования может привести к утечке через СМИ к другим скважинам.
- Семенной клеток после предварительной инкубации проницаемой поддержки
- Внесите ваши тщательно суспензии клеток в апикальной стороне мембраны: для 6,5 мм скважин добавить 0,1 мл клеточной суспензии (т.е. 50 000 клеток) на апикальной стороне мембраны.
- Внесите 0.6ml среды на базальной стороне мембраны.
- Поток клетки апикальной и базальной стороны в течение 10 дней, чтобы установить хорошо дифференцированные культуры: средства обмена в два раза в неделю, используя метод показал:
- Удалить базального объема первого
- Замените апикальной объема (0,1 мл среды)
- Добавить 0,6 мл среды в базальной стороне мембраны.
Этот метод способствует ячейки привязанность к мембране и предотвращает клетки от воздействия воздуха в течение длительного периода времени (обмен СМИ быстро и положить обратно в инкубатор). - Создать воздух-жидкость (ALI) на 10 день, удаляя апикальной среде, то, заменяя 0,6 мл среды на базальной стороне мембраны.
- Поддерживать клетки в АЛИ в течение 6 недель, изменение средств массовой информации два раза в неделю. Ресничные клетки начнут появляться через 4 недели после создания АЛИ. Клетки будет добиться равномерного дифференцировке в клетки мерцательного 6 недель после создания АЛИ.
Материалы приготовления:
1. Подготовка раствора для покрытия акций (сделать это в BSC):
Первичные человеческие бронхиальные эпителиальные клетки хорошо растут на поверхности, покрытые фибронектина / BSA / коллаген 3. Раствор для нанесения покрытия фондового используется для 100 мм культуре ткани пластины для эксплантов и трансплантации культур, как описано выше. Кроме того, раствор для покрытия могут быть использованы для покрытия покровные для ускорения ячейки привязанности, покровные затем может быть использована для иммунной экспериментов.
- Фибронектин (1mg/ml маточного раствора): Используйте F2006-2 мг от Sigma. Растворите 2 мг в 2mls сбалансированных соли стерильной Эрл ы Решение (EBSS, Sigma 28 888), фильтр с диаметром пор 0,2 мкм фильтр в шприц Биологические кабинета безопасности (BSC). Магазин в 1 мл -20 ° C морозильник для дальнейшего использования, а также использовать 1 мл для подготовки 100 мл раствора для покрытия.
- BSA (1mg/ml маточного раствора): Используйте Sigma A4919-1г. Взвесьте 20 мг BSA и растворить в 20 мл стерильного EBSS, фильтр с диаметром пор 0,2 мкм шприц фильтр в BSC. Алиготе в 1 мл флаконы и хранят в морозильной камере -20 ° C до необходимости. Используйте 1 мл акции, чтобы сделать 100mls покрытия решение.
- . Коллаген маточного раствора (при условии, как 0,1%, или на 1mg/ml от Sigma C8919) Примечание: открываются только в BSC и печатью плотно перед возвращением в холодильник. Используйте 3 мл акции, чтобы сделать 100 мл раствора для покрытия.
- Покрытие маточного раствора: В BSC: добавить 3mls коллагена (1mg/ml) до 1 мл Фибронектин (1mg/ml) и 1 мл BSA (1mg/ml), плюс 95 мл EBSS (стерильные). Хорошо перемешайте и аликвоту в 2 мл флаконах и хранить в морозильной камере -20 ° C до необходимости. Заключительные концентрации в растворе для покрытия складе: фибронектина (10 мкг / мл), BSA (10 мкг / мл) и коллагена (30 мкг / мл) в EBSS.
2. Подготовка питательной среды (подготовка в BSC): средняя состоит из DMEM / Хэма F-12 из Sigma с бычьей гипофизарный экстракт (15 мкг / мл) и эпидермального фактора роста (10 нг / мл) с другими добавками, как указано ниже. Антибиотик / противогрибковым (1%) и FBS (1%) добавляются только что каждый раз, когда культура среда изменилась. Эта среда была собрана путем анализа различных методов, которые описаны дыхательных путей эпителиальных клеточных культурах 3-9. Наша среда предназначена для оптимального роста человека бронхиальных эпителиальных клеток.
- Говядина гипофизарный экстракт (BPE 1mg/ml маточного раствора): Sigma P1476 (2,5 мл на BPE 14mg/ml стерильные и фильтруется раствор): развести 2,5 мл акций (14mg/ml) до конечной концентрации 1mg/ml. т.е. добавить 2,5 мл BPE акции до 32,5 мл стерильного EBSS для запаса 1mg/ml. Разделить на порции 7,5 мл (4 трубы в 7,5 мл аликвоты и одна трубка 5 мл аликвоты). После разбавления, хранить аликвоты при -20 ° C до необходимости. Длительное хранение восстановленного продукта и повторного замораживания и оттаивания не рекомендуется.
- Эпидермального фактора роста (ЭФР 10 мкг / мл маточного раствора): Сигма-E9644 0,2 мг. Развести содержимое (0,2 мг) в 20 мс 0,2 мм фильтруется 10 мМ уксусной кислоты, содержащей 0,1% BSA (т.е. растворяют 20 мг BSA в 20 мл 10 мМ уксусной кислоты и затем использовать фильтр для восстановления эпидермального фактора роста). Алиготе в 0,5 мл аликвоты и хранить в морозильной камере -20. Используйте 100 мкл на 100 мл среды.
- Адреналин (5mg/ml маточного раствора): Sigma E1635. Растворите 10 мг в 2 мл 1М фильтруется соляной кислоты (HCl), аликвоту в 50 мкл флаконы и замораживают (-20 ° С).
- Инсулин (2mg/ml маточного раствора): Sigma I6634 50 мг. Растворите 50 мг в 25 мл фильтруют (фильтр 0,2 мкм) разбавленной соляной кислоты (1 мм). Алиготе в 1.25ml ампул.
- Tranferrin прав (50 мг / мл маточного раствора): Sigma T8158 100 мг. Растворите 100 мг в 2 мл DH20 (фильтруется с 0,2 мкм). Алиготе к 100 мкл каждого (в 0,5 мл флаконах).
- Трийод-L-тиронина (1mg/ml маточного раствора): Sigma T6397 100 мг. Растворите 100 мг в 100 мл 1М HCl фильтруется. Алиготе в 1 мл аликвоты. Алиготе 0,5 мл в 10 мкл аликвоты.
- Hydorcortisone (5mg/ml маточного раствора). Сигма H0888 отвешивать 100 мг и растворить в 20 мл этанола, фильтруется для 5mg/ml акций. Алиготе 1 мл флаконах. Разделить 1 мл (5mg/ml) до 50 мкл аликвоты (0,5 мл флаконах).
- Ретиноевая кислота (1mg/ml маточного раствора, разбавляют до 0.01mg/ml при использовании): Sigma R2625 100 мг). Растворите 100 мг в 10 мл этанола. Разделить на порции по 1,0 мл. Разделить (1 мл) флакон до 50 труб 20 мкл каждого из них. Замораживание при -20 ° C. Возьмите один флакон 20 мкл и развести на 2000μl со средствами массовой информации для запаса 0.01mg/ml когда это необходимо.
- Альбумин раствор из бычьей сыворотки, стерильно фильтруется, культура клеток испытания: Sigma A8412. Магазин решение в холодный (4 ° С), пока это необходимо. Открытый только в BSC.
- Антибиотик-противогрибковым, Sigma A5955: аликвоту на 1 мл объема и замерзает при -20 ° C до необходимости. Используйте на 1% конечной концентрации в среде.
- FBS, Sigma F1015: Деактивировать FBS при 50 ° С в течение 30 минут. Дать остыть в BSC. Алиготе в 1 мл и 10 мл стерильного ампул. Используйте на 1% конечная концентрация в культуральной среде, и в 10% конечной концентрации в средствах массовой информации для нейтрализации трипсин / ЭДТА раствором.
- Конституция культуральной среде:
Для500 мл среды DMEM/HamF12 использовать:- 1 тюбик BPE (каждый из 7.5ml 1mg/ml) для конечной концентрации 15μg/ml.
- 1 тюбик EGF (0,5 мл 10μg/ml) для конечной концентрации 10ng/ml.
- 1 тюбик Адреналин (50 мкл 5mg/ml) для конечной концентрации 0.5μg/ml.
- 1 флакон инсулина (1.25ml из 2mg/ml) для конечной концентрации 5μg/ml.
- 1 флакон трансферин (100 мкл 50мг/мл) для конечной концентрации 10μg/ml.
- 5 мкл трийод-L-тиронина (по крайней 1mg/ml) для конечной концентрации 10ng/ml.
- 1 флакон Гидрокортизон (50 мкл 5mg/ml) для конечной концентрации 0.5μg/ml.
- 5 мкл ретиноевая кислота разбавляется до 0.01mg/ml для конечной концентрации 0.1ng/ml.
- 10 мкл раствор альбумина из бычьей сыворотки для конечной концентрации 1.5μg/ml
3. Подготовка Диссоциация решения:
- Подготовка трипсин / ЭДТА маточного раствора: растворяют 100 мг трипсина (Sigma T9935-100 мг) и 40 мг ЭДТА (Sigma E6758) в 500 мл 0,01 М PBS (Sigma E6758). . Алиготе в 2 мл флаконах и хранить в морозильной камере -20 ° C Разбавьте исходный раствор: добавить 2 мл исходного раствора до 6 мл PBS (конечная концентрация трипсина составляет 250 мкг / мл и для ЭДТА составляет 100 мкг / мл).
- Решение для остановки ферментативной реакции: Подготовьте свежий 10% FBS в СМИ в BSC: добавить 1 мл ФБС до 9 мл среды (DMEM / Хэма F-12). Для каждой пластины 100 мм используют 8 мл подогретой 10% FBS, чтобы нейтрализовать 8 мл раствора диссоциации.
4. Специальные требования:
- При культивировании клеток эпителия, вы должны держать все в чистоте и дезинфицировать. Все реагенты, используемые для клеточной культуры должны быть стерильными или фильтруется с 0,2 мкм фильтр. Подготовка материалов и добавок должно быть сделано в биологических кабинета безопасности (BSC). СМИ того или изменения в средствах массовой информации должно быть сделано в BSC.
- Галстук волосы прочь, носить одноразовые крышки если таковые имеются, и носить пальто лаборатории и перчатки.
- Держите все рабочие поверхности свободными от беспорядка. Чистая рабочих поверхностей на 70% этанола между операциями и позволяет минимум на 15 минут между обработкой различных культур.
- Этикетка все реагенты и бутылки СМИ, включают дата получения и дата подготовлены.
- Изучение культуры и средств массовой информации регулярно для доказательства валового бактериальной или грибковой контаминации.
- Испытание регулярно микоплазмы (если необходимо)
- Разминка культуральной среды до 37 ° C, прежде чем изменять СМИ на клетки.
- Антибиотики / противогрибковые и ФБС должны быть свежие добавлены в среду.
- Изменение среды по крайней мере каждые 3-4 дня. Не позволяйте клетках сидят при комнатной температуре в течение длительного времени. Изменение средств массовой информации и безотлагательно вернуться к инкубатора.
Представитель Результаты:
Культура характеристик и морфологии человека бронхиальных эпителиальных клеток
Микроскопия человека бронхиальных эпителиальных клеток щеткой от бронхиальной сегментов, используемых для культуры, до культивирования, продемонстрировали полосы и мерцательного и не мерцательного эпителия указывает нормального эпителия (рис. 1, Приложение 1). Иммуноокрашивание из цитоспина подготовки клеток из эксплантов и клетки посеяны на покровные, показало, что все камеры были положительными для эпителия конкретных цитокератины (рис. 3). Успешное культур от эксплантатов бронхиальной ткани произошло в 8 из 9 тканей, как один из эксплантов культур заразился. Кольца эпителиальных клеток достигла 1-2 см радиус в 3-4 недели (рис. 2а). Успешное эксплантаты культивировали еще в 6 раз. Во всех успешных культур, есть свидетельства миграции клеток в течение 48 часов начиная трансплантатов (рис. 2б). Клетки были булыжные внешний вид, который отличается для этих эпителиальных клеток, как показано на рисунках 2, 4, 5 и 6. Суб-культурный бронхиальной клетки показали равномерной положительной иммуногистохимическое цитокератин и E-кадгерина. Иммуноокрашивание со специфическими антителами против других типов клеток, не показали никаких признаков загрязнения культур фибробластов, mesenchymal или эндотелиальных клеток (α-SMA, CD31 и виментин: PECAM-1 пятна соответственно) (рис. 5). Клетки культивировали на мембраны полиэстера (transwells) с воздушно-жидкостной интерфейс дифференцировались в мерцательного эпителия, как показано на рисунке 6. Представитель видеозаписи бронхиальные эпителиальные клетки, выращенные на transwells демонстрируют дифференцированные эпителия в избиении реснички (Приложение 2).
Характеристики человеческого эпителия бронхов клеточных культурах испытания приведены в таблице 1. Медиана времени до первого прохода (P1) было 4 недели, а средняя доходность составила 15,1 ± 2750 тысяч клеток (п = 9 тканей). Жизнеспособность клеток из эксплантов и на P1 оценивалась путем исключения трипанового синий, и был стабильно высоким (99%) в этих бронхиальной культур. К югу от культивируемых клеток из эксплантов культур от каждой ткани были объединены после первого прохождения для последующего использования. Среднее число ячейки оправился от эксплантов была значительно выше, чем последующие культуры Прохождение (каждые 2 миллиона клеток от P1 дали P2: 6,75 ± 2,4 миллионов клеток, п = 5 тканей). Один P2 культура была отброшена как морфология не было характерно для эпителиальных клеток (рис. 7а). Кроме того, два других местах (P2 и P3) различных тканях (рис. 7б) были отброшены.
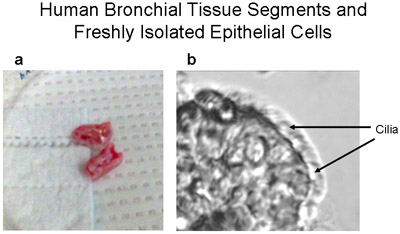
Рисунок 1 правам бронхиальной сегменты ткани и свежевыделенных эпителиальных полоса мерцательного и не ресничных клеток. (А) представитель картину человеческой бронхиальной сегменты ткани - ~ 1-2см долго и <1 см диаметра используются для первичных культурах человеческих бронхиальной эпителиальных клеток. (Б) полоса человека бронхиальных эпителиальных клеток щеткой от бронхиальной сегмент демонстрирует как мерцательного и не мерцательного эпителия, увеличение 320X. Видео из клеток с ресничками избиения предоставляется в качестве дополнения 1.
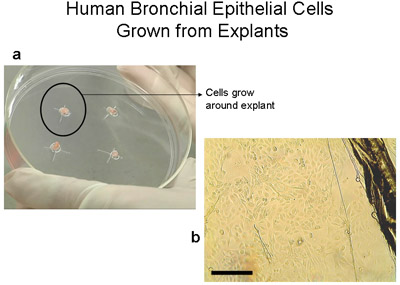
Рисунок 2 правам бронхиальные эпителиальные клетки, выращенные из эксплантов на 100 мм пластинах культуры ткани. а) 100 мм пластины с 2-3mm3 ткани. Обратите внимание на кольцо клетки около 1-2см, которая становится видна невооруженным глазом в течение 3-4 недель. б) Изображение край ткани эксплантов и эпителиальных клеток, поскольку они мигрируют из эксплантов, бар = 100 мкм. Эксплантов переданы новой пластинкой стал трансплантации. Эксплантов можно пересадить в 6 раз.
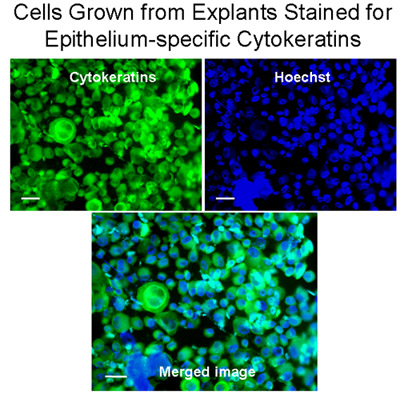
Рисунок 3 клетки, выращенные из эксплантов окрашивают в течение эпителия конкретных цитокератины. Cytospins клеток из эксплантов были окрашены для цитокератины (зеленый) с моноклональными анти-Pan цитокератин-FITC (смесь), которая признает человеческое цитокератины 1, 4, 5, 6, 8, 10, 13, 18 и 19. Ядра окрашиваются Hoechst пятна (синий). Объединенного изображения показывает, что бронхиальная клетки, выращенные из эксплантов были в основном эпителиальные клетки, Бар = 20 мкм.
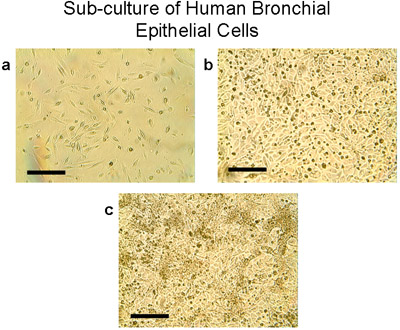
Рисунок 4 суб-культуру человека бронхиальных эпителиальных клеток. а) Использование трипсин / ЭДТА, клетки из эксплантов и пересадки поднимаются от 100 мм пластин, подсчитываются и высевают 2-3 млн. клеток на T75 колбу. Клетки растут к югу от слияния (80-90%) в колбы T75 в 28-30 дней (б, в). Обратите внимание на типичные морфологии булыжником эпителиальных клеток, Бар = 100 мкм.
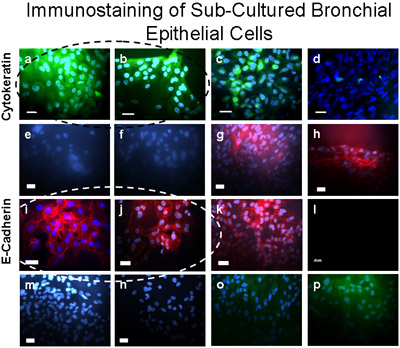
Рисунок 5 Суб-культивированный бронхиальной клетки были проверены как эпителиальные использованием иммунной окраски. Эти клетки окрашивали положительные (зеленый) для цитокератин-FITC (а, б) положительный контроль за цитокератин-FITC показан на A549 эпителиальных клеток (с) и отрицательного контроля демонстрируется в фибробласты (г). Искусственный Бронхиальная клеток, окрашенных положительной (темно-красный) для E-Cadherin/Alexa Fluor 594 (I, J), и не пятно на α-SMA-Cy3 (д, е), виментин / TRITC (м), ни CD31 (PECAM -1/FITC) (о), указывающее на отсутствие загрязнения первичной культурной бронхиальных эпителиальных клеток с гладкой мускулатуры, мезенхимальные, или эндотелиальных клеток соответственно. Положительный (темно-красный) контроль за E-Cadherin/Alexa Fluor 594 демонстрируется на A549 эпителиальных клеток (к). Положительный контроль для α-SMA-Cy3 (красный) демонстрируется в фибробласты (д, з). Вторичный контроль антител приведены в бронхиальные эпителиальные клетки для Alexa Fluor 594 (л); кролика антимышиным TRITC (п) и Donkey анти-козел FITC (р). Bar = 20 мкм.
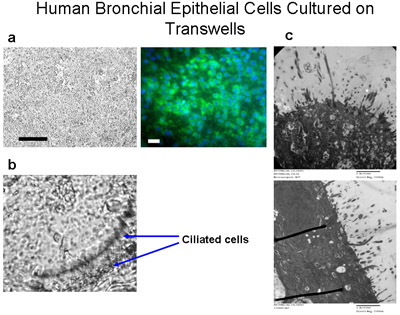
Рисунок 6 правам бронхиальные эпителиальные клетки, культивируемые на transwells. Ресничные клетки культивируют на мембраны полиэстера (6,5 мм в диаметре) при плотности посева в 50000 челLs на одну скважину () Бар = 100 мкм. Иммуноокрашивание из клетки культивировали на transwells с цитокератин-FITC (зеленый) и DAPI (синий) показывает, что эти клетки в основном эпителиальные клетки, Бар = 20 мкм. Клетки культивируются погружен в средствах массовой информации в течение 10 дней, затем подается СМИ со дна только в течение еще 4-6 недель, чтобы создать АЛИ до реснички растут как показано в (б), 160x увеличением. См. Дополнение 2 для видео избиения реснички. (С) ПЭМ-изображения демонстрируют реснички роста культур ALI через 6 недель, увеличение = 150000x.
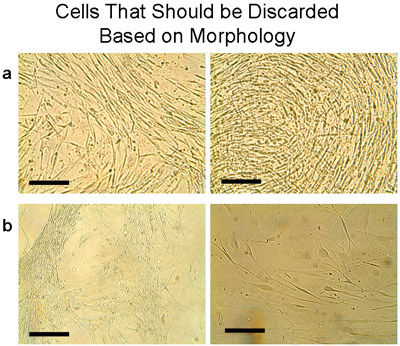
Рисунок 7 Пример клетки, которые должны быть отброшены на основе морфологии. Эти клетки обычно появляются, когда ткани были пересажены много раз. Заметим, что оба клеток и трансплантации должен быть уничтожен. а) Клетки были собраны из одной пластины с трансплантации, которые культивировались в 6 раз и помещают в колбу T75. В течение 1 недели клетки показали различные морфологии, которые не представляют собой булыжник появление эпителиальных клеток. Вместо этого, тонкие удлиненные клетки росли густо. б) Дополнительные примеры клеток, которые не должны быть объединены с типичными эпителиальных клеток, но они должны быть отброшены. Бар = 100 мкм.
Таблица 1: Характеристика человека бронхиальных эпителиальных клеточных культур
| Успех ставки (# тканей) | 8 / 9 (88,8%) |
| Медиана времени (диапазон) на P1 (недели) | 4 (3-5) |
| Среднее (SEM) клетки нет. на P1 | 15.1 (2.75) х 10 6 |
| Среднее (СЭМ) на жизнеспособность P1 | 99% (2%) |
| (Р1 = первый проход) | |
Дополнение 1 показана полоса мерцательного и не мерцательного эпителия бронхов клетки щеткой от человека бронхиальной сегмента, используемого для трансплантации, увеличение 320X. Нажмите здесь для Дополнение 1 Video.
Дополнение 2 Дифференцированные бронхиальные эпителиальные клетки, выращенные на воздух-жидкость. Видео (2а и 2б) показывают, избиение реснички, увеличение 160X и 320X, соответственно. Нажмите здесь для видео 2А Дополнение. Нажмите здесь для видео 2B Дополнение.
Обсуждение
В этом исследовании мы представили подробные методы по культуре и расширение первичных человеческих бронхиальной эпителиальных клеток. Мы показали, как эксплантов и пересадки бронхиальной ткани, культивировали в средствах массовой информации, которые способствуют росту клеток эпит...
Благодарности
Авторы выражают глубокую благодарность д-р Ричард Inculet за предоставление бронхиальной ткани. Исследования этике совета утверждения были получены от здравоохранения Гамильтона Св. Иосифа и Университет Западного Онтарио / Лондон Центра медицинских наук (доктор Дэвид Маккормак), тканей и архива комитета, отдел патологии. Мы также благодарим Эрни Спитцер (электронная микроскопия, McMaster University) за предоставление ТОИ наших культур ALI, и Даниэла Фаркаш за предоставление некоторых материалов, необходимых для иммунной окраски. Эта работа финансировалась за счет гранта Блока срок от Онтарио торакального общества, доктор Асма Яги была поддержана FSORC стипендии, здравоохранение святого Иосифа, Гамильтон, Онтарио, Канада.
Материалы
Другие требования: инкубатор, биологической безопасности кабинета (BSC), центрифуги, 100 мм пластин культуры, стерильные пробирки (15 мл, 50 мл и 2 мл), стерильные наконечники пипеток, скальпель ручки и лезвия, небольшие острые ножницы, халатах и перчатках. Они могут быть получены у предпочтительных поставщиков.
Ссылки
- Phillips, J. Growing Cells on Transwell Inserts - Tips and Techniques [Internet]. Corning Life Sciences, Technical Resources, Online Training. , (2008).
- Turi, J. L. Oxidative stress activates anion exchange protein 2 and AP-1 in airway epithelial cells. Am J Physiol Lung Cell Mol. Physiol. 283, L791-L798 (2002).
- Lechner, J. F., Haugen, A., McClendon, I. A., Pettis, E. W. Clonal growth of normal adult human bronchial epithelial cells in a serum-free medium. In Vitro. 18, 633-642 (1982).
- Yoshisue, H. Characterization of ciliated bronchial epithelium 1, a ciliated cell-associated gene induced during mucociliary differentiation. Am. J. Respir. Cell Mol. Biol. 31, 491-500 (2004).
- Wetering, S. v. a. n. Regulation of secretory leukocyte proteinase inhibitor (SLPI) production by human bronchial epithelial cells: increase of cell-associated SLPI by neutrophil elastase. J. Investig. Med. 48, 359-366 (2000).
- Tristram, D. A., Hicks, W., Hard, R. Respiratory syncytial virus and human bronchial epithelium. Arch. Otolaryngol. Head Neck Surg. 124, 777-783 (1998).
- Mattinger, C., Nyugen, T., Schafer, D., Hormann, K. Evaluation of serum-free culture conditions for primary human nasal epithelial cells. Int. J. Hyg. Environ. Health. 205, 235-238 (2002).
- Freshney, R. I., Freshney, R. I. . Culture of epithelial cells. , 1-23 (1992).
- Freshney, R. I., Freshney, R. I. Normal human bronchial epithelial cell cultures in Culture of specialized cells series. Culture of epithelial cells. , 181-196 (1992).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены