Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Primaire cellules épithéliales bronchiques humaines Cultivé à partir d'explants
Dans cet article
Résumé
Nous décrivons ici une méthode détaillée pour la culture primaire des cellules épithéliales bronchiques humaines à partir d'explants de tissus des voies aériennes bronchiques humaines, y compris la croissance différenciée sur une interface air-liquide. Cette méthode fournit une source abondante de cellules primaires pour enquêter sur le rôle de l'épithélium des voies aériennes dans la santé des poumons et des maladies humaines.
Résumé
Cellules épithéliales bronchiques humaines sont nécessaires pour les modèles cellulaires de la maladie et pour étudier l'effet des excipients et des agents pharmacologiques sur la fonction et la structure des cellules épithéliales humaines. Ici nous décrivons en détail la méthode de culture des cellules épithéliales bronchiques du tissu bronchique qui est récolté par le chirurgien au moment de la chirurgie du poumon (cancer du poumon par exemple ou une chirurgie de réduction du volume pulmonaire). Avec l'approbation de l'éthique et le consentement éclairé, le chirurgien prend ce qui est nécessaire pour la pathologie et nous fournit une partie bronchique qui est éloignée des zones malades. Le tissu est ensuite utilisé comme source d'explants qui peuvent être utilisés pour la culture primaire des cellules épithéliales bronchiques en culture. Segments bronchiques environ 0,5 à 1 cm de long et 1 cm de diamètre ≤ sont rincés à l'EBSS froide et l'excès de tissu parenchymateux est enlevé. Les segments sont à ciel ouvert et hachées dans 2 à 3 mm
Protocole
Homme segments bronchiques constituent une source abondante de cellules épithéliales bronchiques primaires. Dans cet article nous décrivons un protocole pour la croissance et l'expansion de l'Homme épithéliales bronchiques (HBE) à partir de cellules fraîchement isolées humaine segments bronchiques. Ce protocole se compose de cinq sections:
- Revêtement et gratter plaques de culture 100mm
- Préparation des explants de tissu bronchique
- Les greffes de tissus bronchiques
- Passage des cellules HBE
- Croissance des cellules ciliées sur les HBE Transwells
Avant de commencer Remarque que toutes les mesures sont faites dans l'enceinte de sécurité biologique (BSC) sauf indication contraire. S'il vous plaît assurez-vous d'avoir tout le matériel nécessaire pour cette procédure. S'il vous plaît lire les Matériaux, réactifs et la section Préparation et assurez-vous que vous avez aseptique (c'est à dire dans une enceinte de sécurité biologique ou BSC) a préparé les éléments suivants:
Solution stock de revêtement: la fibronectine (10 ug / ml), BSA (10 pg / ml) et de collagène (30 ug / ml) dans une solution saline équilibrée de Earle s (EBSS, stérile).
Milieu de culture: DMEM / Ham F-12 avec des additifs, antibiotiques antimycosiques (1%) et de FBS (1%)
Des solutions de dissociation: la trypsine / EDTA stock de solution et DMEM/F-12 avec du FBS (10%)
1. Revêtement et gratter plaques 100mm Culture: explants seront ensemencées dans des plaques de culture 100mm. Commencez par des plaques de culture de 100mm avec revêtement solution d'enrobage. Cela devrait être fait dans le BSC, tout garder stérile.
- Placer des plaques de culture stérile de 100mm et une solution d'enrobage (collagène / fibronectine / BSA) dans le BSC.
- Pipeter 2,0 ml de solution de revêtement sur une plaque de 100mm.
- Tourbillonner autour d'enduire la base de la plaque. Assurez-vous que la solution de revêtement recouvre la base de la plaque uniformément.
- Pipeter la solution des restes et l'utiliser pour enrober une seconde plaque de 100mm. Répétez l'opération pour que les plaques que nécessaire. Le nombre de plaques nécessaire varie avec le nombre d'explants de tissus.
- Assurez-vous que la solution de revêtement couvre les bases des plaques uniformément démontrée.
- Couvrir les plaques avec leurs couvertures. Laisser les plaques à sécher dans l'incubateur pendant 1-2 heures et aspirer l'excédent de solution avant de l'utiliser pour les explants de tissu bronchique. Inutilisés des plaques de culture revêtues peuvent être placés dans un sac stérile; scellés et conservés à 4 ° C pour une utilisation ultérieure (peut être stockée jusqu'à un mois au réfrigérateur). Amener à température ambiante avant utilisation.
- Vaporiser propres petits ciseaux pointus, scalpel et une pince à l'éthanol 70% et mettre en BSC. Scratch plaques revêtues en appuyant fermement avec un scalpel à la forme profonde de petits X s (au moins 4). Si le zéro n'est pas assez profond, des pièces de tissu ne sera pas s'installer dans les crêtes et flottera.
2. Préparation des explants de tissu bronchique
Utilisez le tissu bronchique obtenue dans les 24-36 heures après la chirurgie. Gardez le tissu sur la glace dans EBSS jusqu'à utilisation.
- En dehors de la BSC: tissu Placer dans un plat de Pétri. Rincez les humains isolés des échantillons de tissus bronchiques à fond dans EBSS.
- Disséquer les excès de tissus environnants.
- Coupez les morceaux bronchique.
- Apportez des tissus dans le BSC et le transfert dans une plaque de tissu stérile 100mm culture avec DMEM/HamF12 froide + 1% d'antibiotique / antifongique.
- Utilisez la petite ciseaux pour couper le tissu en 2-3 mm 3 pièces.
- Placer un morceau de tissu coupé dans le centre de chaque X avec une pince et presser délicatement.
- Laissez les morceaux de tissu (explants) adhèrent à la plaque pendant quelques secondes, puis ajouter doucement 10ml de milieu complet (DMEM/HamF12 + additifs 1% d'antibiotique / antimycotique + FBS 1%). Si le tissu flotte après avoir ajouté les médias, l'utilisation des forceps pour pousser le tissu dans les crêtes de l'X ou de faire une nouvelle X. Il peut être nécessaire de faire de nouveaux X s si les crêtes ne sont pas assez profonds.
- Plaques place dans l'incubateur et le changement des médias tous les 3-4 jours.
- Les tissus sont prêts à être transplantés lorsqu'ils ont suffisamment de cellules épithéliales cultivées dans des explants de tissu pour couvrir les zones 1 à 2 cm. Cela prend environ 4 semaines.
3. Les greffes de tissus bronchiques
- Utiliser des plaques enduites de 100mm et rayé. Depuis quelques explants de tissus pourrait ne pas être réussie, le nombre de plaques dépend de combien de morceaux de tissus que vous êtes le repiquage. Si vous utilisez des plaques qui ont été préalablement enduits et conservés à 4 ° C, porter à température ambiante avant utilisation.
- En utilisant des pinces, soigneusement ramasser les tissus de la plaque d'origine et le lieu dans le centre de X s dans la nouvelle plaque, et appuyez doucement. Les tissus sans excroissance doit être jeté.
- Laissez tissus adhérer à la plaque pendant quelques secondes, ajoutez les médias et incuber l'oreille comme décritLier des explants (02/07 au 02/09).
4. Passage du épithéliales bronchiques humaines (HBE), les cellules
- Dégel 2 ml de solution stock de trypsine / EDTA pour chaque plaque de culture tissulaire 100mm. Diluer actions avec 6ml de solution stérile de PBS 0,01 M (ie ajouter 2 ml de solution concentrée à 6 ml de PBS (concentration finale de la trypsine est de 250 pg / ml et pour l'EDTA est de 100 pg / ml).
- Après avoir déménagé explants une nouvelle plaque, aspirer les médias à partir de plaques avec 1 à 2 cm anneaux de cellules.
- Ajouter 8 ml de réchauffé diluée Trypsine / EDTA à chaque plaque de 100mm et le placer dans l'incubateur (37 ° C) pendant 3-15 minutes. Vérifiez fréquemment, laissant la trypsine trop longtemps peut endommager les cellules.
- Vérifiez les plaques au microscope pour être sûr que la plupart des cellules ont été levées. Les cellules seront rondes et se détacher comme indiqué.
- Ajouter 8 ml de réchauffé 10% de FBS dans les médias par plaque pour inactiver la solution de trypsine / EDTA.
- Combiner des volumes de toutes les plaques dans un tube (ou tubes séparés, si les différents tissus). Compter les cellules en utilisant un hématimètre.
- Centrifuger à 100g pendant 5 minutes. Un culot cellulaire va se former à la base du tube.
- Re-suspendre le culot cellulaire dans le milieu complet (DMEM / Ham F12 + tous les additifs + 1% d'antibiotiques antimycosiques + 1% de FBS) à la concentration cellulaire désirée.
- Placez tous les 2-3 millions de cellules par flacon T75 et ajouter des médias complète au besoin. Incuber les médias et le changement toutes les 3-4 semaines. Les cellules se développent à sous-confluence (80-90%) dans les flacons T75 dans environ 4 semaines. Les cellules doivent être levées et élargi ou utilisé à des sous-confluence pour empêcher la sénescence.
5. Growing cilié épithéliales bronchiques humaines (HBE) sur les cellules Transwells.
Primaire des cellules épithéliales cultivées à partir d'explants de tissus / greffes, peut être étendu jusqu'à trois fois, puis utilisé. Une densité de 50.000 à 100.000 cellules par cm 2 est recommandé 1,2. Une densité plus élevée favorise la rapide différenciation.
Note: Préparer une suspension de cellules et de mesurer leur nombre. Re-suspendre en milieu de culture à 1 million de cellules par 2ml.
- Commencez par préparer les membranes perméables du transwells en pré-incubant les inserts de culture cellulaire avec milieu (DMEM / Ham F12) avant utilisation. Cette étape est nécessaire avec ces cellules sensibles et aidera la fixation des cellules.
- Utilisez le 6,5 mm inserts qui s'intègrent dans les 24 et plusieurs plaques bien.
- Ajouter à moyen et à deux côtés de la membrane (pour 6,5 mm, utiliser inserts 0.6ml sur le fond, 0.1ml sur le dessus). Incuber 1 heure à l'incubateur de culture cellulaire.
- Retirez délicatement (aspirer) les moyennes des deux côtés de la membrane à commencer par le volume basale premier.
Soigneusement signifie: la membrane peut être facilement endommagés, alors la pipette du milieu sur le côté de l'insert de culture, utilisez la quantité recommandée. Ne pas le faire se traduira par une fuite de plus de médias pour les autres puits.
- Cellules semences après pré-incubation de support perméable
- Pipeter soigneusement votre suspension cellulaire dans le côté de la membrane apicale: pour les puits de 6,5 mm ajouter 0,1 ml de suspension cellulaire (c'est à dire 50 000 cellules) sur le côté de la membrane apicale.
- Pipeter 0,6 ml moyennes sur le côté de la membrane basale.
- Alimenter les cellules des côtés apicale et basale pendant 10 jours pour établir une culture bien différenciés: moyen d'échange deux fois par semaine en utilisant la méthode a démontré:
- Retirer le volume basale premier
- Remplacer le volume apicale (0.1ml moyenne)
- Ajouter 0,6 ml de milieu sur le côté de la membrane basale.
Cette méthode favorise la fixation des cellules à membrane et empêche les cellules d'être exposé à l'air pendant de longues périodes de temps (média d'échange et rapidement remis dans l'incubateur). - Créer une interface air-liquide (ILA) au jour 10 en supprimant le support apicale, puis en remplaçant le 0,6 ml de milieu sur le côté de la membrane basale.
- Maintenir les cellules dans ALI pendant 6 semaines, le changement des médias deux fois par semaine. Cellules ciliées commenceront à apparaître 4 semaines après la création de l'ILA. Cellules permettra d'atteindre une différenciation des cellules ciliées uniforme dans 6 semaines après la création de l'ILA.
Préparation des matériaux:
1. Préparation de la solution stock de revêtement (le faire dans le BSC):
Primaire cellules épithéliales bronchiques humaines poussent bien sur des surfaces revêtues de fibronectine / BSA / collagène 3. La solution stock revêtement est utilisé pour plaques de 100 mm de culture de tissus pour les greffes et les cultures explant comme décrit ci-dessus. Aussi la solution de revêtement peut être utilisé pour des lamelles manteau pour accélérer la fixation des cellules, les lamelles peuvent ensuite être utilisées pour des expériences immunomarquage.
- La fibronectine (solution stock 1mg/ml): Utilisez F2006-2mg de Sigma. Dissoudre 2mg de 2mls de solution stérile Earle s Balanced Salt (EBSS, Sigma 28 888), un filtre de 0,2 um filtre seringue dans le cabinet de sécurité biologique (ESB). 1ml stocker dans le congélateur à -20 ° C pour une utilisation ultérieure, et l'utilisation de 1 ml pour préparer un mls 100 de solution d'enrobage.
- BSA (solution stock 1mg/ml): Utilisez Sigma A4919-1G. Peser 20 mg de BSA et de se dissoudre dans EBSS mls 20 stérile, filtre avec filtre de 0,2 um seringue dans le BSC. Aliquoter dans des flacons de 1ml et stocker dans le congélateur à -20 ° C jusqu'à ce que nécessaire. Utilisez 1ml de stock pour faire 100ml de solution d'enrobage.
- . Solution stock collagène (à condition que 0,1% ou de Sigma C8919 1mg/ml) Note: ouvert uniquement le BSC et l'étanchéité avant de retourner au réfrigérateur. Utiliser 3 ml de bouillon pour obtenir 100 ml de solution d'enrobage.
- Solution stock de revêtement: Dans le BSC: ajoutez collagène 3mls (1mg/ml) pour 1ml fibronectine (1mg/ml) et 1ml de BSA (1mg/ml), plus 95 mls EBSS (stérile). Mélangez bien et aliquot en flacons de 2 ml et stocker dans le congélateur à -20 ° C jusqu'à ce que nécessaire. Les concentrations finales dans la solution stock de revêtement: la fibronectine (10 ug / ml), BSA (10 pg / ml) et de collagène (30 ug / ml) dans EBSS.
2. Préparation du milieu de culture (préparation de la BSC): milieu est constitué de DMEM / Ham F-12 de Sigma avec extrait pituitaire bovin (15 ug / ml) et le facteur de croissance épidermique (10 ng / ml) avec d'autres additifs, comme indiqué ci-dessous. Antibiotique / antimycotique (1%) et de FBS (1%) sont ajoutés fraîchement chaque fois que le milieu de culture est changé. Ce milieu a été préparé en examinant plusieurs méthodes qui décrit les cultures de cellules épithéliales des voies aériennes 3-9. Notre support est prévu pour une croissance optimale des cellules épithéliales bronchiques humaines.
- Extrait pituitaire bovin (BPE solution stock de 1mg/ml): Sigma P1476 (2,5 ml solution à 14mg/ml BPE stérile et filtrée): Diluer 2,5 ml de stock (14mg/ml) à une concentration finale de 1mg/ml. ie ajouter 2,5 ml d'actions BPE à 32,5 ml de EBSS stérile pour un stock de 1mg/ml. Diviser en parties aliquotes ml 7.5 (4 tubes de 7,5 ml aliquotes et un tube de 5 ml aliquotes). Après dilution, des aliquotes conserver à -20 ° C jusqu'à ce que nécessaire. Un stockage prolongé du produit reconstitué et répétés de congélation et de décongélation ne sont pas recommandés.
- Facteur de croissance épidermique (EGF 10 solution stock pg / ml): Sigma E9644-0.2mg. Reconstituer le contenu (0,2 mg) en 20 ms de 0,2 mm filtrés 10 mM d'acide acétique contenant 0,1% de BSA (soit dissout 20 mg de BSA dans 20 ml de 10 mM d'acide acétique et de filtrer ensuite utiliser pour reconstituer FEM). Aliquoter en aliquots de 0,5 ml et stocker dans le congélateur à -20. Utilisez 100 ul pour 100 ml de milieu.
- L'épinéphrine (solution stock 5mg/ml): Sigma E1635. Dissoudre 10 mg dans 2ml d'acide chlorhydrique 1M filtré (HCl), partie aliquote dans des flacons de 50 ul et le gel (-20 ° C).
- Insuline (solution stock 2mg/ml): Sigma I6634 50mg. Dissoudre 50 mg dans 25ml filtré (0,2 um filtre) HCl dilué (1mm). Aliquoter 1,25 ml dans des flacons.
- Tranferrin homme (50 mg / ml de solution concentrée): Sigma T8158 100mg. Dissoudre 100 mg dans 2 ml dh20 (filtrée avec filtre de 0,2 um). Aliquotes à 100 ul de chaque (en fioles de 0.5ml).
- Triiodo-L-thyronine (solution stock 1mg/ml): Sigma T6397 100mg. Dissoudre 100 mg de chlorhydrate de 1M 100ml filtrés. Aliquoter en aliquots de 1ml. 0.5ml Aliquoter en aliquots 10 ul.
- Hydorcortisone (solution stock 5mg/ml):. Sigma H0888 Peser 100 mg et dissoudre dans de l'éthanol filtrée 20ml pour le stock 5mg/ml. Aliquoter à des flacons de 1ml. Diviser une 1ml (5mg/ml) de 50 pl aliquotes (0,5 ml flacons).
- L'acide rétinoïque (solution stock 1mg/ml diluée à 0.01mg/ml lorsqu'il est utilisé): Sigma R2625 100mg). Dissoudre 100 mg dans 10 ml d'éthanol. Diviser pour aliquotes 1.0ml. Diviser (1ml) flacon de 50 tubes de 20 pi chacun. Congeler à -20 ° C. Prenez un flacon et diluer à 20 pi 2000μl avec les médias pour un stock de 0.01mg/ml lorsque nécessaire.
- Solution d'albumine sérique bovine à partir, une filtration stérile de culture cellulaire, testé: Sigma A8412. Conserver la solution dans le froid (4 ° C) jusqu'à ce que nécessaire. Ouvert uniquement dans le BSC.
- Antibiotiques antimycosiques, Sigma A5955: aliquote à des volumes de 1 ml et congeler à -20 ° C jusqu'à ce que nécessaire. Utiliser à une concentration finale de 1% en moyenne.
- FBS, Sigma F1015: Désactiver FBS à 50 ° C pendant 30 minutes. Laisser refroidir dans le BSC. Aliquoter dans 1 ml et 10 ml des flacons stériles. Utiliser à une concentration finale de 1% en milieu de culture et à la concentration finale de 10% dans les médias pour neutraliser la trypsine / EDTA.
- Constitution de milieu de culture:
Pour500 ml de milieu DMEM/HamF12 utilisation:- 1 tube de BPE (chacun 7,5 ml de 1mg/ml) pour une concentration finale de 15μg/ml.
- 1 tube de l'EGF (0,5 ml de 10μg/ml) pour une concentration finale de 10ng/ml.
- 1 tube de l'épinéphrine (50 pl de 5mg/ml) pour une concentration finale de 0.5μg/ml.
- 1 flacon d'insuline (1,25 ml d'2mg/ml) pour une concentration finale de 5μg/ml.
- 1 flacon de transferrine (100 pi de 50mg/ml) pour une concentration finale de 10μg/ml.
- 5 pl de triiodo-L-thyronine (à 1mg/ml) pour une concentration finale de 10ng/ml.
- 1 flacon d'hydrocortisone (50 pl de 5mg/ml) pour une concentration finale de 0.5μg/ml.
- 5 ul de l'acide rétinoïque dilué à 0.01mg/ml pour une concentration finale de 0.1ng/ml.
- Solution à 10 ul d'albumine du sérum bovin pour une concentration finale de 1.5μg/ml
3. Préparation des solutions de dissociation:
- Préparation de la solution stock de trypsine / EDTA: dissoudre 100 mg de trypsine (Sigma T9935-100mg) et 40mg EDTA (Sigma E6758) dans 500 ml de PBS 0,01 M (Sigma E6758). . Aliquoter dans des flacons de 2ml et stocker dans le congélateur à -20 ° C Diluer la solution mère: ajouter 2 ml de solution concentrée à 6 ml de PBS (concentration finale de la trypsine est de 250 pg / ml et pour l'EDTA est de 100 pg / ml).
- Solution pour arrêter les réactions enzymatiques: Préparer une solution fraîche 10% FBS dans les médias dans le BSC: ajouter 1 ml de FBS à 9 ml de milieu (DMEM / Ham F-12). Pour chaque plaque 100mm utiliser 8 ml de réchauffé 10% de FBS à neutraliser 8 ml de la solution de dissociation.
4. Exigences particulières:
- Culture de cellules épithéliales Lorsque, vous devez garder à tout nettoyer et à désinfecter. Tous les réactifs utilisés pour la culture cellulaire doit être stérile ou filtrée avec un filtre 0,2 um. Préparation des matériaux et des additifs doit être fait dans une enceinte de sécurité biologique (ESB). Outre les médias ou en changeant des médias devrait être fait dans un BSC.
- Attacher les cheveux loin, porter un bonnet jetables si possible, et porter une blouse de laboratoire et des gants.
- Gardez toutes les surfaces de travail exempt de fouillis. Nettoyer les surfaces de travail avec de l'éthanol à 70% entre les opérations et permettre un minimum de 15 minutes entre la manipulation des cultures différentes.
- Étiqueter tous les réactifs et les bouteilles de médias, notamment la date de réception et la date de préparation.
- Examiner les cultures et les médias régulièrement pour des signes de contamination bactérienne ou fongique grave.
- Testez régulièrement pour le mycoplasme (si nécessaire)
- Warm up milieu de culture à 37 ° C avant de changer de média sur les cellules.
- Antibiotiques / antifongiques et FBS doit être fraîchement ajouté au milieu.
- Changer moyenne au moins tous les 3-4 jours. Ne laissez pas les cellules reposer à température ambiante pendant une longue période. Changer les médias et les retourner rapidement à l'incubateur.
Les résultats représentatifs:
Caractéristiques de la culture et la morphologie des cellules épithéliales bronchiques humaines
Microscopique des cellules épithéliales bronchiques humaines brossé à partir des segments bronchiques utilisés pour la culture, avant la culture, a montré des bandes de deux ciliées et non ciliées les cellules épithéliales qui indique un épithélium normal (figure 1, supplément 1). Immunocoloration de préparations de cellules cytospin à partir d'explants et de cellules ensemencées sur des lamelles a révélé que toutes les cellules ont été positifs pour les cytokératines épithélium spécifique (figure 3). Le succès des cultures d'explants de tissus bronchiques sont survenues chez 8 des 9 tissus, comme l'une des cultures d'explants ont été infectés. Les anneaux de cellules épithéliales atteint 1-2 cm de rayon dans les 3-4 semaines (figure 2a). Explants ont été cultivés avec succès à nouveau jusqu'à 6 fois. Dans toutes les cultures de succès, il y avait des preuves de la migration des cellules dans les 48 heures suivant le début de la transplantation (Figure 2b). Les cellules ont un aspect pavées qui est distincte de ces cellules épithéliales, comme indiqué dans les figures 2, 4, 5 et 6. Sous-cultures de cellules bronchiques montrait uniformes immunomarquage positif pour la cytokératine et la E-cadhérine. Immunomarquage avec des anticorps spécifiques contre d'autres types cellulaires n'ont montré aucune indication de contamination des cultures par les fibroblastes, mesenccellules hymal ou endothéliales (α-SMA, vimentine et CD31: PECAM-1 taches respectivement) (figure 5). Les cellules cultivées sur des membranes de polyester perméable (transwells) avec interface air-liquide différenciées en épithélium cilié comme l'a montré dans la figure 6. Enregistrements vidéo représentant des cellules épithéliales bronchiques cultivés sur transwells démontrent un épithélium différencié en battant des cils (Supplément 2).
Caractéristiques de l'humain cultures de cellules épithéliales bronchiques testés sont présentés dans le Tableau 1. Le délai médian de premier passage (P1) a été de 4 semaines, et le rendement moyen était de 15,1 ± 2,75 millions de cellules (n = 9 tissus). La viabilité des cellules à partir d'explants et à P1 a été évaluée par exclusion du bleu trypan, et a été élevée et constante (99%) dans ces cultures bronchique. Sous-cultures de cellules de l'explant cultures de chaque tissu ont été regroupés après le passage d'abord pour une utilisation ultérieure. Le nombre moyen de cellules récupérées à partir d'explants a été significativement plus élevé que le passage ultérieur de la culture (tous les 2 millions de cellules de P1 P2 donné: 6,75 ± 2,4 millions de cellules, tissus n = 5). Une culture de P2 a été écartée pour la morphologie n'était pas typique de cellules épithéliales (figure 7a). De même, deux autres passages (P2 et P3) de différents tissus (figure 7b) ont été rejetées.
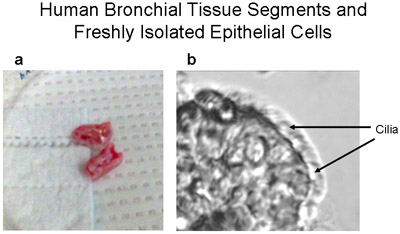
Figure 1 homme segments du tissu bronchique et une bande fraîchement isolées épithéliales des cellules ciliées et non ciliées. Image représentative (a) de segments tissus bronchiques humaines - ~ 1-2cm de long et <1 cm de diamètre-utilisée pour des cultures primaires de cellules épithéliales bronchiques humaines. (B) Une bande de cellules épithéliales bronchiques humaines brossé à partir du segment bronchique démontre à la fois ciliées et non ciliées les cellules épithéliales, 320X grossissement. Vidéo de cellules en battant des cils est fournie en tant que Supplément 1.
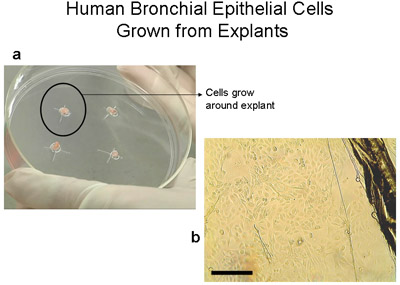
Figure 2 cellules épithéliales bronchiques humaines cultivées à partir d'explants sur le 100mm plaques de culture tissulaire. a) la plaque de 100mm avec 2-3mm3 tissus. Notez l'anneau de cellules d'environ 1 à 2 cm qui devient visible à l'œil nu après 3-4 semaines. b) l'image du bord du tissu explant et les cellules épithéliales comme ils migrent de l'explant, barre = 100 microns. Explants transférés à une nouvelle plaque greffes deviennent. Explants peuvent être transplantés jusqu'à 6 fois.
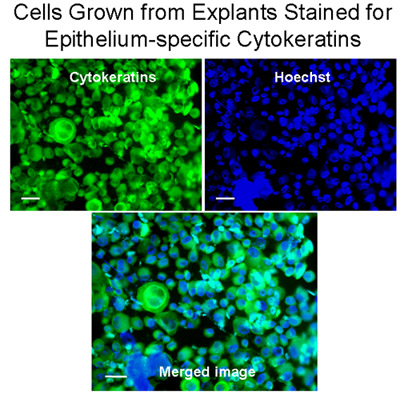
Figure 3 cellules cultivées à partir d'explants colorées pour l'épithélium spécifique des cytokératines. Cytospins de cellules à partir d'explants ont été colorées pour les cytokératines (vert) avec l'anticorps monoclonal anti-cytokératine pan-FITC (mélange) qui reconnaît humaine cytokératines 1, 4, 5, 6, 8, 10, 13, 18 et 19. Les noyaux ont été colorés avec Hoechst tache (en bleu). L'image fusionnée démontre que les cellules bronchiques grandi à partir d'explants ont été principalement les cellules épithéliales, bar = 20μm.
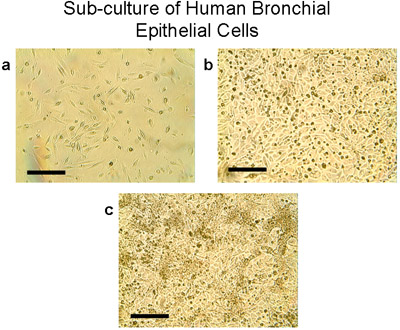
Figure 4 Sous-culture de cellules épithéliales bronchiques humaines. a) En utilisant la trypsine / EDTA, les cellules à partir d'explants et les greffes sont levées à partir des plaques 100mm, comptées et ensemencées à 2-3 millions de cellules par flacon T75. Les cellules se développent à sous-confluence (80-90%) dans les flacons T75 en 28-30 jours (b, c). Notez la morphologie pavées typiques des cellules épithéliales, bar = 100 microns.
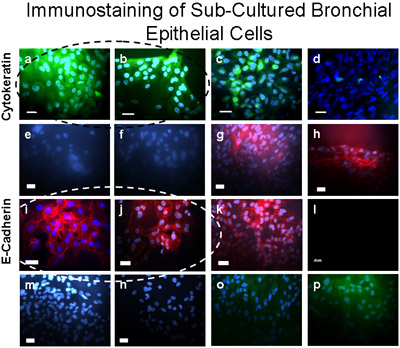
Figure 5 sous-cultivé les cellules bronchiques ont été vérifiés comme immunomarquage utilisant épithéliales. Ces cellules colorées positives (en vert) pour cytokératine-FITC (a, b), un contrôle positif pour la cytokératine-FITC est montré dans les cellules épithéliales A549 (c) et un contrôle négatif est démontré dans des fibroblastes (d). Des cultures de cellules bronchiques coloration positive (rouge foncé) pour E-Cadherin/Alexa Fluor 594 (i, j), et ne tache pas pour α-SMA-Cy3 (e, f), vimentine / TRITC (m), ni CD31 (PECAM -1/FITC) (o), indiquant qu'aucune contamination de l'cultures primaires des cellules épithéliales bronchiques avec des muscles lisses, mésenchymateuses, ou des cellules endothéliales, respectivement. Contrôle positif (rouge foncé) pour E-Cadherin/Alexa Fluor 594 est démontrée sur les cellules épithéliales A549 (k). Contrôle positif pour α-SMA-Cy3 (rouge) est démontrée dans les fibroblastes (g, h). Contrôle des anticorps secondaire sont présentés dans les cellules épithéliales bronchiques pour Alexa Fluor 594 (l); lapin anti-souris TRITC (n) et Donkey anti-chèvre FITC (p). Barre = 20μm.
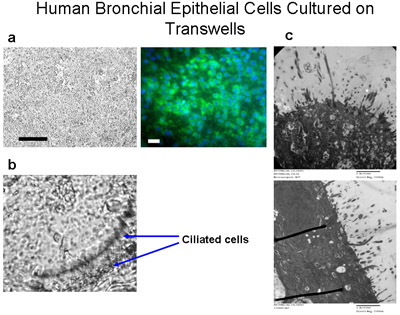
Figure 6 cellules épithéliales bronchiques humaines en culture sur transwells. Cellules ciliées sont cultivées sur des membranes en polyester perméable (6,5 mm de diamètre) à une densité de semis de 50 000 cells par puits (a) = 100 microns bar. Immunocoloration des cellules cultivées sur transwells avec cytokératine-FITC (vert) et DAPI (bleu) démontre que ces cellules sont des cellules épithéliales essentiellement, bar = 20μm. Les cellules sont cultivées submergés dans les médias pendant 10 jours, les médias ensuite alimenté par le bas que pour un autre 4-6 semaines pour créer un ALI jusqu'au cils sont cultivées comme indiqué en (b) 160x de grossissement,. Voir le Supplément 2 pour les vidéos de battre les cils. (C) images TEM montrent la croissance des cils des cultures ALI moins 6 semaines, grossissement = 150000x.
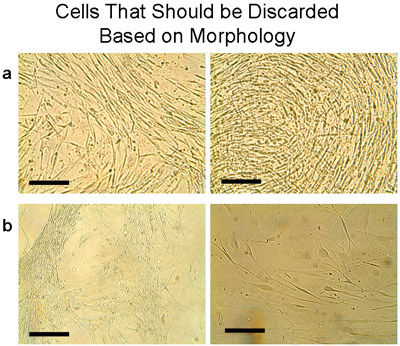
Figure 7 Exemple de cellules qui devraient être jetés basée sur la morphologie. Ces cellules apparaissent généralement lorsque le tissu a été transplantée à plusieurs reprises. Notez que les deux cellules et la transplantation doivent être jetés. a) Les cellules ont été recueillies d'une plaque avec les greffes qui ont été cultivés 6 fois et plaqué dans un flacon T75. Dans 1 semaine les cellules ont une morphologie distincte qui ne représentent pas l'apparence des cellules épithéliales pavées. Au lieu de cela, minces cellules allongées ont été de plus en plus dense. b) Autres exemples de cellules qui ne devraient pas être regroupés avec les cellules épithéliales typiques, mais doit être jeté. Barre = 100 microns.
Tableau 1: Caractéristiques des humains cultures de cellules épithéliales bronchiques
| Le taux de réussite (nombre de tissus) | 8 / 9 (88,8%) |
| Le temps médian (plage) à P1 (en semaines) | 4 (3-5) |
| Mean aucune cellule (MEB). en P1 | 15,1 (2,75) x 10 6 |
| Moyenne (SEM) viabilité à P1 | 99% (2%) |
| (P1 = premier passage) | |
Supplément 1 montre une bande de ciliées et non ciliées les cellules épithéliales bronchiques brossé d'un segment bronchiques humaines utilisées pour des transplantations, 320X grossissement. Cliquez ici pour le Supplément 1 Vidéo.
Supplément 2 différenciés des cellules épithéliales bronchiques cultivés sur une interface air-liquide. Vidéos (2a et 2b) montrent battre les cils, un grossissement de 160X et 320X respectivement. Cliquez ici pour la vidéo 2A supplément. Cliquez ici pour la vidéo 2B supplément.
Discussion
Dans cette étude, nous avons présenté des méthodes détaillées pour la culture et l'expansion de l'enseignement primaire cellules épithéliales bronchiques humaines. Nous avons démontré comment des explants et des greffes de tissu bronchique, cultivées dans un milieu qui favorise la croissance des cellules épithéliales, peut fournir une source continue de cellules des voies respiratoires épithéliales humaines pour les études de non-différenciées des modèles cellulaires (immergée) et différenci...
Remerciements
Les auteurs sont très reconnaissants au Dr Richard Inculet pour fournir les tissus bronchiques. Éthique de la recherche approbations du Conseil ont été obtenus à partir de Saint-Joseph de Hamilton et l'Université de Western Ontario / London Health Sciences Centre (Dr. David McCormack), les tissus et les Archives du Comité, Département de pathologie. Nous remercions également Ernie Spitzer (microscopie électronique, Université McMaster) pour fournir TEMs de nos cultures ALI, et Farkas Daniela pour fournir une partie des matériaux nécessaires à la immunomarquage. Ce travail a été financé par une subvention terme Bloquer l'Ontario Thoracic Society, le Dr Asma Yaghi a été soutenue par une bourse FSORC, soins de santé St-Joseph de Hamilton, Ontario, Canada.
matériels
Autres exigences: incubateur, du cabinet de sécurité biologique (BSC), une centrifugeuse, des plaques de culture de 100 mm, tubes stériles (15 ml, 50 ml et 2 ml), embouts de pipette stérile, poignée de scalpel et de lames, de petits ciseaux pointus, des blouses de laboratoire et des gants. Ceux-ci peuvent être obtenus auprès de vos fournisseurs préférés.
Références
- Phillips, J. Growing Cells on Transwell Inserts - Tips and Techniques [Internet]. Corning Life Sciences, Technical Resources, Online Training. , (2008).
- Turi, J. L. Oxidative stress activates anion exchange protein 2 and AP-1 in airway epithelial cells. Am J Physiol Lung Cell Mol. Physiol. 283, L791-L798 (2002).
- Lechner, J. F., Haugen, A., McClendon, I. A., Pettis, E. W. Clonal growth of normal adult human bronchial epithelial cells in a serum-free medium. In Vitro. 18, 633-642 (1982).
- Yoshisue, H. Characterization of ciliated bronchial epithelium 1, a ciliated cell-associated gene induced during mucociliary differentiation. Am. J. Respir. Cell Mol. Biol. 31, 491-500 (2004).
- Wetering, S. v. a. n. Regulation of secretory leukocyte proteinase inhibitor (SLPI) production by human bronchial epithelial cells: increase of cell-associated SLPI by neutrophil elastase. J. Investig. Med. 48, 359-366 (2000).
- Tristram, D. A., Hicks, W., Hard, R. Respiratory syncytial virus and human bronchial epithelium. Arch. Otolaryngol. Head Neck Surg. 124, 777-783 (1998).
- Mattinger, C., Nyugen, T., Schafer, D., Hormann, K. Evaluation of serum-free culture conditions for primary human nasal epithelial cells. Int. J. Hyg. Environ. Health. 205, 235-238 (2002).
- Freshney, R. I., Freshney, R. I. . Culture of epithelial cells. , 1-23 (1992).
- Freshney, R. I., Freshney, R. I. Normal human bronchial epithelial cell cultures in Culture of specialized cells series. Culture of epithelial cells. , 181-196 (1992).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon