Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Primären humanen bronchialen Epithelzellen aus Explantaten Grown
In diesem Artikel
Zusammenfassung
Hier beschreiben wir eine detaillierte Verfahren zur Züchtung von primären humanen bronchialen Epithelzellen aus Explantaten des menschlichen bronchialen Atemwege Gewebe einschließlich differenzierter Wachstum auf einer Luft-Flüssigkeit-Grenzfläche. Diese Methode bietet eine reichhaltige Quelle von primären Zellen zur Untersuchung der Rolle der Atemwegsepithel in der menschlichen Lunge Gesundheit und Krankheit.
Zusammenfassung
Menschliche bronchialen Epithelzellen sind für die Zell-Modelle von Krankheiten benötigt werden, und die Wirkung von Hilfsstoffen und pharmakologische Mittel zur Funktion und Struktur des menschlichen Epithelzellen zu untersuchen. Hier haben wir im Detail beschreiben die Methode der wachsenden bronchialen Epithelzellen der Bronchien Atemwege Gewebe, das durch den Chirurgen zu den Zeiten der Lungenchirurgie (zB Lungenkrebs oder Lungenvolumenreduktion Chirurgie) geerntet wird. Mit Ethik Genehmigung und Einwilligung, nimmt der Chirurg, was für Pathologie benötigt und bietet uns eine bronchiale Teil, der fern von der erkrankten Bereiche ist. Das Gewebe wird dann als eine Quelle der Explantate, die für den Anbau von primären bronchialen Epithelzellen in Kultur verwendet werden können verwendet. Bronchial-Segmente über 0,5-1cm lang und ≤ 1 cm im Durchmesser sind mit kaltem EBSS und überschüssiges Drüsengewebe entfernt wird gespült. Segmente sind aufgeschnitten und Hackfleisch in 2-3mm
Protokoll
Menschliche Bronchial-Segmente bieten eine reichhaltige Quelle von primären bronchialen Epithelzellen. In diesem Artikel beschreiben wir ein Protokoll für Wachstum und Expansion von humanen bronchialen Epithelzellen (HBE) Zellen aus frisch isolierten menschlichen Bronchien Segmenten. Dieses Protokoll besteht aus fünf Abschnitten:
- Beschichtungs-und Scratching 100mm Kulturplatten
- Vorbereitung Bronchial Tissue Explantate
- Bronchial Tissue Transplantation
- Passage von HBE Cells
- Wachsende Flimmerepithel HBE Cells auf Transwells
Bevor Sie beginnen Beachten Sie, dass alle Schritte in der biologischen Sicherheitswerkbank (BSC) Soweit nicht anders angegeben sind DONE. Bitte stellen Sie sicher, dass alle Materialien für dieses Verfahren notwendig. Bitte lesen Sie die Materialien, Reagenzien und Vorbereitung Abschnitt und stellen Sie sicher, dass Sie aseptisch (dh in einem biologischen Sicherheitsschrank oder BSC) erstellt die folgenden:
Coating-Stammlösung: Fibronectin (10 ug / ml), BSA (10 ug / ml) und Kollagen (30 pg / ml) in Balanced Salt Earle s Solution (EBSS, steril).
Kulturmedium: DMEM / Ham F-12 mit Zusätzen, Antibiotika-Antimykotika (1%) und FBS (1%)
Dissoziation Lösungen: Trypsin / EDTA-Stammlösung und DMEM/F-12 mit FBS (10%)
1. Beschichtungs-und Scratching 100mm Kulturplatten: Explantate werden in 100mm Kultur ausplattiert werden. Beginnen Sie mit der Beschichtung 100mm Kulturplatten mit Beschichtungslösung. Dies sollte in der BSC getan werden, damit alles steril.
- Legen Sie sterile 100mm Kulturplatten und Beschichtungslösung (Kollagen / Fibronektin / BSA) in die BSC.
- Pipette 2,0 ml Beschichtungslösung in einem 100mm Platte.
- Swirl um die Beschichtung der Basis der Platte. Sicherstellen, dass die Beschichtung Lösung deckt die Basis der Platte gleichmäßig.
- Pipette die übrig gebliebenen Lösung aus und verwenden Sie es zu beschichten einen zweiten 100mm Platte. Wiederholen Sie dies für so viele Platten wie nötig. Die Anzahl der Platten benötigt variiert mit der Anzahl der Gewebe-Explantate.
- Sicherstellen, dass die Beschichtung Lösung deckt die Grundlagen der Platten gleichmäßig unter Beweis gestellt.
- Decken Sie die Platten mit ihren abdeckt. Lassen Sie die Platten in den Inkubator für 1-2 Stunden trocknen lassen und absaugen überschüssige Lösung vor der Verwendung zur Bronchialgewebe Explantate. Ungenutzte beschichteten Kulturplatten kann in einem sterilen Beutel verpackt werden; versiegelt und bei 4 ° C für eine spätere Verwendung (kann bis zu einem Monat im Kühlschrank aufbewahrt werden). Bringen Sie vor dem Gebrauch Raumtemperatur.
- Spray reinigen kleinen scharfen Schere, Skalpell, Pinzette und mit 70% Ethanol und bringen in BSC. Scratch beschichteten Platten, indem Sie fest mit dem Skalpell zu tief kleinen X s (mindestens 4) zu bilden. Wenn der Kratzer nicht tief genug ist, wird Gewebestücke nicht in Grate niederzulassen und schwimmt.
2. Vorbereitung Bronchial Tissue Explantate
Verwenden Sie Bronchialgewebe innerhalb von 24-36 Stunden nach der Operation erhalten. Keep Gewebe auf Eis in EBSS bis zur Verwendung.
- Außerhalb des BSC: Zeigen Gewebe in einer Petrischale. Spülen Sie den isolierten menschlichen Bronchien Gewebeproben gründlich in EBSS.
- Dissect überschüssiges Gewebe.
- Schneiden Sie das Bronchialsystem Stücke.
- Bringen Sie das Gewebe in die BSC und Überführung in eine sterile 100mm Gewebekulturplatte mit kaltem DMEM/HamF12 + 1% Antibiotikum / Antimykotikum.
- Verwenden Sie die scharfen kleinen Schere, um das Gewebe in 2-3 mm 3 Stücke schneiden.
- Legen Sie ein Stück geschnitten Gewebe in der Mitte jedes X mit einer Pinzette und drücken Sie sanft.
- Lassen Sie die Gewebestücke (Explantate), um die Platte für ein paar Sekunden halten und dann vorsichtig hinzu 10ml komplette Medien (DMEM/HamF12 + Additiven +1% Antibiotikum / Antimykotikum + 1% FBS). Wenn das Gewebe schwimmt nach dem Hinzufügen von Medien, Verwendung einer Pinzette, um das Gewebe in die Rillen des X drücken oder einen neuen X. Es kann notwendig sein, neue X s machen, wenn die Stege nicht tief genug.
- Legen Platten in Inkubator und Change-Medien alle 3-4 Tage.
- Gewebe sind bereit, Transplantation, wenn genügend Epithelzellen rund Gewebe Explantate haben sich zu 1-2cm Bereiche abdecken. Dies dauert etwa 4 Wochen.
3. Bronchial Tissue Transplantation
- Verwenden 100mm beschichtet und kratzte Platten. Seit einiger Gewebe Explantate möglicherweise nicht erfolgreich ist, hängt die Anzahl der Platten auf, wie viele Stücke von Gewebe sind Sie Umpflanzen. Wenn Sie mit Platten, die zuvor beschichtet worden sind und bei 4 ° C gelagert werden, auf Raumtemperatur bringen vor dem Gebrauch.
- Mit einer Pinzette vorsichtig abholen Gewebe aus der ursprünglichen Platte und in der Mitte der X s in die neue Platte, und drücken Sie sanft. Gewebe ohne Auswuchs sollte verworfen werden.
- Lassen Gewebe anhaften für einige Sekunden, fügen Sie Medien und inkubieren wie beschrieben Ohrlier für Explantate (2,7-2,9).
4. Passage des menschlichen bronchialen Epithelzellen (HBE)-Zellen
- Thaw 2ml Trypsin / EDTA-Stammlösung für jedes 100mm Gewebekulturplatte. Verdünnen Lager mit 6ml steriler 0,01 M PBS (dh 2 ml Stammlösung auf 6 ml PBS (Endkonzentration von Trypsin liegt bei 250 pg / ml und für EDTA ist 100 ug / ml).
- Nach dem Umzug Explantate auf eine neue Platte, absaugen Medien aus Platten mit 1-2cm Ringe von Zellen.
- Add 8ml von erwärmt verdünnt Trypsin / EDTA-Lösung in jede 100mm Platte und im Inkubator (37 ° C) für 3-15 Minuten. Überprüfen Sie regelmäßig, so dass Trypsin zu lange werden die Zellen schädigen.
- Überprüfen Sie Platten unter dem Mikroskop zu sicher, die meisten der Zellen aufgehoben wurden. Zellen aufzuspüren und zu lösen, wie dargestellt.
- Add 8ml von erwärmten 10% FBS in Medien pro Platte, um das Trypsin / EDTA-Lösung zu inaktivieren.
- Kombinieren Volumina aller Platten in einer Röhre (oder getrennten Röhren, wenn verschiedene Gewebe). Zählen von Zellen unter Verwendung eines Hämozytometers.
- Zentrifugation bei 100g für 5 Minuten. Ein Zellpellet wird an der Basis der Röhre bilden.
- Re-suspend Zellpellet in komplettem Medium (DMEM / Ham F12 + alle Zusatzstoffe + 1% Antibiotika-Antimykotikum + 1% FBS), um die gewünschte Zellkonzentration.
- Platzieren Sie jede 2 bis 3.000.000 Zellen pro T75 einwiegen und komplette Medien wie erforderlich. Inkubieren und Change-Medien, alle 3-4 Wochen. Zellen wachsen zu Subkonfluenz (80-90%) in T75 Flaschen in ca. 4 Wochen. Die Zellen sollten angehoben und erweitert werden oder es kann an Subkonfluenz zu Seneszenz zu verhindern.
5. Wachsende Flimmerepithel Menschliche bronchialen Epithelzellen (HBE) Zellen auf Transwells.
Primäre Epithelzellen aus Gewebe Explantate / Transplantationen gewachsen, können bis zu drei Mal erweitert werden, und dann verwendet. Ein Aussaatdichte von 50.000 bis 100.000 Zellen pro cm 2 ist 1,2 empfohlen. Höhere Dichte fördert die schnellere Differenzierung.
Hinweis: Eine Suspension von Zellen und messen ihre Zahlen. In Kulturmedium resuspendieren auf 1 Million Zellen pro 2ml.
- Beginnen Sie mit der Vorbereitung der Membranen der Transwells durch Vorinkubation der Zellkultur-Einsätze mit Medium (DMEM / Ham F12) vor dem Gebrauch. Dieser Schritt ist notwendig mit diesen empfindlichen Zellen und Zelladhäsion zu helfen.
- Verwenden Sie den 6,5 mm-Einsätze, die in den 24-Loch-well-Platten passen.
- Add Medium auf beiden Seiten der Membran (für 6,5 mm Einsätze Einsatz 0,6 ml auf der Unterseite, 0.1ml oben). Inkubieren 1 Stunde in Zellkulturbrutschrank.
- Entfernen Sie vorsichtig (absaugen) das Medium von beiden Seiten der Membran, beginnend mit der basalen Volumen zuerst.
Vorsichtig heißt: die Membran leicht beschädigt werden kann, so Pipette das Medium an der Seite der Kultur einzufügen, um die Lautstärke zu empfehlen. Andernfalls wird in undichten über Medien auf andere Brunnen führen.
- Samenzellen nach Vorinkubation der Permeable Unterstützung
- Pipette vorsichtig Ihrer Zellsuspension in der apikalen Seite der Membran: für 6,5 mm Bohrungen 0,1 ml Zellsuspension (dh 50.000 Zellen) zur apikalen Seite der Membran.
- Pipette 0,6 ml Medium auf die basale Seite der Membran.
- Feed the Zellen aus der apikalen und basalen Seiten für 10 Tage, um einen gut differenzierten Kultur zu etablieren: Tauschmittel zweimal pro Woche mit dem Beweis-Methode:
- Entfernen basalen Volume zuerst
- Ersetzen apikalen Volumen (0,1 ml Medium)
- Fügen Sie 0,6 ml Medium, um die basale Seite der Membran.
Diese Methode fördert die Zell-Bindung an Membran und verhindert, dass Zellen wird die Luft für längere Zeit (Austausch Medien schnell und wieder in Inkubator) ausgesetzt. - Erstellen Sie eine Air-Liquid-Interface (ALI) an Tag 10 durch Entfernen der apikalen Medium, dann ersetzt der 0,6 ml Medium auf die basale Seite der Membran.
- Pflegen Sie Zellen in ALI für 6 Wochen, ändern Medien zweimal pro Woche. Flimmerzellen startet erscheinenden 4 Wochen nach Gründung der ALI. Die Zellen werden einheitliche Differenzierung in Flimmerzellen erreichen 6 Wochen nach der Gründung der ALI.
Materialien Zubereitung:
1. Vorbereitung der Coating-Stammlösung (tun dies in der BSC):
Primären humanen bronchialen Epithelzellen wachsen gut auf Oberflächen mit Fibronectin / BSA / Kollagen 3 beschichtet. Die Beschichtung Stammlösung wird für 100 mm Zellkulturplatten für Explantation und Transplantation Kulturen, wie oben beschrieben verwendet. Auch die Beschichtungslösung zu beschichten Deckgläser verwendet werden kann zur Beschleunigung der Zelladhäsion, kann die Deckgläser dann Immunfärbung Experimente genutzt werden.
- Fibronectin (1mg/ml Stammlösung): Verwenden F2006-2mg von Sigma. Lösen Sie 2mg in 2mls der Balanced Salt sterile Earle s Solution (EBSS, Sigma 28888), Filter mit 0,2 &mgr; Spritzenfilter in den Biological Safety Cabinet (BSC). Shop 1ml in der -20 ° C Gefrierschrank für eine spätere Verwendung, und verwenden Sie 1 ml für die Herstellung eines 100 ml Beschichtungslösung.
- BSA (1mg/ml Stammlösung): Verwenden Sie Sigma A4919-1g. Wiegen Sie 20 mg BSA und lösen in 20 ml sterile EBSS, Filter mit 0,2 &mgr; Spritzenfilter in der BSC. Aliquot in 1ml Ampullen und speichern in der -20 ° C Gefrierschrank bis es gebraucht wird. Verwenden Sie 1ml auf Lager In den 100mls der Beschichtungslösung zu machen.
- . Collagen-Stammlösung (sofern als 0,1% oder 1mg/ml von Sigma C8919) Hinweis: nur offen in die BSC und wieder dicht vor der Rückkehr in Kühlschrank. Verwenden Sie 3 ml auf Lager In den 100 ml der Beschichtungslösung zu machen.
- Coating-Stammlösung: In den BSC: add 3mls Kollagen (1mg/ml) zu 1 ml Fibronectin (1mg/ml) und 1 ml BSA (1mg/ml), plus 95 mls EBSS (steril). Gut mischen und Aliquot in 2 ml-Fläschchen und speichern in der -20 ° C Gefrierschrank bis es gebraucht wird. Endkonzentrationen in der Beschichtung Stammlösung: Fibronectin (10 ug / ml), BSA (10 ug / ml) und Kollagen (30 pg / ml) in EBSS.
2. Vorbereitung des Nährbodens (Vorbereitung in der BSC): Medium besteht aus DMEM / Ham F-12 von Sigma mit Rinder-Hypophysen-Extrakt (15 pg / ml) und epidermal growth factor (10 ng / ml) mit anderen Additiven wie unten angegeben. Antibiotikum / Antimykotikum (1%) und FBS (1%) werden frisch jedes Mal, wenn das Kulturmedium gewechselt aufgenommen. Dieses Medium wurde durch die Überprüfung mehrerer Methoden, die Atemwegsepithelzellen Zellkulturen 3-9 beschrieben zusammengestellt. Unser Medium ist für ein optimales Wachstum der menschlichen bronchialen Epithelzellen bestimmt.
- Bovine Hypophysenextrakt (BPE 1mg/ml Stammlösung): Sigma P1476 (2,5 ml BPE bei 14mg/ml sterile und gefilterte Lösung): Verdünnen Sie 2,5 ml auf Lager (14mg/ml) zu einer Endkonzentration von 1mg/ml. dh 2,5 ml BPE Lager bis 32,5 ml sterile EBSS für einen Bestand von 1mg/ml. Teilen Sie sich in 7,5 ml Aliquots (4 Röhren von 7,5 ml Aliquots und eine Tube 5 ml Aliquot). Nach der Verdünnung, speichern Aliquots bei -20 ° C bis zum Gebrauch. Längere Lagerung der rekonstituierten Produkts und wiederholtes Einfrieren und Auftauen wird nicht empfohlen.
- Epidermal Growth Factor (EGF 10 pg / ml Stammlösung): Sigma-E9644 0,2 mg. Den Inhalt (0,2 mg) in 20 ms von 0,2 mm gefiltert 10 mM Essigsäure mit 0,1% BSA (dh auflösen 20 mg BSA in 20 ml 10 mM Essigsäure und Filter verwenden Sie dann zu rekonstruieren EGF). Aliquot in 0,5 ml Aliquots und speichern in die -20 Gefrierschrank. Verwenden Sie 100 &mgr; für 100 ml-Medien.
- Adrenalin (5mg/ml Stammlösung): Sigma E1635. Lösen Sie 10 mg in 2 ml 1M gefiltert Salzsäure (HCl), Aliquot in 50 ul Fläschchen und einfrieren (-20 ° C).
- Insulin (2mg/ml Stammlösung): Sigma I6634 50mg. Lösen Sie 50 mg in 25 ml filtriert (0,2 um Filter) verdünnter HCl (1 mM). Aliquot in 1,25 ml Flaschen.
- Tranferrin Menschen (50 mg / ml Stammlösung): Sigma T8158 100mg. Lösen 100mg in 2ml DH20 (gefiltert mit 0,2 um-Filter). Aliquot auf 100 &mgr; jeder (in 0,5 ml Röhrchen).
- Triiod-L-thyronine (1mg/ml Stammlösung): Sigma T6397 100mg. Lösen 100mg in 100ml 1M HCl gefiltert. Aliquot in 1ml Aliquots. Aliquot 0,5 ml in 10 &mgr; l Aliquots.
- Hydorcortisone (5mg/ml Stammlösung):. Sigma H0888 abwiegen 100mg und lösen sich in 20ml gefiltert Ethanol für 5mg/ml Lager. Aliquot auf 1ml Ampullen. Teilen Sie eine 1ml (5mg/ml) bis 50 ul Aliquots (0,5 ml Fläschchen).
- Retinsäure (1mg/ml Stammlösung, verdünnt auf 0.01mg/ml wenn verwendet): Sigma R2625 100mg). Lösen 100mg in 10 ml Ethanol. Teilen, um 1,0 ml Aliquots. Divide (1 ml) Fläschchen zu 50 Tuben 20 &mgr; l jeder. Einfrieren bei -20 ° C. Nehmen Sie eine 20 &mgr; l Flasche und verdünnt auf 2000μl mit Medien für einen Bestand von 0.01mg/ml, wenn nötig.
- Albumin-Lösung von Rinderserumalbumin, sterilfiltriert, Zellkultur getestet: Sigma A8412. Shop-Lösung in der Kälte (4 ° C), bis sie benötigt. Öffnen Sie nur in der BSC.
- Antibiotika-Antimykotikum, Sigma A5955: Aliquot auf 1ml Volumen und bei -20 ° C bis zum Gebrauch. Verwenden Sie bei 1% Endkonzentration im Medium.
- FBS, Sigma F1015: Inactivate FBS bei 50 ° C für 30 Minuten. Lassen Sie die in der BSC cool. Aliquot in 1ml und 10 ml sterile Fläschchen. Verwenden Sie bei 1% Endkonzentration im Kulturmedium und bei 10% Endkonzentration in den Medien zu Trypsin / EDTA-Lösung zu neutralisieren.
- Verfassung von Kulturmedium:
Für500 ml Medium DMEM/HamF12 verwenden:- 1 Tube BPE (jeweils 7,5 ml von 1mg/ml) für eine endgültige Konzentration von 15μg/ml.
- 1 Tube EGF (0,5 ml 10μg/ml) für eine Endkonzentration von 10ng/ml.
- 1 Tube Adrenalin (50 ul 5mg/ml) für eine Endkonzentration von 0.5μg/ml.
- 1 Flasche mit Insulin (1,25 ml der 2mg/ml) für eine Endkonzentration von 5μg/ml.
- 1 Durchstechflasche mit Transferrin (100 &mgr; l von 50mg/ml) für eine endgültige Konzentration von 10μg/ml.
- 5 ul Triiod-L-thyronine (at 1mg/ml) für eine Endkonzentration von 10ng/ml.
- 1 Durchstechflasche mit Hydrocortison (50 ul 5mg/ml) für eine Endkonzentration von 0.5μg/ml.
- 5 ul der Retinsäure auf 0.01mg/ml für eine Endkonzentration von 0.1ng/ml verdünnt.
- 10 pl Albuminlösung aus Rinderserum für eine Endkonzentration von 1.5μg/ml
3. Vorbereitung der Dissoziation Solutions:
- Vorbereitung von Trypsin / EDTA-Stammlösung: Man löst 100 mg Trypsin (Sigma T9935-100mg) und 40 mg EDTA (Sigma E6758) in 500 ml 0,01 M PBS (Sigma E6758). . Aliquot in 2ml Ampullen und speichern in der -20 ° C Gefrierschrank Stammlösung: 2 ml Stammlösung auf 6 ml PBS (Endkonzentration von Trypsin liegt bei 250 pg / ml und für EDTA ist 100 ug / ml).
- Lösung zum Anhalten enzymatischen Reaktionen: Bereiten Sie frische 10% FBS in den Medien in den BSC: 1 ml FBS bis 9 ml Medium (DMEM / Ham F-12). Für jede 100mm Platte verwenden 8 ml erwärmte 10% FBS zu 8 ml der Dissoziation Lösung zu neutralisieren.
4. Spezielle Anforderungen:
- Wenn Kultivierung Epithelzellen, müssen Sie alles sauber zu halten und zu desinfizieren. Alle Reagenzien für die Zellkultur verwendet werden sollten sterile oder gefiltert mit 0,2 um Filter. Vorbereitung von Materialien und Zusatzstoffe sollten in einem biologischen Sicherheitsschrank (BSC) durchgeführt werden. Medien Ergänzung oder Änderung von Medien sollte in einer BSC durchgeführt werden.
- Tie Haare weg, tragen Sie eine Wegwerf-Kappe, falls verfügbar, und tragen Sie eine Laborkittel und Handschuhe.
- Bewahren Sie alle Arbeitsflächen frei von Kabelgewirr. Reinigen Sie die Arbeitsflächen mit 70% Ethanol zwischen Betrieb und ermöglichen ein Minimum von 15 Minuten zwischen den Umgang mit verschiedenen Kulturen.
- Kennzeichnen Sie alle Reagenzien und Flaschen von Medien, zählen Eingangsdatum und Datum vorbereitet.
- Untersuchen Kulturen und Medien regelmäßig auf Anzeichen von grober bakterielle oder Pilzbefall.
- Testen Sie regelmäßig auf Mykoplasmen (falls erforderlich)
- Warm up Kulturmedium auf 37 ° C vor dem Wechseln der Medien auf die Zellen.
- Antibiotika / Antimykotika und FBS sollte frisch bis zugesetzt werden.
- Ändern Medium mindestens alle 3-4 Tage. Lassen Sie sich nicht die Zellen sitzen bei Raumtemperatur für eine lange Zeit. Ändern Medien und umgehend Inkubator zurückzukehren.
Repräsentative Ergebnisse:
Kultur Eigenschaften und Morphologie der menschlichen bronchialen Epithelzellen
Mikroskopie der menschlichen bronchialen Epithelzellen aus dem Bronchialsystem Segmente für Kultur verwendet, vor Kultivierung gebürstet, zeigte Streifen der beiden Flimmer-und Nicht-Flimmerepithelzellen Angabe einer normalen Epithel (Abbildung 1, Supplement 1). Immunfärbung von Zytospin Präparate von Zellen aus Explantaten und Zellen auf Deckgläsern ausgesät ergab, dass alle Zellen positiv für das Epithel-spezifischen Zytokeratine (Abbildung 3) waren. Erfolgreiche Kulturen aus Explantaten der bronchialen Gewebe in 8 von 9 Gewebe eingetreten ist, als einer der Explantation Kulturen infiziert wurde. Die Ringe der Epithelzellen erreicht 1-2 cm Radius in 3-4 Wochen (Abbildung 2a). Erfolgreiche Explantate wurden wieder bis zu 6 Mal kultiviert. In allen erfolgreichen Kulturen, gab es Hinweise auf die Zellwanderung innerhalb von 48 Stunden nach Beginn der Transplantation (Abb. 2b). Cells hatte einen Pflasterstein Erscheinung, die verschiedene für diese Epithelzellen wie in den Abbildungen 2, 4, 5 und 6 dargestellt ist. Sub-kultivierten bronchialen Zellen zeigten einheitlich positive Immunfärbung für Cytokeratin und E-Cadherin. Immunfärbung mit spezifischen Antikörpern gegen andere Zelltypen zeigten keine Anzeichen einer Kontamination der Kulturen von Fibroblasten, mesenchymal oder Endothelzellen (α-SMA, Vimentin und CD31: PECAM-1 Flecken bzw.) (Abbildung 5). Cells auf durchlässigen Polyestermembranen (Transwells) mit Air-Liquid-Interface in Flimmerepithel differenziert wie in Abbildung 6 gezeigt, kultiviert. Vertreter Videoaufzeichnungen der bronchialen Epithelzellen auf Transwells gewachsen zeigen ein differenziertes Epithel mit Zilien schlagen (Supplement 2).
Eigenschaften des menschlichen bronchialen Epithelzellen Zellkulturen getestet, sind in Tabelle 1 dargestellt. Die mediane Zeit bis zur ersten Passage (P1) wurde 4 Wochen, und die mittlere Rendite betrug 15,1 ± 2,75 Millionen Zellen (n = 9 Gewebe). Die Lebensfähigkeit der Zellen aus Explantaten und P1 wurde durch Trypanblau-Ausschluss beurteilt und war durchweg hoch (99%) in dieser bronchiale Kulturen. Sub-kultivierten Zellen aus dem Explantat Kulturen aus jedem Gewebe wurden nach dem ersten Durchgang für die spätere Verwendung zusammengefasst. Die mittlere Zellzahl von Explantaten wieder deutlich höher war als die anschließende Passage Kultur (alle 2 Millionen Zellen von P1 P2 ergab: 6,75 ± 2,4 Millionen Zellen, n = 5 Gewebe). Eine P2 Kultur wurde verworfen, da die Morphologie war nicht typisch für Epithelzellen (Abbildung 7a). Ebenso wurden zwei weitere Passagen (P2 und P3) von verschiedenen Geweben (Abbildung 7b) verworfen.
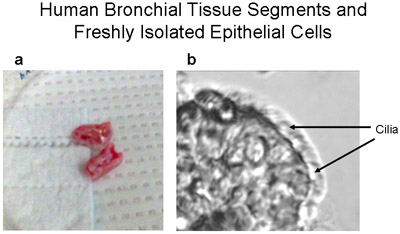
Abbildung 1 Human Bronchialgewebe Segmenten und einem frisch isolierten epithelialen Streifen Flimmer-und Nicht-Haarzellen. (A) repräsentatives Bild der menschlichen Bronchialgewebe Segmente - ~ 1-2cm lang und <1cm für primäre Kulturen von humanen bronchialen Epithelzellen Durchmesser verwendet. (B) Ein Streifen des menschlichen bronchialen Epithelzellen aus dem Bronchialsystem Segment gebürstet demonstriert sowohl Flimmer-und Nicht-Flimmerepithelzellen, Vergrößerung 320X. Video von Zellen mit Cilien schlagen wird als Supplement 1 vorgesehen.
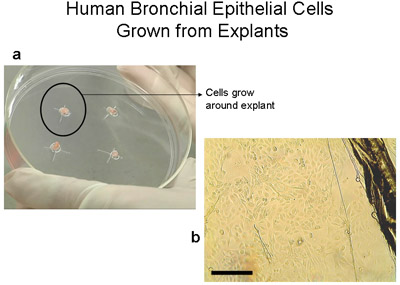
Abbildung 2 Human bronchialen Epithelzellen aus Explantaten auf 100mm Gewebekulturplatten gewachsen. a) 100 mm Platte mit 2-3mm3 Gewebe. Beachten Sie den Ring von Zellen von ca. 1-2cm, die mit bloßem Auge nach 3-4 Wochen wird. b) Bild von Rand Explantation Gewebe und Epithelzellen, wie sie aus dem Explantat, bar = 100 um zu migrieren. Explantate auf eine neue Platte geworden Transplantationen übertragen. Explantate können bis zu 6 Mal transplantiert werden.
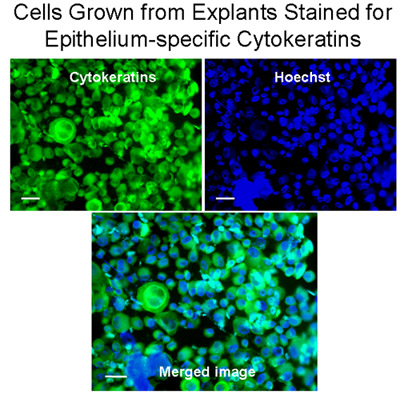
Abbildung 3 Zellen aus Explantaten für Epithel-spezifischen Zytokeratine gefärbt gewachsen. Cytospins von Zellen aus Explantate wurden für Zytokeratine (grün) mit dem monoklonalen anti-Pan Cytokeratin-FITC (Mischung), die menschlichen Zytokeratine 1, 4, 5, 6, 8, 10, 13, 18 und 19 erkennt gefärbt. Die Kerne wurden mit Hoechst gefärbt Färbung (blau). Das fusionierte Bild zeigt, dass Bronchialzellen aus Explantaten gewachsen waren vor allem Epithelzellen, Bar = 20 um.
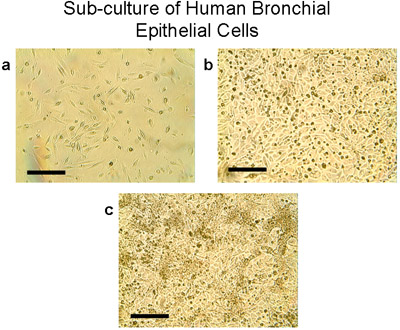
Abbildung 4 Sub-Kultur von humanen bronchialen Epithelzellen. a) unter Verwendung von Trypsin / EDTA, werden die Zellen aus Explantaten und Transplantaten aus der 100mm Platten angehoben, gezählt und ausgesät bei 2-3 Millionen Zellen pro T75 Kolben. Zellen wachsen zu Subkonfluenz (80-90%) in T75 Flaschen in 28-30 Tagen (b, c). Beachten Sie die typischen Kopfsteinpflaster Morphologie der Epithelzellen, Bar = 100 um.
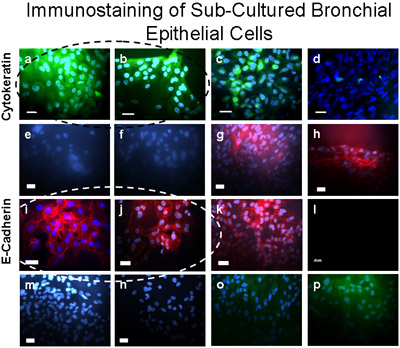
Abbildung 5 Sub-Cultured bronchiale Zellen wurden als Epithelzellen mit Immunfärbung bestätigt. Diese Zellen positiv gefärbt (grün) für Cytokeratin-FITC (a, b), eine positive Kontrolle für Cytokeratin-FITC ist in A549 Epithelzellen (c) und eine negative Kontrolle ist in Fibroblasten (d) gezeigt, dargestellt. Cultured Bronchial-Zellen positiv gefärbt (dunkelrot) für E-Cadherin/Alexa Fluor 594 (i, j), und nicht für α-SMA-Cy3 (e, f), Vimentin / TRITC (m), noch CD31 (PECAM Fleck -1/FITC) (o) zeigt keine Kontamination der primären kultivierten bronchialen Epithelzellen mit der glatten Muskulatur, mesenchymale oder Endothelzellen bzw.. Positive (dunkelrot) Steuerung für E-Cadherin/Alexa Fluor 594 auf A549 Epithelzellen (k) unter Beweis gestellt. Positive Kontrolle für α-SMA-Cy3 (rot) in Fibroblasten nachgewiesen werden (g, h). Kaninchen-anti-Maus-TRITC (n) und Donkey anti-Ziege FITC (p); sekundäre Antikörper Bedienelemente sind in bronchialen Epithelzellen für Alexa Fluor 594 (l) dargestellt. Bar = 20 um.
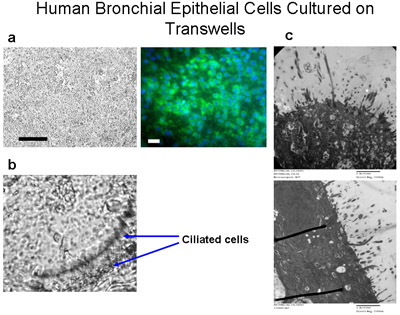
Abbildung 6 Human bronchialen Epithelzellen auf Transwells kultiviert. Flimmerzellen sind durchlässig Polyester-Membranen (6,5 mm Durchmesser) bei einer Aussaatdichte von 50.000 cel kultiviertenls pro Well (a) Bar = 100 um. Immunfärbung der Zellen auf Transwells mit Cytokeratin-FITC (grün) und DAPI kultiviert (blau) zeigt, dass diese Zellen hauptsächlich Epithelzellen, Bar = 20 um sind. Die Zellen werden kultiviert, untergetaucht in den Medien für 10 Tage, dann zugeführt Medien aus dem unteren nur für etwa 4-6 Wochen zu einer ALI erstellen, bis Zilien angebaut werden, wie in (b), Vergrößerung 160x. Siehe Beilage 2 für Videos zu schlagen Zilien. (C) TEM-Bilder zeigen Zilien Wachstum von ALI Kulturen nach 6 Wochen, Vergrößerung = 150000x.
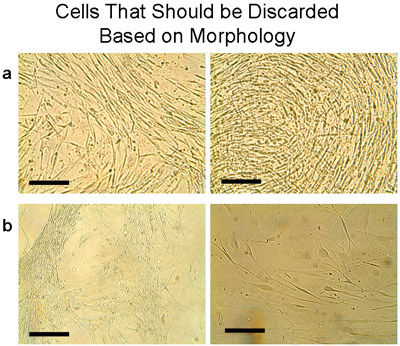
Abbildung 7 Beispiel von Zellen, die auf Basis der Morphologie verworfen werden sollte. Diese Zellen treten in der Regel, wenn das Gewebe hat oft verpflanzt worden. Beachten Sie, dass beide Zellen und Transplantation verworfen werden sollte. a) Die Zellen wurden aus einer Platte mit Transplantaten, die 6 Mal kultiviert wurden und vergoldet in einer T75-Kolben gesammelt. Innerhalb 1 Woche zeigten die Zellen eine deutliche Morphologie, die nicht vertreten war das Kopfsteinpflaster Aussehen von Epithelzellen. Stattdessen wurden dünne längliche Zellen, die dicht. b) Weitere Beispiele von Zellen, die nicht mit den typischen Epithelzellen gebündelt werden sollten, sondern muss entsorgt werden. Bar = 100 um.
Tabelle 1: Charakteristika der menschlichen bronchialen Epithelzellen Zellkulturen
| Erfolgsquote (Anzahl der Gewebe) | 9.8 (88,8%) |
| Die mediane Zeit (Bereich) zu P1 (Wochen) | 4 (3-5) |
| Mittelwert (SEM) Zelle nicht. bei P1 | 15,1 (2,75) x 10 6 |
| Mittelwert (SEM) Lebensfähigkeit P1 | 99% (2%) |
| (P1 = first passage) | |
Supplement 1 zeigt einen Streifen von Flimmer-und Nicht-Flimmerepithel bronchialen Epithelzellen aus einem menschlichen Bronchial-Segment für Transplantationen verwendet gebürstet, Vergrößerung 320X. Klicken Sie hier für die Supplement 1 Video.
Supplement 2 Differenzierte bronchialen Epithelzellen auf ein Luft-Flüssigkeit-Grenzfläche gewachsen. Videos (2a und 2b) zeigen, was Sache ist Zilien, Vergrößerung 160X und 320X bzw.. Klicken Sie hier für die Supplement 2A Video. Klicken Sie hier für die Supplement 2B Video.
Diskussion
In dieser Studie stellten wir detaillierte Methoden für die Kultur-und Ausbau von primären humanen bronchialen Epithelzellen. Wir haben gezeigt, wie Explantate und Transplantationen von bronchialen Gewebe, in Medien, die Epithelzellen Wachstum zu fördern kultiviert, kann eine kontinuierliche Quelle der menschlichen Epithelzellen der Atemwege für Studien nichtgetrennte (unter Wasser) und differenziert (angebaut an den Luft-Flüssigkeit-Grenzfläche) Zelle Modelle bieten . Diese Zellen können in Drogentests Systeme g...
Danksagungen
Die Autoren sind sehr dankbar, dass Dr. Richard Inculet für die Bereitstellung der bronchialen Gewebe. Research Ethics Board Genehmigungen wurden vom St. Josefs Healthcare Hamilton und der University of Western Ontario / London Health Sciences Centre (Dr. David McCormack), Tissue and Archives Committee, Department of Pathology erhalten. Wir danken auch Ernie Spitzer (Electron Microscopy, McMaster University) für die Bereitstellung von TEM unserer ALI Kulturen und Daniela Farkas für die Bereitstellung einiger der Materialien für die Immunfärbung benötigt. Diese Arbeit wurde von einem Block Begriff Zuschuss von der Ontario Thoracic Society finanziert werden; Dr. Asma Yaghi wurde durch ein Stipendium FSORC, St. Joseph Healthcare, Hamilton, Ontario, Kanada unterstützt.
Materialien
Weitere Anforderungen: Inkubator, biologische Sicherheitswerkbank (BSC), Zentrifuge, 100mm Kulturplatten, sterilen Röhrchen (15 ml, 50 ml und 2 ml), sterile Pipettenspitzen, Skalpell Griff und Klingen, kleine scharfe Schere, Kittel und Handschuhe. Diese können Sie bei Ihrem bevorzugten Lieferanten bezogen werden.
Referenzen
- Phillips, J. Growing Cells on Transwell Inserts - Tips and Techniques [Internet]. Corning Life Sciences, Technical Resources, Online Training. , (2008).
- Turi, J. L. Oxidative stress activates anion exchange protein 2 and AP-1 in airway epithelial cells. Am J Physiol Lung Cell Mol. Physiol. 283, L791-L798 (2002).
- Lechner, J. F., Haugen, A., McClendon, I. A., Pettis, E. W. Clonal growth of normal adult human bronchial epithelial cells in a serum-free medium. In Vitro. 18, 633-642 (1982).
- Yoshisue, H. Characterization of ciliated bronchial epithelium 1, a ciliated cell-associated gene induced during mucociliary differentiation. Am. J. Respir. Cell Mol. Biol. 31, 491-500 (2004).
- Wetering, S. v. a. n. Regulation of secretory leukocyte proteinase inhibitor (SLPI) production by human bronchial epithelial cells: increase of cell-associated SLPI by neutrophil elastase. J. Investig. Med. 48, 359-366 (2000).
- Tristram, D. A., Hicks, W., Hard, R. Respiratory syncytial virus and human bronchial epithelium. Arch. Otolaryngol. Head Neck Surg. 124, 777-783 (1998).
- Mattinger, C., Nyugen, T., Schafer, D., Hormann, K. Evaluation of serum-free culture conditions for primary human nasal epithelial cells. Int. J. Hyg. Environ. Health. 205, 235-238 (2002).
- Freshney, R. I., Freshney, R. I. . Culture of epithelial cells. , 1-23 (1992).
- Freshney, R. I., Freshney, R. I. Normal human bronchial epithelial cell cultures in Culture of specialized cells series. Culture of epithelial cells. , 181-196 (1992).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten