このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
外植片から成長した初代ヒト気管支上皮細胞
要約
ここでは気液界面上で差別化された成長を含むヒト気管支気道組織の外植片から初代ヒト気管支上皮細胞を成長させるための詳細な方法について説明します。このメソッドは、人間の肺の健康と疾患における気道上皮の役割を調査するための主要な細胞の豊富なソースを提供します。
要約
ヒト気管支上皮細胞は、疾患の細胞モデルのために必要であるとヒト上皮細胞の機能と構造に賦形剤及び薬理学的薬剤の効果を調査する。ここでは詳細に肺の手術(例えば肺癌や肺容量減少手術)の時に外科医によって収穫された気管支気道組織から気管支上皮細胞を成長させる方法を説明します。倫理の承認とインフォームドコンセントと、外科医は、病理学に必要なものを取り、病気の分野から離れている気管支の部分を提供してくれます。組織は、文化の中で主要な気管支上皮細胞を成長させるために使用できる外植片のソースとして使用されます。 0.5〜1センチメートル長く、直径≤約1cm気管支セグメントは、冷たいEBSSで洗浄され、過剰実質組織が削除されます。セグメントは、オープンカットと2〜3ミリメートルに刻まれている
プロトコル
ヒト気管支のセグメントは、主気管支上皮細胞の豊富なソースを提供しています。この記事では、成長と新たに単離したヒト気管支のセグメントからヒト気管支上皮(HBE)細胞の増殖のためのプロトコルについて説明します。このプロトコルは、5つのセクションで構成されています。
- コーティングと100ミリメートルの培養プレートを傷つけない
- 気管支組織外植片の準備
- 気管支組織移植
- HBE細胞の継代
- Transwells上で成長している繊毛HBE細胞
あなたは、特に断りのない限りすべてのステップは生物学的安全キャビネット(BSC)で行われることに注意を始める前に 。この手順に必要なすべての材料を持っていることを確認してください。材料、試薬および準備セクションを読み、無菌的に(生物学的安全キャビネットまたはBSCで、すなわち)以下を準備していることを確認してください。
コーティングの原液:フィブロネクチン(10μg/ ml)を、アールの平衡塩類溶液にBSA(10μg/ mlの)とコラーゲン(30μg/ mlの)(EBSS、無菌)。
培地:DMEM /ハムF - 12の添加物、抗生物質-抗真菌剤(1%)とFBS(1%)
解離ソリューション:FBSとトリプシン/ EDTAストック溶液とDMEM/F-12(10%)
1。コーティングと100ミリメートルの培養プレート掻く :外植片は、100ミリメートル培養プレートに播種される。コーティング液でコーティング100ミリメートル培養プレートで起動します。これは、すべてが無菌に保つ、BSCで行う必要があります。
- BSCの滅菌100ミリメートル培養プレートとコーティング液(コラーゲン/フィブロネクチン/ BSA)を置きます。
- 100ミリメートルプレートのコーティング溶液のピペット2.0mlの。
- コートプレートの底をに周り渦巻く。コーティング液は均等にプレートの底をカバーすることを確認してください。
- 残った液をピペッティングし、コートに2番目の100ミリメートルプレートを使用してください。必要に応じて多くのプレートとして、この手順を繰り返します。必要なプレートの数は、組織外植片の数によって異なります。
- コーティング液が均等に示したプレートの拠点をカバーすることを確認してください。
- 彼らのカバーでプレートをカバーしています。プレートは1〜2時間インキュベーターで乾燥させ、気管支組織外植片のための使用前に過剰の溶液を吸引することができます。未使用のコート培養プレートは滅菌袋に置くことができる。密封し、4℃保存後の使用のために(冷蔵庫で月まで保存することができます)。使用前に室温に持参。
- スプレークリーン小さなはさみ、メス、および70%エタノールで鉗子やBSCに持参。深い小さなXのを(少なくとも4)を形成するためにメスでしっかりと押すことでコーティングしたプレートをこすります。スクラッチは、十分な深さではない場合、組織片は、尾根に解決しないとフロートします。
2。気管支組織外植片の準備
手術後24〜36時間以内に得られる気管支組織を使用してください。使用直前までEBSSで氷上に組織を維持する。
- BSC外:ペトリ皿に配置して組織。 EBSSで徹底的に隔離されたヒト気管支組織標本を洗浄します。
- 過剰な周囲の組織をばらばらにする。
- 気管支の部分を開いてカット。
- BSCと冷たいDMEM/HamF12と滅菌100ミリメートル組織培養プレートへの転送+ 1%抗生物質/抗真菌剤にティッシュを持参してください 。
- 2〜3ミリメートル3つの部分に組織を切断する鋭い小さなはさみを使用してください。
- 片足鉗子でそれぞれXの中央でカットの組織片と軽く押す。
- 組織片(移植片)が数秒間プレートに付着し、静かに完全なメディア10mlの(抗真菌剤/ DMEM/HamF12 +添加剤1パーセント抗生物質+ 1%FBS)を追加してみましょう。組織は、メディアを追加した後に浮かぶ場合、尾根が十分な深さではない場合には、新しいX sを作るために必要になることがありますXの尾根にティッシュを押したり、新しいXを作るために鉗子を使用する。
- インキュベーターと変化メディアの場所のプレートごとに3〜4日。
- 組織は、十分な上皮細胞は1〜2センチメートル領域をカバーする組織外植片の周りに成長している時に移植する準備が整いました。これは、約4週間かかります。
3。気管支組織移植
- 100ミリメートルコーティングと傷プレートを使用してください。いくつかの組織片が成功しない可能性があるので、プレートの数は、移植されるか、多くの組織片に依存します。以前に4℃で塗布し、格納されているプレートを使用している場合は、使用前に室温にもたらす。
- 鉗子を使用して、慎重に新しいプレートにX sの中心にあるオリジナルのプレートと場所から組織を拾う、と優しく押してください。ない伸長を有する組織は破棄されるべきである。
- メディアを追加し、前述のように耳をインキュベート、組織が数秒間プレートに付着しましょう植片(2.7〜2.9)のためのリール。
4。ヒト気管支上皮(HBE)細胞の継代
- 各100ミリメートル組織培養プレートのためにトリプシン/ EDTAストック溶液の2ミリリットルを解凍。滅菌0.01M PBS(すなわち、6 mlのPBS(トリプシンの最終濃度が250μg/ mlのとEDTAのための100μg/ mlの場合)に2 mlのストック溶液を加えるの6ミリリットルで株式を希釈する。
- 新しいプレートに植片を移動した後、細胞の1〜2センチメートルリングでプレートから培地を吸引除去する。
- 3月15日分間インキュベーター内の各100ミリメートルプレートと場所(37℃)に希釈したトリプシン/ EDTA溶液を温めるの8ミリリットルを追加。長すぎる細胞を損傷することがでトリプシンを残し、頻繁に確認してください。
- 細胞のほとんどが解除されているを確認するために顕微鏡下でプレートを確認してください。細胞は切り上げと示すように分離させます。
- トリプシン/ EDTA溶液を不活性化するためにプレートごとにメディアに温めておいた10%FBSの8ミリリットルを追加。
- つのチューブ(または別々のチューブの異なる組織であれば)に全てのプレートのボリュームを組み合わせる。血球計を用いて細胞を数える。
- 5分間、100グラムで遠心分離します。細胞ペレットは、真空管の基部に形成されます。
- 所望の細胞濃度に完全なメディアで再懸細胞ペレット(DMEM /ハムF12 +すべての添加剤+ 1%抗生物質 - 抗真菌剤+ 1%FBS)。
- T75フラスコあたり2〜3万セルそれぞれを置き、必要に応じて完全なメディアを追加します。 3〜4週間インキュベートし、メディアを変更してください。細胞は約4週間でT75フラスコでサブ合流点(80〜90%)に成長する。細胞が押し上げられて拡大したり、老化を防止するために、サブ合流で使用してください。
5。 Transwellsに繊毛ヒト気管支上皮(HBE)細胞を成長 。
組織外植片/移植から成長した主な上皮細胞は、3回まで拡大し、使用することができます。 1cm 2あたり50,000〜100,000細胞の播種密度は、1,2をお勧めします。より高い密度は、より高速な分化を促進する。
注意:細胞の懸濁液を調製し、その数値を測定する。 2ミリリットル当たり1万個の細胞から培養液中で再懸濁する。
- 使用前に培地(DMEM /ハムF12)で細胞培養インサートをプレインキュベートすることによってtranswellsの透過性の膜を準備して開始します。このステップでは、 これらの感受性細胞で必要であり、細胞の付着を助ける。
- 24ウェル複数のウェルプレートに収まる6.5ミリメートルインサートを使用してください。
- 膜の両側(6.5 mmの挿入のための底部に0.6ミリリットルを使用して、上に0.1ミリリットル)にメディアを追加。細胞培養インキュベーターで1時間インキュベートします。
- 慎重に第一基底のボリュームで始まる膜の両側から(吸引)培地を取り除く。
慎重に意味:膜が容易に破損することができるので、推奨されるボリュームを使用して、文化のインサートの側面の下培地をピペットで。そうしないと、他の井戸へのメディアの上に漏れが発生します。
- 透過性支持体のプレインキュベーション後の種子の細胞
- 慎重にピペット膜の頂端側にして細胞懸濁液は6.5mm井戸は膜の頂端側に細胞懸濁液0.1 ml(すなわち50,000細胞)を追加するため。
- 膜の基底側のピペット0.6ミリリットルの培地。
- うまく差別化された文化を確立するために10日間の頂と基底側面から細胞をフィード:交換媒体を示した方法を使用して週二回。
- 第一基底のボリュームを削除します。
- 心尖部容積(0.1ミリリットル培地)を置き換える
- 膜の基底側に培地0.6 mlを加え。
このメソッドは、膜に細胞接着を促進し、長時間(交換メディアを迅速かつインキュベーターに戻さ)のために空気にさらされることから細胞を防ぐことができます。 - その後、膜の基底側に培地0.6 mlを置き換える、尖培地を除去して10日目に気液界面(ALI)を作成します。
- 6週間ALIで細胞を維持するため、週二回メディアを変更してください。繊毛細胞は4週間ALIの作成後に表示されて開始されます。細胞は6週間ALIの作成後に繊毛細胞に均一な分化を達成します。
材料の準備:
1。コーティングストック溶液の調製(BSCでこれを実行):
初代ヒト気管支上皮細胞は、フィブロネクチン/ BSA /コラーゲン3でコーティングした表面でよく育つ。上記のようなコーティングの原液は、外植片と移植の文化のための100 mmの組織培養プレートに使用されます。また、コーティング液が細胞接着をスピードアップするためにコートをカバーガラスに使用することができる、カバースリップをして実験を免疫染色に利用することができます。
- フィブロネクチン(1mg/mlのストック溶液):シグマから使用F2006 - 2mgを 。生物学的安全キャビネット(BSC)で0.2μmのシリンジフィルターでフィルター滅菌アールの平衡塩類溶液(EBSS、シグマ28888)、の2mlsで2mgのを溶かす。ストアは、後で使用するため-20℃の冷凍庫で1ミリリットル、およびコーティング溶液100 MLSを準備するために1 mlを使用してください。
- BSA(1mg/mlのストック溶液):使用シグマA4919 - 1G。 BSCにおける0.2μmのシリンジフィルターとフィルター、20mgのBSAを秤量し、20 MLS滅菌EBSSで溶解する。必要になるまで-20℃の冷凍庫で1ミリリットル瓶とストアに分注し。コーティング液の100mlsにする株式の1ミリリットルを使用してください。
- コラーゲン原液(シグマC8919から0.1%または1mg/mlとして提供)注:。冷蔵庫に戻る前に唯一のBSCとタイトなシールで開きます。コーティング溶液100mlを作るために株式の3 mlを使用してください。
- コーティングの原液 :BSCの:1ミリリットルフィブロネクチン(1mg/ml)と1ミリリットルBSA(1mg/ml)、プラス95 MLS EBSS(滅菌)する(1mg/ml)3mlsのコラーゲンを追加。必要になるまで-20℃の冷凍庫で2 mlのバイアルとストアによく混ぜ、アリコート。コーティングの原液中の最終濃度:フィブロネクチン(10μg/ ml)を、BSA(10μg/ mlの)とEBSSのコラーゲン(30μg/ mlの)。
2。培養液の準備(BSCで準備):中には、下記に示すような他の添加剤とウシ下垂体抽出物(15μg/ mlの)と上皮成長因子(10 ng / mlの)とシグマからDMEM /ハムF - 12で構成されています。抗生物質/抗真菌剤(1%)とFBS(1%)新鮮な培地が変更されるたびに追加されます。この培地は、気道上皮細胞培養3-9の説明に従って、複数の方法を見直すことでコンパイルされました。私たちの培地はヒト気管支上皮細胞の最適な成長のために意図されています。
- ウシ下垂体抽出物(BPE 1mg/mlのストック溶液):シグマP1476(14mg/ml滅菌およびろ液で2.5 mlのBPE):株式の希釈2.5 MLS(14mg/ml)1mg/mlの最終濃度まで。すなわち、1mg/mlのストック用の滅菌EBSSの32.5 mlに2.5 mlのBPEの株式を追加します。 7.5ミリリットルのアリコート(7.5 mlのアリコートの4管と5 mLをいずれかのチューブ)に分かれる。希釈後、必要になるまで-20℃で保存のアリコート。長期再構成された製品の貯蔵と凍結融解の繰り返しは推奨されません。
- 上皮成長因子(EGF 10μg/ mlのストック溶液):シグマE9644 - 0.2mg。 0.1%BSA(すなわち、10mMの酢酸20ml中に20mgのBSAを溶解し、再構成のEGFに使用してフィルタリング)を含む10mM酢酸をフィルタリング0.2mmの20ミリ秒で再構成内容(0.2mg)。 0.5mlのアリコートと-20の冷凍庫で保管に分注し。 100mlのメディアのために100μlのを使用してください。
- エピネフリン(5mg/mlストック溶液):シグマE1635。 1Mフィルタリング塩酸(HCl)、50μlのバイアルと凍結(-20℃)へのアリコートの2ミリリットルに10mgを溶解する。
- インスリン(2mg/mlの原液):シグマI6634 50mgの。 25ミリリットルフィルタリング(0.2μmのフィルター)希釈したHCl(1mm)の中の50mgのを溶かす。 1.25ミリリットルバイアルに分注し。
- Tranferrinヒト(50 mg / mlのストック溶液):シグマT8158 100mgの。 (0.2μmのフィルターでフィルタリングされた)2ミリリットル・ Alarm_Dで100mgのを溶かす。 100μlの各(0.5ミリリットル瓶で)に分注し。
- トリヨード- L -チロニン(1mg/mlのストック溶液):シグマT6397 100mgの。塩酸をフィルタリング100ミリリットル1Mで100mgのを溶かす。 1ミリリットルのアリコートに分注し。 10μlのアリコートに分注し0.5ミリリットル。
- Hydorcortisone(5mg/mlのストック溶液):。シグマH0888は、100mgのを秤量し、5mg/mlストックの20ミリリットルフィルタリングエタノールに溶解する。 1ミリリットルバイアルに分注し。 50μlのアリコート(0.5ミリリットル瓶)まで1ミリリットル(5mg/ml)を割ります。
- レチノイン酸(1mg/mlのストック溶液は、使用時0.01mg/mlに希釈):シグマR2625 100mg)を。エタノール10mlので100mgのを溶かす。 1.0ミリリットルアリコートに分割してください。 20μlの各50管へ(1ミリリットル)瓶を割る。 -20℃で凍結one20μlのバイアルを取り出し、必要なときに0.01mg/mlの株式のメディアで2000μlに希釈する。
- テストしたウシ血清、滅菌濾過、細胞培養からのアルブミン溶液:シグマA8412。寒いのストアソリューション(4 ° C)、必要になるまで。 BSCでのみ開きます。
- 抗生物質-抗真菌、シグマA5955:-20 ° C必要になるまで少なくとも1ミリリットルボリュームに分注して凍結。培地に1%の最終濃度で使用してください。
- FBS、シグマF1015は:50でFBSを不活性化° Cで30分間。 BSCに冷却することができます。 1ミリリットル、10 mlの滅菌バイアルに分注し。トリプシン/ EDTA溶液を中和するために培地に1%の最終濃度で、メディアでは10%の最終濃度で使用してください。
- 培地の憲法:
の培地DMEM/HamF12使用500mlの:- 15μg/mlの最終濃度BPEの1チューブ(1mg/mlのそれぞれ7.5ミリリットル)。
- 10ng/mlの最終濃度EGF(10μg/mlの0.5ミリリットル)の1チューブ。
- 0.5μg/mlの最終濃度のためのエピネフリンの1チューブ(5mg/ml50μlの)。
- 5μg/mlの最終濃度のためのインスリンの1バイアル(2mg/mlの1.25ミリリットル)。
- 10μg/mlの最終濃度Transferin 1バイアル(50mg/ml液100μl)。
- 10ng/mlの最終濃度トリヨード- L -チロニンを5μl(1mg/mlで)。
- 0.5μg/mlの最終濃度に対してヒドロコルチゾン1バイアル(5mg/ml50μlの)。
- 0.1ng/mlの最終濃度0.01mg/mlに希釈したレチノイン酸の5μlを。
- 1.5μg/mlの最終濃度のためのウシ血清から10μlのアルブミン溶液
3。解離溶液の調製:
- トリプシン/ EDTAストック溶液の調製:500ミリリットル0.01M PBS( シグマE6758)で100mgのトリプシン( シグマT9935 - 100mg)をし、40mgのEDTA( シグマE6758)を溶かす。 。2ミリリットル瓶と-20℃の冷凍庫でストアへのアリコートをストック溶液を希釈:6 mlのPBS(トリプシンの最終濃度EDTAのための250μg/ mlのとは100μg/ mlの場合)に2 mlのストック溶液を加える。
- 酵素反応を停止させるためのソリューション:BSCのメディアに10%FBSを新鮮な準備:9ミリリットル培地(DMEM /ハムF - 12)に1ミリリットルFBSを追加。各100ミリメートルプレート用解離液8mlを中和するために温めておいた10%FBS 8mlを使用してください。
4。特別な要件:
- 培養するとき上皮細胞、あなたはすべてを清潔にし、消毒を維持する必要があります。細胞培養に使用されるすべての試薬は、滅菌または0.2μmのフィルターで濾過してください。材料と添加剤の調製は、生物学的安全キャビネット(BSC)で行う必要があります。メディアのメディアの追加や変更は、BSCに行われる必要があります。
- 、離れて毛を結ぶ可能な場合は使い捨てのキャップを着用し、実験着と手袋を着用してください。
- 混乱からの自由なすべての作業面をしてください。操作の間に70%エタノールで作業面を清掃し、異文化を扱う間、15分の最小値を許可する。
- 日付、受信した日付と準備を含む、メディアのすべての試薬とボトルにラベルを付けます。
- 総細菌または真菌汚染の証拠のために定期的に文化やメディアを調べます。
- (必要に応じて)マイコプラズマのために定期的にテストする
- ° C細胞でメディアを変更する前に37に培地をウォームアップ。
- 抗生物質/抗真菌薬とFBSは、新鮮な培地に添加する必要があります。
- 少なくとも3〜4日ごとに培地を変更してください。細胞が長時間室温で放置しないでください。メディアを変更し、速やかにインキュベーターに戻す。
代表的な結果:
文化の特性とヒト気管支上皮細胞の形態
ヒト気管支上皮細胞の顕微鏡は、前培養に、培養に用いる気管支セグメントから正常な上皮( 図1、補足1)を示す線毛、非線毛上皮細胞の両方の実証ストリップを磨いた。すべての細胞が上皮固有のサイトケラチン( 図3)に対して陽性であることを明らかにしたカバースリップ上に播種植片と細胞からの細胞のサイトスピン標本の免疫染色。外植片培養のいずれかが感染したとして気管支組織の外植片からの成功の文化は、9組織のうち8で発生した。上皮細胞のリングは3〜4週間で1〜2 cmの半径( 図2a)に達した。成功した外植片は6回に再び培養した。成功したすべての文化では、移植を開始の48時間( 図2b)内の細胞移動の証拠があった。細胞は、 図2、4、5と6に示すように、これらの上皮細胞のための区別された石畳の外観を有していた。継代培養気管支細胞はサイトケラチンとE -カドヘリンのための一様な正の免疫染色を示した。他の種類の細胞に対する特異的抗体で免疫染色はmesenc、線維芽細胞培養の汚染の徴候は認められなかったhymal、または内皮細胞(α- SMA、ビメンチンおよびCD31:PECAM - 1汚れそれぞれ)( 図5)。細胞は、 図6に示すように線毛上皮細胞に分化気液界面で透過性のポリエステル膜(transwells)上で培養。 transwells上に成長した気管支上皮細胞の代表的なビデオ録画には繊毛( 補足2)を破って、差別化上皮を示しています。
テストしたヒト気管支上皮細胞培養の特性を表1に示す。初通過(P1)までの期間の中央値は4週間で、平均収量は15.1でした± 2.75万セル(N = 9の組織)。外植片からとP1の細胞の生存率をトリパンブルー排除法により評価し、これらの気管支の文化では(99%)一貫して高かった。各組織からの外植片の培養から継代培養細胞は、その後の使用のための最初の通過後にプールした。外植片から回収の平均細胞数は、その後の継代培養(:6.75 ± 2.4万セル、n = 5の組織P1から各2万個の細胞は、P2をもたらした)よりも有意に高かった。形態は上皮細胞( 図7a)の典型的ではなかったとして一つP2の文化を捨てた。同様に、異なる組織( 図7b)の二つの通路(P2およびP3)は廃棄されました。
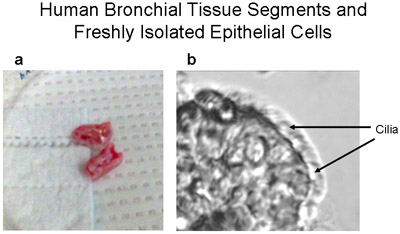
1ヒト気管支組織のセグメントと繊毛と非繊毛細胞の新たに単離した上皮ストリップを示しています。 〜1〜2センチメートル長いと<1センチメートルヒト気管支上皮細胞の初代培養のために直径に使用される - ヒト気管支組織のセグメントの()代表画像。 (b)の気管支セグメントからブラシをかけられるヒト気管支上皮細胞のストリップは、繊毛と非繊毛の両方上皮細胞、倍率320 ×で示しています。鼓動繊毛を持つ細胞のビデオは、 補足1として提供されています。
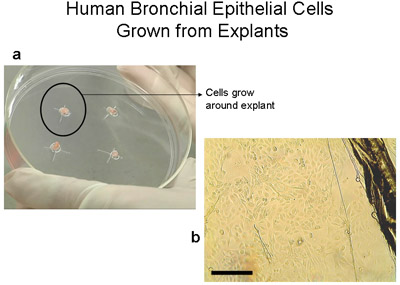
100ミリメートル組織培養プレート上に植から成長した2ヒト気管支上皮細胞を示しています。 2〜3立方ミリメートル組織とa)の100ミリメートルプレート。 3-4週後に肉眼で見えるようになる約1〜2センチメートルの細胞のリングに注意してください。 B)外植組織および上皮細胞の端の写真は、外植片、棒=100μmのからの移行として。外植片は、移植となる新たなプレートに移した。外植片は6回まで移植することができる。
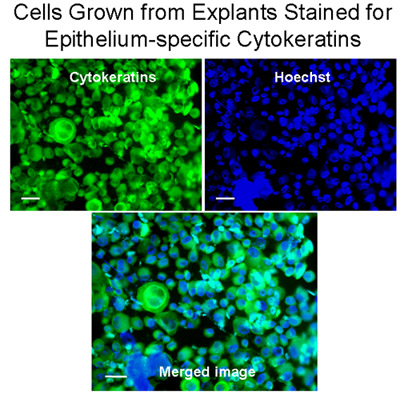
上皮特異的なケラチンを染色植から成長した図3セル。外植片からの細胞のCytospinsは、人間のサイトケラチン1、4、5、6、8、10、13、18、および19を認識するモノクローナル抗パンサイトケラチン- FITC(混合物)とサイトケラチン(緑)で染色した。核は染色ヘキスト(青色)で染色した。マージされた画像は、外植片から増殖気管支細胞は主に上皮細胞、バー=20μmのあったことを示している。
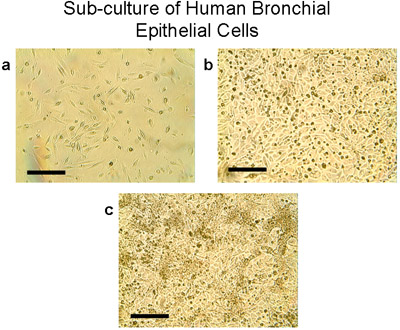
図4ヒト気管支上皮細胞のサブカルチャー。トリプシン/ EDTAを使用して)は、外植片と移植からの細胞を100mmのプレートから持ち上げカウントし、T75フラスコあたり2〜3万個の細胞で播種されています。細胞は28〜30日でT75フラスコ(A、B、C)でサブ合流(80〜90%)に成長する。上皮細胞の典型的な石畳の形態、バー=100μmのことに注意してください。
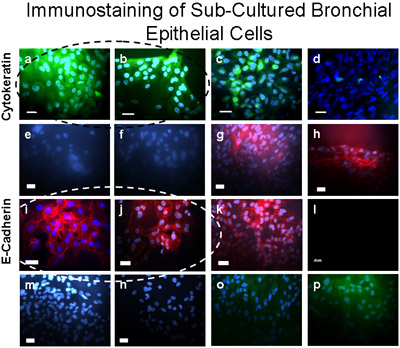
図5継代培養気管支細胞は、上皮使用して免疫染色との確認がなされた。サイトケラチン- FITC(A、B)、サイトケラチン- FITC用ポジティブコントロールのために(緑)陽性に染色これらの細胞は、A549上皮細胞(c)に示されており、ネガティブコントロールは、線維芽細胞(d)に示されています。培養気管支細胞はE-Cadherin/Alexa Fluor 594の(i、j)のための正(赤暗いの)染色、及びα- SMA - Cy3標識(E、F)、ビメンチン/ TRITC(M)、またCD31(PECAMに対して染色しなかったそれぞれ間葉系平滑筋と初代培養気管支上皮細胞、または内皮細胞のコンタミネーションがないことを示す-1/FITC)(O)。 E-Cadherin/Alexa Fluor 594のための肯定的な(暗赤色)コントロールは、A549上皮細胞(K)で示されている。 α- SMA - Cy3標識(赤色)のためのポジティブコントロールは、線維芽細胞(G、H)で示されています。ウサギ抗マウスTRITC(n)とロバ抗ヤギFITC(P)、二次抗体のコントロールは、Alexa Fluor 594の(L)のための気管支上皮細胞に表示されます。バー=20μmの。
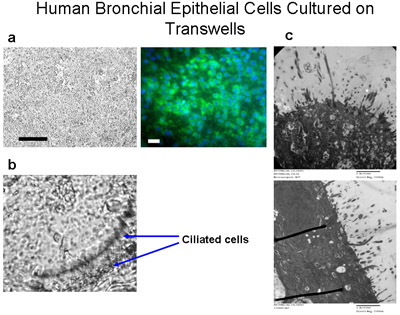
transwells上で培養6ヒト気管支上皮細胞を示しています。繊毛細胞は50,000セルの播種密度で透過性のポリエステル膜(6.5ミリメートルの直径)上で培養されていますウェルあたりLS()バー=100μmの。サイトケラチン- FITC(緑)およびDAPI(青)とtranswells上で培養した細胞の免疫染色すると、これらの細胞は主に上皮細胞、バー=20μmのであることを示している。 (B)、倍率160倍に示すように10日間のメディアで水没培養し、その後、別の4-6週間のための唯一の底から供給されたメディアは、繊毛まで、ALIを作成するために細胞が栽培されています。繊毛を破ってのビデオのために2を補足してください。 (C)のTEM像は、6週間、倍率= 150000xでALIの文化の繊毛の成長を示しています。
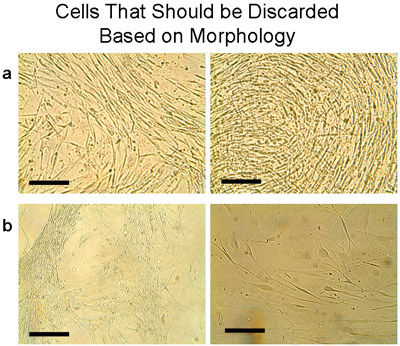
形態に基づいて廃棄されるべきセルの7例を示します 。これらの細胞は通常、組織が何度も移植されたときに表示されます。両方の細胞と移植は破棄されるべきであることに注意してください。 A)細胞はT75フラスコで6回とメッキを培養した移植でワンプレートから採取された。 1週間以内に細胞が上皮細胞の石畳の外観を表現していない明確な形態を示した。代わりに、薄い細長い細胞が密に成長した。 B)典型的な上皮細胞でプールされるべきではないが、廃棄されるべきセルのその他の例は。バー=100μmの。
表1:ヒト気管支上皮培養細胞の特性
| (#組織の)成功率 | 8 / 9(88.8%) |
| P1までの時間の中央値(範囲)(週) | 4(3-5) |
| (SEM)細胞の無を意味する。 P1で | 15.1(2.75)× 10 6 |
| P1で(SEM)実行可能性を意味する | 99%(2%) |
| (P1 =初通過) | |
補足1が移植のために使用されるヒト気管支セグメントからブラッシング繊毛と非繊毛気管支上皮細胞のストリップを示し、倍率320 ×で。 ここをクリックして補足1ビデオのために。
気液界面上に成長した2分化した気管支上皮細胞を補う 。動画(2aと2b)は、それぞれ破っ繊毛、倍率160Xと320 ×を示す。 ここをクリックしてサプリメント2Aのビデオのために。 ここをクリックしてサプリメント2Bのビデオのために。
ディスカッション
本研究では、文化と初代ヒト気管支上皮細胞の拡大のための詳細な方法を提示した。我々は、上皮細胞の増殖を促進する培地で培養外植片と気管支組織の移植は、、(気液界面上に成長した)非差別(水中)と分化した細胞モデルの研究のためのヒト気道上皮細胞の連続的なソースを提供する方法を実証。これらの細胞は、より密接に彼らの実際の生理的環境での細胞のようになっているこ?...
謝辞
著者らは、気管支の組織を提供するための博士リチャードInculetに非常に感謝しています。研究倫理審査会の承認は、聖ヨセフのヘルスケアハミルトンとウェスタンオンタリオ/ロンドン健康科学センター(デビッドマコーマック)、ティッシュやアーカイブ委員会、病理部の大学から得た。我々はまた、免疫染色に必要な材料のいくつかを提供する私たちのALI培養の通信機器メーカー、およびダニエラのファーカスを提供するためのアーニースピッツァーを(電子顕微鏡、マクマスター大学)に感謝します。この作品は、オンタリオ州胸部学会からのブロックの用語の助成金によって賄われていた博士はアスマヤギ氏はFSORC奨学金、聖ヨセフのヘルスケア、ハミルトン、オンタリオ州、カナダによってサポートされていました。
資料
その他の要件:インキュベーター、生物学的安全キャビネット(BSC)、遠心100mmの培養プレート、滅菌チューブ(15ミリリットル、50ミリリットル、及び2 ml)を、滅菌ピペットチップ、メスハンドルと刃、小さなはさみ、白衣、手袋。これらは、お好みの供給者から入手することができます。
参考文献
- Phillips, J. Growing Cells on Transwell Inserts - Tips and Techniques [Internet]. Corning Life Sciences, Technical Resources, Online Training. , (2008).
- Turi, J. L. Oxidative stress activates anion exchange protein 2 and AP-1 in airway epithelial cells. Am J Physiol Lung Cell Mol. Physiol. 283, L791-L798 (2002).
- Lechner, J. F., Haugen, A., McClendon, I. A., Pettis, E. W. Clonal growth of normal adult human bronchial epithelial cells in a serum-free medium. In Vitro. 18, 633-642 (1982).
- Yoshisue, H. Characterization of ciliated bronchial epithelium 1, a ciliated cell-associated gene induced during mucociliary differentiation. Am. J. Respir. Cell Mol. Biol. 31, 491-500 (2004).
- Wetering, S. v. a. n. Regulation of secretory leukocyte proteinase inhibitor (SLPI) production by human bronchial epithelial cells: increase of cell-associated SLPI by neutrophil elastase. J. Investig. Med. 48, 359-366 (2000).
- Tristram, D. A., Hicks, W., Hard, R. Respiratory syncytial virus and human bronchial epithelium. Arch. Otolaryngol. Head Neck Surg. 124, 777-783 (1998).
- Mattinger, C., Nyugen, T., Schafer, D., Hormann, K. Evaluation of serum-free culture conditions for primary human nasal epithelial cells. Int. J. Hyg. Environ. Health. 205, 235-238 (2002).
- Freshney, R. I., Freshney, R. I. . Culture of epithelial cells. , 1-23 (1992).
- Freshney, R. I., Freshney, R. I. Normal human bronchial epithelial cell cultures in Culture of specialized cells series. Culture of epithelial cells. , 181-196 (1992).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved