È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Primario cellule epiteliali bronchiali umane Grown da espianti
In questo articolo
Riepilogo
Qui si descrive un metodo dettagliato per la coltivazione primaria cellule epiteliali bronchiali umane da espianti di tessuti umani delle vie aeree bronchiali tra cui la crescita differenziati su un aria-liquido. Questo metodo fornisce una fonte abbondante di cellule primarie per indagare il ruolo dell'epitelio delle vie aeree dei polmoni umani nella salute e nella malattia.
Abstract
Cellule epiteliali bronchiali umane sono necessarie per modelli cellulari della malattia e per indagare l'effetto di eccipienti e agenti farmacologici sulla funzione e la struttura delle cellule epiteliali umane. Qui si descrivono in dettaglio il metodo di coltivazione cellule epiteliali bronchiali dal tessuto delle vie aeree bronchiali che viene raccolto dal chirurgo al momento della chirurgia polmonare (ad esempio il cancro ai polmoni o di riduzione del volume polmonare). Con l'approvazione etica e il consenso informato, il chirurgo prende ciò che è necessario per patologia e ci fornisce una porzione bronchiale che è lontano dalle zone malate. Il tessuto viene quindi utilizzato come fonte di espianti che possono essere utilizzati per la coltivazione di cellule primarie epiteliali bronchiali in coltura. Segmenti bronchiali circa 0,5-1cm di lunghezza e ≤ 1 centimetro di diametro, sono sciacquati con EBSS freddi e eccesso di tessuto parenchimale è stato rimosso. I segmenti sono tagliati aperti e tritata in 2-3mm
Protocollo
Umano segmenti bronchiale fornire una fonte abbondante di cellule primarie epiteliali bronchiali. In questo articolo viene descritto un protocollo per la crescita e l'espansione di Human epiteliali bronchiali (HBE) cellule appena isolate segmenti bronchiali umane. Questo protocollo si compone di cinque sezioni:
- Rivestimento e Scratching piastre di coltura 100 millimetri
- Preparazione Espianti tessuto bronchiale
- Trapianti di tessuto bronchiale
- Passaggio di cellule HBE
- Crescere Cellule HBE ciliato in Transwells
Prima di iniziare Si noti che tutti i passaggi sono fatto in GABINETTO SICUREZZA BIOLOGICA (BSC), salvo diversa indicazione. Assicurati di avere tutti i materiali necessari per questa procedura. Si prega di leggere i Materiali, reagenti e la sezione Preparazione e assicurarsi di avere asettico (cioè in un gabinetto di sicurezza biologica o BSC) ha preparato il seguente:
Rivestimento soluzione madre: fibronectina (10 mg / ml), BSA (10 mg / ml) e collagene (30 mg / ml) in soluzione salina bilanciata Earle s (EBSS, sterile).
Cultura medio: DMEM / Ham F-12 con additivi, antibiotico-antimicotico (1%) e FBS (1%)
Soluzioni di dissociazione: tripsina / EDTA soluzione stock e DMEM/F-12 con FBS (10%)
1. Rivestimento e Scratching piastre di coltura 100 millimetri: Espianti sarà placcato in piastre di coltura 100mm. Per iniziare, piastre di coltura rivestimento 100 millimetri con soluzione di rivestimento. Questo dovrebbe essere fatto nel BSC, tenere tutto sterile.
- Luogo piastre di coltura sterile 100mm e soluzione di rivestimento (collagene / fibronectina / BSA) nel BSC.
- Pipettare 2,0 ml di soluzione di rivestimento in una piastra di 100 mm.
- Swirl intorno a mano alla base del piatto. Assicurarsi che la soluzione di rivestimento copre la base del piatto in modo uniforme.
- Pipettare la soluzione rimasto fuori e usarlo per ricoprire un secondo piatto 100mm. Ripetere l'operazione per il numero di piatti necessari. Il numero di piatti necessari varia a seconda del numero di espianti di tessuto.
- Assicurarsi che la soluzione di rivestimento copre le basi delle lastre in modo uniforme, come dimostrato.
- Coprire le piastre con le loro copertine. Lasciare asciugare le piastre in incubatrice per 1-2 ore ed aspirare la soluzione in eccesso prima dell'uso per espianti di tessuto bronchiale. Inutilizzati piastre di coltura rivestito può essere collocato in un sacchetto sterile sigillato e conservato a 4 ° C per un uso successivo (è possibile memorizzare fino a un mese in frigo). Portare a temperatura ambiente prima dell'uso.
- Spray pulire piccole forbici affilate, bisturi e pinze con il 70% di etanolo e mettono in BSC. Scratch piatti rivestiti premendo saldamente con bisturi per formare profondi piccoli X s (almeno 4). Se il graffio non è abbastanza profondo, pezzi di tessuto non si sistemerà in creste e galleggia.
2. Preparazione Espianti tessuto bronchiale
Usa tessuto bronchiale ottenuta entro 24-36 ore dopo l'intervento chirurgico. Mantenere il tessuto sul ghiaccio in EBSS fino al momento dell'utilizzo.
- Al di fuori del BSC: tessuto Mettere in una piastra di Petri. Sciacquare il isolato campioni umani tessuto bronchiale accuratamente in EBSS.
- Sezionare fuori eccesso di tessuto circostante.
- Taglio aperto i pezzi bronchiale.
- Portare i tessuti nel BSC e trasferire in un piatto sterile 100 millimetri coltura tissutale per il freddo DMEM/HamF12 + 1% antibiotico / antimicotico.
- Utilizzare le forbici affilato per tagliare il tessuto in 2-3 mm 3 pezzi.
- Mettete un pezzo di tessuto tagliato al centro di ogni X con una pinza e premere delicatamente.
- Lasciate che i pezzi di tessuto (espianti) aderiscono alla piastra per alcuni secondi, e poi delicatamente aggiungere 10 ml di mezzi di comunicazione completo (DMEM/HamF12 + additivi +1% antibiotico / antimicotico FBS + 1%). Se il tessuto galleggia dopo l'aggiunta dei media, usare il forcipe per spingere il tessuto nelle creste del X o fare un nuovo X. Potrebbe essere necessario fare nuova X s se le creste non sono abbastanza profondo.
- Piastre posto in incubatrice e il cambiamento dei media ogni 3-4 giorni.
- I tessuti sono pronti a trapianto di cellule epiteliali sufficienti quando sono cresciuti intorno espianti di tessuto per coprire le zone 1-2cm. Questa operazione richiede circa 4 settimane.
3. Trapianti di tessuto bronchiale
- Usa 100 millimetri piastre rivestite e graffiato. Poiché alcuni espianti di tessuto potrebbe non avere successo, il numero di piatti dipende da quanti pezzi di tessuto si sta trapianto. Se si utilizza piatti che sono stati precedentemente ricoperto e conservato a 4 ° C, portare a temperatura ambiente prima dell'uso.
- Prendere con cautela raccogliere tessuto dalla lastra originale e posto nel centro di X s nella nuova piastra e premere delicatamente. Tessuti senza escrescenza devono essere eliminati.
- Lasciate tessuto aderire alla piastra per alcuni secondi, aggiungere i media e incubare orecchio, come descrittolier per espianti (2,7-2,9).
4. Passaggio di risorse umane epiteliali bronchiali (HBE), le cellule
- Scongelare 2 ml di tripsina / EDTA soluzione madre per ogni piatto 100 millimetri coltura tissutale. Diluire con 6 ml di PBS sterile 0.01M (cioè aggiungere 2 ml di soluzione concentrata a 6 ml di PBS (concentrazione finale di tripsina è di 250 mcg / ml e per EDTA è di 100 mg / ml).
- Dopo essersi trasferito espianti di un piatto nuovo, aspirare media di piatti con 1-2cm anelli di cellule.
- Aggiungere 8 ml di diluito riscaldato tripsina / EDTA soluzione per ogni piatto 100mm e posto in incubatore (37 ° C) per 3-15 minuti. Controllare frequentemente, lasciando tripsina troppo a lungo danneggia le cellule.
- Controllare le piastre al microscopio per essere sicuri che la maggior parte delle cellule sono state tolte. Cellule arrotondare per eccesso e staccare come mostrato.
- Aggiungi 8ml di riscaldare il 10% FBS in supporti per piastra per inattivare la tripsina / EDTA soluzione.
- Combina volumi di tutte le lastre in un tubo (o tubi separati se diversi tessuti). Contare le cellule utilizzando un emocitometro.
- Centrifugare a 100g per 5 minuti. Un pellet di cellule formeranno alla base del tubo.
- Risospendere il pellet cellulare in mezzi completo (DMEM / Ham F12 + tutti gli additivi + 1% antibiotico-antimicotico + 1% FBS) e la concentrazione cella desiderata.
- Posto ogni 2-3 milioni di cellule per T75 pallone e aggiungere contenuti multimediali complete, come richiesto. Incubare e il cambiamento dei media ogni 3-4 settimane. Cellule crescono a sub-confluenza (80-90%) in fiasche T75 in circa 4 settimane. Le cellule devono essere sollevati ed ampliato o utilizzati a livello sub-confluenza per evitare senescenza.
5. Crescente Ciliated umane epiteliali bronchiali (HBE) cellule su Transwells.
Primarie di cellule epiteliali cresciute da espianti di tessuto / trapianti, può essere espansa fino a tre volte, e poi utilizzati. Una densità di semina di 50.000 a 100.000 cellule per cm 2 è raccomandato 1,2. Maggiore densità promuove veloce differenziazione.
Nota: Preparare una sospensione di cellule e misurare il loro numero. Risospendere nel terreno di coltura a 1 milioni di cellule per 2 ml.
- Inizia con la preparazione delle membrane permeabili del transwells di pre-incubazione gli inserti coltura cellulare di media (DMEM / Ham F12) prima dell'uso. Questo passaggio è necessario con queste cellule sensibili e aiuterà l'attaccamento delle cellule.
- Utilizzare il 6,5 inserti mm che inseriscono nel 24 pozzetti più bene.
- Aggiungi medio su entrambi i lati della membrana (per 6,5 mm utilizzare 0,6 ml inserti in basso, 0,1 ml in alto). Incubare per 1 ora in cultura incubatore cellulare.
- Rimuovere con cautela (aspirato) il supporto da entrambi i lati della membrana di partenza con il volume basale prima.
Significa attenzione: la membrana possono essere facilmente danneggiati, in modo pipetta del mezzo lungo il lato dell'inserto cultura, utilizzare il volume consigliato. Non farlo si tradurrà in perdite più di media per altri pozzi.
- Cellule discendenza dopo pre-incubazione di supporto permeabile
- Pipettare con attenzione la tua sospensione cellulare nella parte apicale della membrana: 6,5 millimetri per i pozzi aggiungere 0,1 ml di sospensione cellulare (cioè 50.000 cellule) per la parte apicale della membrana.
- Pipettare 0,6 ml di media sul lato della membrana basale.
- Alimentare le cellule dai lati apicale e basale per 10 giorni di tempo per stabilire una cultura ben differenziati: mezzo di scambio due volte a settimana utilizzando il metodo illustrato:
- Rimuovere il volume basale prima
- Sostituire il volume apicale (0,1 ml di media)
- Aggiungere 0,6 ml di terreno al lato della membrana basale.
Questo metodo favorisce l'attaccamento alla membrana delle cellule e impedisce alle cellule di essere esposte all'aria per lunghi periodi di tempo (scambio multimediali in maniera rapida e rimesso in incubatrice). - Crea un aria-liquido (ALI) il giorno 10 rimuovendo il medio apicale, poi sostituendo il 0,6 ml di terreno sul lato della membrana basale.
- Mantenere le cellule in ALI per 6 settimane, il cambiamento dei media due volte alla settimana. Cellule ciliate inizierà apparire 4 settimane dopo la creazione della ALI. Cellule raggiungerà la differenziazione uniforme in cellule ciliate 6 settimane dopo la creazione della ALI.
Materiali Preparazione:
1. Preparazione della soluzione di rivestimento Stock (farlo nel BSC):
Primario cellule epiteliali bronchiali umane crescono bene su superfici rivestite con fibronectina / BSA / collagene 3. La soluzione madre di rivestimento viene utilizzato per 100 piastre di coltura tissutale mm per espianto e trapianto di culture come descritto sopra. Anche la soluzione di rivestimento può essere usato per coprioggetto mano per accelerare l'attaccamento cella, il coprioggetto può essere utilizzato per esperimenti di immunoistochimica.
- Fibronectina (soluzione madre 1mg/ml): utilizzare F2006-2mg di Sigma. Sciogliere 2 mg in 2mls di soluzione salina bilanciata sterile Earle s (EBSS, Sigma 28888), filtro con filtro da 0,2 micron siringa nel Gabinetto di sicurezza biologica (BSC). 1 ml Conservare nel congelatore di -20 ° C per un uso successivo e utilizzare 1 ml per la preparazione di 100 ml di soluzione di rivestimento.
- BSA (soluzione madre 1mg/ml): Utilizzare Sigma A4919-1g. Pesare 20 mg di BSA e sciogliere in 20 ml EBSS sterile, filtro con filtro da 0,2 micron siringa nel BSC. Aliquotare in fiale da 1 ml e conservare nel congelatore di -20 ° C fino al momento dell'uso. Utilizzare 1 ml di brodo per fare 100 ml di soluzione di rivestimento.
- . Soluzione madre di collagene (fornito come 0,1% o 1mg/ml da Sigma C8919) Nota: aperto solo la BSC e tenuta prima di tornare in frigorifero. Utilizzare 3 ml di brodo per fare 100 ml di soluzione di rivestimento.
- Rivestimento soluzione madre: Nella BSC: aggiungere collagene 3mls (1mg/ml) a 1 ml fibronectina (1mg/ml) e 1 ml BSA (1mg/ml), più 95 ml EBSS (sterile). Mescolare bene e aliquote in 2 fiale ml e conservare nel congelatore di -20 ° C fino al momento dell'uso. Concentrazioni finali in soluzione di rivestimento magazzino: fibronectina (10 mg / ml), BSA (10 mg / ml) e collagene (30 mg / ml) in EBSS.
2. Preparazione del terreno di coltura (preparazione del BSC): Medio consiste in DMEM / Ham F-12 di Sigma con estratto di ipofisi bovina (15 mg / ml) e fattore di crescita epidermico (10 ng / ml) con altri additivi, come indicato di seguito. Antibiotico / antimicotico (1%) e FBS (1%) sono aggiunti di recente ogni volta che viene cambiato il terreno di coltura. Questo mezzo è stata compilata esaminando i metodi più quella descritta colture di cellule epiteliali delle vie aeree 3-9. Il nostro mezzo è destinato per una crescita ottimale delle cellule epiteliali bronchiali umane.
- Estratto di ipofisi bovina (BPE soluzione madre 1mg/ml): Sigma P1476 (2,5 ml BPE a 14mg/ml soluzione sterile e filtrata): Diluire 2,5 ml di brodo (14mg/ml) ad una concentrazione finale di 1mg/ml. ossia, aggiungere 2,5 ml di magazzino BPE a 32,5 ml di EBSS sterile per uno stock di 1mg/ml. Dividere in aliquote da 7,5 ml (4 tubi aliquote di 7,5 ml e un flacone da 5 ml aliquota). Dopo la diluizione, aliquote conservare a -20 ° C fino al momento dell'uso. Conservazione prolungata del prodotto ricostituito e ripetuto congelamento e scongelamento non sono raccomandati.
- Fattore di crescita epidermico (EGF 10 mg / ml soluzione madre): Sigma-E9644 0,2 mg. Ricostituire il contenuto (0,2 mg) in 20 ms di 0,2 mm filtrata 10 mM di acido acetico contenente 0,1% BSA (cioè sciogliere BSA 20 mg in 20 ml di 10 mM di acido acetico e filtrare quindi utilizzare per ricostituire FEG). Aliquotare in aliquote da 0,5 ml e conservare in congelatore -20. Usa 100μl per 100 mezzi di ml.
- Epinefrina (soluzione madre 5mg/ml): Sigma E1635. Sciogliere 10 mg in 2 ml di acido cloridrico 1M filtrata (HCl), aliquota in flaconcini da 50 microlitri e congelare (-20 ° C).
- Insulina (soluzione madre 2mg/ml): Sigma I6634 50mg. Sciogliere 50 mg in 25 ml filtrata (0.2μm filtro) HCl diluito (1 mm). Aliquote in flaconi 1.25ml.
- Tranferrin umano (50 mg / ml soluzione madre): Sigma T8158 100mg. Sciogliere 100 mg in 2 ml dH20 (filtrati con filtro 0,2 micron). Aliquota da 100μl ciascuno (in 0,5 ml).
- Triiodo-L-thyronine (soluzione madre 1mg/ml): Sigma T6397 100mg. Sciogliere 100 mg in 100 ml filtrati HCl 1M. Aliquota in aliquote da 1 ml. 0,5 ml aliquota in aliquote 10μl.
- Hydorcortisone (soluzione madre 5mg/ml):. Sigma H0888 Pesare 100 mg e si sciolgono in 20 ml di etanolo filtrata per magazzino 5mg/ml. Aliquota da fiale da 1 ml. Dividere un 1ml (5mg/ml) a 50μl aliquote (0,5 ml).
- L'acido retinoico (soluzione madre 1mg/ml, diluito 0.01mg/ml quando usati): Sigma R2625 100mg). Sciogliere 100 mg in 10 ml di etanolo. Si dividono per aliquote 1,0 ml. Divide (1 ml) fiala a 50 tubi di 20μl ciascuna. Congelare a -20 ° C. Prendete un flaconcino 20μl e diluire a 2000μl con i media, per uno stock di 0.01mg/ml quando necessario.
- Soluzione di albumina da siero bovino, sterile, filtrata, colture cellulari testati: Sigma A8412. Conservare la soluzione al freddo (4 ° C) fino al momento dell'uso. Aperto solo la BSC.
- Antibiotica-antimicotica, Sigma A5955: aliquota ai volumi di 1 ml e congelare a -20 ° C fino al momento dell'uso. Utilizzare a 1% di concentrazione finale nel mezzo.
- FBS, Sigma F1015: Disattivare FBS a 50 ° C per 30 minuti. Lasciare raffreddare nella BSC. Aliquotare in fiale da 1 ml e 10 ml sterile. Utilizzare a 1% di concentrazione finale nel terreno di coltura e al 10% di concentrazione finale in media per neutralizzare tripsina / EDTA soluzione.
- Costituzione del terreno di coltura:
Per500 ml di terreno DMEM/HamF12 uso:- 1 tubo di BPE (ogni 7.5ml di 1mg/ml) per una concentrazione finale di 15μg/ml.
- 1 tubo di EGF (0,5 ml di 10μg/ml) per una concentrazione finale di 10ng/ml.
- 1 tubo di epinefrina (50μl di 5mg/ml) per una concentrazione finale di 0.5μg/ml.
- 1 fiala di insulina (1.25ml di 2mg/ml) per una concentrazione finale di 5μg/ml.
- 1 flacone di Transferin (100μl di 50mg/ml) per una concentrazione finale di 10μg/ml.
- 5 ml di Triiodo-L-thyronine (a 1mg/ml) per una concentrazione finale di 10ng/ml.
- 1 flacone di Idrocortisone (50μl di 5mg/ml) per una concentrazione finale di 0.5μg/ml.
- 5 ml di Acido Retinoico diluito 0.01mg/ml per una concentrazione finale di 0.1ng/ml.
- 10 ul di soluzione di albumina da siero bovino per una concentrazione finale di 1.5μg/ml
3. Preparazione di soluzioni Dissociazione:
- Preparazione di tripsina / EDTA soluzione madre: sciogliere 100 mg di tripsina (Sigma T9935-100mg) e 40 mg EDTA (Sigma E6758) in 500 ml 0.01M PBS (Sigma E6758). . Aliquota in fiale da 2ml e conservare nel congelatore di -20 ° C Diluire soluzione madre: aggiungere 2 ml di soluzione concentrata a 6 ml di PBS (concentrazione finale di tripsina è di 250 mcg / ml e per EDTA è di 100 mg / ml).
- Soluzione per fermare le reazioni enzimatiche: preparare fresca 10% FBS in media nel BSC: aggiungere 1 ml di FBS a 9 ml di media (DMEM / Ham F-12). Per ogni piatto 100 millimetri uso 8 ml di riscaldare il 10% FBS per neutralizzare 8 ml della soluzione di dissociazione.
4. Requisiti speciali:
- Quando le cellule epiteliali coltura, è necessario tenere tutto pulito e disinfettato. Tutti i reagenti utilizzati per la coltura cellulare dovrebbe essere sterile o filtrata con filtro 0.2μm. Preparazione dei materiali e degli additivi deve essere fatto in una cabina di sicurezza biologica (BSC). Inoltre i media o la modifica dei mezzi di comunicazione dovrebbe essere fatta in un BSC.
- Tie capelli lontano, indossare un cappellino usa e getta, se disponibile, e indossare un camice da laboratorio e guanti.
- Mantenere tutte le superfici di lavoro libero da ingombri. Pulire le superfici di lavoro con etanolo al 70% tra le operazioni e consentire un minimo di 15 minuti tra la gestione culture diverse.
- Etichetta tutti i reagenti e bottiglie di media, includono data di ricezione e la data preparati.
- Esaminare le culture e media regolarmente per le prove di gravi contaminazioni batteriche o fungine.
- Prova regolarmente per micoplasma (se necessario)
- Warm up terreno di coltura a 37 ° C prima di cambiare i media sulle cellule.
- Antibiotici / antimicotici e FBS dovrebbe essere appena aggiunto alla media.
- Cambiamenti a medio almeno ogni 3-4 giorni. Non lasciare che le cellule a temperatura ambiente per lungo tempo. Cambia media e restituire alla incubatrice.
Rappresentante dei risultati:
Caratteristiche della cultura e morfologia delle cellule epiteliali bronchiali umane
Microscopia di cellule epiteliali bronchiali umane spazzolato dai segmenti bronchiali di cultura, prima di coltura, ha dimostrato strisce di entrambe le cellule epiteliali ciliate e non ciliate indicando un epitelio normale (Figura 1, supplemento 1). Immunocolorazione cytospin di preparati di cellule da espianti e cellule seminate su vetrini rivelato che tutte le cellule erano positive per l'epitelio specifico citocheratine (Figura 3). Culture di successo da espianti di tessuto bronchiale verificato in 8 dei 9 tessuti, come una delle culture espianto è stato infettato. Gli anelli di cellule epiteliali raggiunto 1-2 cm di raggio di 3-4 settimane (Figura 2a). Espianti di successo sono stati colti di nuovo fino a 6 volte. In tutte le culture di successo, non vi era evidenza di migrazione cellulare entro 48 ore dalla partenza del trapianto (Figura 2b). Cellule avevano un aspetto acciottolato che si distingue per queste cellule epiteliali, come indicato nelle figure 2, 4, 5 e 6. Cellule bronchiali sub-coltura hanno mostrato uniforme immunocolorazione positive per citocheratina ed E-caderina. Immunostaining con anticorpi specifici contro altri tipi cellulari non hanno mostrato alcuna indicazione di contaminazione di culture di fibroblasti, mesenccellule hymal, o endoteliali (α-SMA, vimentina e CD31: PECAM-1 macchie rispettivamente) (Figura 5). Cellule coltivate su membrane permeabili poliestere (transwells) con aria-liquido differenziato in epitelio ciliato, come dimostrato nella Figura 6. Registrazioni video rappresentativi delle cellule epiteliali bronchiali coltivate su transwells dimostrare un epitelio differenziato con il battito delle ciglia (Supplemento 2).
Caratteristiche delle culture umane delle cellule epiteliali bronchiali testati sono riportati nella tabella 1. Il tempo mediano al primo passaggio (P1) è stato di 4 settimane, e la resa media era di 15,1 ± 2,75 milioni cellule (n = 9 tessuti). La vitalità delle cellule da espianti e al P1 è stata valutata mediante l'esclusione trypan blu, ed è stata sempre elevata (99%) in queste culture bronchiale. Sub-colture di cellule dalle culture espianto di tutti i tessuti sono stati raggruppati dopo primo passaggio per un uso successivo. Il numero medio di cellule recuperate da espianti è stata significativamente superiore a quello della cultura Passage successivi (ogni 2 milioni di cellule da P1 P2 prodotto: 6,75 ± 2,4 milioni di cellule, tessuti n = 5). Una cultura P2 è stato scartato come la morfologia non era tipico delle cellule epiteliali (figura 7a). Analogamente, due altri passaggi (P2 e P3) di diversi tessuti (figura 7b) sono stati scartati.
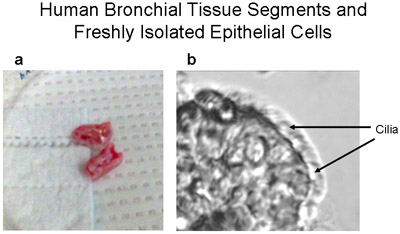
Figura 1 segmenti umani tessuto bronchiale e una striscia appena isolato delle cellule epiteliali ciliate e non ciliate. (A) quadro rappresentativo delle risorse umane segmenti di tessuto bronchiale - ~ 1-2cm di lunghezza e <1 centimetro di diametro, utilizzato per colture primarie di cellule epiteliali bronchiali umane. (B) Una striscia di cellule epiteliali bronchiali umane spazzolato dal segmento bronchiale dimostra cellule epiteliali ciliate sia e non ciliate, ingrandimento 320X. Video di cellule con ciglia battere è fornito come supplemento 1.
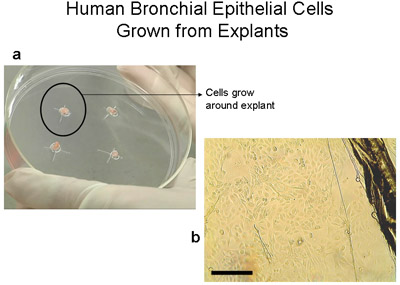
Figura 2 cellule epiteliali bronchiali umane cresciute da espianti su piastre 100 millimetri coltura dei tessuti. a) piastra di 100 mm con 2-3mm3 tessuti. Si noti l'anello di cellule di circa 1-2cm, che diventa visibile a occhio nudo dopo 3-4 settimane. b) Immagine di bordo espianto di tessuti e cellule epiteliali che migrano dalla espianto, bar = 100μm. Espianti trasferito in una nuova piastra diventano trapianti. Espianti possono essere trapiantati fino a 6 volte.
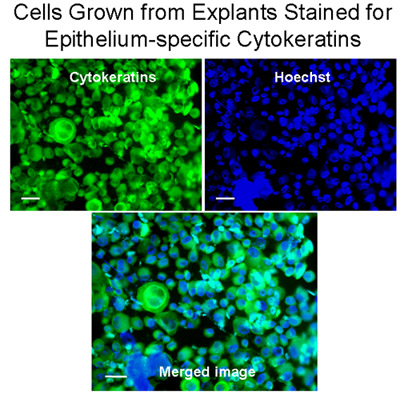
Figura 3 Cellule cresciute da espianti colorate per epitelio specifici citocheratine. Cytospins da espianti di cellule sono state colorate per citocheratine (verde) con il monoclonale anti-Pan Citocheratina-FITC (miscela) che riconosce umano citocheratine 1, 4, 5, 6, 8, 10, 13, 18 e 19. I nuclei sono stati colorati con Hoechst macchia (blu). L'immagine fusa dimostra che le cellule bronchiali cresciuto da espianti sono stati principalmente le cellule epiteliali, Bar = 20μm.
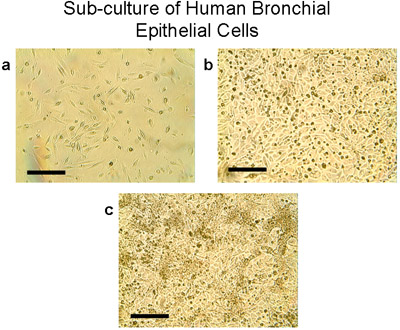
Figura 4 sub-cultura di cellule epiteliali bronchiali umane. a) Utilizzando tripsina / EDTA, le cellule da espianti e trapianti vengono sollevati dalle tavole 100 mm, contati e testa di serie a 2-3 milioni di cellule per T75 pallone. Cellule crescono a sub-confluenza (80-90%) in fiasche T75 nei giorni 28-30 (b, c). Si noti la morfologia tipica di ciottoli di cellule epiteliali, Bar = 100μm.
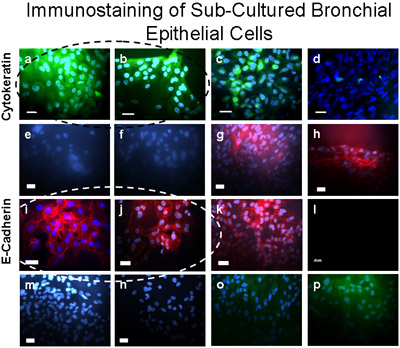
Figura 5 cellule bronchiali sub-coltivate sono stati verificati come epiteliali immunocolorazione utilizzando. Queste cellule colorate positivo (verde) per citocheratina-FITC (a, b), un controllo positivo per citocheratina-FITC è mostrato nella A549 cellule epiteliali (c) e un controllo negativo è dimostrata nei fibroblasti (d). Colture di cellule bronchiali macchiato positivo (rosso scuro) per E-Cadherin/Alexa Fluor 594 (i, j), e non si macchia di α-SMA-Cy3 (e, f), Vimentin / TRITC (m), né CD31 (PECAM -1/FITC) (o) indica l'assenza di contaminazione del primario colture di cellule epiteliali bronchiali con muscolatura liscia, mesenchimali, cellule endoteliali o rispettivamente. Controllo positivo (rosso scuro) per E-Cadherin/Alexa Fluor 594 è dimostrata su cellule epiteliali A549 (k). Controllo positivo per α-SMA-Cy3 (rosso) è dimostrata nei fibroblasti (g, h). Controlli anticorpo secondario sono indicate nelle cellule epiteliali bronchiali per Alexa Fluor 594 (l); coniglio anti-topo TRITC (n) e Donkey anti-capra FITC (p). Bar = 20μm.
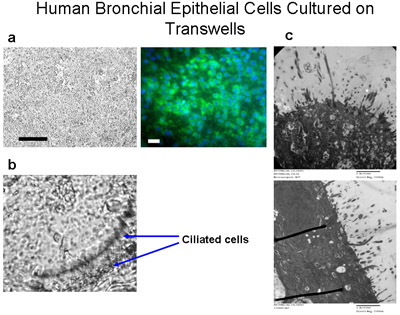
Figura 6 cellule epiteliali bronchiali umane in coltura su transwells. Cellule ciliate sono coltivati su membrane permeabili in poliestere (6,5 mm di diametro) con una densità di semina di 50.000 cells per bene (a) Bar = 100μm. Immunocolorazione delle cellule in coltura su transwells con citocheratina-FITC (verde) e DAPI (blu) dimostra che queste cellule sono principalmente cellule epiteliali, Bar = 20μm. Le cellule sono coltivate immersi in media per 10 giorni, i media poi alimentata dal fondo solo per un altro 4-6 settimane per creare un ALI fino ciglia sono coltivati come mostrato in (b), ingrandimento 160x. Vedere Supplemento 2 per i video di battere ciglia. (C) immagini TEM dimostrano la crescita di culture ciglia ALI a 6 settimane, ingrandimento = 150000x.
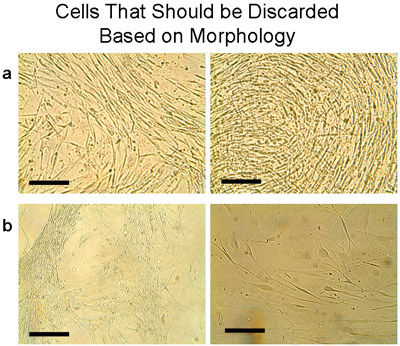
Figura 7 Esempio di cellule che deve essere eliminata basata sulla morfologia. Queste cellule di solito appaiono quando il tessuto è stato trapiantato molte volte. Da notare che entrambe le celle e trapianto devono essere eliminati. a) Le cellule sono state raccolte da un piatto con trapianti che sono state coltivate 6 volte e placcato in un pallone T75. Entro 1 settimana le cellule mostravano una morfologia distinta che non rappresentano l'aspetto acciottolato delle cellule epiteliali. Invece, sottili cellule allungate stavano crescendo densamente. b) Altri esempi di cellule che non dovrebbero essere messe in comune con le cellule epiteliali tipici, ma deve essere scartato. Bar = 100μm.
Tabella 1: Caratteristiche delle umane culture di cellule epiteliali bronchiali
| Tasso di successo (numero di tessuti) | 8 / 9 (88,8%) |
| Il tempo mediano (range) a P1 (settimane) | 4 (3-5) |
| Media (SEM) non cellulare. a P1 | 15.1 (2.75) x 10 6 |
| Media (SEM) vitalità a P1 | 99% (2%) |
| (P1 = primo passaggio) | |
Supplemento 1 mostra una striscia di cellule bronchiali ciliate e non epiteliali ciliate spazzolato da un segmento bronchiale umano utilizzati per i trapianti, ingrandimento 320X. Clicca qui per il video supplemento 1.
Supplemento 2 differenziata cellule epiteliali bronchiali coltivate su uno aria-liquido. Video (2a e 2b) mostrano battere ciglia, ingrandimento 160X e 320X, rispettivamente. Clicca qui per il video 2A Supplemento. Clicca qui per il video 2B supplemento.
Access restricted. Please log in or start a trial to view this content.
Discussione
In questo studio abbiamo presentato i metodi dettagliati per la cultura e l'espansione delle primarie cellule epiteliali bronchiali umane. Abbiamo dimostrato come espianti e trapianti di tessuto bronchiale, colta nei media che promuovono la crescita delle cellule epiteliali, in grado di fornire una fonte continua di cellule epiteliali delle vie respiratorie umane per gli studi di non-differenziati modelli cellulari (in immersione) e differenziata (cresciuta in aria-liquido) . Queste cellule possono essere utilizzate...
Access restricted. Please log in or start a trial to view this content.
Riconoscimenti
Gli autori sono molto grati al dottor Richard Inculet per aver fornito i tessuti bronchiali. Ricerca etica approvazioni consiglio sono stati ottenuti da San Giuseppe Healthcare Hamilton e The University of Western Ontario / London Health Sciences Centre (Dr. David McCormack), Tissue and Archives Comitato, Dipartimento di Patologia. Ringraziamo anche Ernie Spitzer (Microscopia Elettronica, McMaster University) per aver fornito TEM delle nostre culture ALI, Farkas e Daniela per aver fornito alcuni dei materiali necessari per immunocolorazione. Questo lavoro è stato finanziato da una sovvenzione di blocco termine dalla Società Ontario Toracica; Dr. Asma Yaghi è stato sostenuto da una borsa di studio FSORC, Sanità San Giuseppe, Hamilton, Ontario, Canada.
Access restricted. Please log in or start a trial to view this content.
Materiali
Altri requisiti: incubatore, biologici di sicurezza cabinet (BSC), centrifughe, piastre di coltura da 100 mm, provette sterili (15 ml, 50 ml, e 2 ml), puntali sterili, manico bisturi e lame, di piccole forbici affilate, camici e guanti. Questi possono essere ottenuti dai vostri fornitori preferiti.
Riferimenti
- Phillips, J. Growing Cells on Transwell Inserts - Tips and Techniques [Internet]. Corning Life Sciences, Technical Resources, Online Training. , (2008).
- Turi, J. L. Oxidative stress activates anion exchange protein 2 and AP-1 in airway epithelial cells. Am J Physiol Lung Cell Mol. Physiol. 283, L791-L798 (2002).
- Lechner, J. F., Haugen, A., McClendon, I. A., Pettis, E. W. Clonal growth of normal adult human bronchial epithelial cells in a serum-free medium. In Vitro. 18, 633-642 (1982).
- Yoshisue, H. Characterization of ciliated bronchial epithelium 1, a ciliated cell-associated gene induced during mucociliary differentiation. Am. J. Respir. Cell Mol. Biol. 31, 491-500 (2004).
- Wetering, S. van Regulation of secretory leukocyte proteinase inhibitor (SLPI) production by human bronchial epithelial cells: increase of cell-associated SLPI by neutrophil elastase. J. Investig. Med. 48, 359-366 (2000).
- Tristram, D. A., Hicks, W., Hard, R. Respiratory syncytial virus and human bronchial epithelium. Arch. Otolaryngol. Head Neck Surg. 124, 777-783 (1998).
- Mattinger, C., Nyugen, T., Schafer, D., Hormann, K. Evaluation of serum-free culture conditions for primary human nasal epithelial cells. Int. J. Hyg. Environ. Health. 205, 235-238 (2002).
- Freshney, R. I. Culture of epithelial cells. Freshney, R. I. , Wiley-Liss, Inc. New York. 1-23 (1992).
- Freshney, R. I. Normal human bronchial epithelial cell cultures in Culture of specialized cells series. Culture of epithelial cells. Freshney, R. I. , Wiley-Liss, Inc. New York. 181-196 (1992).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon