Method Article
El análisis de grandes complejos de proteínas por espectrometría de masas estructurales
En este artículo
Resumen
Espectrometría de masas ha demostrado ser una valiosa herramienta para el análisis de grandes complejos de proteínas. Este método permite a los puntos de vista en la arquitectura de la composición, estequiometría y en general de las asambleas de múltiples subunidades. Aquí se describe, paso a paso, cómo realizar un análisis de espectrometría de masas estructurales, y caracterizar estructuras macromoleculares.
Resumen
Las células vivas controlar y regular sus procesos biológicos a través de la acción coordinada de un gran número de proteínas que se ensamblan en una serie de dinámicas, múltiples complejos de proteínas 1. Para obtener una comprensión mecanicista de los procesos celulares diferentes, es crucial para determinar la estructura de los complejos de proteínas, y revela cómo su organización estructural dictados de su función. Muchos aspectos de los complejos multi-proteína, sin embargo, difícil de caracterizar, debido a su heterogeneidad, la estructura asimétrica, y la dinámica. Lo tanto, se requieren nuevos enfoques para el estudio de los niveles superiores de la organización de las proteínas.
Una de las herramientas de la biología estructural emergentes para el análisis de complejos macromoleculares es la espectrometría de masas (MS) 2-5. Este método proporciona información sobre la composición de proteínas complejas, estequiometría de subunidades, y la topología estructural. El poder de la MS se deriva de su alta sensibilidad y, en consecuencia, el requisito de la muestra bajo, lo que le permite examinar los complejos de proteínas expresadas en los niveles endógenos. Otra ventaja es la velocidad de análisis, que permite la monitorización de las reacciones en tiempo real. Por otra parte, la técnica puede medir simultáneamente las características de las poblaciones separadas que coexisten en una mezcla.
Aquí se describe un protocolo detallado para la aplicación de MS estructurales para el análisis de conjuntos de proteínas de gran tamaño. El procedimiento comienza con la preparación de los capilares recubiertas de oro para la ionización electrospray nanoflujo (NESI). Luego continúa con la preparación de muestras, haciendo hincapié en las condiciones de amortiguamiento que debe ser compatible con NESI por un lado, y permiten mantener intactas complejos en el otro. A continuación, explicar, paso a paso, cómo optimizar las condiciones experimentales para la medición de masas de alta y adquirir MS y MS en tándem espectros. Por último, la tabla de procesamiento de datos y análisis que siguen. En lugar de tratar de caracterizar todos los aspectos de las asambleas de proteínas, este protocolo presenta los procedimientos básicos de MS, lo que permite el rendimiento de MS y MS / MS experimentos en los complejos no covalentes. En general, nuestro objetivo es proporcionar a los investigadores no conocen el campo de la MS estructurales, con el conocimiento de las herramientas experimentales principal.
Protocolo
Parte 1: Preparación de oro recubierto de tubos capilares para la ionización electrospray nanoflujo
El análisis de los complejos no covalentes se realiza generalmente por medio de la ionización por electrospray nanoflujo (NESI) 6, el uso de vidrio o cuarzo capilares que se han tirado a una punta fina (diámetro de aproximadamente 1 m interior), y recubiertas con material conductor (generalmente oro) . Tales capilares están disponibles listos para el uso de fuentes comerciales (nuevo objetivo o Proxeon), sin embargo, puede ser más rentable para prepararlos en casa:
- Palo de dos tiras de una almohadilla adhesiva de doble cara en la parte inferior de una placa de Petri, 2 cm. Coloque una varilla de vidrio (8 cm x 5 mm) en el centro de una de las almohadillas. La almohadilla adhesiva celebrará los capilares en el lugar, y la varilla de vidrio apoyará el preparado capilares, y mantener las puntas de la rotura (Fig. 1).
- El uso de vidrio de borosilicato capilares, 1,0 mm x 0,78 mm de diámetro OD (utilizamos envases de 500 unidades de pared delgada capilares de borosilicato de Warner Instruments, cat.. G100TF-4). Inserte un capilar en el extractor de la aguja (utilizamos el modelo P-97 de la Compañía de Sutter Instrument). Sujete el capilar suavemente en su lugar, y ajustar su posición en la que se encuentra en el centro del filamento de calentamiento de la aguja del extractor. Apriete las abrazaderas con cuidado, hasta que el capilar se mantuvo firme en ambos extremos.
- Tire de la capilaridad, mediante un programa predefinido. Cada capilar sacó dará lugar a dos final, en forma de capilares. El proceso de la programación del extractor es uno de ensayo y error, hasta que una forma de la punta aceptable se obtiene. Nosotros usamos el siguiente programa:
Paso Calor Jale Vell Tiempo 1 750 - 15 80 2 700 - 15 50 3 750 200 20 80 - Retire la tira capilares del instrumento e inspeccione las puntas, descartando las que estén deformadas o rotas. Use unas pinzas romas (que utilizar pinzas de posicionamiento de precisión CK), para colocar los vasos capilares en la placa de Petri. La base del capilar debe atribuirse a la almohadilla adhesiva y la parte superior debe apoyarse en la varilla de vidrio, con la punta hacia arriba.
- Una vez que la placa de Petri está lleno (alrededor de 80 en forma capilar en un 10 cm de diámetro del plato), insertar la placa en el oro lacado por pulverización catódica (utilizamos el modelo no. EMS550, de EMS). Asegúrese de que el suministro de gas se elige de acuerdo a las instrucciones del fabricante, y activar un ciclo de recubrimiento predefinida (que utilizan la presión de argón 4 psi, a una presión de vacío de 5 x 10 -2 mbar, una corriente de 45 mA y un tiempo de recubrimiento de 1 min, por 3-6 ciclos, hasta los capilares son uniformemente de oro).
Parte 2: Preparación de la muestra
- Bajas concentraciones micromolar de la muestra se requiere (1 - 20 M). Si es necesario, concentrar la muestra el uso de dispositivos de ultrafiltración centrífuga (por ejemplo, Vivaspin de Sartorius, o NanoSep de Pall Corporation). Se recomienda que verifique la adsorción del complejo de proteínas de la membrana dispositivo, antes de su uso.
- A menudo, los topes de depuración o las soluciones de almacenamiento del complejo de proteínas no son compatibles con Nesi, para que sólo las soluciones volátiles pueden ser utilizados. Por lo tanto, el buffer de cambio es necesario. Este paso crítico en el que todos los restos de sales, las moléculas de separación o cualquier otro no volátil aductos tales como glicerol, TDT, o EDTA se retiran, determina la calidad de los espectros. Por lo general, una solución acuosa de acetato de amonio se utiliza, a una concentración de entre 5 mm y M-1, y en 6.8 pH. Buffer de cambio se puede realizar utilizando un gel de microcentrífuga columna de filtración (por ejemplo, Micro Bio-Spin seis columnas de cromatografía de Bio-Rad). Este paso puede repetirse 1-3 veces con una dilución mínima (menos de un factor de 1,3 por dispositivo 5), hasta el cambio máximo se alcanza. Si la concentración y el intercambio de buffer es necesario, estas se pueden hacer en conjunto, mediante ultrafiltración centrífuga (e, g., Vivaspin de Sartorius, o NanoSep de Pall Corporation).
Parte 3: Calibración del espectrómetro de masas para la medición de masas de alta
La mayoría de los experimentos llevados a cabo en los complejos multi-proteína se realizó con un electrospray nano cuadrupolo-tiempo de vuelo (Q-TOF) de instrumentos. Se sugiere que utilice un filtro de masas cuadrupolar ajustarse a las bajas frecuencias, para permitir el análisis y la transmisión de masas de iones de alta m / z valores de 7,8. EsTambién recomendó que las entradas de gas 7,8 o 9 mangas que añadir en el instrumento de la guía de iones de primera, a fin de controlar la presión en la etapa de primera aspiradora. Este último permite la optimización de la transmisión, y desolvatación de iones de gran tamaño 7-9. En la actualidad, comercial ESI-TOF y los instrumentos Q-TOF están disponibles de varios fabricantes (por ejemplo, las aguas, Sciex, Bruker, o Agilent) que pueden ser modificados con relativa facilidad y de forma rentable, para aplicaciones nativas de MS 7,8. Es posible, sin embargo, utilizar configuraciones estándar o TOF QTof en instrumentos tales como la LCT o QToF1 (Waters) para adquirir espectros de masas de los complejos de hasta 1 MDa, sin necesidad de modificaciones de hardware 5.
El protocolo se describe a continuación se llevó a cabo en un instrumento SYNAPT (Waters).
- La preparación de 100 mg / ml de solución de CSI en agua purificada. CSI es utilizada para la calibración de masas de alta en las agrupaciones de sal con una sola carga, (CSI) n Cs + se extienden sobre una amplia variedad de masas, de 393 m / z a más de 10.000 (Fig. 2).
- Con unas pinzas romas, tomar un recubrimiento capilar de la placa de Petri y 2μL carga de la solución de CsI en el capilar, utilizando una punta GeLoader Eppendorf.
- Inserte el capilar en el soporte capilar, y ajustar el tubo capilar, de tal forma que la punta es de aproximadamente 10 mm de distancia del borde del soporte.
- Deslice la solución hacia la punta del capilar, ya sea manualmente o utilizando un adaptador de girar.
- Colocar los capilares bajo un microscopio óptico y el ajuste de la punta, con el fuerte tipo AA pinzas.
- Conecte el soporte capilar para la interfaz ES nanoflujo. Gire la etapa xyz hacia atrás para evitar daños en los capilares, e impulsar la etapa en su posición activa. El capilar se debe colocar 1 - 10 mm desde el orificio del cono.
- Aplicar la tensión capilar (1050-1400 V) y la presión nanoflujo baja (0.00-0.03 bar) hasta el spray se inicia, a continuación, tratar de reducir la presión nanoflujo a un valor mínimo.
- Optimizar la intensidad de la señal mediante el ajuste de la ubicación de la etapa de xyz, la tensión capilar, la presión nanoflujo, y el flujo de gas desolvatación.
- Para detectar una amplia variedad de masas de CSI pico serie, las tensiones de la aceleración debe ser optimizado (se utilizan los siguientes parámetros: capilar 1.3-1.7 kV, el cono de la muestra de 80 150 V, la extracción de cono de 1.3 V).
- Para optimizar la transmisión de los iones de alta masa, que requieren condiciones suaves desolvatación, la presión de apoyo en la fase de vacío inicial, entre la fuente y el analizador, debe ser levantado. Esto se puede lograr mediante una cuidadosa reducción de la conductancia de la línea de vacío de origen a la bomba de desplazamiento, cerrando parcialmente la válvula de aislamiento (SpeediValve). Con el fin de definir el punto óptimo, el último debe hacerse mientras se observa el efecto sobre la intensidad de la señal (por lo general el uso 3,0-6,5 mbar).
- Recoger alrededor de 30 exploraciones a un exploraciones / segundo, en un rango de m / z de entre 1.000 y 15.000 m / z.
- Después de la adquisición, calibrar el TOF utilizando la tabla de calibración adecuada.
Parte 4: MS de complejos de proteínas intactas
- Cargue la muestra, tal como se describe (Parte 3, Secciones 2-5), e iniciar la aspersión.
- Para empezar, la optimización inicial de la espuma (la parte 3, secciones 6-9), hasta que se recibe la señal. La posición exacta de los estados de carga es dependiente de la proteína, sin embargo, se pueden predecir, utilizando la relación entre la masa de iones y el estado de carga media, por lo tanto: (Z av) 10: Z = 0,0778 av √ (m), en la que m es la masa del complejo en Daltons. Para evitar la disociación complejo, no se calientan la fuente de iones: o bien cambiar el calentador, o mantener la temperatura por debajo de 40 ° C.
- Variar la posición capilar, el cono de la muestra y de las tensiones extractor para maximizar la transmisión de iones, y comprobar los cambios que provoca en el espectro. Un posible punto de partida podría ser el cono de tensión de 100 V, extractor de cono: 1 V, la tensión capilar 1,5 kV. Optimizar estos parámetros, en combinación con la presión nanoflujo.
- Para mejorar la desolvatación y tira el agua residual y los componentes del tampón, aumentar la tensión de polarización y la presión del gas en la celda de colisión. Este paso debe ser realizado cuidadosamente, para evitar la disociación del complejo. Voltajes típicos prejuicios están dentro del rango de 10 a 100 V, con un flujo de gas trampa de 10-10 ml / min (Fig. 3). El ajuste manual de la configuración de RF y el perfil de cuadrupolo pueden mejorar la transmisión de iones de alta masa.
- Ajuste la trampa y las energías de transferencia de colisión. A menudo, los voltajes más altos son necesarios para la emisión de iones de alta masa (por lo general dentro del rango de 10-30 V). En este punto, es importante para evitar la colisión inducida por la disociación del complejo.
- Después de una señal estable es reached, se recomienda que la presión y la tensión capilar nanoflujo disminuir a valores mínimos, mientras se mantiene estable spray.
Parte 5: espectrometría de masas en tándem: disociar los complejos de proteínas
- Una vez que una señal óptima y estable que se haya obtenido, seleccione un ión precursor. Establecer el centro de masa y la anchura de aislamiento (por lo general, utilice una resolución de LM, de 12, y una resolución de SM de entre 13 y 15). Use un amplio rango de masas para detectar la masa de alta / baja productos de la disociación de carga. Se recomienda que se establece el rango de m / z en el nivel máximo, y luego reducirlo a los valores deseados. Además, sugerimos la superposición de las MS y MS / MS espectros, para validar el aislamiento del ión precursor seleccionado.
- Para llevar a cabo MS / MS, disociar el ión precursor mediante el aumento de la energía de colisión (CE) y la presión en la celda de colisión. Aumentar o trampa o transferencia CE gradualmente, en pasos de 10-20V, y elevar la presión del gas de colisión a 0-5 ml / min (valores comunes). Seguimiento de los cambios en el espectro hasta que las condiciones de activación óptimo se alcanza. Alta energía de activación puede provocar la disociación de una o más subunidades del complejo intacto, y aclarar las afinidades interacción de diferentes subunidades. Por lo general el uso de argón como gas de colisión en la trampa de las células / transferencia, aunque los beneficios de la utilización de un gas más pesado (por ejemplo, Xe o SF 6) se han reportado, sin embargo, estos gases son sustancialmente más caros 11 (Fig. 3).
- Se recomienda que más de un estado de carga de ser seleccionados para análisis MS / MS. En el caso de componentes que se superponen, la adquisición de un conjunto de tándem MS espectros ayudará a resolver la serie cargo de las diferentes poblaciones. Por otra parte, los estados superiores de carga se disocian con más facilidad, en comparación con estados de carga inferior 12.
- Además de la caracterización del complejo intacto, se sugiere que los pequeños subcomplejos en la solución se genera, en condiciones suaves de desnaturalización. La MS y MS / MS de subcomplejos forman la base para la definición de la arquitectura de la subunidad del complejo 13. Por la interrupción parcial de las interacciones subunidad subunidad, añadir poco a poco solventes orgánicos (por ejemplo, metanol, isopropanol o acetonitrilo) a una concentración de 50%, o cambiar el pH de la solución mediante la adición de amoniaco o ácido fórmico (hasta una concentración de 4 %).
- Para determinar las masas de las subunidades que componen el complejo, es importante para adquirir un espectro bajo condiciones de desnaturalización. Esto puede llevarse a cabo con Zip-Tip C 4 (Millipore) con 25:75 agua / acetonitrilo relación, con 1% de ácido fórmico como solvente de elución.
Parte 6: procesamiento y análisis de datos
- Los datos se analizan en línea, utilizando un análisis espectral de los programas de MS espectros. Generalmente utilizamos el programa MassLynx (Waters).
- Para espectros que abarcan una amplia gama de m / z gama, se recomienda que los planes de diferentes parámetros de suavizado y centro de gravedad se aplicará para la alta y baja m / z regiones, para reflejar la diferencia en la resolución máxima de estas regiones.
- Para identificar las series de carga y cálculo de estados de carga y de las masas, el "manual de encontrar" la función de MassLynx se puede aplicar. En los casos de espectros de masas complejas con componentes que se superponen, el cálculo manual de las masas puede ser más fácil.
- Para facilitar estos procesos de asignación, software adicional se puede utilizar, por ejemplo: MaxEnt para deconvolución espectros 14 SOMMS para el montaje de pico y simulación de 15, y la Cumbre para la asignación de la composición y estequiometría de subcomplejos proteína y la generación de redes de interacción de proteínas 13,16,17 .
Parte 7: Resultados de Representante

Figura 1. Preparación recubierto de oro nano-electrospray capilares.
A. Coloque dos de doble cara cinta adhesiva a una placa de Petri, 2 cm. Para apoyar el preparado capilares, coloque una varilla de vidrio (8 cm x 5 mm) en el centro de una de las almohadillas. B. Pegue el extremo romo del preparado capilares de la almohadilla adhesiva, y apoyarse en la punta de la varilla de vidrio. C. Una vez que la placa de Petri se llena con los preparados capilares, escudo de oro hasta que una fina capa de oro es depositado uniformemente sobre la superficie externa de los capilares.
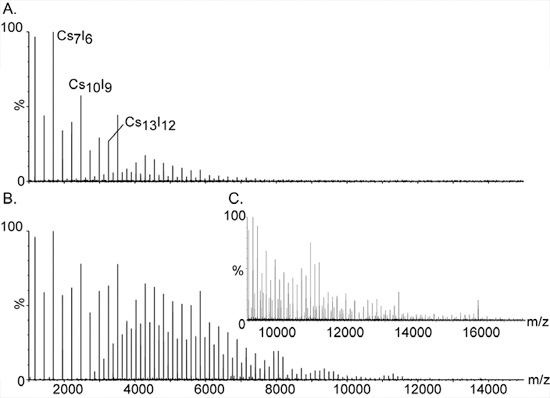
Figura 2. Calibración de masas de alta con yoduro de iones de cesio.
Los grandes grupos y monisotopic de CSI han convertido en el compuesto de elección para la calibración de los espectrómetros de masas para el análisis de masas de alta. La serie de picos equidistantes se extienden sobre una amplia gama, desde m / z 393 a más de 10.000. Son assigNED a grupos con una sola carga de sal de la composición general (CsI) n + Cs. Señales adicionales entre los picos más importantes son causadas por especies de doble y triple carga de la serie, [(CsI) n Cs2] 2 + y [(CsI) n Cs3] 3 +, respectivamente. El aumento de la presión en la fase de vacío inicial es esencial para detectar los grupos de masas de alta. El efecto de la presión en los picos de alta masa se demuestra en los paneles A. y B. con las colaciones de presión de 1,2 y 5,3, respectivamente. C. La expansión del espectro de masas se muestra a la B.
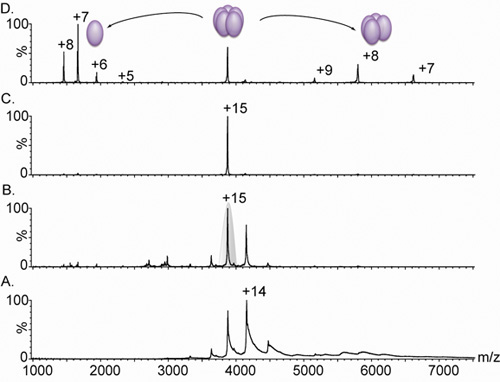
Figura 3. Nanoflujo electrospray espectros de masas de una lectina pentamérica.
A. La espectrometría de masas de un complejo de la variante de lectina (derivado de Lib1-B7 por la evolución dirigida 18) da lugar a una distribución de estado de carga entre 3.000 y 5.000 m / z, sin embargo, debido a la desolvatación inadecuada de los iones, los picos son amplias. Comparativa de panel A. y B. muestran el efecto de aumentar la tensión de polarización de 4V (A). A 15 V (B). Sobre la anchura del pico. Este aumento en las condiciones de acelerar las causas de la extracción de agua residual y los componentes de amortiguación, proporcionando un espectro muy resuelto. La masa medida (60240 ± 38 Da) corresponde a un complejo pentamérica. C. El estado de carga de 15 fue seleccionado para el análisis de MS en tándem (sombreados en gris en el panel B). D. El aumento de la energía de colisión provoca la liberación de un monómero muy cargada, centrada en 1.664 m / z, y una compleja rectificada tetramérica, en el rango de 5.000 - 8.000 m / z. Todos los espectros fueron obtenidos de una muestra que contiene 20 mM de solución de acetato de amonio 0,5 M.
Discusión
Para adquirir la atención de alta calidad de los espectros se debe dar a los pasos de preparación de muestras, que incluyen la concentración de la muestra y el intercambio de buffer. Más muestras diluidas dará una señal de baja, mientras que las muestras de alta concentración puede ser algo viscoso, y bloquear la aguja electrospray. Por otra parte, los aditivos solución tales como sales, glicerina, detergentes, iones metálicos, y agentes reductores (DTT o β-mercaptoetanol), tienden a adherirse a la superficie exterior de las proteínas, y causar ensanchamiento de los picos. Por lo tanto, con el fin de alcanzar picos bien resueltos, estos componentes deben ser añadidos a las concentraciones más bajas posible.
Otro parámetro importante es la posición de la nanoflujo capilar, en relación con el orificio del espectrómetro de masas. Encontrar el "sweet spot" puede ser un reto para los usuarios sin experiencia, sin embargo, que influye significativamente en la calidad de los espectros. También es importante examinar las nanoflujo capilar antes del inicio de la pulverización. El tamaño de la gota es una función del diámetro de la punta, que debe ser ~ 1μm. Pequeñas gotas de plomo a la ionización más eficiente, y por lo tanto sería ventajoso. También es importante comprobar que no hay burbujas de aire dentro de los capilares que podrían bloquear el flujo, y que el recubrimiento de oro no se extrae del capilar durante la adquisición, si es así, más acabado de la punta. Tenga en cuenta que una cantidad excesiva de la muestra se incrementará la posibilidad de optimizar las condiciones de MS, como la tensión capilar, voltajes de aceleración, presión y energía de la colisión.
En general, los procedimientos que se explican en el protocolo se han utilizado para determinar la composición, la estequiometría y la arquitectura de numerosos complejos de proteínas (ver comentarios 2,3,4). El análisis de grandes conjuntos MDa como el ribosoma 19 y muy ordenado cápsides virus 20-22, en la definición de la unión del sustrato a las máquinas moleculares 23-25, o la caracterización de redes de interacción de la subunidad 26,17,16,17,27,28 servir como sólo algunos ejemplos del valor de este enfoque.
Divulgaciones
Agradecimientos
Los autores agradecen a los miembros del grupo a Sharon por su revisión crítica, y por sus contribuciones al manuscrito. Estamos muy agradecidos por el apoyo de los Programas de Morasha y bikura, la Israel Science Foundation (Grant N º 1823 / 07 y 378/08), el Josef Cohn Minerva Centro de Investigación biomembrana, la Familia Chais Programa de Becas para los nuevos científicos, el Abraham y Sonia Rochlin Fundación, el Fideicomiso de la Familia Wolfson caridad; el Centro Helen y Milton A. Kimmelman de Estructura Biomolecular y de la Asamblea, la finca de Shlomo y Beirzwinsky Sabine; Meil de Botton Aynsley, y Karen Siem, Reino Unido. Damos las gracias a Dan Tawfik y Yadid Itamar por darnos la muestra de la variante de lectina.
Materiales
Requisitos de la muestra:
| Muestra | Requisito | Comentarios |
| Volumen | 2.1 l | Por capilaridad |
| Concentración | 1-20μM | Por complejos |
| Buffer | Buffer Aquanos volátiles tales como acetato de amonio a pH = 6-8 | Por lo general 5 mM-1M |
| Detergente | Mínimo | Los racimos de moléculas de detergente produce picos anchos y sin resolver |
| Glicerol | Mínimo (hasta un 5%) | Se adhiere a las proteínas de forma no específica y, en consecuencia, se observan picos anchos |
| Disolventes orgánicos | Hasta un 50% | Pueden desnaturalizar las proteínas complejos |
| Ácidos | Hasta el 4% | Complejos de desnaturalizar las proteínas |
| Sales | Mínimo | Aductos de sal de plomo a los picos de ancho y sin resolver |
| TDT | Mínimo | M 1.2 puede estar presente |
| Agentes quelantes | Mínimo | Más de 250 M conducir a la formación de aductos amplia |
Referencias
- Alberts, B. The cell as a collection of protein machines: preparing the next generation of molecular biologists. Cell. 92 (3), 291-294 (1998).
- Benesch, J. L., Ruotolo, B. T., Simmons, D. A., Robinson, C. V. Protein complexes in the gas phase: technology for structural genomics and proteomics. Chem Rev. 107 (8), 3544-3567 (2007).
- Heck, A. J. Native mass spectrometry: a bridge between interactomics and structural biology. Nat Methods. 5 (11), 927-933 (2008).
- Sharon, M., Robinson, C. V. The role of mass spectrometry in structure elucidation of dynamic protein complexes. Annu Rev Biochem. 76, 167-193 (2007).
- Hernandez, H., Robinson, C. V. Determining the stoichiometry and interactions of macromolecular assemblies from mass spectrometry. Nat Protoc. 2 (3), 715-726 (2007).
- Wilm, M., Mann, M. Analytical properties of the nanoelectrospray ion source. Analytical Chemistry. 68 (1), 1-8 (1996).
- Sobott, F. A tandem mass spectrometer for improved transmission and analysis of large macromolecular assemblies. Anal Chem. 74 (6), 1402-1407 (2002).
- van den Heuvel, R. H. Improving the performance of a quadrupole time-of-flight instrument for macromolecular mass spectrometry. Anal Chem. 78 (21), 7473-7483 (2006).
- Chernushevich, I. V., Thomson, B. A. Collisional cooling of large ions in electrospray mass spectrometry. Anal Chem. 76 (6), 1754-1760 (2004).
- Mora, d. e. l. a., J, . Electrospray ionization of large multiply charged species proceeds via Dole s charged residue model. Anal Chim Acta. 406, 93-104 (2000).
- Lorenzen, K. Optimizing macromolecular tandem mass spectrometry of large non-covalent complexes using heavy collision gases. Int J Mass Spectrom. 268, 198-206 (2007).
- Benesch, J. L. Quadrupole-time-of-flight mass spectrometer modified for higher-energy dissociation reduces protein assemblies to peptide fragments. Anal Chem. 81 (3), 1270-1274 (2009).
- Taverner, T. Subunit architecture of intact protein complexes from mass spectrometry and homology modeling. Acc Chem Res. 41 (5), 617-627 (2008).
- Ferrige, A. G., Seddon, M. J., Skilling, J., Ordsmith, N. The application of MaxEnt to high resolution mass spectrometry. Mass Spectrom. 6, 765-770 (1992).
- van Breukelen, B., Barendregt, A., Heck, A. J., van den Heuvel, R. H. Resolving stoichiometries and oligomeric states of glutamate synthase protein complexes with curve fitting and simulation of electrospray mass spectra. Rapid Commun Mass Spectrom. 20 (16), 2490-2496 (2006).
- Sharon, M. Symmetrical modularity of the COP9 signalosome complex suggests its multifunctionality. Structure. 17 (1), 31-40 (2009).
- Hernandez, H. Subunit architecture of multimeric complexes isolated directly from cells. EMBO Rep. 7 (6), 605-610 (2006).
- Yadid, I., Tawfik, D. S. Reconstruction of functional beta-propeller lectins via homo-oligomeric assembly of shorter fragments. J Mol Biol. 365 (1), 10-17 (2007).
- Videler, H. Mass spectrometry of intact ribosomes. FEBS Lett. 579 (4), 943-947 (2005).
- Uetrecht, C. High-resolution mass spectrometry of viral assemblies: molecular composition and stability of dimorphic hepatitis B virus capsids. Proc Natl Acad Sci U S A. 105 (27), 9216-9220 (2008).
- Uetrecht, C. Stability and shape of hepatitis B virus capsids in vacuo. Angew Chem Int Ed Engl. 47 (33), 6247-6251 (2008).
- Morton, V. L., Stockley, P. G., Stonehouse, N. J., Ashcroft, A. E. Insights into virus capsid assembly from non-covalent mass spectrometry. Mass Spectrom Rev. 27 (6), 575-595 (2008).
- Sharon, M. 20S proteasomes have the potential to keep substrates in store for continual degradation. J Biol Chem. 281 (14), 9569-9575 (2006).
- van Duijn, E., Heck, A. J., Vies, S. M. v. a. n. d. e. r. Inter-ring communication allows the GroEL chaperonin complex to distinguish between different substrates. Protein Sci. 16 (5), 956-965 (2007).
- van Duijn, E. Tandem mass spectrometry of intact GroEL-substrate complexes reveals substrate-specific conformational changes in the trans ring. J Am Chem Soc. 128 (14), 4694-4702 (2006).
- Synowsky, S. A., van Wijk, M., Raijmakers, R., Heck, A. J. Comparative multiplexed mass spectrometric analyses of endogenously expressed yeast nuclear and cytoplasmic exosomes. J Mol Biol. 385 (4), 1300-1313 (2009).
- Sharon, M. Structural organization of the 19S proteasome lid: insights from MS of intact complexes. PLoS Biol. 4 (8), e267-e267 (2006).
- Zhou, M. Mass spectrometry reveals modularity and a complete subunit interaction map of the eukaryotic translation factor eIF3. Proc Natl Acad Sci U S A. 105 (47), 18139-18144 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados