Method Article
Yapısal Kütle Spektrometresi büyük protein kompleksleri Analiz
Bu Makalede
Özet
Kütle spektrometresi büyük protein kompleksleri ve analiz etmek için değerli bir araç olduğu kanıtlanmıştır. Bu yöntem, çok-altbirim meclislerinin bileşimi, stokiyometri ve genel mimari içgörüler sağlar. Burada, tarif, adım-adım yapısal bir kütle spektrometresi analizi gerçekleştirmek ve makromoleküler yapıları karakterize etmek için nasıl.
Özet
Yaşayan hücreler kontrol ve dinamik, çok protein kompleksleri 1 bir diziye kendilerini bir araya proteinlerin çok sayıda koordineli eylemler yoluyla kendi biyolojik süreçleri düzenlemektir. Çeşitli hücre süreçlerini mekanistik bir anlayış kazanmak için, bu tür protein komplekslerinin yapısını belirlemek ve yapısal organizasyon işlevi dikte nasıl ortaya çıkarmak için çok önemlidir. Pek çok açıdan çok protein kompleksleri, ancak, heterojen doğası, asimetrik yapısı ve dinamikleri nedeniyle karakterize etmek zor. Bu nedenle, yeni yaklaşımlar, protein örgütün üçüncül düzeylerinin çalışması için gereklidir.
Makromoleküler kompleksleri analiz etmek için ortaya çıkan yapısal biyoloji araçlarını Bir kütle spektrometresi (MS), 2-5 . Bu yöntem karmaşık protein bileşimi, altbirim stokiyometri ve yapısal topolojisi hakkında bilgi verir. MS güç bir sonucu, düşük örnek gereği olarak, endojen düzeyde ifade protein komplekslerinin incelenmesi, yüksek hassasiyet sağlar türemiştir. Diğer bir avantajı, hız, analiz, gerçek zamanlı olarak reaksiyon izlenmesine olanak sağlar. Ayrıca, teknik, aynı zamanda ortak mevcut bir karışımı ayrı popülasyonlarının özelliklerini ölçmek.
Burada, biz, büyük protein meclislerinin analizi, yapısal MS uygulama için ayrıntılı bir protokol açıklar. Prosedürü nanoflow elektrosprey iyonizasyon (Nesi) altın kaplı kılcal damarların hazırlanması ile başlar. Daha sonra bir yandan Nesi ile uyumlu olması, ve diğer taraftan sağlam kompleksler korumak için tampon koşulları vurgulanarak, numune hazırlama ile devam ediyor. Daha sonra açıklayacağım, adım adım yüksek kitle ölçümleri için deneysel koşullar optimize etmek ve MS ve tandem MS spektrumları elde etmek için nasıl. Son olarak, veri işleme ve takip analizleri tablosu. Protein meclislerinin her yönüyle karakterize etmek için çalışmadan ziyade, bu protokol, non-kovalent kompleksleri MS ve MS / MS deneyler performans sağlayan, temel MS prosedürleri tanıtır. Genel olarak, hedefimiz, temel deneysel araçları bilgi, yapısal MS alanında tanışmamak araştırmacılar sağlamaktır.
Protokol
Bölüm 1: nanoflow elektrosprey iyonizasyon için altın kaplı kılcal damarların hazırlanması
Non-kovalent kompleksleri analizi genellikle cam veya kuvars kılcal damarları (genellikle altın) (~ 1 mm iç çapı), ince bir ucu iletken bir malzeme ile kaplı çekti kullanarak, nanoflow elektrosprey iyonizasyon (Nesi) 6 tarafından yapılır . Böyle kılcal damarların ticari kaynaklardan (Yeni Amaç veya Proxeon) kullanıma hazır olmakla birlikte, in-house onları hazırlamak için daha fazla maliyet-etkin olabilir:
- Iki altına 2 cm arayla bir Petri kabı, çift taraflı yapışkan şeritler sopa. Pedleri birinin merkezinde bir cam çubuk (8 cm x 5 mm) yerleştirin. Yerinde kılcal damarlar yapışkan yapacak ve cam çubuk hazırlanan kılcal damarların destek ve kırılma (Şekil 1) ipuçları devam edecektir.
- (Hayır. G100TF-4 Warner Instruments 500 ince duvar borosilikat paketler, kedi.) Borosilikat cam kapilerleri, 1.0 mm OD x 0.78 mm id kullanın. Bir iğne çektirmenin kapiller (Sutter Instrument Co model P-97) içine yerleştirin. İğne çektirmesi ısıtma filament merkezi yatıyor böylece yerine hafifçe kılcal Kelepçe, ve kendi konumunu ayarlamak. Kılcal her iki uçta da firmanın düzenlenen kadar kelepçeler, yavaşça sıkın.
- Önceden tanımlanmış bir program kullanarak, kılcal çekin. Çekti Her kılcal son iki şeklindeki kılcal damarların yol açacaktır. Kabul edilebilir bir ucu şeklini elde edilinceye kadar çektirmenin programlama süreci, deneme-yanılma biri. Biz şu programı kullanabilirsiniz:
Adım Isı Çekme Vell Zaman 1 750 - 15 80 2 700 - 15 50 3 750 200 20 80 - Cihazdan çekti kılcal damarları çıkartın ve ipuçları, iptal etme, deforme olmuş veya kırık olduğunu herhangi bir kontrol edin. Petri kabındaki kılcal damarların yer künt cımbız (CK Hassas konumlandırma cımbız kullanın) kullanın. Kapiller tabanı yapışkan bağlı olmalı ve üst kısmı yukarı bakacak ucu, cam çubuk dayanmak gerekir.
- Petri kabı sonra (80, 10 cm çaplı çanak içine kılcal damarların uyum hakkında) dolu, (biz bir model kullanır. EMS550, EMS) coater sputter altın bir tabak yerleştirin. Gaz kaynağı (5 x 10 -2 mbar, 45mA güncel bir vakum basıncı, 4 psi Argon basınç kullanın ve bir kaplama zaman üreticinin talimatlarına göre seçilmiş ve önceden tanımlanmış bir kaplama döngüsü etkinleştirmek olduğundan emin olun . 1 dakika, 3-6 döngüleri için, kılcal damarlar kadar) eşit altın.
Bölüm 2: Örnek hazırlama
- Düşük örnek mikromolar konsantrasyonları (1 - 20 mcM) ihtiyaç vardır. Gerekirse, santrifüj ultrafiltrasyon cihazlar (örneğin, Sartorius Vivaspin veya NanoSep Pall Corporation) kullanarak örnek konsantre. Kullanmadan önce, cihaz membran protein kompleksi adsorpsiyon doğrulamanız önerilir.
- Genellikle, arıtma tamponlar veya protein kompleksi depolama çözümleri için sadece uçucu çözümler olabilir Nesi ile uyumlu değildir. Bu nedenle, tampon değişimi gereklidir. Bu kritik adım, tuzlar, tampon molekülleri veya gliserol, DTT ya da EDTA gibi diğer uçucu olmayan adducts tüm izlerini defedildiği spektrumlarının kalitesini belirler. Genellikle, sulu amonyum asetat çözeltisi, kullanılan 5 mM ve 1 M arasında bir konsantrasyon ve pH değerlerinde 6-8. Tampon döviz mikrosantrifüj jel filtrasyon sütun (örneğin, Mikro Bio-Bio-Rad Spin 6 kromatografi kolon) kullanılarak yapılabilir. Bu adım, minimum seyreltme (cihaz 5 başına 1.3 kat daha az) ile maksimum döviz elde edilene kadar 1-3 kez tekrar edilebilir. Hem de konsantrasyonu ve tampon değişimi gerekiyorsa, bu santrifüj ultrafiltrasyon (e Pall Corporation, g., Sartorius Vivaspin, ya da NanoSep) ile birlikte yapılabilir olabilir.
Bölüm 3: yüksek kitle ölçümleri için kütle spektrometresi Kalibre
Çok protein kompleksleri üzerinde yapılan deneylerin çoğu nano elektrosprey kuadropol-time-of-flight (Q-TOF) aracı kullanılarak yapılmaktadır. Iyonlarının yüksek m / z değerleri 7,8 ile iletim ve kitle analizi sağlamak için, düşük frekanslar için ayarlanabilir bir quadrupole kütle filtre kullanmanız tavsiye edilir. .ayrıca gaz girişleri 7,8 veya kollu 9 ilk vakum aşamada basınç kontrolü sağlamak için, ilk iyon kılavuzu enstrüman olması önerilir. Sonuncusu optimizasyonu, iletim ve çok büyük iyonları 7-9 desolvation sağlar. Şu anda, ticari ESI-TOF ve Q-TOF aletleri, yerli MS uygulamaları 7,8, nispeten kolay ve maliyet etkin bir şekilde modifiye edilebilir birkaç üreticileri (örneğin, Waters, SCIEX, Bruker veya Agilent) mevcuttur . Mümkündür, ancak, donanım değişikliği 5 gerek kalmadan 1 MDA kadar kompleksleri için kütle spektrumları elde etmek için, LCT veya QToF1 (Waters) gibi araçlar üzerindeki standart TOF veya QToF yapılandırmaları kullanmak.
Synapt aleti (Waters) aşağıda belirtilen protokol yapıldı.
- Arıtılmış su, CsI 100 mg / ml solüsyon hazırlayın. CsI tek başına ücret tuz kümeleri gibi yüksek kütle kalibrasyon, (CSI) n Cs için kullanılır + 393 m / z 10,000 'in üzerinde (Şekil 2), çok geniş bir kitle yelpazesi uzatmak.
- Künt cımbız kullanarak, bir Eppendorf GeLoader ucunu kullanarak, kılcal Petri kabı ve CsI çözüm yük 2μL kaplı kılcal almak.
- Kılcal kılcal tutucu içine yerleştirin ve kapiler ucu sahibinin kenarından yaklaşık 10 mm uzakta olduğunu bu şekilde ayarlayabilirsiniz.
- Ya da el kılcal ucuna doğru çözüm slayt veya aşağı bir spin adaptörü kullanarak.
- Optik bir mikroskop altında kılcal yerleştirin ve ucu keskin AA-tip cımbız kullanarak düzeltin.
- Kılcal sahibi nanoflow ES arabirimine bağlayın. Kapiller hasar görmesini önlemek için xyz aşamada geriye doğru çevirin ve sahnede aktif konuma itin. Kapiller 1 konulmalıdır - konik delikli 10 mm.
- Sprey başlatılan kadar kılcal gerilimi (1050-1400 V) ve düşük nanoflow basıncı (0,00-,03 bar) uygulayın, daha sonra en az bir değere nanoflow basıncı azaltmak için deneyin.
- Xyz sahne konumu, kılcal gerilim nanoflow basınç ve desolvation gaz akışını ayarlayarak sinyal yoğunluğu optimize edin.
- CsI zirve serisi geniş bir kitle tespit için, hızlanan gerilimler (kılcal 1,3-1,7 kV, örnek koni 80-150V, ekstraksiyon koni 1-3 V, aşağıdaki parametreleri kullanabilirsiniz) optimize edilmelidir.
- Nazik desolvation koşulları, ilk vakum aşamasında desteğini basıncı, kaynak ve analizörü arasındaki gerektiren yüksek kitle iyonlar, iletim optimize etmek için, yükseltilmiş olmalıdır. Bu dikkatle izolasyon vanası (SpeediValve) kısmen kapatarak, kaydırma pompa kaynak vakum hattına iletkenlik azaltarak elde edilebilir. Sinyal yoğunluğu üzerindeki etkisi (genellikle 3,0-6,5 mBar) izlerken optimal noktasını tanımlamak için, ikincisi yapılmalıdır.
- M / z m / z simgesine 15.000 ile 1000 arasında bir mesafeden, 1 tarama / sn 'de yaklaşık 30 taramalar toplayın
- Kazanılmasından sonra, uygun bir kalibrasyon tablosunu kullanarak TOF kalibre edin.
Bölüm 4: tam protein kompleksleri MS analizi
- , Örnek yük olarak tanımlanmıştır (Bölüm 3, Bölüm 2-5) ve sprey başlatabilir.
- Sinyal tespit edilene kadar, sprey ilk optimizasyonu (Bölüm 3, Bölüm 6-9) ile başlayın. Sorumlu devletlerin tam konumunu protein bağımlı; ancak böylece, iyon kütle ve ortalama ücret devlet arasındaki ilişkiyi kullanarak, tahmin edilebilir:, (Z ortalama) 10 Z av = 0,0778 √ (m), hangi m dalton kompleks kitle. Karmaşık disosiasyon önlemek için, iyon kaynağı ısı: ya ısıtıcı kapatın veya sıcaklık 40'ın altında tutmak ° C
- Kılcal konumu, örnek koni ve iyon geçişi en üst düzeye çıkarmak için çıkarıcı gerilimler değişir ve spektrumları meydana gelen değişim kontrol edin. 1 V, kılcal gerilimi 1,5 kV: çıkarıcı koni, olası bir başlangıç noktası koni gerilimi 100 V olabilir. Nanoflow basıncı ile birlikte, bu parametrelerin optimize edin.
- Desolvation geliştirmek ve kalan su ve tampon parçaları şerit, önyargı gerilim ve çarpışma hücre gaz basıncı artar. Bu adım, kompleks disosiasyon önlemek için dikkatli bir şekilde yapılmalıdır. Tipik önyargı gerilimleri bir tuzak gaz akışı ile 1-10 ml / dk (Şekil 3), 10-100 V aralığında. RF ayarı ve kuadropol profili manuel ayar, yüksek kütle iyonları iletimi artırabilir.
- Trap ve Transfer çarpışma enerjileri ayarlayın. Genellikle, yüksek gerilimler, yüksek kütle iyonları (genellikle 10-30 V aralığında) iletimi için gereklidir. Bu noktada, karmaşık çarpışma bağlı disosiasyon önlemek için önemlidir.
- Sonra istikrarlı bir sinyal reached, istikrarlı sprey korurken nanoflow basıncı ve kapiller gerilim, asgari değerler ile azalmış olması tavsiye edilir.
Bölüm 5: Tandem kütle spektrometresi: dissociating protein kompleksleri
- En iyi ve istikrarlı bir sinyal elde edildikten sonra, bir habercisi iyon seçin. Kütle merkezi ve izolasyon genişliği (biz genellikle 12 LM çözünürlük ve 13 ile 15 arasında bir HM çözünürlük) ayarlayın. Yüksek kütle / düşük şarj disosiasyon ürünleri tespit etmek için geniş bir kitle aralığı kullanın. Maksimum seviyeye m / z aralığı ayarlamak önerilir ve sonra istediğiniz değerleri azaltmak. Biz seçilen habercisi iyon izolasyonu daha da doğrulamak için, MS ve MS / MS spektrumları atma öneririz.
- MS / MS gerçekleştirmek için, çarpışma hücre çarpışma enerjisi (CE) ve basıncı artırarak habercisi iyon ayrıştırmaları. Ya tuzak artırın veya 10-20V adımlarla, yavaş yavaş CE aktarın ve 0-5 ml / dk (ortak değerleri) çarpışma gaz basıncını yükseltebilir. Monitör değişiklikleri en iyi aktivasyon koşullarında kadar spektrumları ulaşılır. Yüksek aktivasyon enerjisi, sağlam kompleks bir veya daha fazla alt birimden ayrılma neden ve farklı alt birimden etkileşim yakınlık açıklık olabilir. Biz genellikle daha ağır bir gaz (örneğin, Xe veya SF 6) kullanmanın faydaları bildirilmiş olmasına rağmen, bir çarpışma Tuzak / Transfer hücreleri gaz olarak Argon kullanmak; Ancak, bu gazlar (Şekil 3) 11 önemli ölçüde daha pahalı.
- Bu birden fazla şarj durumu MS / MS analizi için seçilmiş olması tavsiye edilir. Örtüşen bileşenlerin durumda, tandem MS spektrum bir dizi satın farklı popülasyonlar şarj serisi çözümünde yardımcı olacaktır. Ayrıca, yüksek şarj devletlerin daha düşük bir şarj devletler 12 ile karşılaştırıldığında, daha kolay ayrıştırmaları.
- Sağlam kompleks karakterizasyonu yanı sıra, hafif denatüre edici koşullar altında, küçük subcomplexes çözüm olacağını tavsiye edilir. Subcomplexes, MS ve MS / MS analizleri karmaşık 13 altbirim mimarisi tanımlamak için temel oluşturur. Subunit altbirim etkileşimleri kısmi kesinti için, yavaş yavaş% 50 bir konsantrasyon organik çözücüler (örneğin, metanol, izopropanol, ya da asetonitril) eklemek, ya da amonyak veya formik asit (4 bir konsantrasyon ekleyerek çözeltinin pH değişikliği %).
- Kompleksi oluşturan bireysel altbirimden kitleleri belirlemek için, denatüre edici koşullar altında bir spektrum elde etmek için önemlidir. Bu elüsyon çözücü olarak% 1 formik asit, 25:75 su / asetonitril oranı ile ZipTip C 4 (Millipore) kullanılarak yapılabilir.
Bölüm 6: Veri işleme ve analiz
- Veri MS spektrumları, spektral analiz programları kullanarak, çevrimdışı analiz edilir. Biz normalde MassLynx programı (Waters) kullanın.
- Geniş bir m / z aralığı yayılan spektrumları için, bu bölgelerin en yüksek çözünürlük farkı yansıtmak için, yüksek ve düşük m / z bölgeler için yumuşatma ve ağırlık parametreleri farklı planları uygulanabilir öneririz.
- Şarj serisi şarj devletler ve kitleler belirlemek ve hesaplamak için MassLynx fonksiyonu uygulanabilir "manuel". Çakışan bileşenler ile karmaşık bir kütle spektrumlarının durumlarda, elle hesaplama kitlelerin daha kolay olabilir.
- Bu atama işlemleri kolaylaştırmak için, ek bir yazılım olabilir, örneğin: spektrumları deconvolution 14, zirve montaj ve simülasyon 15 için SOMMS, protein subcomplexes kompozisyon ve stokiyometri atama ve protein etkileşim ağları üreten 13,16,17 ZİRVESİ için MaxEnt .
Bölüm 7: Temsilci Sonuçlar

Şekil 1. Altın kaplı nano-elektrosprey kılcal damarların hazırlanması.
A. Petri kabı, 2 cm arayla iki adet çift taraflı yapışkan bantlar takın . B. hazırlanan kılcal damarlar destek için, yapışkan hazırlanan kılcal damarların künt sonunda Çubuk pedleri birinin merkezinde bir cam çubuk (8 cm x 5 mm) yerleştirin ve cam çubuk ucu yalın. C. Petri kabı, altın bir ince film eşit kılcal damarların dış yüzey üzerinde biriken kadar altın ile hazırlanan kılcal damarlar, mont ile doludur .
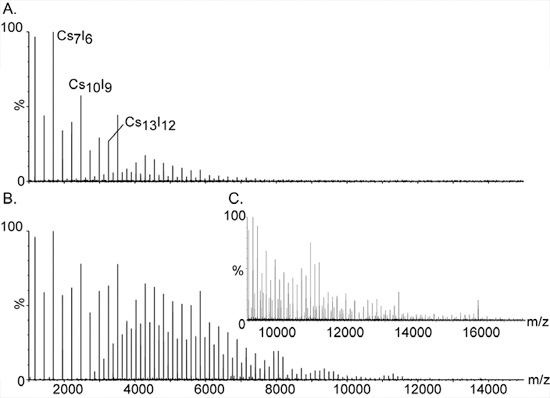
Şekil 2. Sezyum iyodür iyonları kullanarak yüksek kütle kalibrasyonu.
CsI büyük ve monisotopic kümeleri yüksek kitle analizi için kütle spektrometre kalibre için tercih edilen bileşik yaptık. Eşit aralıklı zirvelerinden dizi m / z 393 den 10,000 'in üzerinde, geniş bir yelpazede uzatmak. Onlar assigned tek başına genel bileşimi (CSI) n Cs + tuz kümeleri ücret. Önemli zirveleri arasında Ek sinyaller serisi çift ve üçlü ücret türler neden olur; [(CSI) n Cs2] 2 + ve 3 +, sırasıyla [(CSI) n CS3]. Ilk vakum aşamada basıncı artırarak yüksek kitle kümeleri tespit için esastır. Paneller bir yüksek kütle tepeleri üzerinde basınç etkisi olduğunu göstermiştir. B. sırasıyla 1.2 ve 5.3, basınç readbacks ile C. Tayf genişletilmesi B gösterilmiştir.
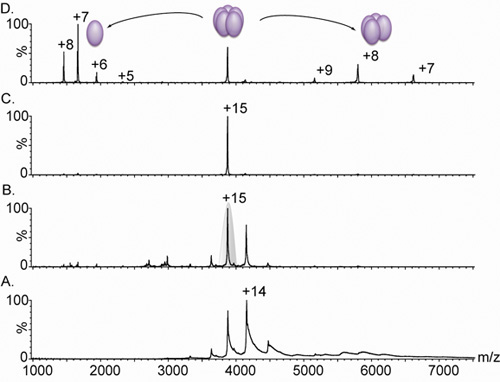
Şekil 3. Pentameric lektin Nanoflow elektrosprey kitle spektrumu.
A. lektin varyant kompleks Kütle spektrometresi (Lib1-B7 yönlendirilmiş evrim 18 türetilmiş) şarj durumu dağılımları, 3.000 ve 5.000 m / z arasında bir yol verir, ancak iyonları yetersiz desolvation nedeniyle, zirveleri geniş . Karşılaştırma paneli A. ve B. 4V (A) (B) pik genişliği 15V kutuplama gerilimi artan etkisini gösteriyor. Koşullarında hızlanan bu artış, yüksek çözülmesi spektrum verimli, kalan su ve tampon parçaları sıyırma neden olur. Ölçülen kütle (60,240 ± 38 Da) pentameric kompleksine karşılık gelir. C. 15 şarj durumu için tandem MS analizleri (Panel B gri gölgeli.) D seçildi. Çarpışma enerjisi artış 5.000 aralığında, 1664 m / z merkezli bir yüksek tahsil monomer, ve elimden tetramerik kompleksi salınımına neden olur - 8.000 m / z simgesine Tüm spektrumları 0,5 M amonyum asetat 20 mcM çözüm içeren bir örnek elde edildi.
Tartışmalar
Elde etmek için yüksek kaliteli spektrumları dikkat örnek konsantrasyonu ve tampon değişimi içeren numune hazırlama adımları verilmelidir. Seyreltilmiş örnekleri içinde son derece konsantre örnekler oldukça viskoz ise, düşük sinyal verimi ve elektrosprey iğne bloke olacaktır. Ayrıca, tuzlar, gliserol, deterjan, metal iyonları ve indirgeyici ajanlar (DTT veya β-mercaptoethanol) gibi çözüm katkılar, proteinlerin dış yüzeyi uymak eğilimindedir ve doruklarına genişletilmesi neden. Bu nedenle, iyi bir çözüme doruklarına ulaşmak için, bu bileşenlerin mümkün olan en düşük konsantrasyonlarda ilave edilmelidir.
Bir diğer önemli parametre, kılcal nanoflow konumu, kütle spektrometresi orifis göre. "Tatlı nokta" bulma deneyimsiz kullanıcılar için zor olabilir ama yine de spektrumları kalitesini önemli ölçüde etkiler. Nanoflow sprey başlamadan önce kapiller incelemek için de önemlidir. Damlacık boyutu ~ 1 mikrona kadar olmalıdır ucu çapı, bir fonksiyonudur. Küçük damlacıklar daha etkin iyonizasyon kurşun, ve bu nedenle avantajlı olacaktır. Kapiller içinde herhangi bir hava kabarcığı akışını engellemek olduğunu doğrulamak için de önemlidir ve altın kaplama satın alma sırasında kapiller elimden olmadığını, eğer öyleyse, daha fazla ipucu düzeltin. Aşırı miktarda örnek kılcal gerilim, hızlanan gerilimler, basınç, ve çarpışma enerjisi gibi MS koşulları optimize olasılığı artacağı göz önünde bulundurun.
Genel olarak, protokol açıklanmıştır usul, sayısız protein kompleksleri bileşimi, stokiyometri ve mimari (bkz. yorumlar 2,3,4) belirlemek için kullanılır olmuştur. Ribozom 19 gibi büyük MDA kompleksleri ve yüksek sipariş virüs capsids 20-22, analizi, moleküler makineler 23-25, veya subunit etkileşim ağları karakterizasyonu için bağlayıcı substratı tanımlayan 26,17,16,17,27,28 olarak hizmet ancak bu yaklaşımın değeri birkaç örnek.
Açıklamalar
Teşekkürler
Yazarlar Sharon grup üyeleri, eleştiri ve el yazması katkıları için teşekkür ederim. Biz destek için Morasha ve Bikura Programlar, İsrail Bilim Vakfı (Grant No 1823-1807 ve 378/08), Biomembrane Araştırma Josef Cohn Minerva Merkezi, Yeni bilim adamları için Chais Aile Fellows Programı, İbrahim minnettarız Sonia Rochlin Vakfı; Wolfson Aile Charitable Trust, Helen ve Milton A. KimmelKimmelman Merkezi Biyomoleküler Yapı ve Meclis için; Shlomo ve Sabine Beirzwinsky emlak; Meil de Botton Aynsley, ve Karen Siem Reap, İngiltere. Biz, bize lektin varyant örnek vermek için, Dan Tawfik ve Itamar Yadid minnettar.
Malzemeler
Örnek gereksinimleri:
| Örnek | Gereklilik | Yorumlar |
| Hacim | 1-2 mcL | Kapiller Başına |
| Konsantrasyon | 1-20μM | Karmaşık Başına |
| Tampon | Amonyum asetat gibi Aquanos uçucu tampon pH = 6-8 | Tipik olarak 5 mM-1M |
| Deterjan | En az | Deterjan moleküllerinin Kümeleri geniş ve çözülmemiş doruklarına üretir |
| Gliserin | Minimal (5%) | Nonspecifically proteinlere yapışır ve, dolayısıyla, geniş doruklarına gözlenmektedir |
| Organik solventler | % 50'ye varan | Proteinler kompleksleri denatüre olabilir |
| Asitler | En fazla% 4 | Denatüre protein kompleksleri |
| Tuzlar | En az | Tuz adducts geniş ve çözülmemiş zirveleri |
| DTT | En az | 1-2 mcM mevcut olabilir |
| Şelat ajanları | En az | 250 mcM şeyden önce kapsamlı adduct oluşumuna yol |
Referanslar
- Alberts, B. The cell as a collection of protein machines: preparing the next generation of molecular biologists. Cell. 92 (3), 291-294 (1998).
- Benesch, J. L., Ruotolo, B. T., Simmons, D. A., Robinson, C. V. Protein complexes in the gas phase: technology for structural genomics and proteomics. Chem Rev. 107 (8), 3544-3567 (2007).
- Heck, A. J. Native mass spectrometry: a bridge between interactomics and structural biology. Nat Methods. 5 (11), 927-933 (2008).
- Sharon, M., Robinson, C. V. The role of mass spectrometry in structure elucidation of dynamic protein complexes. Annu Rev Biochem. 76, 167-193 (2007).
- Hernandez, H., Robinson, C. V. Determining the stoichiometry and interactions of macromolecular assemblies from mass spectrometry. Nat Protoc. 2 (3), 715-726 (2007).
- Wilm, M., Mann, M. Analytical properties of the nanoelectrospray ion source. Analytical Chemistry. 68 (1), 1-8 (1996).
- Sobott, F. A tandem mass spectrometer for improved transmission and analysis of large macromolecular assemblies. Anal Chem. 74 (6), 1402-1407 (2002).
- van den Heuvel, R. H. Improving the performance of a quadrupole time-of-flight instrument for macromolecular mass spectrometry. Anal Chem. 78 (21), 7473-7483 (2006).
- Chernushevich, I. V., Thomson, B. A. Collisional cooling of large ions in electrospray mass spectrometry. Anal Chem. 76 (6), 1754-1760 (2004).
- Mora, d. e. l. a., J, . Electrospray ionization of large multiply charged species proceeds via Dole s charged residue model. Anal Chim Acta. 406, 93-104 (2000).
- Lorenzen, K. Optimizing macromolecular tandem mass spectrometry of large non-covalent complexes using heavy collision gases. Int J Mass Spectrom. 268, 198-206 (2007).
- Benesch, J. L. Quadrupole-time-of-flight mass spectrometer modified for higher-energy dissociation reduces protein assemblies to peptide fragments. Anal Chem. 81 (3), 1270-1274 (2009).
- Taverner, T. Subunit architecture of intact protein complexes from mass spectrometry and homology modeling. Acc Chem Res. 41 (5), 617-627 (2008).
- Ferrige, A. G., Seddon, M. J., Skilling, J., Ordsmith, N. The application of MaxEnt to high resolution mass spectrometry. Mass Spectrom. 6, 765-770 (1992).
- van Breukelen, B., Barendregt, A., Heck, A. J., van den Heuvel, R. H. Resolving stoichiometries and oligomeric states of glutamate synthase protein complexes with curve fitting and simulation of electrospray mass spectra. Rapid Commun Mass Spectrom. 20 (16), 2490-2496 (2006).
- Sharon, M. Symmetrical modularity of the COP9 signalosome complex suggests its multifunctionality. Structure. 17 (1), 31-40 (2009).
- Hernandez, H. Subunit architecture of multimeric complexes isolated directly from cells. EMBO Rep. 7 (6), 605-610 (2006).
- Yadid, I., Tawfik, D. S. Reconstruction of functional beta-propeller lectins via homo-oligomeric assembly of shorter fragments. J Mol Biol. 365 (1), 10-17 (2007).
- Videler, H. Mass spectrometry of intact ribosomes. FEBS Lett. 579 (4), 943-947 (2005).
- Uetrecht, C. High-resolution mass spectrometry of viral assemblies: molecular composition and stability of dimorphic hepatitis B virus capsids. Proc Natl Acad Sci U S A. 105 (27), 9216-9220 (2008).
- Uetrecht, C. Stability and shape of hepatitis B virus capsids in vacuo. Angew Chem Int Ed Engl. 47 (33), 6247-6251 (2008).
- Morton, V. L., Stockley, P. G., Stonehouse, N. J., Ashcroft, A. E. Insights into virus capsid assembly from non-covalent mass spectrometry. Mass Spectrom Rev. 27 (6), 575-595 (2008).
- Sharon, M. 20S proteasomes have the potential to keep substrates in store for continual degradation. J Biol Chem. 281 (14), 9569-9575 (2006).
- van Duijn, E., Heck, A. J., Vies, S. M. v. a. n. d. e. r. Inter-ring communication allows the GroEL chaperonin complex to distinguish between different substrates. Protein Sci. 16 (5), 956-965 (2007).
- van Duijn, E. Tandem mass spectrometry of intact GroEL-substrate complexes reveals substrate-specific conformational changes in the trans ring. J Am Chem Soc. 128 (14), 4694-4702 (2006).
- Synowsky, S. A., van Wijk, M., Raijmakers, R., Heck, A. J. Comparative multiplexed mass spectrometric analyses of endogenously expressed yeast nuclear and cytoplasmic exosomes. J Mol Biol. 385 (4), 1300-1313 (2009).
- Sharon, M. Structural organization of the 19S proteasome lid: insights from MS of intact complexes. PLoS Biol. 4 (8), e267-e267 (2006).
- Zhou, M. Mass spectrometry reveals modularity and a complete subunit interaction map of the eukaryotic translation factor eIF3. Proc Natl Acad Sci U S A. 105 (47), 18139-18144 (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır