Method Article
Анализ Большие белковые комплексы структурных масс-спектрометрии
В этой статье
Резюме
Масс-спектрометрия оказалась ценным инструментом для анализа больших белковых комплексов. Этот метод позволяет взглянуть на состав, стехиометрии и общую архитектуру нескольких субъединиц сборок. Здесь мы описываем, шаг за шагом, как выполнить структурного анализа масс-спектрометрии, и характеризуют макромолекулярных структур.
Аннотация
Живые клетки контролировать и регулировать их биологические процессы, посредством согласованных действий большого количества белков, которые объединяют себя в массив динамический, мульти-белковые комплексы 1. Чтобы получить механистического понимания различных клеточных процессов, крайне важно определить структуру таких комплексов белка, и выявить, каким образом их структурная организация диктует свои функции. Многие аспекты мульти-белковые комплексы, однако, трудно охарактеризовать, из-за их неоднородности, асимметричная структура и динамика. Таким образом, необходимы новые подходы к изучению высшего образования белка организации.
Одна из новых структурных инструментов биологии для анализа макромолекулярных комплексов масс-спектрометрии (MS) 2-5. Этот метод позволяет получить информацию о сложных по составу белков, субъединицы стехиометрии, и структурные топологии. Власти РС вытекает из его высокую чувствительность и, как следствие, низкие требования образца, что дает возможность изучения белковых комплексов, высказанные на эндогенные уровни. Еще одним преимуществом является скорость анализа, которая позволяет осуществлять мониторинг реакции в реальном времени. Более того, метод может одновременно измерять характеристики отдельных популяций сосуществующих в смеси.
Здесь мы описываем подробный протокол для применения структурных MS для анализа больших сборки белка. Процедура начинается с подготовки с золотым покрытием капилляры для nanoflow электрораспылением ионизации (Неси). Затем он продолжает с пробоподготовки, подчеркивая буфера условия, которые должны быть совместимы с Неси, с одной стороны, и позволяют сохранить нетронутыми комплексов, с другой. Мы тогда объяснить, шаг за шагом, как оптимизировать экспериментальные условия для высокотемпературных измерений массы и приобрести MS и MS тандеме спектров. Наконец, график обработки данных и анализов, которые следуют. Вместо того, чтобы охарактеризовать все аспекты сборки белка, этот протокол вводит основные MS процедур, что позволяет производительность MS и MS / MS эксперименты по нековалентных комплексов. В целом, наша цель заключается в предоставлении исследователям знакомы с области структурной MS, со знанием основных экспериментальных инструментов.
протокол
Часть 1: Подготовка золотым покрытием капилляров для ионизации электрораспылением nanoflow
Анализ нековалентных комплексов, как правило, осуществляется с помощью nanoflow электрораспылением ионизации (Неси) 6, с использованием стекла или кварца капилляры, которые были выведены в виде штрафа в наконечник (~ 1 мкм, внутренний диаметр), а также покрытые проводящего материала (обычно золота) . Такие капилляры имеются готовые к использованию из коммерческих источников (Новая цель или Proxeon), однако он может быть более экономически эффективным, чтобы подготовить их в доме:
- Придерживайтесь две полоски двусторонней клейкой прокладки на дно чашки Петри, 2 см друг от друга. Место стеклянной палочкой (8 см х 5 мм) в центре одного из колодки. Клейкой прокладки проведет капилляров на месте, и стеклянной палочкой поддержит подготовленный капилляров, и держать советы от разрушения (рис. 1).
- Используйте боросиликатного стекла капиллярах, диаметр 1,0 мм х 0,78 мм идентификатор (мы используем пакеты из 500 тонкую стенку капилляров из боросиликатного Warner инструменты, кошки. Нет. G100TF-4). Вставьте один капилляр в иглу съемник (мы используем модель P-97 из Саттер машиностроительный завод). Зажим капиллярной мягко на месте, и корректировать свою позицию, с тем, что она лежит в центре нагрева нити иглы съемник в. Затяните зажимы мягко, до капиллярной проводится фирмой на обоих концах.
- Вытяните капиллярные, используя предопределенные программы. Каждый капиллярной вытащил даст начало двум финал, формы капилляров. Процесс программирования съемник на методе проб и ошибок, до приемлемой формой кончика получается. Мы используем следующую программу:
Шаг Тепло Тянуть Велл Время 1 750 - 15 80 2 700 - 15 50 3 750 200 20 80 - Удалить вытащил капилляры от инструмента и проверить советы, отбрасывая любые, которые деформированы или сломаны. Используйте тупой пинцет (мы используем позиционирования пинцетом из Precision CK), разместить капилляров в чашке Петри. База капиллярной должны быть прикреплены к клейкой прокладки и верхняя часть должна опираться на стеклянной палочкой, с наконечником вверх.
- После чашки Петри полна (около 80 капилляров вписаться в 10 см диаметра тарелки), вставить пластину в золото напыления для нанесения покрытий (мы используем модель нет. EMS550, от EMS). Убедитесь, что подача газа выбирается в соответствии с инструкциями производителя и активации предустановленного цикла покрытия (мы используем Аргон давление 4 бар, в вакуумметрического давления, 5 х 10 -2 мбар, ток 45 мА, а покрытие время 1 мин, в течение 3-6 циклов, до капилляров равномерно золотых).
Часть 2: Пробоподготовка
- Низкий микромолярных концентрации образца требуется (1 - 20 мкм). При необходимости, концентрат примера с использованием центробежной ультрафильтрации устройств (например, Vivaspin от Sartorius, или NanoSep от Pall Corporation). Мы рекомендуем вам проверить адсорбции белкового комплекса на устройство мембраны, перед использованием.
- Часто, очистка буфера или хранения растворов белкового комплекса, не совместимы с Неси, на которые нужен только летучие решения могут быть использованы. Таким образом, буфер обмена необходимо. Это важный шаг, в котором все следы соли, буферные молекулы или любого другого нелетучих аддуктов такие как глицерин, DVB-T, или ЭДТА удаляются, определяет качество спектров. Как правило, водный раствор ацетата аммония используется в концентрации от 5 мм и 1 м, а при рН 6-8. Буфер обмена можно выполнить с помощью фильтрации микроцентрифужных гель колонки (например, микро Био-Spin 6 хроматографии столбцы из Bio-Rad). Этот шаг может быть повторен 1-3 раза с минимальным разбавлением (менее чем в 1,3 раза на устройство 5), до максимального обмена достигается. Если обе концентрации и буфером обмена необходимо, они могут сделать вместе, используя центробежные ультрафильтрации (е, ж, Vivaspin от Sartorius, или NanoSep от Pall Corporation).
Часть 3: Калибровка масс-спектрометра для высокотемпературных измерений массы
Большинство экспериментов, проведенных на различных белковых комплексов осуществляется с использованием нано электрораспылением квадрупольного времени пролета (Q-TOF) инструмента. Предполагается, что вы используете квадрупольный фильтр масс доводят до низких частот, для включения передачи и массовый анализ ионов с высокой т / г значения 7,8. ЭтоРекомендуется также, что газ бухт 7,8 или 9 рукава быть добавлены в документ в первом руководстве иона, чтобы позволить контроля давления на первом этапе вакуум. Последний позволяет оптимизировать передачу и десольватации очень больших ионов 7-9. В настоящее время коммерческие ESI-TOF и Q-ToF инструменты доступны из нескольких производителей (например, воды, Sciex, Bruker, или Agilent), которая может быть изменена сравнительно легко и экономически эффективно, для родных приложений MS 7,8. Не исключено, однако, использовать стандартные конфигурации ToF или QToF на такие инструменты, как LCT или QToF1 (Waters) приобретать масс-спектров для комплексов до 1 MDA, без необходимости аппаратных модификаций 5.
Протокол указанных ниже проводилось на Synapt инструмент (Waters).
- Подготовка 100 мг / мл раствора CsI в очищенной воде. CsI используется для калибровки на высоком массы однократно заряженных кластеров соль, (CsI) п Cs + распространяется на широкий диапазон масс, от 393 т / г до более чем 10 000 (рис. 2).
- Использование тупой пинцет, возьмите покрытием капилляра от чашки Петри и нагрузки 2μL решения CsI в капилляр, используя наконечник Эппендорф GeLoader.
- Вставьте капилляр в капиллярной держателя, а также настроить капиллярной таким образом, что его конец находится примерно в 10 мм от края держателя.
- Слайд решение к кончику капилляра вручную или с помощью адаптера спином вниз.
- Место капилляре под оптическим микроскопом и обрезать кончик, используя резкие AA-типа пинцета.
- Подключите капиллярной владельцу интерфейс ES nanoflow. Поворот этапе хуг назад, чтобы не повредить капилляр, и нажмите этап в его рабочее положение. Капиллярной должны быть помещены 1 - 10 мм от конуса отверстие.
- Применение капиллярного напряжения (1050-1400 В) и низкого давления nanoflow (0.00-0.03 бар) до спрей инициируется, а затем попытаться уменьшить nanoflow давление минимальное значение.
- Оптимизация интенсивности сигнала путем изменения расположения этапе XYZ, капиллярные напряжения, nanoflow давления и потока десольватации газа.
- Чтобы обнаружить широкий диапазон масс CsI пик серии, ускоряющего напряжения должны быть оптимизированы (мы используем следующие параметры: капиллярные 1,3-1,7 кВ, образец конус 80-150V, добыча конуса 1-3 V).
- Для оптимизации передачи больших ионов массы, которые требуют нежного условиях десольватации, поддержка давление в начальной стадии вакуум, между источником и анализатором, должны быть повышены. Это может быть достигнуто путем тщательного снижения проводимости линейного источника вакуума прокрутки насос, частично закрывая запорный клапан (SpeediValve). Для того чтобы определить оптимальную точку, последнее должно быть сделано в то время как мониторинг влияния на интенсивность сигнала (мы обычно используем 3.0-6.5 мБар).
- Сбор около 30 сканирований на 1 скан / сек, в т / г диапазоне от 1000 до 15000 м / z.
- После приобретения, калибровки TOF использованием соответствующей таблице калибровки.
Часть 4: МС анализа интактных белковых комплексов
- Загрузите пример, как описано (часть 3, разделы 2-5), и начать распыление.
- Начните с начальной оптимизации спрей (часть 3, § § 6-9), пока сигнал не обнаружен. Точное положение зарядовых состояний является белок-зависимых, однако она может быть предсказано, используя соотношение между массой ионов и среднее состояние заряда, таким образом: (Z пр.) 10: Z ср = 0,0778 √ (м), в которых т есть масса комплекса в Дальтон. Для предотвращения комплекс диссоциации, не нагреваются ионного источника: либо перейти нагреватель, или держать при температуре ниже 40 ° C.
- Вары капиллярной положение, образец конуса и экстрактор напряжения максимально ионно передачи и проверки в результате изменений в спектрах. Возможный исходный пункт может быть конусом напряжение 100 В; экстрактор конуса: 1 В; капиллярной напряжением 1,5 кВ. Оптимизация этих параметров, в сочетании с nanoflow давления.
- Для улучшения десольватации и сдирать остатки воды и буферных компонентов, увеличение напряжения смещения и давления газа в столкновении клетки. Этот шаг должен быть выполнен тщательно, чтобы предотвратить диссоциации комплекса. Типичные напряжения смещения находятся в диапазоне 10-100 В, с потоком ловушку газ 1-10 мл / мин (рис. 3). Ручная регулировка настройки РФ и квадрупольного профиль может улучшить передачу высоких ионов массы.
- Отрегулируйте ловушки и энергии Передача столкновения. Часто, более высокое напряжение, необходимое для передачи больших масс ионов (обычно в пределах 10-30 V). На этом этапе важно, чтобы избежать столкновения вызванное диссоциации комплекса.
- После стабильного сигнала тeached, рекомендуется, чтобы давление nanoflow и капиллярных напряжения быть снижена до минимальных значений, при сохранении стабильного распыления.
Часть 5: Тандем масс-спектрометрии: комплексы диссоциирующего белка
- После оптимальный и стабильный сигнал был получен, выберите предшественником иона. Установить центра масс и изоляции ширина (мы обычно используем LM разрешением 12, а разрешение МЗ от 13 до 15). Использование широкого спектра масс для обнаружения повышенной массой / низкий заряд продукты диссоциации. Рекомендуется, чтобы вы установили т / г диапазона до максимального уровня, а затем уменьшить его до желаемого значения. Кроме того, мы предлагаем наложения MS и MS / MS спектров, для проверки изоляции выбрана предшественником иона.
- Для выполнения MS / MS, диссоциируют предшественника ионной за счет увеличения энергии столкновения (CE) и давление на столкновение клетки. Увеличение либо ловушка или передача CE постепенно, с шагом в 10-20В, и поднять давление столкновения газа до 0-5 мл / мин (общих ценностей). Монитор изменения в спектрах до оптимальных условий активации были достигнуты. Высокая энергия активации может вызвать диссоциацию одного или нескольких подразделений с нетронутым комплексом, и уточнить взаимодействие сродства различных подразделений. Обычно мы используем Аргон как столкновение газа в ловушке / Передача клеток, хотя выгоды от использования тяжелых газов (например, Хе или SF 6) не поступало, однако, эти газы существенно дороже 11 (рис. 3).
- Рекомендуется, чтобы более одного заряда состоянии быть выбраны для MS / MS анализа. В случае наложения компонентов, приобретая набор тандеме MS спектров помогут в решении заряда серии различных групп населения. Более того, высшие состояния заряда будет отделить легче, по сравнению с меньшим зарядом государств 12.
- В дополнение к характеристике нетронутыми комплекс, предполагается, что небольшие подкомплексы в растворе будет создан, в мягких денатурирующих условиях. MS и MS / MS анализа подкомплексы основой для определения субъединицы Архитектура комплекса 13. Для частичного разрушения субъединицы-субъединицы взаимодействия, постепенно добавляют органические растворители (например, метанол, изопропиловый спирт, или ацетонитрил) до концентрации 50%, или на изменение рН раствора, добавляя аммиак или муравьиной кислоты (до концентрации 4 %).
- Для определения массы отдельных субъединиц, которые составляют комплекс, важно получить спектр в денатурирующих условиях. Это может быть осуществлено с использованием Zip-Tip C 4 (Millipore) с 25:75 вода / ацетонитрил отношения, с 1%-ной муравьиной кислоты в качестве растворителя элюирования.
Часть 6: Обработка и анализ данных
- Данные проанализированы в автономном режиме, с помощью спектральной программ для MS анализа спектров. Мы обычно используем MassLynx программы (Waters).
- Для спектров, которые охватывают широкий т / г диапазона, мы рекомендуем, чтобы различные схемы сглаживания и тяжести параметры будут применяться при высоких и низких т / г регионов, чтобы отразить разницу в пик решение этих регионах.
- Чтобы определить заряд серии и расчета зарядовых состояний и масс, "ручной найти" функции MassLynx могут быть применены. В случаях сложных масс-спектров с перекрытием компонентов, автоматический расчет массы может быть проще.
- Для облегчения этих процессов назначения, дополнительное программное обеспечение может быть использовано, например: MaxEnt для спектров деконволюции 14, SOMMS для пиковых монтаж и моделирование 15, и САММИТ для назначения состава и стехиометрии белка подкомплексы и создания сетей взаимодействия белка 13,16,17 .
Часть 7: Представитель Результаты

Рисунок 1. Подготовка золотым покрытием нано-электрораспылением капилляров.
А. Приложите два двухсторонних полосы клея на чашке Петри, 2 см друг от друга. Для поддержки подготовлены капилляров, место стеклянной палочкой (8 см х 5 мм) в центре одного из колодки. Б. Придерживайтесь тупой конец подготовлены капилляры клейкой прокладки, и худой кончик стеклянной палочкой. C. После чашки Петри заполняют подготовленной капилляров, покрыть их золотом до тонкой пленки золота равномерно оседают на внешней поверхности капилляров.
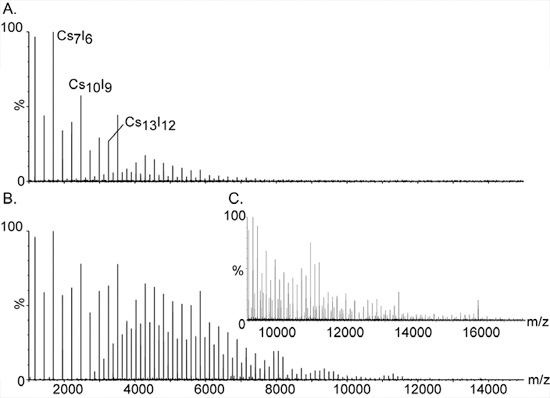
Рисунок 2. Высокая калибровки массы, используя ионов цезия йодистого.
Большой и monisotopic кластеров CsI сделали это соединение выбора для калибровки масс-спектрометров высокого анализ массы. Серии равноотстоящих пиков распространяется на широкий диапазон от т / г 393 до более чем 10000. Они assigопределена для однозарядных соль кластеры общего состава (CsI) п Cs +. Дополнительные сигналы между основными пиками вызваны двойной и тройной заряженные видов серии; [(CsI) п Cs2] 2 + и [(CsI) п Cs3] 3 +, соответственно. Увеличение давления на начальном этапе вакуум имеет важное значение для выявления кластеров высокой массы. Влияние давления на высоких пиков масса показана в панели. и B. с давлением readbacks в 1,2 и 5,3, соответственно. C. Расширение спектра масс показан на B.
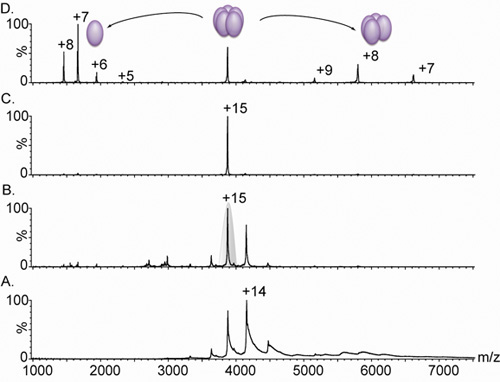
Рисунок 3. Nanoflow электрораспылением масс-спектры pentameric лектина.
А. Масс-спектрометрия лектина комплексный вариант (производный от Lib1-B7 по направленной эволюции 18) приводит к зарядовое состояние распределения между 3000 и 5000 т / г, однако из-за неадекватного десольватации ионов, пики широк. Сравнение панель А. и Б. показать эффект от увеличения напряжения смещения от 4В (.) До 15В (B.) На ширину пика. Это увеличение в ускорении условиях создает снятия остаточной воды и буферных компонентов, что дает высокую разрешенный спектр. Измеренная масса (60 240 ± 38 Da) соответствует pentameric комплекса. C. +15 зарядовое состояние было тогда, отобранных для тандема МС анализа (заштрихована серым в Группе B). D. Увеличением энергии столкновения приводит к высвобождению весьма напряженной мономера, с центром в 1664 м / г, и раздели тетрамерной комплекса, в диапазоне 5000 - 8000 м / z. Все спектры были получены на основе выборки, содержащей 20 мкМ раствор в 0,5 М ацетата аммония.
Обсуждение
Для получения спектров высокого внимания качеству следует уделять пробоподготовки шагов, которые включают в себя концентрацию пробы и буфера обмена. За разбавленных образцов даст сигнал низкого уровня, в то время высококонцентрированных образцов может быть довольно вязким, а также заблокировать электрораспылением иглы. Более того, решение добавки, такие как соли, глицерин, моющие средства, ионы металлов, и восстановителей (DTT или β-меркаптоэтанол), как правило, придерживаются внешней поверхности белки, и вызывают расширение пиков. Таким образом, для достижения хорошо разрешенных пиков, эти компоненты должны быть добавлены в низких концентрациях возможно.
Еще одним ключевым параметром является положение nanoflow капилляр, по сравнению с отверстием масс-спектрометра. Поиск "сладкое пятно" может оказаться непростой задачей для неопытных пользователей, тем не менее, он значительно влияет на качество спектров. Важно также рассмотреть nanoflow капиллярной перед началом распыления. Размер капель является функцией диаметр кончика, которое должно быть ~ 1 мкм. Малые капли приводит к более эффективной ионизации, и поэтому она будет выгодно. Важно также проверить, что Есть нет пузырьков воздуха внутри капилляра, которые могут блокировать поток, и что золотое покрытие не удаляются из капиллярной во время съемки, а если так, то дальнейшее отделки чаевые. Имейте в виду, что чрезмерное количество образца увеличит возможности оптимизации условий, таких как MS капиллярной напряжения, ускоряющего напряжения, давления и энергии столкновения.
В целом, процедуры описаны в протоколе были использованы для определения состава, стехиометрии и архитектуры многочисленных белковых комплексов (см. обзоры 2,3,4). Анализ крупных комплексов МДа таких как рибосомы 19 и высокоупорядоченных капсиды вирус 20-22, в определении субстрата для молекулярных машин, 23-25, или характеристика сетей субъединицы взаимодействия 26,17,16,17,27,28 служить но несколько примеров того, ценность такого подхода.
Раскрытие информации
Благодарности
Авторы выражают благодарность членам Шарон группы за их критический обзор, и за их вклад в рукописи. Мы благодарны за поддержку и Мораша бикура программы, Израиль научного фонда (грант пп 1823/07 и 378/08), Йозеф Кон Минерва Центре Биомембранных исследований, семьи Chais стипендиатов программы для новых ученых, Авраам и Соня Rochlin фонда; семьи Вольфсон Благотворительный фонд; Хелен и Милтон А. Kimmelman Центра биомолекулярных Структура и Ассамблеи; имении Шломо и Сабин Beirzwinsky; Meil де Боттон Эйнсли, и Карен Сием, Великобритания. Мы благодарны Дэн Тофик и Итамар Yadid за предоставленную нам лектина образец вариант.
Материалы
Пример требований:
| Образец | Требование | Комментарии |
| Объем | 1-2 мкл | Пер капиллярной |
| Концентрация | 1-20 мкм | На комплексе |
| Буфер | Aquanos летучих буфера, такие как ацетат аммония при рН = 6 - 8 | Обычно 5 мМ-1М |
| Моющее средство | Минимальный | Кластеры молекул моющего средства производят широкий и неразрешенных пиков |
| Глицерин | Минимальная (до 5%) | Адгезия неспецифически с белками и, следовательно, широкие пики наблюдаются |
| Органические растворители | До 50% | Может денатурации белков комплексов |
| Кислоты | До 4% | Денатурации белковых комплексов |
| Соли | Минимальный | Соль аддуктов привести к широким и неразрешенных пиков |
| DTT | Минимальный | 1-2 мкм, могут присутствовать |
| Агенты хелирования | Минимальный | Выше 250 мкМ привести к обширным образованием аддукта |
Ссылки
- Alberts, B. The cell as a collection of protein machines: preparing the next generation of molecular biologists. Cell. 92 (3), 291-294 (1998).
- Benesch, J. L., Ruotolo, B. T., Simmons, D. A., Robinson, C. V. Protein complexes in the gas phase: technology for structural genomics and proteomics. Chem Rev. 107 (8), 3544-3567 (2007).
- Heck, A. J. Native mass spectrometry: a bridge between interactomics and structural biology. Nat Methods. 5 (11), 927-933 (2008).
- Sharon, M., Robinson, C. V. The role of mass spectrometry in structure elucidation of dynamic protein complexes. Annu Rev Biochem. 76, 167-193 (2007).
- Hernandez, H., Robinson, C. V. Determining the stoichiometry and interactions of macromolecular assemblies from mass spectrometry. Nat Protoc. 2 (3), 715-726 (2007).
- Wilm, M., Mann, M. Analytical properties of the nanoelectrospray ion source. Analytical Chemistry. 68 (1), 1-8 (1996).
- Sobott, F. A tandem mass spectrometer for improved transmission and analysis of large macromolecular assemblies. Anal Chem. 74 (6), 1402-1407 (2002).
- van den Heuvel, R. H. Improving the performance of a quadrupole time-of-flight instrument for macromolecular mass spectrometry. Anal Chem. 78 (21), 7473-7483 (2006).
- Chernushevich, I. V., Thomson, B. A. Collisional cooling of large ions in electrospray mass spectrometry. Anal Chem. 76 (6), 1754-1760 (2004).
- Mora, d. e. l. a., J, . Electrospray ionization of large multiply charged species proceeds via Dole s charged residue model. Anal Chim Acta. 406, 93-104 (2000).
- Lorenzen, K. Optimizing macromolecular tandem mass spectrometry of large non-covalent complexes using heavy collision gases. Int J Mass Spectrom. 268, 198-206 (2007).
- Benesch, J. L. Quadrupole-time-of-flight mass spectrometer modified for higher-energy dissociation reduces protein assemblies to peptide fragments. Anal Chem. 81 (3), 1270-1274 (2009).
- Taverner, T. Subunit architecture of intact protein complexes from mass spectrometry and homology modeling. Acc Chem Res. 41 (5), 617-627 (2008).
- Ferrige, A. G., Seddon, M. J., Skilling, J., Ordsmith, N. The application of MaxEnt to high resolution mass spectrometry. Mass Spectrom. 6, 765-770 (1992).
- van Breukelen, B., Barendregt, A., Heck, A. J., van den Heuvel, R. H. Resolving stoichiometries and oligomeric states of glutamate synthase protein complexes with curve fitting and simulation of electrospray mass spectra. Rapid Commun Mass Spectrom. 20 (16), 2490-2496 (2006).
- Sharon, M. Symmetrical modularity of the COP9 signalosome complex suggests its multifunctionality. Structure. 17 (1), 31-40 (2009).
- Hernandez, H. Subunit architecture of multimeric complexes isolated directly from cells. EMBO Rep. 7 (6), 605-610 (2006).
- Yadid, I., Tawfik, D. S. Reconstruction of functional beta-propeller lectins via homo-oligomeric assembly of shorter fragments. J Mol Biol. 365 (1), 10-17 (2007).
- Videler, H. Mass spectrometry of intact ribosomes. FEBS Lett. 579 (4), 943-947 (2005).
- Uetrecht, C. High-resolution mass spectrometry of viral assemblies: molecular composition and stability of dimorphic hepatitis B virus capsids. Proc Natl Acad Sci U S A. 105 (27), 9216-9220 (2008).
- Uetrecht, C. Stability and shape of hepatitis B virus capsids in vacuo. Angew Chem Int Ed Engl. 47 (33), 6247-6251 (2008).
- Morton, V. L., Stockley, P. G., Stonehouse, N. J., Ashcroft, A. E. Insights into virus capsid assembly from non-covalent mass spectrometry. Mass Spectrom Rev. 27 (6), 575-595 (2008).
- Sharon, M. 20S proteasomes have the potential to keep substrates in store for continual degradation. J Biol Chem. 281 (14), 9569-9575 (2006).
- van Duijn, E., Heck, A. J., Vies, S. M. v. a. n. d. e. r. Inter-ring communication allows the GroEL chaperonin complex to distinguish between different substrates. Protein Sci. 16 (5), 956-965 (2007).
- van Duijn, E. Tandem mass spectrometry of intact GroEL-substrate complexes reveals substrate-specific conformational changes in the trans ring. J Am Chem Soc. 128 (14), 4694-4702 (2006).
- Synowsky, S. A., van Wijk, M., Raijmakers, R., Heck, A. J. Comparative multiplexed mass spectrometric analyses of endogenously expressed yeast nuclear and cytoplasmic exosomes. J Mol Biol. 385 (4), 1300-1313 (2009).
- Sharon, M. Structural organization of the 19S proteasome lid: insights from MS of intact complexes. PLoS Biol. 4 (8), e267-e267 (2006).
- Zhou, M. Mass spectrometry reveals modularity and a complete subunit interaction map of the eukaryotic translation factor eIF3. Proc Natl Acad Sci U S A. 105 (47), 18139-18144 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены