Method Article
구조 질량 분광법에 의해 큰 단백질 단지 분석
요약
질량 분석계는 큰 단백질 단지를 분석하는 데 유용한 도구로 입증되었습니다. 이 방법은 멀티 - subunit 어셈블리의 구성, stoichiometry 및 전반적인 아키텍처에 대한 통찰력을 수 있습니다. 여기, 우리가 설명하는, 단계 단계의 구조 질량 분광법 분석을 수행하고, macromolecular 구조를 특성화하는 방법.
초록
살아있는 세포는 제어 및 동적 다중 단백질 단지 하나의 배열로 자신을 조립 단백질의 다수의 조정 작업을 통해 생물 학적 프로세스를 조절. 다양한 세포 과정의 기계론의 이해를 얻으려면, 그것은 같은 단백질 단지의 구조를 결정하고, 그들의 구조 조직은 그들의 임무를 지시하는 방법 공개하는 데있어 매우 중요합니다. 다중 단백질 단지 중 많은 부분은, 그러나, 그들의 이기종 자연, 비대칭 구조와 역학에 의한 특성화 어렵습니다. 따라서, 새로운 접근은 단백질 조직의 차 수준의 학습이 필요합니다.
macromolecular의 단지를 분석을위한 새로운 구조 생물학 도구 중 하나는 질량 분석계 (MS) 2-5입니다. 이 방법은 복잡한 단백질 구성, subunit의 stoichiometry 및 구조 토폴로지에 대한 정보를 산출. MS의 힘은 그 결과, 낮은 샘플 요구 사항으로, 어떤은 내생 수준에서 표현 단백질 단지의 시험을 가능, 높은 감도에서 유래합니다. 또 다른 장점은 실시간으로 반응 모니터링을 허용 분석의 속도입니다. 또한, 기술은 동시에 공동 기존의 혼합물에서 별도의 인구의 특성을 측정할 수 있습니다.
여기, 우리는 큰 단백질 어셈블리의 분석 구조 MS의 응용 프로그램에 대한 자세한 프로토콜을 설명합니다. 절차는 nanoflow의 전기 분무 이온화 (nESI)에 골드 코팅 모세 혈관의 준비 시작합니다. 그런 다음 한 손으로에서 nESI와 호환되어야하고, 다른 한편으로는 그대로 단지를 유지하도록해야 버퍼 조건을 강조, 샘플 준비를 계속합니다. 우리는 다음 설명, 단계 단계의 높은 질량 측정을위한 실험 조건을 최적화하고 MS와 탠덤 MS 스펙트럼을 획득하는 방법. 마지막으로, 우리는 데이터 처리 및 분석을 수행 차트. 오히려 단백질 어셈블리의 모든 측면을 특징하려고 시도하는 것보다,이 프로토콜은 공유 결합이 아닌 단지에서 MS와 MS / MS 실험의 성능을 사용, 기본적인 MS 절차를 소개합니다. 전반적으로, 우리의 목표는 주요 실험 도구의 지식, 구조 MS 분야와 모르는 연구자를 제공하는 것입니다.
프로토콜
1 부 : nanoflow의 전기 분무 이온화를위한 골드 코팅 모세 혈관의 작성
비 - 공유 결합 단지의 분석은 일반적으로 유리하거나 좋은 팁 (~ 1 μm의 내경)과 전도성 물질로 코팅하는 됐네 석영 모세관 (일반적으로 금색)를 사용하여, nanoflow의 전기 분무 이온화 (nESI) 6에 의해 수행됩니다 . 이러한 모세 혈관이 상용 소스 (뉴 목적 또는 Proxeon)에서 바로 사용하실 수 있습니다, 그러나, 그것은 사내에서 그들을 준비하는 비용 효율적인 수 있습니다 :
- 2cm 분리 배양 접시의 바닥에 양면 접착 패드의 두 스트립을 스틱. 패드 중 하나의 중심에 유리 막대 (8cm X 5mm)를 놓으십시오. 접착제 패드 대신에 모세 혈관을 보유되며, 유리 막대가 준비 모세 혈관을 지원하고, (그림 1) 깨는에서 도움말을 유지합니다.
- (아니. G100TF - 4 우리가 워너 인스 트루먼 트에서 500 얇은 벽 borosilicate 모세 혈관의 팩을 사용, 고양이). borosilicate 유리 모세관, 1.0 mm OD X 0.78 mm ID를 사용. 한 바늘 풀러 (우리가 셔터 악기 주식 회사에서 모델 P - 97을 사용)에 모세관 넣습니다. 그것은 바늘 풀러의 가열 필라멘트의 중심에 놓여 있도록 장소에서 부드럽게 모세를 클램프하고, 위치를 조정합니다. 모세관이 양쪽에서 기업 개최 때까지 부드럽게 클램프를 조인다.
- 미리 정의된 프로그램을 사용하여 모세를 당겨. 가져온 모든 모세관 두 최종 모양의 모세 혈관을 일으키다 것입니다. 허용 팁 모양이 얻을 때까지 풀러 프로그래밍의 과정, 재판 및 - 오류 중 하나입니다. 우리는 다음과 같은 프로그램을 사용 :
단계 열 당기세요 벨 시간 1 750 - 15 80 2 700 - 15 50 3 750 200 20 80 - 악기에서 가져온 모세 혈관을 제거하고 도움말, 폐기 변형하거나 부러진 것을 모든 검사. 배양 접시에있는 모세 혈관을 배치 무딘 핀셋을 (우리가 CK 정밀의 위치 핀셋을 사용), 사용합니다. 모세관의 기본은 접착 패드에 연결되어야하며 상부가 가리키는 팁과 유리 막대 의지해야합니다.
- 일단 페트리 접시는 (10cm 지름의 접시에 80 모세관 맞는 정도) 가득, (우리가없이 모델을 사용합니다. EMS550를 EMS에서) coater의 스퍼터 황금에 플레이트를 삽입합니다. 가스 공급 장치가 (우리가 5 × 10 -2 mbar, 45mA의 전류의 진공 압력, 4 PSI 아르곤 압력을 사용하고의 코팅 시간 제조 업체의 지시에 따라 선택하고, 미리 정의된 코팅주기를 활성화되어 있는지 확인 1 분, 3-6주기 위해 모세 혈관까지) 고르게 황금 있습니다.
2 부 : 샘플 준비
- 시료의 농도가 낮은 micromolar (- 20 μm의 1)가 필요합니다. 필요한 경우, 원심 ultrafiltration 장치 (예 : 팔 Corporation의 Sartorius에서 Vivaspin 또는 NanoSep)를 사용하여 샘플을 집중. 그것은 사용하기 전에, 당신이 장치 막에 단백질 복합의 흡착을 확인하는 것이 좋습니다.
- 종종, 정화 버퍼 또는 단백질의 복잡한 스토리지 솔루션은 휘발성 솔루션을 사용할 수있는 nESI와 호환되지 않습니다. 따라서, 버퍼 교환이 필요합니다. 소금, 버퍼 분자 또는 글리세롤, DTT, 또는 EDTA (에틸렌 다이아 민 테트라 초산)과 같은 다른 비 - 휘발성 부가물의 모든 흔적을 제거하는이 중요한 단계는, 스펙트럼의 품질을 결정합니다. 일반적으로 수성 암모늄 아세테이트 용액은 5 밀리미터 1 M 사이의 농도에서 사용하고 6-8 산도에 있습니다. 버퍼 교환 microcentrifuge의 겔 여과 칼럼 (예, 바이오 - 래드에서 마이크로 바이오 스핀 6 크로마 토그래피 컬럼)를 사용하여 수행할 수 있습니다. 최대한의 교환이 이루어 때까지이 단계는 최소한의 희석 (장치 5 당 1.3의 계수 이하)에 1-3 번 반복 수 있습니다. 농도와 버퍼 교환이 모두 필요한 경우, 이러한 원심 ultrafiltration을 (팔 Corporation의 E, G., Sartorius에서 Vivaspin 또는 NanoSep)를 사용하여 함께 할 수 있습니다.
파트 3 : 높은 질량 측정을위한 질량 분석계를 눈금 보정
다중 단백질 단지에서 실시 실험의 대부분은 나노 전기 분무 quadrupole - 시간의 비행 (Q - ToF) 악기를 사용하여 수행됩니다. 그것은 당신이 높은 M / Z 값이 7,8와 이온의 전송 및 대량 분석을 활성화하기 위해 낮은 주파수 조정 quadrupole 질량 필터를 사용하는 것이 좋습니다. 그것은또한 가스 인레츠 7,8 또는 소매 구는 최초의 진공 단계에서 압력 제어를 사용하려면 첫 번째 이온 가이드의 장비에 추가하는 것이 좋습니다. 후자는 전송의 최적화, 그리고 매우 큰 이온 7-9의 desolvation 수 있습니다. 현재, 상업 ESI - ToF 및 Q - ToF 악기 원래 MS 애플 리케이션을위한 7,8, 비교적 쉽게 그리고 비용 효과적으로 수정할 수있는 여러 제조 업체 (예를 들어, 워터스, SCIEX, Bruker, 또는 애질런트)에서 사용할 수 있습니다. 그것은 가능하지만, 하드웨어 수정 5 필요없이 1 MDA까지 단지에 대한 질량 스펙트럼을 획득하기 위해 LCT 또는 QToF1 (워터스)로 악기에 대한 표준 ToF 또는 QToF 구성을 사용할 수 있습니다.
프로토콜 아래에 설명된은 Synapt 악기 (워터스)에 실시되었습니다.
- 물을 정화에 CSI 100 MG / ML 솔루션을 준비합니다. CSI는 높은 질량 단독 청구 소금 클러스터로 교정 (CSI) N 고사에 사용됩니다 + 393에서 M / Z 자 이상 10,000 (그림 2), 넓은 질량 범위 확장.
- 무딘 핀셋을 사용 Eppendorf의 GeLoader 팁을 사용하여 모세관에 페트리 접시와 CSI 솔루션의 부하 2μL에서 코팅된 모세관을.
- 모세관 홀더에 모세를 삽입하고, 팁 멀리 홀더의 가장자리에서 약 10mm입니다 같은 방법으로 모세관을 조정합니다.
- 수동 모세관의 끝을 향해 솔루션을 슬라이드, 또는 어댑터 아래 스핀을 사용합니다.
- 광학 현미경으로 모세관을 놓고 날카로운 AA 타입 핀셋을 사용하여 팁을 잘라.
- nanoflow 에스 인터페이스 모세관 홀더를 연결합니다. 모세관의 손상을 방지하기 위해 뒤로 XYZ 스테이지를 회전하며, 활성화된 위치로 무대를 누르십시오. 모세는 1을 배치한다 - 콘 구멍에서 10mm.
- 스프레이가 시작될 때까지 모세관 전압 (1050년부터 1400년까지 V)과 낮은 nanoflow 압력 (0.00-0.03 바)를 적용한 다음, 최소 값을 nanoflow 압력을 줄이기 위해 시도합니다.
- XYZ 단계의 위치, 모세관 전압, nanoflow 압력 및 desolvation 가스 흐름을 조정하여 신호 강도를 최적화합니다.
- CSI 최고 시리즈의 다양한 대량 범위를 검색하려면, 가속 전압은 (모세관 1.3-1.7 KV, 샘플 콘 80 150V, 추출 원추 1-3 V 우리가 다음 매개 변수를 사용) 최적화해야합니다.
- 소스 및 분석기 사이의 부드러운 desolvation 조건, 초기 진공 단계에서 백업 압력을 필요로 높은 대량 이온의 전송을 최적화하려면, 제기해야합니다. 이것은 신중하게 부분적으로 격리 밸브 (SpeediValve)을 닫아, 스크롤 펌프에 소스 진공 라인의 전도성을 줄임으로써 얻을 수있다. 신호 강도 (우리가 일반적으로 3.0-6.5 mBar를 사용)에 미치는 영향을 모니터링하면서 최적의 지점을 정의하기 위해서는 후자가 완료되어야합니다.
- M / Z. 15,000 1,000 사이의 M / Z 범위에서 1 스캔 / 초 30에 대한 검사를 수집
- 취득 후, 적절한 교정 테이블을 사용하여 TOF를 보정.
부 4 : 그대로 단백질 단지의 MS 분석
- 당신의 샘플을 부하로 (파트 3, 제 2-5) 설명 및 스프레이를 시작합니다.
- 신호가 감지 때까지 스프레이 초기 최적화 (파트 3, 제 6-9)로 시작합니다. 요금 미국의 정확한 위치는 단백질에 의존되지만, 그것은 따라서 이온 질량 평균 충전 상태 사이의 관계를 이용하여 예측할 수 수 (Z AV) 10 : Z AV = 0.0778 √ (M),있는 m 달톤스에있는 단지의 질량이다. 복잡한 분리를 방지하기 위해, 이온 소스를 가열하지 마십시오 중 히터를 끄고, 또는 40 아래의 온도를 유지 ° C.를
- 모세관 위치, 샘플 원추와 이온 전송을 극대화하기 위해 추출기 전압을 변경할하고 스펙트럼의 결과 변화를 확인하십시오. 1 V, 모세관 전압 1.5 KV : 추출기 콘; 가능한 출발점이 콘 전압 100 V 수 있습니다. nanoflow 압력와 함께 이러한 매개 변수를 최적화합니다.
- desolvation을 개선하고 잔여 물, 버퍼 구성 요소를 제거하기 위해서는 바이어스 전압과 충돌 세포의 가스 압력을 증가. 단지의 분리를 방지하기 위해이 단계는 신중하게 수행해야합니다. 일반적인 바이어스 전압은 10-10 ML / 분 (그림 3)의 함정에 가스 흐름과 함께, 10-100 V의 범위 내에서입니다. RF 설정 및 quadrupole 프로필의 수동 조절이 높은 대량 이온의 전달을 향상시킬 수 있습니다.
- 트랩 및 전송 충돌 에너지를 조정합니다. 종종, 높은 전압은 높은 질량 이온 (보통 10-30 V의 범위 내에서)의 전송을 위해 필요합니다. 이 시점에서, 단지의 충돌 유발 분해를 방지하는 것이 중요합니다.
- 안정적인 신호는 R 후eached, 그것은 안정 스프레이를 유지하면서 nanoflow 압력과 모세관 전압, 최소한의 가치를 감소하는 것이 좋습니다.
제 5 부 : 탄뎀 질량 분광법 : dissociating 단백질 단지
- 최적의 안정적인 신호를 획득되면, 전구체 이온을 선택합니다. 질량 중심과 절연 너비를 (우리가 일반적으로 12 LM 해상도, 13 사이 15 HM 해상도를 사용)로 설정합니다. 높은 질량 / 낮은 요금 분리 제품을 감지하는 다양한 대량 범위를 사용합니다. 그것은 당신이 최대 수준으로 M / Z 범위를 설정할 것을 권장하고 원하는 값으로 그것을 줄일 수있다. 우리는 더 이상 선택 전구체 이온의 고립을 검증하기 위해 MS 및 MS / MS 스펙트럼을 도랑 좋습니다.
- MS / MS를 수행하려면, 충돌 전지에 충돌 에너지 (CE)와 압력을 증가시켜 전구체 이온을 떼어 놓다. 중 트랩을 늘리거나 10 - 20V의 단계에서, 점차 CE를 전송하고, 0-5 ML / 분 (일반적인 값)에 충돌 가스 압력을 제고. 최적 활성 조건까지 스펙트럼의 모니터 변경에 도달합니다. 높은 활성화 에너지는 그대로 복잡한에서 하나 이상의 subunits의 분리를 유발하고, 다른 subunits의 상호 작용 동질성을 명확히 수 있습니다. 무거운 가스 (예 : XE 또는 SF 6) 사용의 혜택이보고되었습니다하지만 우리는 일반적으로 트랩 / 양도 세포에 충돌 가스로 아르곤을 사용하지만, 이러한 가스는 (그림 3) 11 실질적으로 더 비쌉니다.
- 그것은 하나 이상의 충전 상태가 MS / MS 분석을 위해 선택하는 것이 좋습니다. 중복 구성 요소의 경우, 탠덤 MS 스펙트럼의 집합을 취득하면 다른 인구의 요금 시리즈를 해결하는 도움이 될 것입니다. 또한, 높은 요금 상태는 낮은 요금 상태 12와 비교하여보다 쉽게 떼어 놓다 것입니다.
- 손상 단지의 특성 이외에, 그것은 온화한 denaturing 조건 하에서 용액에 작은 subcomplexes가 생성됩니다 것을 제안합니다. subcomplexes의 MS 및 MS / MS 분석은 복잡한 13 subunit 아키텍처를 정의하는 기초를 형성합니다. subunit - subunit 상호 작용의 부분 파괴 들어, 점차적으로 50 % 농도 유기 용제 (예 : 메탄올, 이소프로판올, 또는 acetonitrile)까지 추가하거나, 최대 4 농도 암모니아 또는 개미 산성을 (추가하여 솔루션의 산도를 변경 %).
- 복잡한를 작성할 개별 subunits의 대중을 확인하려면, 그것은 denaturing 조건 하에서 스펙트럼을 습득하는 것이 중요합니다. 이것은 용리 용매로 1퍼센트 개미 산성과 함께, 25:75 물 / acetonitrile 비율로 우편 - 팁에게 C 4 (Millipore)를 사용하여 수행하실 수 있습니다.
6 부 : 데이터 처리 및 분석
- 데이터는 MS 스펙트럼에 대한 스펙트럼 분석 프로그램을 사용하여 오프라인 분석이다. 우리는 일반적으로 MassLynx 프로그램 (워터스)를 사용하십시오.
- 다양한 M / Z 범위에 걸쳐 스펙트럼을 위해, 우리는이 지역의 최대 해상도 차이를 반영하기 위해, 스무딩 및 중심 매개 변수의 서로 다른 제도가 높고 낮은 M / Z 지역에 대해 적용하는 것이 좋습니다.
- 요금 시리즈를 식별하고 충전 상태 및 대중을 계산하려면, MassLynx의 기능이 적용될 수있는 "매뉴얼은 찾기". 중복 구성 요소가 복잡한 대량 스펙트럼의 경우에는 대중의 수동 계산 쉬울 수 있습니다.
- 이러한 할당 프로세스를 촉진하기 위해 추가 소프트웨어가 사용될 수 있습니다, 예를 들면 다음과 같습니다 스펙트럼의 deconvolution 14, 피크 피팅 및 시뮬레이션 15 SOMMS, 그리고 단백질 subcomplexes의 조성과 stoichiometry를 지정하고 단백질 상호 작용 네트워크 13,16,17 생성을위한 정상 회담을위한 MaxEnt .
7 부 : 대표 결과

그림 1. 골드 코팅 나노 전기 분무 모세 혈관을 준비.
A.는 2cm 간격, 페트리 접시에 두 양면 접착 스트립을 연결합니다. 준비된 모세 혈관을 지원하기 위해, B.는 접착 패드로 준비 모세 혈관의 뭉툭한 끝을 스틱. 패드 중 하나의 중심에 유리 막대 (8cm X 5mm)를 장소, 유리 막대에있는 팁을 기대다. C. 금 박막이 균일 모세 혈관의 외부 표면에 입금 때까지 페트리 접시가 금을 준비 모세 혈관, 외투 그들과 함께 가득되면.
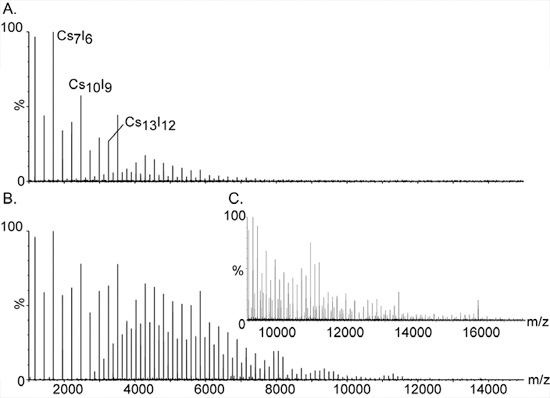
그림 2. 세슘 요오드화물 이온을 사용하여 높은 질량 교정.
CSI의 크고 monisotopic 클러스터는 높은 대량 분석을위한 질량 분광계를 보정에 대한 선택의 화합물 만들었습니다. 동등 간격 봉우리 시리즈는 M / Z 393에서 잘 이상의 10,000, 넓은 범위의 확장. 그들은 assig 아르네드은 홀로 일반적인 구성 (CSI) N 고사 +의 소금 클러스터를 청구합니다. 주요 봉우리 사이에 추가적인 신호가 시리즈의 더블 및 트리플 요금 종로 인해 발생하는, [(CSI) N CS2] 2 +와 3 +, 각각 [(CSI) N CS3]. 초기 진공 단계에서 압력을 증가하면 높은 대량 클러스터를 검출 필수적입니다. 높은 질량 피크 압력의 효과는 패널의 시연이다. 그리고 B. 각각 1.2와 5.3의 압력 readbacks와 함께. C. 질량 스펙트럼의 확장 B에 표시됩니다.
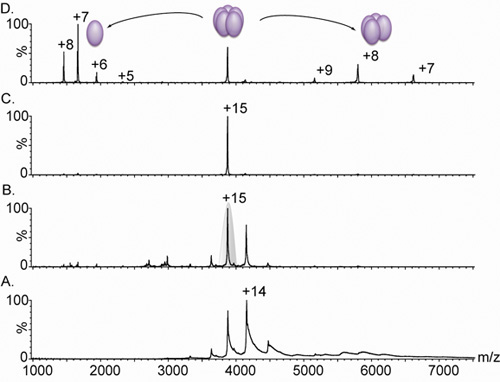
그림 3. pentameric 렉틴과의 Nanoflow 전기 분무 질량 스펙트럼.
렉틴과 변형 복합 A. 질량 분석법은 (감독 진화 18로 Lib1 - B7에서 파생된) 3,000 5,000 M / Z 사이의 충전 상태 배포판에 상승을 제공하지만, 이온의 불충 분한 desolvation 때문에 봉우리 넓은 있습니다. 패널 A.와 B. 비교 (B.) 최대 너비에 15V로 4V (.)의 바이어스 전압을 증가의 효과를 보여줍니다. 가속 조건이 증가 고도 해결 스펙트럼을 항복, 잔여 물, 버퍼 구성 요소의 스트립을 초래합니다. 측정 질량 (60,240 ± 38 다)는 pentameric 복잡한에 해당합니다. C. 15 충전 상태가 다음 탠덤 MS 분석 (패널 B에 회색으로 음영.) D에 대한 선정되었습니다. 충돌 에너지의 증가는 5000의 범위에서 1천6백64미터 / Z 중심이 높은 충전 단량체, 그리고 송두리째 tetrameric 복합의 석방을 원인 - 8,000미터 / Z.을 모든 검사 결과는 0.5M 아세트산 암모늄의 용액 20 μm의를 포함하는 샘플에서 얻은되었습니다.
토론
취득 고품질의 스펙트럼의 주목은 샘플 농도와 버퍼 교환을 포함하는 샘플 준비 단계에 부여해야합니다. 희석 샘플 이상의 고농도 샘플이 다소 점성 수있는 반면, 낮은 신호를 항복하고, 전기 분무의 바늘을 차단합니다. 또한, 이러한 염분, 글리세롤, 세제, 금속 이온, 그리고 감소 대리인 (DTT 또는 β - 메르 캅 토 에탄올)와 같은 솔루션 첨가제는 단백질의 외부 표면을 고수하는 경향, 그리고 봉우리의 확대 원인. 따라서, 잘 해결 봉우리를 달성하기 위해 이러한 구성 요소는 가능한 가장 낮은 농도에 추가되어야합니다.
또 다른 주요 매개 변수는 질량 분석계 오리피스에 상대적으로 모세관 nanoflow의 위치입니다. "스위트 스폿"을 찾는 것은 미숙한 사용자를위한 도전 수도 있습니다, 그럼에도 불구하고, 그것은 상당히 스펙트럼의 품질에 영향을 미칩니다. nanoflow 전에 스프레이 개시에 모세관 검사하는 것도 중요하다. 소적 크기는 ~ 1μm되어야 팁 직경의 기능입니다. 작은 방울은보다 효율적인 이온화로 연결하고, 따라서 유리한 것입니다. 그 흐름을 차단 할 수있는 모세관 내에 기포가가 없다는 것을 확인하는 것도 중요하고, 골드 코팅은 취득시 모세관에서 제거 아니라는 것을, 그렇다면, 추가로 팁을 잘라. 샘플의 과도한 금액에는 모세관 전압, 가속 전압, 압력, 충돌 에너지로 최적화 MS 조건의 가능성을 증가는 점에 유의하십시오.
전체 프로토콜에 설명되어있는 절차는 수많은 단백질 단지의 조성, stoichiometry 및 아키텍처 (리뷰 2,3,4 참조)를 결정하는 데 사용되었습니다. 같은 ribosome 19과 같은 대형 MDA의 단지 고도 주문 바이러스 capsids 20-22의 분석 분자 기계 23-25, 또는 subunit 상호 작용 네트워크의 특성에 바인딩 기판 정의에 26,17,16,17,27,28는 역할을 하지만이 방법의 가치의 몇 가지 예입니다.
공개
감사의 말
저자는 자신의 중요한 검토하고, 원고들의 공헌에 대한 샤론 그룹 회원 주셔서 감사합니다. 우리는 Morasha과 Bikura 프로그램, 이스라엘 과학 재단 (부여 Nos. 1823년에서 1807년까지과 378/08), Biomembrane 연구 조셉 콘 미네르바 센터, 뉴 과학자 Chais 가족 펠로 프로그램, 아브라함의 지원 감사 그리고 소니아 Rochlin 재단, 울프슨 가족 자선 신탁, 헬렌과 Biomolecular 구조 및 조립에 밀튼 A. Kimmelman 센터, Shlomo와 사빈 Beirzwinsky의 부동산, Meil 드 Botton 앤슬리, 그리고 카렌 심, 영국. 우리는 우리에게 렉틴 변형 샘플을 줘서 댄 타픽 및 Itamar Yadid에게 감사하고 있습니다.
자료
샘플 요구 사항 :
| 견본 | 요구 사항 | 댓글 |
| 음량 | 1-2 μL | 모세관 당 |
| 집중 | 1 - 20μM | 복잡한 당 |
| 버퍼 | 산도에서 같은 암모늄 아세테이트로 Aquanos 휘발성 버퍼 = 6-8 | 일반적으로 5 MM - 1M |
| 세제 | 최소의 | 세제 분자의 클러스터는 광범위하고 해결되지 않은 봉우리를 생산 |
| 글리세린 | 최소 (최대 5 %) | nonspecifically 단백질을 준수하며, 따라서, 넓은 봉우리가 관찰 |
| 유기 용제 | 최대 50 % | 단백질에게 단지를 변성 수 |
| 지방산 | 최대 4 %로 | 변성 단백질 단지 |
| 염류 | 최소의 | 소금 부가물는 광범위하고 해결되지 않은 봉우리로 연결 |
| DTT | 최소의 | 1-2 μm의 현재 수 |
| Chelating 요원 | 최소의 | 250 μm의 위 광범위한 adduct 형성으로 이어질 |
참고문헌
- Alberts, B. The cell as a collection of protein machines: preparing the next generation of molecular biologists. Cell. 92 (3), 291-294 (1998).
- Benesch, J. L., Ruotolo, B. T., Simmons, D. A., Robinson, C. V. Protein complexes in the gas phase: technology for structural genomics and proteomics. Chem Rev. 107 (8), 3544-3567 (2007).
- Heck, A. J. Native mass spectrometry: a bridge between interactomics and structural biology. Nat Methods. 5 (11), 927-933 (2008).
- Sharon, M., Robinson, C. V. The role of mass spectrometry in structure elucidation of dynamic protein complexes. Annu Rev Biochem. 76, 167-193 (2007).
- Hernandez, H., Robinson, C. V. Determining the stoichiometry and interactions of macromolecular assemblies from mass spectrometry. Nat Protoc. 2 (3), 715-726 (2007).
- Wilm, M., Mann, M. Analytical properties of the nanoelectrospray ion source. Analytical Chemistry. 68 (1), 1-8 (1996).
- Sobott, F. A tandem mass spectrometer for improved transmission and analysis of large macromolecular assemblies. Anal Chem. 74 (6), 1402-1407 (2002).
- van den Heuvel, R. H. Improving the performance of a quadrupole time-of-flight instrument for macromolecular mass spectrometry. Anal Chem. 78 (21), 7473-7483 (2006).
- Chernushevich, I. V., Thomson, B. A. Collisional cooling of large ions in electrospray mass spectrometry. Anal Chem. 76 (6), 1754-1760 (2004).
- Mora, d. e. l. a., J, . Electrospray ionization of large multiply charged species proceeds via Dole s charged residue model. Anal Chim Acta. 406, 93-104 (2000).
- Lorenzen, K. Optimizing macromolecular tandem mass spectrometry of large non-covalent complexes using heavy collision gases. Int J Mass Spectrom. 268, 198-206 (2007).
- Benesch, J. L. Quadrupole-time-of-flight mass spectrometer modified for higher-energy dissociation reduces protein assemblies to peptide fragments. Anal Chem. 81 (3), 1270-1274 (2009).
- Taverner, T. Subunit architecture of intact protein complexes from mass spectrometry and homology modeling. Acc Chem Res. 41 (5), 617-627 (2008).
- Ferrige, A. G., Seddon, M. J., Skilling, J., Ordsmith, N. The application of MaxEnt to high resolution mass spectrometry. Mass Spectrom. 6, 765-770 (1992).
- van Breukelen, B., Barendregt, A., Heck, A. J., van den Heuvel, R. H. Resolving stoichiometries and oligomeric states of glutamate synthase protein complexes with curve fitting and simulation of electrospray mass spectra. Rapid Commun Mass Spectrom. 20 (16), 2490-2496 (2006).
- Sharon, M. Symmetrical modularity of the COP9 signalosome complex suggests its multifunctionality. Structure. 17 (1), 31-40 (2009).
- Hernandez, H. Subunit architecture of multimeric complexes isolated directly from cells. EMBO Rep. 7 (6), 605-610 (2006).
- Yadid, I., Tawfik, D. S. Reconstruction of functional beta-propeller lectins via homo-oligomeric assembly of shorter fragments. J Mol Biol. 365 (1), 10-17 (2007).
- Videler, H. Mass spectrometry of intact ribosomes. FEBS Lett. 579 (4), 943-947 (2005).
- Uetrecht, C. High-resolution mass spectrometry of viral assemblies: molecular composition and stability of dimorphic hepatitis B virus capsids. Proc Natl Acad Sci U S A. 105 (27), 9216-9220 (2008).
- Uetrecht, C. Stability and shape of hepatitis B virus capsids in vacuo. Angew Chem Int Ed Engl. 47 (33), 6247-6251 (2008).
- Morton, V. L., Stockley, P. G., Stonehouse, N. J., Ashcroft, A. E. Insights into virus capsid assembly from non-covalent mass spectrometry. Mass Spectrom Rev. 27 (6), 575-595 (2008).
- Sharon, M. 20S proteasomes have the potential to keep substrates in store for continual degradation. J Biol Chem. 281 (14), 9569-9575 (2006).
- van Duijn, E., Heck, A. J., Vies, S. M. v. a. n. d. e. r. Inter-ring communication allows the GroEL chaperonin complex to distinguish between different substrates. Protein Sci. 16 (5), 956-965 (2007).
- van Duijn, E. Tandem mass spectrometry of intact GroEL-substrate complexes reveals substrate-specific conformational changes in the trans ring. J Am Chem Soc. 128 (14), 4694-4702 (2006).
- Synowsky, S. A., van Wijk, M., Raijmakers, R., Heck, A. J. Comparative multiplexed mass spectrometric analyses of endogenously expressed yeast nuclear and cytoplasmic exosomes. J Mol Biol. 385 (4), 1300-1313 (2009).
- Sharon, M. Structural organization of the 19S proteasome lid: insights from MS of intact complexes. PLoS Biol. 4 (8), e267-e267 (2006).
- Zhou, M. Mass spectrometry reveals modularity and a complete subunit interaction map of the eukaryotic translation factor eIF3. Proc Natl Acad Sci U S A. 105 (47), 18139-18144 (2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유