Method Article
L'analyse des complexes protéiques par spectrométrie de masse Grande structurels
Dans cet article
Résumé
La spectrométrie de masse s'est avérée être un outil précieux pour l'analyse des complexes protéiques importants. Cette méthode permet un aperçu de l'architecture composition, la stoechiométrie et générale de la multi-unité assemblées. Ici, nous décrivons, étape par étape, comment réaliser une analyse par spectrométrie de masse structurel, et de caractériser des structures macromoléculaires.
Résumé
Les cellules vivantes contrôler et réguler leurs processus biologiques à travers l'action coordonnée d'un grand nombre de protéines qui s'assemblent en un tableau de dynamique, complexes multi-protéiques 1. Pour acquérir une compréhension mécaniste de divers processus cellulaires, il est crucial de déterminer la structure des complexes protéiques tels, et de révéler comment leur organisation structurelle dicte leur fonction. De nombreux aspects de complexes multi-protéiques sont, cependant, difficile à caractériser, en raison de leur nature hétérogène, la structure asymétrique et dynamique. Par conséquent, de nouvelles approches sont nécessaires pour l'étude des niveaux de l'enseignement supérieur de l'organisation des protéines.
Un des outils émergents pour l'analyse de la biologie structurale des complexes macromoléculaires est la spectrométrie de masse (MS) 2-5. Cette méthode donne des informations sur la composition des protéines complexes, stoechiométrie sous-unité, et la topologie structurelle. La puissance de MS vient de sa grande sensibilité et, en conséquence, l'exigence de l'échantillon, ce qui permet l'examen des complexes de protéines exprimées à des niveaux endogènes. Un autre avantage est la vitesse d'analyse, qui permet le suivi des réactions en temps réel. Par ailleurs, la technique peut mesurer simultanément les caractéristiques des populations distinctes qui coexistent dans un mélange.
Ici, nous décrivons un protocole détaillé pour l'application des réformes structurelles MS pour l'analyse des assemblages de protéines. La procédure commence par la préparation de l'or à revêtement capillaires pour l'ionisation electrospray nanodébit (NESI). Il continue ensuite avec la préparation des échantillons, en insistant sur les conditions de tampon qui doit être compatible avec NESI d'une part, et permettre de maintenir intactes les complexes de l'autre. Nous expliquerons ensuite, étape par étape, comment optimiser les conditions expérimentales pour des mesures de masse à haute et à acquérir MS et MS tandem spectres. Enfin, nous traçons le traitement des données et des analyses qui suivent. Plutôt que de tenter de caractériser tous les aspects des assemblages de protéines, ce protocole introduit les procédures de base MS, permettant des performances d'expériences MS et MS / MS sur de complexes non covalents. Globalement, notre objectif est de fournir aux chercheurs connaissent pas le domaine de la structure MS, avec une connaissance des principaux outils expérimentaux.
Protocole
Partie 1: Préparation d'or enrobées de capillaires pour électronébulisation nanodébit
Analyse des complexes non covalents est généralement effectuée au moyen d'ionisation électrospray nanodébit (NESI) 6, utilisant le verre ou le quartz capillaires qui ont été tiré à une pointe fine (diamètre ~ 1 um interne), et revêtues d'un matériau conducteur (généralement en or) . Ces capillaires sont disponibles prêtes à l'utilisation de sources commerciales (nouvel objectif ou Proxeon); cependant, il peut être plus rentable pour les préparer en interne:
- Aide de deux bandes d'un tampon adhésif double-face pour le fond d'une boîte de Pétri, 2 cm de distance. Placez une baguette de verre (8 cm x 5 mm) dans le centre de l'un des pads. Le tampon adhésif tiendra les capillaires en place, et la tige de verre soutiendra le prêt capillaires, et gardez les conseils de rupture (Fig. 1).
- Utilisez capillaires en verre borosilicate, 1,0 mm x 0,78 mm di OD (nous utilisons des paquets de 500 capillaires minces parois de borosilicate de Warner Instruments, cat. Aucune. G100TF-4). Insérer un capillaire dans l'extracteur d'aiguilles (nous utilisons le modèle P-97 de la Cie Sutter Instrument). Pince capillaire délicatement en place, et d'ajuster sa position afin qu'elle se trouve dans le centre de filament chauffant l'aiguille extracteur. Serrer les colliers doucement, jusqu'à ce que le capillaire est tenu ferme aux deux extrémités.
- Tirez le capillaire, en utilisant un programme prédéfini. Chaque capillaire tiré donnera lieu à deux finales, en forme de capillaires. Le processus de programmation de l'extracteur est l'un des essais-erreurs, jusqu'à une forme de la pointe acceptable est obtenue. Nous utilisons le programme suivant:
Étape Chaleur Tirez Vell Temps 1 750 - 15 80 2 700 - 15 50 3 750 200 20 80 - Retirez les capillaires tiré de l'instrument et d'inspecter les conseils, en écartant celles qui sont déformées ou cassées. Utilisez une pince à épiler contondants (nous utilisons une pince à épiler de précision de positionnement de CK), de placer les capillaires dans la boîte de Pétri. La base de la capillarité doit être joint à la bande adhésive et la partie supérieure doit s'appuyer sur la tige de verre, avec la pointe dirigée vers le haut.
- Une fois la boîte de Pétri est pleine (environ 80 capillaires dans un ajustement de 10 cm de diamètre vaisselle), insérez la plaque dans l'or par pulvérisation coucheuse (nous utilisons le modèle non. EMS550, d'EMS). Assurez-vous que l'alimentation en gaz est choisi selon les instructions du fabricant, et d'activer un cycle de revêtement prédéfinies (on utilise la pression d'Argon 4 psi, à une pression à vide de 5 x 10 -2 mbar, un courant de 45mA, et un temps de revêtement de 1 min, pour les 3-6 cycles, jusqu'à ce que les capillaires sont uniformément dorés).
Partie 2: Préparation des échantillons
- Faibles concentrations micromolaires de l'échantillon sont nécessaires (1 - 20 uM). Si nécessaire, concentrer l'échantillon en utilisant des dispositifs d'ultrafiltration centrifuge (par exemple, Vivaspin de Sartorius, ou Nanosep de Pall Corporation). Il est recommandé de vérifier l'adsorption du complexe protéique de la membrane périphérique, avant de l'utiliser.
- Souvent, les tampons de purification ou de solutions de stockage du complexe protéique sont pas compatibles avec Nesi, pour lesquels seules des solutions volatiles peuvent être utilisés. Par conséquent, l'échange de tampon est nécessaire. Cette étape cruciale, dans laquelle toutes les traces de sels, les molécules de tampon ou de tout autre non-volatile adduits tels que la glycérine, la TNT, ou de l'EDTA sont enlevés, qui détermine la qualité des spectres. Habituellement, une solution aqueuse d'acétate d'ammonium est utilisé à une concentration comprise entre 5 mm et 1 M, et le pH à 6-8. Tampon d'échange peut être effectué en utilisant une colonne de filtration sur gel microcentrifugeuse (par exemple, Micro Bio-Spin 6 colonnes de chromatographie, de Bio-Rad). Cette étape peut être répétée 1-3 fois avec une dilution minimale (moins d'un facteur de 1,3 par dispositif 5), jusqu'à l'échange maximal est atteint. Si la concentration et l'échange de tampon sont requises, elles peuvent faire ensemble, en utilisant l'ultrafiltration centrifuge (e, g., Vivaspin de Sartorius, ou Nanosep de Pall Corporation).
Partie 3: Etalonnage du spectromètre de masse pour des mesures de masse à haute
La plupart des expériences menées sur complexes multi-protéiques sont réalisées en utilisant une électronébulisation nano-quadripolaire à temps de vol (Q-TOF) instrument. Il est suggéré que vous utilisez un filtre de masse quadripolaire ajusté pour les basses fréquences, afin de permettre la transmission et l'analyse de masse d'ions à haute valeurs m / z 7,8. Il estégalement recommandé que les entrées de gaz ou de 7,8 manches 9 soit ajouté à l'instrument dans le guide d'ions d'abord, pour permettre le contrôle de pression à l'étape du premier aspirateur. Ce dernier permet d'optimiser la transmission et désolvatation des ions très grandes 7-9. Actuellement, commercial ESI-TOF et Q-ToF instruments sont disponibles auprès de plusieurs fabricants (par exemple, les eaux, SCIEX, Bruker, ou Agilent) qui peut être modifié relativement facilement et à moindre coût, pour les applications MS natif 7,8. Il est possible, cependant, d'utiliser les configurations standard ToF ou QToF sur des instruments tels que LCT ou QToF1 (Waters) d'acquérir des spectres de masse pour des complexes jusqu'à 1 MDa, sans avoir besoin de 5 modifications matérielles.
Le protocole décrit ci-dessous a été réalisée sur un instrument Synapt (Waters).
- Préparer 100 mg / ml solution de CsI dans l'eau purifiée. CSI est utilisé pour l'étalonnage de masse élevée que les amas de sel une seule charge, (Csl) n Cs + s'étendre sur une gamme de masse de large, de 393 m / z à plus de 10 000 (fig. 2).
- En utilisant une pince à épiler émoussé, prenez un capillaire revêtu de la boîte de Pétri et 2μL la charge de la solution de CsI dans le capillaire, en utilisant une astuce GeLoader Eppendorf.
- Insérez le tube capillaire dans le porte-capillaire, et ajuster le capillaire de telle manière que la pointe est d'environ 10 mm du bord de la titulaire.
- Glissez la solution vers l'extrémité du capillaire soit manuellement, soit en utilisant un adaptateur de spin down.
- Placer le capillaire sous un microscope optique et de l'assiette de la pointe, en utilisant la forte de type AA pincettes.
- Connectez le support capillaire à l'interface ES nanodébit. Tournez la scène xyz vers l'arrière pour éviter d'endommager le capillaire, et pousser la scène dans sa position activée. Le capillaire doit être placé 1 - 10 mm de l'orifice du cône.
- Appliquer la tension capillaire (1050-1400 V) et la pression nanodébit faible (0.00 à 0,03 bar) jusqu'à ce spray est lancé, puis essayez de réduire la pression nanodébit à une valeur minimale.
- Optimiser l'intensité du signal en ajustant la position de l'étape de XYZ, la tension capillaire, la pression nanodébit, et le débit de gaz de désolvatation.
- Pour détecter une large gamme de masse du Csl pic de série, les tensions accélération doit être optimisé (nous utilisons les paramètres suivants: 1.3 à 1.7 kV capillaires, cône échantillon de 80-150V, l'extraction cône 1-3 V).
- Afin d'optimiser la transmission des ions de masse élevée, qui nécessitent des conditions de désolvatation doux, la pression soutien dans la phase initiale de vide, entre la source et l'analyseur, doit être soulevée. Ceci peut être réalisé en prenant soin de réduire la conductance de la ligne de source de vide à la pompe à défiler, en fermant partiellement la vanne d'isolement (SpeediValve). Afin de définir le point optimal, ce dernier devrait être fait tout en surveillant l'effet sur l'intensité du signal (nous utilisons habituellement de 3,0 à 6,5 mbar).
- Recueillir environ 30 balayages à une scans / seconde, à une gamme de m / z compris entre 1.000 à 15.000 m / z.
- Après l'acquisition, de calibrer le TOF utilisant la table d'étalonnage appropriée.
Partie 4: analyse des MS de complexes protéiques intacts
- Chargez votre échantillon, tel que décrit (Partie 3, articles 2-5), et d'initier de pulvérisation.
- Commencez par l'optimisation initiale de la pulvérisation (Partie 3, articles 6-9), jusqu'à ce que le signal est détecté. La position exacte des états de charge est une protéine dépendante, mais elle peut être prédit, en utilisant la relation entre la masse d'ions et de l'état de charge moyenne, ainsi: (Z AV) 10: Z = 0,0778 √ AV (m), dans laquelle m est la masse du complexe en Daltons. Pour empêcher la dissociation complexes, ne chauffez pas la source d'ions: soit passer le radiateur, ou maintenir la température inférieure à 40 ° C.
- Variez la position capillaire, cône de l'échantillon et les tensions d'extraction pour maximiser la transmission d'ions, et vérifier le changement résultant dans les spectres. Un point de départ possible pourrait être cônes de tension de 100 V; extracteur de cône: 1 V, tension capillaire 1,5 kV. D'optimiser ces paramètres, en combinaison avec la pression nanodébit.
- Afin d'améliorer la désolvatation et la bande hors de l'eau résiduelle et les composants de tampon, d'augmenter la tension de polarisation et de la pression du gaz dans la cellule de collision. Cette étape doit être effectuée avec soin, pour empêcher la dissociation du complexe. Tensions de polarisation typiques sont dans la fourchette de 10-100 V, avec un débit de gaz piège de 1-10 ml / min (Fig. 3). Réglage manuel de la mise en RF et le profil quadripôle peut améliorer la transmission des ions de masse élevée.
- Ajustez Trap et énergies de collision de transfert. Souvent, des tensions plus élevées sont nécessaires pour la transmission des ions de masse élevée (habituellement dans la gamme de 10-30 V). À ce stade, il est important d'éviter une collision provoquée par la dissociation du complexe.
- Après un signal stable est reached, il est recommandé que la pression et la tension capillaire nanodébit être réduite à des valeurs minimales, tout en conservant de pulvérisation stable.
Partie 5: spectrométrie de masse en tandem: dissocier les complexes protéiques
- Une fois un signal optimal et stable a été obtenue, sélectionnez un ion précurseur. Placer le centre de masse et la largeur d'isolement (nous utilisons généralement une résolution de 12 LM, et une résolution HM entre 13 et 15). Utiliser une gamme de masse large pour détecter la masse élevée / faible charge de produits de dissociation. Il est recommandé de définir la gamme de m / z pour le niveau maximum, puis de le réduire à la valeur désirée. Nous suggérons en outre de superposer la MS et MS / MS spectres, pour valider l'isolement de l'ion précurseur choisi.
- Pour effectuer MS / MS, dissocier l'ion précurseur en augmentant l'énergie de collision (CE) et la pression sur la cellule de collision. Augmenter ou Piège ou de transfert CE progressivement, par paliers de 10-20V, et d'élever la pression du gaz de collision à 0-5 ml / min (valeurs communes). Surveiller les changements dans les spectres que les conditions optimales d'activation est atteint. Énergie d'activation élevée peut provoquer la dissociation d'un ou plusieurs sous-unités du complexe intact, et de clarifier les affinités d'interaction des différentes sous-unités. Nous utilisons généralement de l'argon comme gaz de collision dans les cellules piège / de transfert, bien que les avantages d'utiliser un plus lourd de gaz (par exemple, Xe ou SF 6) ont été rapportés, cependant, ces gaz sont nettement plus coûteux 11 (Fig. 3).
- Il est recommandé que plus d'un état de charge sera sélectionnée pour MS / MS. Dans le cas de composants qui se chevauchent, l'acquisition d'un ensemble de spectres MS tandem va aider à résoudre la série de charge des différentes populations. Par ailleurs, des états de charge plus élevée va se dissocier plus facilement, par rapport à des états de charge inférieure 12.
- En plus de la caractérisation du complexe intact, il est suggéré que les petits sous-complexes en solution sera généré, sous conditions dénaturantes douces. Les analyses MS et MS / MS de sous-complexes forment la base pour définir l'architecture sous-unité du complexe de 13. Pour rupture partielle de la sous-unité-unité des interactions, ajouter graduellement des solvants organiques (méthanol par exemple, l'isopropanol, ou l'acétonitrile) à une concentration de 50%, ou de changer le pH de la solution par addition d'ammoniaque ou d'acide formique (jusqu'à une concentration de 4 %).
- Afin de déterminer les masses des unités individuelles qui composent le complexe, il est important d'acquérir un spectre dans des conditions dénaturantes. Ceci peut être réalisé en utilisant Zip-Tip C 4 (Millipore) avec un 25/75 d'eau / acétonitrile ratio, avec l'acide formique 1% comme solvant d'élution.
Partie 6: traitement et analyse des données
- Les données sont analysées hors ligne, en utilisant une analyse spectrale des programmes pour MS spectres. Nous utilisons normalement le programme MassLynx (Waters).
- Pour les spectres qui couvrent une large gamme de m / z gamme, nous recommandons que différents régimes de lissage et de paramètres centroïde être appliquées pour la haute et basse de m / z régions, afin de refléter la différence de résolution de pointe de ces régions.
- Pour identifier les séries de charge et de calculer des états de charge et des masses, le «manuel trouver" fonction de MassLynx peut être appliquée. Dans le cas des spectres de masse avec des composants complexes qui se chevauchent, le calcul manuel des masses peut être plus facile.
- Pour faciliter ces processus d'affectation, des logiciels supplémentaires peuvent être utilisés, par exemple: pour la déconvolution des spectres MaxEnt 14, pour le montage de pointe SOMMS et simulation 15, et d'assigner SOMMET la composition et la stoechiométrie des sous-complexes de protéines et de générer des réseaux d'interactions protéiques 13,16,17 .
Partie 7: Résultats Représentant

Figure 1. Préparation recouvert d'or nano-electrospray capillaires.
A. Fixez les deux bandes adhésives double face à une boîte de Pétri, 2 cm de distance. Pour soutenir le prêt capillaires, placer une tige de verre (8 cm x 5 mm) dans le centre de l'un des pads. B. bâton l'extrémité émoussée de l'préparées capillaires de la bande adhésive, et penchez la pointe sur la tige de verre. C. Une fois la boîte de Pétri est rempli avec le prêt capillaires, les enduire avec de l'or jusqu'à ce qu'une fine pellicule d'or est uniformément déposée sur la surface externe des capillaires.
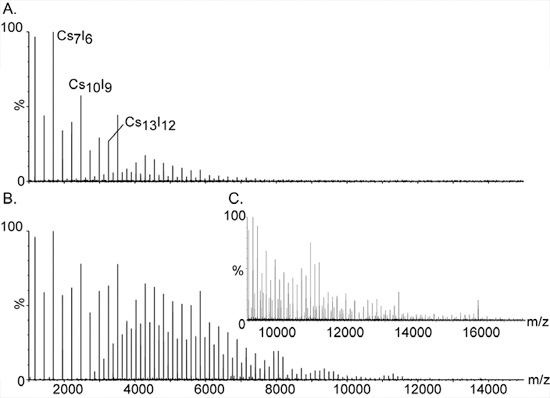
Figure 2. Étalonnage de masse haute en utilisant des ions iodure de césium.
Les grandes grappes et monisotopic du Csl ont fait le choix de composé de l'étalonnage des spectromètres de masse pour l'analyse de la grand'messe. La série de pics équidistants s'étendent sur une large gamme, de m / z 393 à plus de 10.000. Ils sont assignatslable à une seule charge les clusters sel de la composition générale (Csl) n Cs +. Signaux supplémentaires entre les pics majeurs sont causés par les espèces à double et triple charge de la série; [(CsI) n Cs2] 2 + et [(CsI) n Cs3] 3 +, respectivement. Augmenter la pression à l'étape initiale de vide est essentielle pour détecter les grappes de masse élevée. L'effet de la pression sur les pics de masse élevée est démontrée dans Panneaux A. et B. avec des relectures de pression de 1,2 et 5,3, respectivement. C. Extension du spectre de masse montre à B.
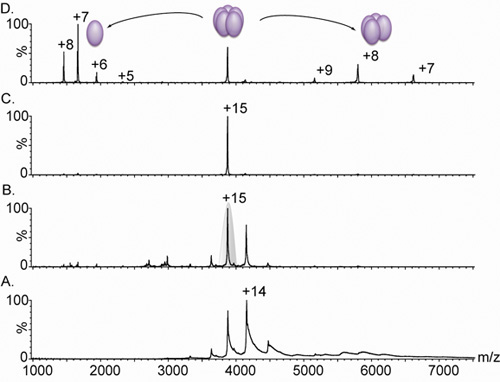
Figure 3. Spectres de masse electrospray nanodébit d'une lectine pentamérique.
A. La spectrométrie de masse d'un complexe lectine variante (dérivé de LIB1-B7 par évolution dirigée 18) donne lieu à un état de charge distributions entre 3.000 et 5.000 m / z; cependant, en raison de l'insuffisance désolvatation des ions, les pics sont larges. Comparaison du panneau A. et B. montrent l'effet d'augmenter la tension de polarisation de 4V (A). À 15V (B.) Sur la largeur du pic. Cette augmentation dans des conditions de l'accélération provoque le décapage de l'eau résiduelle et les composants mémoire tampon, ce qui donne un spectre à haute résolution. La masse mesurée (60 240 ± 38 Da) correspond à un complexe pentamérique. C. L'état de charge 15 a ensuite été sélectionné pour le tandem MS analyse (en gris dans le groupe B). D. L'augmentation de l'énergie de collision provoque la libération d'un monomère très chargé, centré à 1664 m / z, et un complexe tétramérique dépouillé, dans la gamme des 5000 - 8000 m / z. Tous les spectres ont été obtenus à partir d'un échantillon contenant 20 uM de solution dans l'acétate d'ammonium 0.5M.
Discussion
Pour acquérir la qualité de haute attention de spectres devrait être donnée à des étapes de préparation d'échantillons, qui incluent la concentration de l'échantillon et l'échange de tampon. Plus les échantillons dilués donnera un signal faible, tandis que les échantillons très concentrés peuvent être assez visqueux, et de bloquer l'aiguille d'électronébulisation. Par ailleurs, des additifs tels que les sels solution de glycérol, les détergents, les ions métalliques, et des agents réducteurs (TNT ou β-mercaptoéthanol), ont tendance à adhérer à la surface externe des protéines, et provoquer un élargissement des pics. Par conséquent, afin d'atteindre des pics bien résolu, ces éléments devraient être ajoutés à la plus faible concentration possible.
Un autre paramètre clé est la position de la nanodébit capillaire, par rapport à l'orifice du spectromètre de masse. Trouver le "sweet spot" pourrait être difficile pour les utilisateurs inexpérimentés, et pourtant, elle influence considérablement la qualité des spectres. Il est également important d'examiner les nanodébit capillaires avant le début de la pulvérisation. La taille des gouttelettes est une fonction du diamètre pointe, qui devrait être ~ 1 um. De petites gouttelettes conduire à ionisation plus efficace, et serait donc avantageux. Il est également important de valider qu'il n'ya pas de bulles d'air dans le capillaire qui pourrait bloquer l'écoulement, et que le revêtement d'or n'est pas dépouillé du capillaire lors de l'acquisition, si oui, encore couper la pointe. Gardez à l'esprit qu'une quantité excessive de l'échantillon sera d'accroître la possibilité d'optimiser les conditions de MS tels que la tension capillaire, tensions d'accélération, la pression et l'énergie de collision.
Globalement, les procédures expliquées dans le protocole ont été utilisées pour déterminer la composition, la stoechiométrie et l'architecture des complexes protéiques de nombreux (voir avis 2,3,4). Analyse des complexes MDa grande envergure comme le ribosome et 19 capsides de virus hautement ordonné 20-22, dans la définition de liaison du substrat à des machines moléculaires 23-25, ou la caractérisation des réseaux d'interactions sous-unité 26,17,16,17,27,28 servir mais quelques exemples de la valeur de cette approche.
Déclarations de divulgation
Remerciements
Les auteurs remercient les membres du groupe de Sharon pour leur examen critique, et pour leur contribution au manuscrit. Nous sommes reconnaissants de l'appui des programmes et des Morasha Bikura, l'Israel Science Foundation (Grant 378/08 et n ° 1823-1807), Josef Cohn Minerva Centre de recherche biomembrane, la famille Chais Fellows Program pour les nouveaux chercheurs, l'Abraham et Sonia Rochlin Fondation Trust Wolfson famille de bienfaisance, le Helen et Milton A. Kimmelman Center for Structure biomoléculaire et de l'Assemblée; la succession de Shlomo et Sabine Beirzwinsky; Meil de Botton Aynsley, et Karen Siem, Royaume-Uni. Nous sommes reconnaissants à Dan Tawfik et Itamar Yadid de nous donner l'exemple de variante de la lectine.
matériels
Exigences de l'échantillon:
| Exemple | Exigence | Commentaires |
| Volume | 1-2 uL | Par capillarité |
| Concentration | 1-20μM | Par complexe |
| Tampon | Aquanos tampons volatils tels que l'acétate d'ammonium à pH = 6-8 | Typiquement 5 mm-1M |
| Détergent | Minimes | Des grappes de molécules détergentes produisent des pics larges et non résolues |
| Glycérol | Minimal (jusqu'à 5%) | Adhère non spécifique aux protéines et, par conséquent, des pics larges sont observées |
| Les solvants organiques | Jusqu'à 50% | Pourrait dénaturer les protéines complexes |
| Acides | Jusqu'à 4% | Complexes protéiques Dénaturer |
| Sels | Minimes | Adduits Sel conduire à des pics larges et non résolues |
| TNT | Minimes | UM 1-2 peut être présente |
| Les agents chélateurs | Minimes | Dessus de 250 uM conduire à la formation d'adduits vaste |
Références
- Alberts, B. The cell as a collection of protein machines: preparing the next generation of molecular biologists. Cell. 92 (3), 291-294 (1998).
- Benesch, J. L., Ruotolo, B. T., Simmons, D. A., Robinson, C. V. Protein complexes in the gas phase: technology for structural genomics and proteomics. Chem Rev. 107 (8), 3544-3567 (2007).
- Heck, A. J. Native mass spectrometry: a bridge between interactomics and structural biology. Nat Methods. 5 (11), 927-933 (2008).
- Sharon, M., Robinson, C. V. The role of mass spectrometry in structure elucidation of dynamic protein complexes. Annu Rev Biochem. 76, 167-193 (2007).
- Hernandez, H., Robinson, C. V. Determining the stoichiometry and interactions of macromolecular assemblies from mass spectrometry. Nat Protoc. 2 (3), 715-726 (2007).
- Wilm, M., Mann, M. Analytical properties of the nanoelectrospray ion source. Analytical Chemistry. 68 (1), 1-8 (1996).
- Sobott, F. A tandem mass spectrometer for improved transmission and analysis of large macromolecular assemblies. Anal Chem. 74 (6), 1402-1407 (2002).
- van den Heuvel, R. H. Improving the performance of a quadrupole time-of-flight instrument for macromolecular mass spectrometry. Anal Chem. 78 (21), 7473-7483 (2006).
- Chernushevich, I. V., Thomson, B. A. Collisional cooling of large ions in electrospray mass spectrometry. Anal Chem. 76 (6), 1754-1760 (2004).
- Mora, d. e. l. a., J, . Electrospray ionization of large multiply charged species proceeds via Dole s charged residue model. Anal Chim Acta. 406, 93-104 (2000).
- Lorenzen, K. Optimizing macromolecular tandem mass spectrometry of large non-covalent complexes using heavy collision gases. Int J Mass Spectrom. 268, 198-206 (2007).
- Benesch, J. L. Quadrupole-time-of-flight mass spectrometer modified for higher-energy dissociation reduces protein assemblies to peptide fragments. Anal Chem. 81 (3), 1270-1274 (2009).
- Taverner, T. Subunit architecture of intact protein complexes from mass spectrometry and homology modeling. Acc Chem Res. 41 (5), 617-627 (2008).
- Ferrige, A. G., Seddon, M. J., Skilling, J., Ordsmith, N. The application of MaxEnt to high resolution mass spectrometry. Mass Spectrom. 6, 765-770 (1992).
- van Breukelen, B., Barendregt, A., Heck, A. J., van den Heuvel, R. H. Resolving stoichiometries and oligomeric states of glutamate synthase protein complexes with curve fitting and simulation of electrospray mass spectra. Rapid Commun Mass Spectrom. 20 (16), 2490-2496 (2006).
- Sharon, M. Symmetrical modularity of the COP9 signalosome complex suggests its multifunctionality. Structure. 17 (1), 31-40 (2009).
- Hernandez, H. Subunit architecture of multimeric complexes isolated directly from cells. EMBO Rep. 7 (6), 605-610 (2006).
- Yadid, I., Tawfik, D. S. Reconstruction of functional beta-propeller lectins via homo-oligomeric assembly of shorter fragments. J Mol Biol. 365 (1), 10-17 (2007).
- Videler, H. Mass spectrometry of intact ribosomes. FEBS Lett. 579 (4), 943-947 (2005).
- Uetrecht, C. High-resolution mass spectrometry of viral assemblies: molecular composition and stability of dimorphic hepatitis B virus capsids. Proc Natl Acad Sci U S A. 105 (27), 9216-9220 (2008).
- Uetrecht, C. Stability and shape of hepatitis B virus capsids in vacuo. Angew Chem Int Ed Engl. 47 (33), 6247-6251 (2008).
- Morton, V. L., Stockley, P. G., Stonehouse, N. J., Ashcroft, A. E. Insights into virus capsid assembly from non-covalent mass spectrometry. Mass Spectrom Rev. 27 (6), 575-595 (2008).
- Sharon, M. 20S proteasomes have the potential to keep substrates in store for continual degradation. J Biol Chem. 281 (14), 9569-9575 (2006).
- van Duijn, E., Heck, A. J., Vies, S. M. v. a. n. d. e. r. Inter-ring communication allows the GroEL chaperonin complex to distinguish between different substrates. Protein Sci. 16 (5), 956-965 (2007).
- van Duijn, E. Tandem mass spectrometry of intact GroEL-substrate complexes reveals substrate-specific conformational changes in the trans ring. J Am Chem Soc. 128 (14), 4694-4702 (2006).
- Synowsky, S. A., van Wijk, M., Raijmakers, R., Heck, A. J. Comparative multiplexed mass spectrometric analyses of endogenously expressed yeast nuclear and cytoplasmic exosomes. J Mol Biol. 385 (4), 1300-1313 (2009).
- Sharon, M. Structural organization of the 19S proteasome lid: insights from MS of intact complexes. PLoS Biol. 4 (8), e267-e267 (2006).
- Zhou, M. Mass spectrometry reveals modularity and a complete subunit interaction map of the eukaryotic translation factor eIF3. Proc Natl Acad Sci U S A. 105 (47), 18139-18144 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon