Method Article
Analisar grandes complexos de proteínas por espectrometria de massa estruturais
Neste Artigo
Resumo
Espectrometria de massa tem provado ser uma ferramenta valiosa para a análise de grandes complexos de proteínas. Este método permite insights sobre a arquitetura de estequiometria, composição e global da subunidade multi-montagens. Aqui, descrevemos, passo-a-passo, como realizar uma análise de espectrometria de massa estrutural, e caracterizar as estruturas macromoleculares.
Resumo
Células vivas controlar e regular seus processos biológicos por meio da ação coordenada de um grande número de proteínas que se reúnem em uma matriz de dinâmica, proteína multi-complexos 1. Para obter uma compreensão mecanicista dos vários processos celulares, é crucial para determinar a estrutura de complexos de proteínas tais, e revelam como a sua organização estrutural determina sua função. Muitos aspectos da proteína multi-complexos são, no entanto, difícil de caracterizar, devido à sua natureza heterogênea, a estrutura assimétrica e dinâmica. Portanto, novas abordagens são necessárias para o estudo dos níveis de organização superior de proteína.
Uma das ferramentas de biologia estrutural emergentes para a análise de complexos macromoleculares é a espectrometria de massa (MS) 2-5. Este método produz informações sobre a composição das proteínas complexas, estequiometria subunidade, e topologia estrutural. O poder do MS deriva de sua alta sensibilidade e, como conseqüência exigência de amostra, baixo, o que permite o exame de complexos de proteínas expressas em níveis endógenos. Outra vantagem é a rapidez da análise, que permite o monitoramento de reações em tempo real. Além disso, a técnica pode medir simultaneamente as características das populações separadas co-existentes em uma mistura.
Aqui, nós descrevemos um protocolo detalhado para a aplicação de MS estruturais para a análise de conjuntos de proteínas de grande porte. O procedimento começa com a preparação de ouro revestidas de capilares para nanofluxo ionização electrospray (Nesi). Em seguida, continua com a preparação da amostra, enfatizando as condições de buffer que deve ser compatível com Nesi por um lado, e permitem manter intacta complexos, de outro. Em seguida, explicar, passo-a-passo, como otimizar as condições experimentais para medições de massa de alta e adquirir MS e tandem MS espectros. Finalmente, o gráfico de processamento de dados e análises que se seguem. Ao invés de tentar caracterizar cada aspecto dos conjuntos de proteínas, este protocolo apresenta procedimentos básicos MS, permitindo o desempenho de MS e MS / MS experimentos sobre a não-covalente complexos. No geral, nosso objetivo é fornecer aos pesquisadores não familiarizados com o campo da MS estrutural, com o conhecimento das principais ferramentas experimentais.
Protocolo
Parte 1: Preparação de ouro revestidas de capilares para nanofluxo ionização electrospray
Análise de não-covalente complexos é normalmente realizada por meio de ionização electrospray nanofluxo (Nesi) 6, usando capilares de vidro ou de quartzo, que foram puxados para uma ponta fina (~ 1 mícron de diâmetro interno) e revestida com material condutor (geralmente de ouro) . Capilares estejam disponíveis ready-to-use de fontes comerciais (Objetivo Novo ou Proxeon), no entanto, pode ser mais rentável para prepará-los em casa:
- Vara duas tiras de adesivo dupla face para a parte inferior de uma placa de Petri, 2 cm. Coloque uma vareta de vidro (8 cm x 5 mm) no centro de uma das almofadas. O adesivo vai realizar os capilares no local, e da vareta de vidro apoiará os capilares preparado, e manter as pontas de quebrar (Fig. 1).
- Use vidro borossilicato capilares, 1,0 mm de diâmetro externo x 0,78 mm id (usamos embalagens de 500 unidades de parede fina borosilicato capilares da Warner Instruments, cat. Não. G100TF-4). Inserir um capilar para o puxador de agulha (usamos modelo P-97 do Instrumento Sutter Co.). Grampo do capilar suavemente no lugar, e ajustar a sua posição de modo que fica no centro do filamento da agulha extrator de aquecimento. Aperte os grampos com cuidado, até o capilar é mantido firme em ambas as extremidades.
- Puxe o capilar, utilizando um programa pré-definido. Cada capilar puxado dará origem a duas finais, em forma de vasos capilares. O processo de programação do extrator é uma de tentativa e erro, até que uma forma aceitável dica é obtido. Usamos o seguinte programa:
Passo Calor Puxe Vell Tempo 1 750 - 15 80 2 700 - 15 50 3 750 200 20 80 - Remove os capilares retirado o instrumento e fiscalizar as dicas, descartando qualquer que são deformados ou quebrados. Use uma pinça blunt (usamos pinças de posicionamento de precisão CK), para colocar os vasos capilares na placa de Petri. A base do capilar deve ser anexado ao adesivo ea parte superior deve se inclinar sobre a haste de vidro, com a ponta apontando para cima.
- Uma vez que a placa de Petri está cheia (cerca de 80 capilares se encaixam em um prato de 10 cm de diâmetro), insira a placa no ouro sputter coater (usamos modelo não. EMS550, de EMS). Certifique-se que o fornecimento de gás é escolhido de acordo com as instruções do fabricante, e ativar um ciclo de revestimento pré-definidos (usamos pressão Argon 4 psi, a uma pressão de vácuo de 5 x 10 -2 mbar, uma corrente de 45mA, e um tempo de revestimento de 1 min, por 3-6 ciclos, até os capilares são uniformemente dourada).
Parte 2: Preparação da amostra
- Baixas concentrações micromolar de amostra são necessários (1-20 mM). Se necessário, concentrar a amostra usando dispositivos de ultrafiltração centrífuga (por exemplo, Vivaspin de Sartorius, ou NanoSep da Pall Corporation). É recomendável que você verificar a adsorção do complexo de proteínas para a membrana dispositivo, antes de usar.
- Muitas vezes, os buffers de purificação ou soluções de armazenamento do complexo de proteínas não são compatíveis com Nesi, para o qual apenas soluções voláteis podem ser usadas. Portanto, buffer de troca é necessária. Este passo crucial, em que todos os vestígios de sais, as moléculas de buffer ou qualquer outro não-volátil adutos, como o glicerol, a TDT, ou EDTA são removidos, determina a qualidade dos espectros. Normalmente, a solução aquosa de acetato de amônio é usado, em uma concentração entre 5 mm e 1 M, e em 08/06 pH. Buffer de troca pode ser realizada utilizando uma coluna de filtração em gel de microcentrífuga (por exemplo, Micro Bio-Spin 6 colunas de cromatografia de Bio-Rad). Este passo pode ser repetido 1-3 vezes com uma diluição mínima (menos de um factor de 1,3 por dispositivo 5), até que a troca máxima é alcançada. Se ambos concentração e troca de buffer são necessárias, estas podem ser feitas em conjunto, utilizando ultrafiltração centrífuga (e, g., Vivaspin de Sartorius, ou NanoSep da Pall Corporation).
Parte 3: Calibração de espectrômetro de massa para medições de massa de alta
A maioria dos experimentos conduzidos na proteína multi-complexos são realizadas usando um electrospray nano quadrupolo-tempo-of-flight (Q-TOF) instrumento. É sugerido que você use um filtro de massa quadrupolar ajustado para baixas freqüências, para permitir a transmissão ea massa análise de íons com alta m / z valores 7,8. Étambém recomendou que entradas de gás 7,8 ou 9 mangas ser adicionado ao instrumento no guia de íons em primeiro lugar, para permitir o controle da pressão na fase de vácuo em primeiro lugar. Este último permite a otimização da transmissão, e dessolvatação de íons muito grande 7-9. Atualmente, comercial ESI-TOF e Q-TOF instrumentos estão disponíveis em diversos fabricantes (por exemplo, Waters, SCIEX, Bruker, ou Agilent), que podem ser modificados de forma relativamente fácil e econômica, para aplicações nativas MS 7,8. É possível, no entanto, para usar as configurações padrão ou ToF QToF em instrumentos como LCT ou QToF1 (Waters) para adquirir espectros de massa para complexos até 1 MDA, sem a necessidade de modificações de hardware 5.
O protocolo descrito a seguir foi realizado em um instrumento Synapt (Waters).
- Prepare 100 mg / ml de CsI em água purificada. CsI é usado para a calibração de massa de alta como os clusters de sal isoladamente cobrado (CSI) n Cs + se estendem por uma vasta massa de largura, a partir de 393 m / z para mais de 10.000 (Fig. 2).
- Usando uma pinça sem corte, faça um capilar revestido da placa de Petri e 2μL carga da solução CsI no capilar, usando uma ponta de GeLoader Eppendorf.
- Inserir o capilar no suporte capilar, e ajuste o capilar de tal forma que a ponta é de aproximadamente 10 mm de distância da borda do titular.
- Deslize a solução para a ponta do capilar manualmente ou usando um adaptador de spin down.
- Coloque o capilar sob um microscópio óptico e aparar a ponta, utilizando as afiadas AA-tipo pinça.
- Conecte o suporte à interface capilar ES nanofluxo. Gire o estágio xyz para trás para evitar danos ao capilar, e empurre o palco para a sua posição ativada. O capilar deve ser colocado 1-10 mm do orifício de cone.
- Aplique a tensão capilar (1050-1400 V) e pressão nanofluxo baixa (0,00-0,03 bar) até spray é iniciado, em seguida, tentar reduzir a pressão nanofluxo para um valor mínimo.
- Otimizar a intensidade do sinal, ajustando a localização do palco xyz, a tensão capilar, a pressão nanofluxo, eo fluxo de gás dessolvatação.
- Para detectar uma ampla gama de massa CsI pico da série, as tensões de aceleração deve ser otimizada (nós usamos os seguintes parâmetros: 1,3-1,7 kV capilar, cone amostra 80-150V, extração de cone 03/01 V).
- Para otimizar a transmissão de íons de alta massa, que exigem condições dessolvatação suave, a pressão de apoio na fase inicial de vácuo, entre a fonte eo analisador, deve ser levantada. Isto pode ser conseguido com cuidado reduzindo a condutância da linha de vácuo de origem para a bomba de deslocamento, por parte de fechar a válvula de isolamento (SpeediValve). , A fim de definir o ponto ótimo, este último deve ser feito durante o monitoramento do efeito da intensidade do sinal (geralmente usamos mBar 3,0-6,5).
- Coletar cerca de 30 scans em 1 scan / seg, em uma faixa de m / z entre 1.000 a 15.000 m / z.
- Após a aquisição, calibrar o TOF usando a tabela de calibração adequadas.
Parte 4: MS análise de complexos de proteínas intactas
- Carregar sua amostra, como descrito (Parte 3, secções 2-5), e iniciar spray.
- Comece por otimização inicial do spray (Parte 3, secções 6-9), até que o sinal é detectado. A posição exata dos estados de carga é a proteína-dependente, no entanto, pode ser previsto, utilizando a relação entre a massa de íons e estado de carga média, assim: (Z médio) 10: Z = 0,0778 av √ (m), em que m é a massa do complexo em Daltons. Para evitar a dissociação complexo, não aquecem a fonte de íons: ou mudar o aquecedor desligado, ou manter a temperatura abaixo de 40 ° C.
- Variar a posição capilar, cone de amostra e tensões extractor para maximizar a transmissão de íons, e verificar as mudanças resultantes nos espectros. Um possível ponto de partida poderia ser tensão cone 100 V; extractor cone: 1 V; tensão capilar 1,5 kV. Otimizar esses parâmetros, em combinação com a pressão nanofluxo.
- Para melhorar dessolvatação e retirar a água residual e componentes buffer, aumentar a tensão de polarização ea pressão do gás na célula de colisão. Esta etapa deve ser realizada com cuidado, para evitar a dissociação do complexo. Tensões de polarização típica estão dentro da faixa de 10-100 V, com um fluxo de gás armadilha de 10-10 ml / min (Fig. 3). Ajuste manual da configuração RF e perfil quadrupolo pode melhorar a transmissão de íons de alta massa.
- Ajuste Trap e energias de colisão de Transferência. Muitas vezes, altas tensões são necessárias para a transmissão de íons de massa elevada (geralmente dentro da faixa de 10-30 V). Neste ponto, é importante para evitar a colisão induzida dissociação do complexo.
- Após um sinal estável é reached, recomenda-se que a pressão ea tensão capilar nanofluxo ser reduzida para valores mínimos, mantendo pulverização estável.
Parte 5: espectrometria de massas Tandem: complexos de proteína dissociar
- Uma vez que um sinal ótima e estável foi obtida, selecione um íon precursor. Definir o centro de massa e largura de isolamento (geralmente usamos uma resolução LM, de 12, e uma resolução de HM entre 13 e 15). Use uma ampla variedade de massas para detectar a massa de alta / products carga baixa dissociação. É recomendável que você defina o intervalo de m / z para o nível máximo, e depois reduzi-lo para os valores desejados. Sugerimos ainda a superposição de MS e MS / MS espectros, para validar o isolamento do íon precursor escolhido.
- Para executar MS / MS, dissociar o íon precursor, aumentando a energia de colisão (CE) ea pressão na célula de colisão. Aumentar ou Armadilha ou Transferência CE gradualmente, em passos de 10-20V, e elevar a pressão do gás de colisão para 0-5 ml / min (valores comuns). Monitorar as mudanças nos espectros até que as condições ótimas de ativação são alcançados. Energia de ativação elevada pode induzir a dissociação de uma ou mais subunidades do complexo intacta, e esclarecer as afinidades interação de diferentes subunidades. Normalmente usamos Argon como um gás de colisão nas células Armadilha / Transferência, embora os benefícios de usar um gás mais pesado (por exemplo, Xe ou SF 6) foram relatados, no entanto, esses gases são substancialmente mais caros 11 (Fig. 3).
- Recomenda-se que mais de um estado de carga ser selecionado para MS / MS análise. No caso de componentes sobrepostos, a aquisição de um conjunto de espectros em tandem MS vai ajudar a resolver a série de carga das diferentes populações. Além disso, os estados superiores carga vai se dissociam mais facilmente, em comparação aos estados carga mais baixa 12.
- Além da caracterização do complexo intacta, sugere-se que subcomplexes menores em solução será gerado, em condições moderadamente desnaturação. As análises de MS e MS / MS de subcomplexes formam a base para a definição da arquitetura subunidade do complexo 13. De ruptura parcial da subunidade subunidade interações, gradualmente adicionar solventes orgânicos (por exemplo, metanol, isopropanol ou acetonitrila) até uma concentração de 50%, ou alterar o pH da solução pela adição de amônia ou ácido fórmico (até uma concentração de 4 %).
- Para determinar as massas das unidades individuais que compõem o complexo, é importante para adquirir um espectro em condições de desnaturação. Isto pode ser efectuado através de Zip Tip-C 4 (Millipore), com uma relação água / acetonitrila 25:75, com 1% de ácido fórmico como o solvente de eluição.
Parte 6: Processamento de dados e análise
- Os dados são analisados off-line, usando um programa de análise espectral para MS espectros. Normalmente usamos o programa MassLynx (Waters).
- Para espectros que abrangem toda uma gama m / z de largura, recomendamos que diferentes regimes de alisamento e parâmetros centróide ser aplicado para a alta e baixa m / z regiões, de modo a reflectir a diferença na resolução de pico destas regiões.
- Para identificar série de carga e calcular os estados de carga e massas, o "manual encontrar" função de MassLynx pode ser aplicada. Em casos de espectros de massa complexa com componentes que se sobrepõem, o cálculo manual de massas pode ser mais fácil.
- Para facilitar estes processos de atribuição, software adicional pode ser usado, por exemplo: MaxEnt para espectros deconvolução 14, SOMMS para a montagem de pico e 15 de simulação, e SUMMIT para atribuir a composição e estequiometria da subcomplexes proteína e gerar redes de interação protéica 13,16,17 .
Parte 7: Resultados Representante

Figura 1. Preparando-se revestidas de ouro nano-electrospray capilares.
A. Coloque duas tiras dupla face adesiva a uma placa de Petri, 2 cm. Para apoiar os vasos capilares preparado, coloque uma vareta de vidro (8 cm x 5 mm) no centro de uma das almofadas. B. Cole a extremidade sem corte dos capilares preparado para o adesivo, e magra a ponta da vareta de vidro. C. Uma vez que a placa de Petri é preenchido com os capilares preparado, revesti-los com o ouro até que uma fina película de ouro é depositado uniformemente sobre a superfície externa dos capilares.
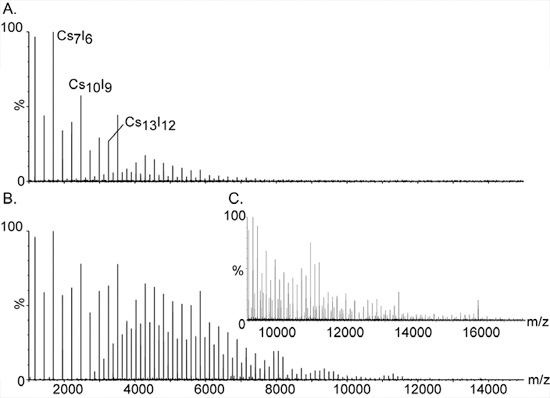
Figura 2. Calibração de massa de alta usando íons iodeto de césio.
Os grandes aglomerados e monisotopic de CsI tornaram o composto de escolha para a calibração de espectrômetros de massa para análise de massa elevada. A série de picos igualmente espaçados se estendem por uma ampla gama, de m / z 393 para mais de 10.000. Eles são ASSIGned às isoladas cobrado aglomerados sal da composição geral (CSI) n + Cs. Sinais adicionais entre os picos principais são causadas por espécies de duplo e triplo-carregada da série; [(CSI) n CS2] 2 + e [(CSI) n Cs3] 3 +, respectivamente. Aumentando a pressão na fase inicial de vácuo é essencial para detectar os clusters de alta massa. O efeito da pressão sobre os picos de alta massa é demonstrado nos Painéis A. e B. readbacks com pressão de 1,2 e 5,3, respectivamente. C. Expansão do espectro de massa mostrado em B.
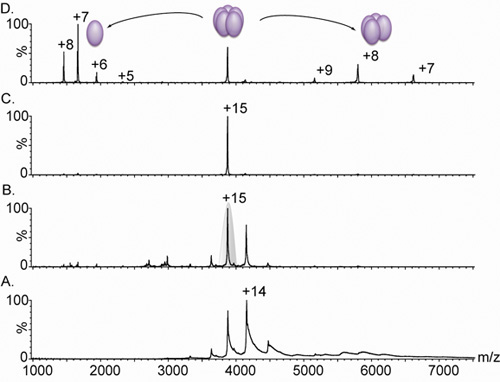
Figura 3. Nanofluxo espectros de massa por electrospray de uma lectina pentamérica.
A. A espectrometria de massa de um complexo variante lectina (derivado de lib1 B7 por evolução dirigida 18) dá origem a uma distribuição de carga de estado entre 3.000 e 5.000 m / z, no entanto, devido à dessolvatação inadequada dos íons, os picos são largos. Comparação de painel de A. e B. mostram o efeito de aumentar a voltagem de 4V (A). A 15V (B). Sobre a largura do pico. Este aumento nas condições de aceleração faz com que o stripping de água residual e de componentes do tampão, produzindo um espectro altamente resolvido. A massa medida (60.240 ± 38 Da) corresponde a um complexo pentamérica. C. O estado de carregamento 15 foi, então, selecionados para análise em tandem MS (sombreados em cinza no painel B). D. O aumento da energia de colisão provoca a libertação de um monômero altamente carregada, centrado em 1.664 m / z, e um complexo despojado tetramérica, na faixa de 5.000 - 8.000 m / z. Todos os espectros foram obtidos a partir de uma amostra contendo 20 mM de solução em acetato de amónio 0,5 M.
Discussão
Para adquirir a atenção espectros de alta qualidade deve ser dada às etapas de preparação de amostra, que incluem concentração da amostra e troca de buffer. Mais de amostras diluídas renderá um sinal de baixa, enquanto que amostras altamente concentrada pode ser bastante viscoso, e bloquear a agulha electrospray. Além disso, os aditivos solução, tais como sais, glicerol, detergentes, íons metálicos e agentes redutores (DTT ou β-mercaptoetanol), tendem a aderir na superfície externa das proteínas, e causar alargamento dos picos. Portanto, a fim de alcançar o bem-resolvida picos, esses componentes devem ser adicionados nas concentrações mais baixas possíveis.
Outro parâmetro importante é a posição do nanofluxo capilar, em relação ao orifício espectrômetro de massa. Encontrar o "sweet spot" pode ser um desafio para usuários inexperientes, no entanto, que influencia significativamente a qualidade dos espectros. Também é importante analisar o nanofluxo capilar antes do início do spray. O tamanho da gota é uma função do diâmetro da ponta, que deve ser ~ 1 Hm. Pequenas gotículas levar a ionização mais eficiente, e, portanto, ser vantajoso. Também é importante para validar que não há bolhas de ar dentro do capilar que possam bloquear o fluxo, e que o revestimento de ouro não é despojado do capilar durante a aquisição, em caso afirmativo, mais aparar a ponta. Tenha em mente que uma quantidade excessiva de amostra aumentará a possibilidade de otimizar as condições MS, tais como a tensão capilar, voltagens de aceleração, pressão e energia de colisão.
No geral, os procedimentos explicados no protocolo têm sido usados para determinar a composição, estequiometria e arquitetura de complexos de proteínas numerosos (ver comentários 2,3,4). Análise de grandes complexos MDa como o ribossomo e 19 capsídeos do vírus altamente ordenada 20-22, na definição de substrato de ligação para máquinas moleculares 23-25, ou a caracterização das redes de interação subunidade 26,17,16,17,27,28 servir como apenas alguns exemplos do valor desta abordagem.
Divulgações
Agradecimentos
Os autores agradecem os membros do grupo Sharon para a sua revisão crítica, e por suas contribuições ao manuscrito. Estamos gratos pelo apoio dos Programas Morasha e Bikura, a Israel Science Foundation (Grant n. º s 378/08 e 1823-1807), o Josef Cohn Minerva Center for Research biomembrana, a Família Chais Fellows Program para novos cientistas, o Abraham e Sonia Rochlin Foundation, o Family Trust Wolfson Charitable, a Helen e Milton A. Kimmelman Centro de Estrutura Biomolecular e Montagem; o espólio de Shlomo e Beirzwinsky Sabine; Meil de Botton Aynsley, e Karen Siem, Reino Unido. Somos gratos a Dan Tawfik e Yadid Itamar por nos dar a amostra variante lectina.
Materiais
Requisitos da amostra:
| Amostra | Exigência | Comentários |
| Volume | 1-2 mL | Por capilar |
| Concentração | 1-20Hm | Por complexos |
| Amortecedor | Aquanos tampão volátil como o acetato de amônio em pH = 6-8 | Tipicamente 5 mM-1M |
| Detergente | Mínimo | Aglomerados de moléculas de detergente produzir picos largos e sem solução |
| Glicerina | Mínima (até 5%) | Adere inespecificamente às proteínas e, conseqüentemente, ampla picos são observados |
| Solventes orgânicos | Até 50% | Pode desnaturar proteínas complexos |
| Ácidos | Até 4% | Desnaturar complexos de proteína |
| Sais | Mínimo | Adutos de sal levar a picos largos e sem solução |
| TDT | Mínimo | M 02/01 pode estar presente |
| Agentes quelantes | Mínimo | Acima de 250 mM levar à formação de aduto extensa |
Referências
- Alberts, B. The cell as a collection of protein machines: preparing the next generation of molecular biologists. Cell. 92 (3), 291-294 (1998).
- Benesch, J. L., Ruotolo, B. T., Simmons, D. A., Robinson, C. V. Protein complexes in the gas phase: technology for structural genomics and proteomics. Chem Rev. 107 (8), 3544-3567 (2007).
- Heck, A. J. Native mass spectrometry: a bridge between interactomics and structural biology. Nat Methods. 5 (11), 927-933 (2008).
- Sharon, M., Robinson, C. V. The role of mass spectrometry in structure elucidation of dynamic protein complexes. Annu Rev Biochem. 76, 167-193 (2007).
- Hernandez, H., Robinson, C. V. Determining the stoichiometry and interactions of macromolecular assemblies from mass spectrometry. Nat Protoc. 2 (3), 715-726 (2007).
- Wilm, M., Mann, M. Analytical properties of the nanoelectrospray ion source. Analytical Chemistry. 68 (1), 1-8 (1996).
- Sobott, F. A tandem mass spectrometer for improved transmission and analysis of large macromolecular assemblies. Anal Chem. 74 (6), 1402-1407 (2002).
- van den Heuvel, R. H. Improving the performance of a quadrupole time-of-flight instrument for macromolecular mass spectrometry. Anal Chem. 78 (21), 7473-7483 (2006).
- Chernushevich, I. V., Thomson, B. A. Collisional cooling of large ions in electrospray mass spectrometry. Anal Chem. 76 (6), 1754-1760 (2004).
- Mora, d. e. l. a., J, . Electrospray ionization of large multiply charged species proceeds via Dole s charged residue model. Anal Chim Acta. 406, 93-104 (2000).
- Lorenzen, K. Optimizing macromolecular tandem mass spectrometry of large non-covalent complexes using heavy collision gases. Int J Mass Spectrom. 268, 198-206 (2007).
- Benesch, J. L. Quadrupole-time-of-flight mass spectrometer modified for higher-energy dissociation reduces protein assemblies to peptide fragments. Anal Chem. 81 (3), 1270-1274 (2009).
- Taverner, T. Subunit architecture of intact protein complexes from mass spectrometry and homology modeling. Acc Chem Res. 41 (5), 617-627 (2008).
- Ferrige, A. G., Seddon, M. J., Skilling, J., Ordsmith, N. The application of MaxEnt to high resolution mass spectrometry. Mass Spectrom. 6, 765-770 (1992).
- van Breukelen, B., Barendregt, A., Heck, A. J., van den Heuvel, R. H. Resolving stoichiometries and oligomeric states of glutamate synthase protein complexes with curve fitting and simulation of electrospray mass spectra. Rapid Commun Mass Spectrom. 20 (16), 2490-2496 (2006).
- Sharon, M. Symmetrical modularity of the COP9 signalosome complex suggests its multifunctionality. Structure. 17 (1), 31-40 (2009).
- Hernandez, H. Subunit architecture of multimeric complexes isolated directly from cells. EMBO Rep. 7 (6), 605-610 (2006).
- Yadid, I., Tawfik, D. S. Reconstruction of functional beta-propeller lectins via homo-oligomeric assembly of shorter fragments. J Mol Biol. 365 (1), 10-17 (2007).
- Videler, H. Mass spectrometry of intact ribosomes. FEBS Lett. 579 (4), 943-947 (2005).
- Uetrecht, C. High-resolution mass spectrometry of viral assemblies: molecular composition and stability of dimorphic hepatitis B virus capsids. Proc Natl Acad Sci U S A. 105 (27), 9216-9220 (2008).
- Uetrecht, C. Stability and shape of hepatitis B virus capsids in vacuo. Angew Chem Int Ed Engl. 47 (33), 6247-6251 (2008).
- Morton, V. L., Stockley, P. G., Stonehouse, N. J., Ashcroft, A. E. Insights into virus capsid assembly from non-covalent mass spectrometry. Mass Spectrom Rev. 27 (6), 575-595 (2008).
- Sharon, M. 20S proteasomes have the potential to keep substrates in store for continual degradation. J Biol Chem. 281 (14), 9569-9575 (2006).
- van Duijn, E., Heck, A. J., Vies, S. M. v. a. n. d. e. r. Inter-ring communication allows the GroEL chaperonin complex to distinguish between different substrates. Protein Sci. 16 (5), 956-965 (2007).
- van Duijn, E. Tandem mass spectrometry of intact GroEL-substrate complexes reveals substrate-specific conformational changes in the trans ring. J Am Chem Soc. 128 (14), 4694-4702 (2006).
- Synowsky, S. A., van Wijk, M., Raijmakers, R., Heck, A. J. Comparative multiplexed mass spectrometric analyses of endogenously expressed yeast nuclear and cytoplasmic exosomes. J Mol Biol. 385 (4), 1300-1313 (2009).
- Sharon, M. Structural organization of the 19S proteasome lid: insights from MS of intact complexes. PLoS Biol. 4 (8), e267-e267 (2006).
- Zhou, M. Mass spectrometry reveals modularity and a complete subunit interaction map of the eukaryotic translation factor eIF3. Proc Natl Acad Sci U S A. 105 (47), 18139-18144 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados