Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
RHOC GTPasa ensayo de activación
En este artículo
Resumen
Este protocolo utiliza un desplegable de ensayo para determinar los niveles de GTPasa RHOC activa dentro de las células.
Resumen
RHOC GTPasa tiene 91% de homología con RhoA GTPasa. Debido a su prevalencia en las células, muchos reactivos y técnicas para la GTPasa RhoA se han desarrollado. Sin embargo, RHOC GTPasa se expresa en las células del cáncer metastásico en niveles relativamente bajos. Por lo tanto, son pocos los RHOC reactivos específicos se han desarrollado. Hemos adaptado un ensayo de activación de Rho GTPasa para detectar RHOC. Esta técnica utiliza una GST-Rho de unión a proteínas de fusión de dominio para sacar activos GTPasa RHOC. Además, se puede cosechar la proteína total en el comienzo de la prueba para determinar los niveles del total (GTP y GDP unido) GTPasa RHOC. Esto permite la determinación de la GTPasa RHOC activa respecto al total de la celda. Varias versiones comerciales de este procedimiento se han desarrollado sin embargo, los equipos comerciales se han optimizado para RhoA GTPasa y por lo general no funcionan bien para RHOC GTPasa. Partes de la prueba han sido modificados, así como el desarrollo de un anticuerpo específico RHOC.
Protocolo
1. Prepare la proteína de fusión GST-
- Stocks de glicerol de bacterias competentes JM109 que contiene la primera N-terminal de 90 aminoácidos de la Rhotekin dominio de unión a Rho (RBD) se subclonó en el vector BamH1/EcoR1 pGEX3x se hacen.
Para garantizar la eficiencia de alta los siguientes pasos deben realizarse para cada experimento. En nuestra experiencia, recién preparada GST-RBD es la clave para un ensayo de GTPasa activación sólido y preciso. - Añadir 50 l (aproximado, no descongelar) de las acciones de glicerol y 50 ml de LB amp y crecer 37 ° C durante la noche con agitación.
- Diluir 1:10 en 500 ml de LB-amp y crecer durante 1 h.
- Inducir la producción de proteínas GST-con 0,1 mM IPTG durante 2 horas.
- Distribuir uniformemente en botellas de centrífuga y centrifugar, rotor Sorval GSA3 a 5000 RPM 4 ° C durante 20 min.
- Resuspender el pellet en botellas de centrífuga de 10 ml de solución amortiguadora de lisis *.
* Buffer de lisis bacteriana: 20% de sacarosa, 10% de glicerol, 50 mM Tris pH 8,0, 0,2 mM Na 2 S 2 O 5, 2 mM de MgCl 2, 2 mM DTT, Agregar nuevo PMSF, benzamida, aprotinina y leupeptina. - Sonicar 2-3 minutos (esto depende del tipo de baño de ultrasonidos. Utilizamos una Fischer de Sonic Dismembranator modelo 500 establecido en la marca de 6, ciclo de 50%).
- Centrífuga, Sorvall SS34, 20 min 10.000 rpm a 4 ° C. En este punto, una pequeña alícuota se puede sacar y dirigido por SDS-PAGE. El gel puede ser teñido con Coomassie y una banda debe ser evidente a los 46 kDa.
- Quitar el sobrenadante y agregar 1 ml de 50% glutatione-Sepharose 4B lechada.
- Incubar durante 30 min a 4 ° C con rotación. Lavar 3 veces con tampón de lisis.
- Volver a suspender las cuentas GST-RBD/glutatione-Sepharose a una suspensión del 50% (aproximadamente 1 ml) con tampón GST-peces **. ** GST-Pescados Buffer: 10% de glicerol, 50 mM Tris pH 7,4, 100 mM NaCl, 1% NP-4, 2 mM MgCl 2, Agregar nuevo PMSF, benzamida, aprotinina y leupeptina
2. De fusión GST-pull down de ensayo
- Use 5.10 x 10 6 células / ensayo
- Lave las células una vez en PBS enfriado con hielo, mantener las placas de hielo (se utiliza una placa de vidrio plano lleno de hielo) y lisar con 0,5 ml de pescado GST-buffer.
- Incubar 5 min en hielo, las células de la cosecha utilizando una goma de policía o raspador plano, traslado al tubo de microcentrífuga y centrifugar 20,000 rpm 5 min a 4 ° C.
- Transferir el sobrenadante a un tubo de microcentrífuga nuevo. Tomar 50 l para determinar el total Rho (es decir, el PIB + GTP unido).
- Añadir 0,5 ml cuentas GST-RBD/glutatione-Sepharose e incubar a 4 ° C, durante la noche con la rotación.
- Lavar 6 veces con tampón GST-peces.
- Volver a suspender las bolas en 40 l de la muestra buffer 2x-Laemelli
En este punto, la concentración de la alícuota total de proteínas Rho tomadas en 2.4 debe ser determinada y 30 g preparado para ser ejecutado en el gel con la muestra de activación correspondiente. - Muestras de ebullición a 90 ° C durante 5 minutos, centrifugar brevemente y tomar el sobrenadante (es decir, evitar las bolas) cargar y ejecutar en un gradiente de 12 y 20.4% gel SDS-PAGE.
- Corra el gel a no superior a 150 voltios, la transferencia a la membrana con tampón Towbin y corriente constante de 100 W.
- Bloquear la membrana con leche / TBST solución al 5% y la sonda con RHOC specfic-anticuerpo.
3. Resultados representante
Los buenos resultados debe producir una única banda de aproximadamente 22 kDa. Malos resultados producen múltiples bandas o un fondo elevado. Esto es indicativo de la degradación de proteínas, el lavado incompleto de muestras o el uso de la antigua GST-RBD.
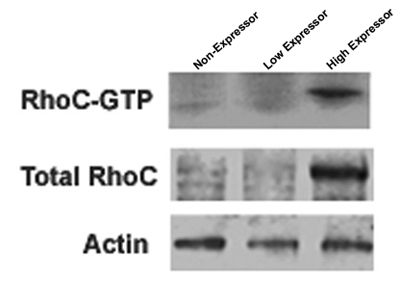
Figura 1. Tres líneas de células independientes que expresan diferentes niveles de RHOC GTPasa se muestran para demostrar los niveles bajos de RHOC activa y total, los altos niveles de RHOC activa y total o RHOC no. La mancha fue despojado entonces y reprobed con un anticuerpo para la actina casa gen mantener a servir como control de carga de la proteína RHOC total.
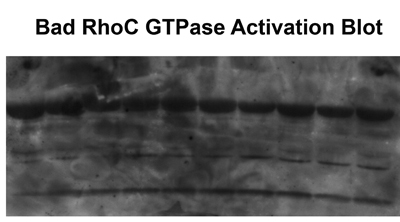
Figura 2. Múltiples bandas o resultados de alta de fondo de la degradación de proteínas, el lavado incompleto de las muestras o el uso de la vieja GST-RBD.
Discusión
El paso más crítico del proceso es la generación de nuevas GST-RBD. No prestar atención a este paso es la razón principal del fracaso. Todos los pasos, desde la generación de la GST-RBD (1,2) a la incubación durante la noche con el lisado celular (2,5), se debe hacer en un solo día. Otro paso importante es asegurarse que hay suficientes células para producir los lisados celulares. Esto es de particular importancia cuando se mira en RHOC GTPasa, que tiende a estar presente en bajos niveles en la célula.
Divulgaciones
Agradecimientos
Departamento de Defensa W81XWH-05-1-0005, W81XWH-06-1-0495, W81XWH-08-1-0029 y W81XWH-08-1-0356
Materiales
| Name | Company | Catalog Number | Comments |
| Gluthione-sepharose 4B beads | GE Healthcare | 17-0756-01 | |
| Criterion 4-20% Tris-HCl gels | Bio-Rad | 345-0032 |
Referencias
- van Golen, K. L., Wu, Z. F., Qiao, X. T., Bao, L. W., Merajver, S. D. RhoC GTPase, a novel transforming oncogene for human mammary epithelial cells that partially recapitulates the inflammatory breast cancer phenotype. Cancer Res. 60 (20), 5832-5838 (2000).
- van Golen, K. L., Wu, Z. F., Qiao, X. T., Bao, L., Merajver, S. D. RhoC GTPase overexpression modulates induction of angiogenic factors in breast cells. Neoplasia. 2 (5), 418-425 (2000).
- Golen, K. L. v. a. n. Reversion of RhoC GTPase-induced inflammatory breast cancer phenotype by treatment with a farnesyl transferase inhibitor. Mol Cancer Ther. 1 (8), 575-583 (2002).
- Golen, K. L. v. a. n. Mitogen activated protein kinase pathway is involved in RhoC GTPase induced motility, invasion and angiogenesis in inflammatory breast cancer. Clin Exp Metastasis. 19 (4), 301-311 (2002).
- Yao, H., Dashner, E. J., van Golen, C. M., van Golen, K. L. RhoC GTPase is required for PC-3 prostate cancer cell invasion but not motility. Oncogene. 25 (16), 2285-2296 (2006).
- Hall, C. L. Type I Collagen receptor (alpha2beta1) signaling promotes prostate cancer cell invasion through RhoC GTPase. Neoplasia. 10 (8), 797-803 (2008).
- Sequeira, L., Dubyk, C. W., Riesenberger, T. A., Cooper, C. R., van Golen, K. L. Rho GTPases in PC-3 prostate cancer cell morphology, invasion and tumor cell diapadesis. Clin Exp Metastasis. 25, 569-579 (2008).
- van Golen, K. L. CCL2 Induces Prostate Cancer Transendothelial Cell Migration via Activation of the Small GTPase Rac. J Cell Biochem. 104, 1587-1597 (2008).
- Chatterjee, M., van Golen, K. L. . Int J Cancer. , (2010).
- Sander, E. E., ten Klooster, J. P., van Delft, S., van der Kammen, R. A., Collard, J. G. Rac downregulates Rho activity: reciprocal balance between both GTPases determines cellular morphology and migratory behavior. J Cell Biol. 147 (5), 1009-1022 (1999).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados