Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
RhoC GTPase-Aktivierungs-Assay
In diesem Artikel
Zusammenfassung
Dieses Protokoll verwendet einen Pull-Down-Assay auf das Niveau der aktiven RhoC GTPase innerhalb der Zellen zu bestimmen.
Zusammenfassung
RhoC GTPase hat 91% Homologie zu RhoA GTPase. Aufgrund der Prävalenz in den Zellen haben viele Reagenzien und Techniken für RhoA GTPase entwickelt worden. Allerdings ist RhoC GTPase in metastasierenden Krebszellen auf relativ niedrigem Niveau exprimiert. Deshalb haben einige RhoC-spezifische Reagenzien entwickelt worden. Wir haben eine Rho-Aktivierungs-Assay angepasst RhoC GTPase zu erkennen. Diese Technik nutzt eine GST-Rho-bindende Domäne Fusionsprotein herausziehen aktive RhoC GTPase. Darüber hinaus können wir insgesamt Protein zu Beginn des Tests Ernte auf ein Niveau von insgesamt (GTP und GDP gebunden) RhoC GTPase zu bestimmen. Dies ermöglicht die Bestimmung des aktiven und totale RhoC GTPase in der Zelle. Mehrere kommerzielle Versionen von diesem Verfahren wurden jedoch entwickelt, sind die kommerziellen Kits für RhoA GTPase optimiert und in der Regel nicht gut für RhoC GTPase. Teile des Tests wurden ebenso wie die Entwicklung eines RhoC-spezifischen Antikörper modifiziert.
Protokoll
1. Bereiten Sie GST-Fusionsprotein
- Glycerol Bestände JM109 kompetente Bakterien mit den ersten N-terminalen 90 Aminosäuren des rhotekin Rho-Bindungsdomäne (RBD) in die BamH1/EcoR1 pGEX3x subkloniert sind.
Um eine hohe Effizienz der folgenden Schritte müssen für jedes Experiment durchgeführt werden. In unserer Erfahrung, frisch zubereitete GST-RBD ist der Schlüssel, um eine robuste und präzise GTPase-Aktivierungs-Assay. - Dann werden 50 ul (ungefähre, nicht auftauen) Glycerin Lager, um 50 ml LB amp und wachsen 37 ° C über Nacht unter Schütteln.
- Verdünnen 1:10 in 500 ml LB-Amp und wachsen für 1 h.
- Induce GST-Protein-Produktion mit 0,1 mM IPTG für 2 Stunden.
- Verteilen Sie gleichmäßig in Zentrifugenbecher und Zentrifuge, Sorval GSA3 Rotor bei 5000 RPM 4 ° C für 20 min.
- Pellet in Zentrifugationsflaschen 10 ml Lysepuffer *.
* Bakterielle Lysis Buffer: 20% Saccharose, 10% Glycerin, 50 mM Tris pH 8,0, 0,2 mM Na 2 S 2 O 5, 2 mM MgCl 2, 2 mM DTT, Add frischen PMSF, Benzamid, Aprotinin und Leupeptin. - Ultraschallbad 2-3 min (abhängig von der Art des Ultraschallgeräts. Wir verwenden ein Fischer Sonic Dismembranator Model 500 auf Stufe 6 eingestellt, 50% Zyklus).
- Zentrifuge, Sorvall SS34, 20 min 10.000 rpm bei 4 ° C. An dieser Stelle ein kleines Aliquot kann herausgenommen werden und wird von SDS-PAGE. Das Gel kann Coomassie gefärbt werden und eine Band sollte bei 46 kDa erkennbar.
- Überstand entfernen und 1 mL 50% Glutathion-Sepharose 4B Gülle.
- Inkubieren für 30 min bei 4 ° C mit Rotation. 3 x waschen mit Lysepuffer.
- Resuspendieren GST-RBD/glutatione-Sepharose Perlen auf eine 50% ige Aufschlämmung (ca. 1 mL) mit GST-Fisch-Puffer **. ** GST-Fish-Puffer: 10% Glycerol, 50 mM Tris pH 7,4, 100 mM NaCl, 1% NP-4, 2 mM MgCl 2, Add frischen PMSF, Benzamid, Aprotinin und Leupeptin
2. GST-Fusions-Pull-down-Assay
- Verwenden Sie 5-10 x 10 6 Zellen / Test
- Wash Zellen einmal in eiskaltem PBS, halten Platten auf Eis (wir verwenden eine flache Glasschale mit Eis gefüllt) und Lyse mit 0,5 ml GST-Fisch-Puffer.
- Inkubieren 5 min auf Eis, Ernte-Zellen mit Hilfe eines Gummi-Polizist oder Wohnung scrapper, Transfer zum Rohr microfuge und Zentrifuge 20.000 rpm 5 min bei 4 ° C.
- Überstand in ein frisches Mikrozentrifugenröhrchen. Nehmen Sie 50 ul auf insgesamt Rho (dh BIP + GTP gebunden) zu bestimmen.
- Fügen Sie 0,5 ml GST-RBD/glutatione-Sepharose Perlen und inkubieren Sie bei 4 ° C, über Nacht mit einer Rotation.
- Wash 6x mit GST-Fisch-Puffer.
- Resuspendieren Perlen in 40 ul 2x-Laemelli Probenpuffer
An diesem Punkt der Konzentration der gesamten Rho-Protein Aliquot in 2,4 genommen zu bestimmen und 30 ug bereit, auf dem Gel mit dem entsprechenden Aktivierung Probe gefahren werden. - Boil-Proben bei 90 ° C für 5 min, kurz zentrifugieren und Überstand nehmen (dh Vermeidung der Perlen) zu laden und laufen auf einer 12-well 4-20% Gradient SDS-PAGE-Gel.
- Run-Gel nicht höher als 150 Volt, Transfer zum Membran mit Towbin Puffer und konstanten Strom von 100 W.
- Block Membran mit 5% Milch / TBST-Lösung und Sonde mit RhoC-specfic Antikörper.
3. Repräsentative Ergebnisse
Gute Ergebnisse sollte eine einzige Bande bei etwa 22 kDa zu produzieren. Schlechte Ergebnisse produzieren mehrere Bänder oder hohen Hintergrund. Dies ist bezeichnend für Proteinabbau, unvollständige Waschen von Proben oder die Verwendung von alten GST-RBD.
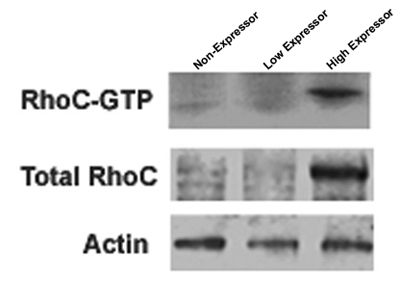
Abbildung 1. Drei separate Zelllinien unterschiedlicher RhoC GTPase gezeigt auf ein niedriges Niveau der aktiven und insgesamt RhoC, ein hohes Maß an aktiver und insgesamt RhoC oder keine RhoC demonstrieren. Der Blot wurde dann abgezogen und reprobed mit einem Antikörper gegen das house keeping-Gens Aktin als Ladekontrolle für die gesamte RhoC Protein dienen.
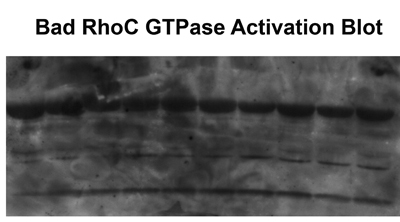
Abbildung 2. Multiple Bands oder hohen Hintergrund ergibt sich aus Proteinabbau, unvollständige Waschen der Proben oder die Verwendung von alten GST-RBD.
Diskussion
Der wichtigste Schritt des Verfahrens ist die Erzeugung von frischen GST-RBD. Andernfalls Aufmerksamkeit, um diesen Schritt zu zahlen ist Hauptgrund für das Scheitern. Alle Schritte, von der Generation der GST-RBD (1,2), die Inkubation über Nacht mit dem Zelllysat (2,5), sollte an einem einzigen Tag durchgeführt werden. Ein weiterer entscheidender Schritt ist, um sicherzustellen, dass es genügend Zellen zu den Zelllysaten zu produzieren. Dies ist von besonderer Bedeutung, wenn man RhoC GTPase, die anwesend zu sein i...
Offenlegungen
Danksagungen
US-Verteidigungsministerium W81XWH-05-1 bis 0005, W81XWH-06-1 bis 0495, W81XWH-08-1 bis 0029 und W81XWH-08-1 bis 0356
Materialien
| Name | Company | Catalog Number | Comments |
| Gluthione-sepharose 4B beads | GE Healthcare | 17-0756-01 | |
| Criterion 4-20% Tris-HCl gels | Bio-Rad | 345-0032 |
Referenzen
- van Golen, K. L., Wu, Z. F., Qiao, X. T., Bao, L. W., Merajver, S. D. RhoC GTPase, a novel transforming oncogene for human mammary epithelial cells that partially recapitulates the inflammatory breast cancer phenotype. Cancer Res. 60 (20), 5832-5838 (2000).
- van Golen, K. L., Wu, Z. F., Qiao, X. T., Bao, L., Merajver, S. D. RhoC GTPase overexpression modulates induction of angiogenic factors in breast cells. Neoplasia. 2 (5), 418-425 (2000).
- Golen, K. L. v. a. n. Reversion of RhoC GTPase-induced inflammatory breast cancer phenotype by treatment with a farnesyl transferase inhibitor. Mol Cancer Ther. 1 (8), 575-583 (2002).
- Golen, K. L. v. a. n. Mitogen activated protein kinase pathway is involved in RhoC GTPase induced motility, invasion and angiogenesis in inflammatory breast cancer. Clin Exp Metastasis. 19 (4), 301-311 (2002).
- Yao, H., Dashner, E. J., van Golen, C. M., van Golen, K. L. RhoC GTPase is required for PC-3 prostate cancer cell invasion but not motility. Oncogene. 25 (16), 2285-2296 (2006).
- Hall, C. L. Type I Collagen receptor (alpha2beta1) signaling promotes prostate cancer cell invasion through RhoC GTPase. Neoplasia. 10 (8), 797-803 (2008).
- Sequeira, L., Dubyk, C. W., Riesenberger, T. A., Cooper, C. R., van Golen, K. L. Rho GTPases in PC-3 prostate cancer cell morphology, invasion and tumor cell diapadesis. Clin Exp Metastasis. 25, 569-579 (2008).
- van Golen, K. L. CCL2 Induces Prostate Cancer Transendothelial Cell Migration via Activation of the Small GTPase Rac. J Cell Biochem. 104, 1587-1597 (2008).
- Chatterjee, M., van Golen, K. L. . Int J Cancer. , (2010).
- Sander, E. E., ten Klooster, J. P., van Delft, S., van der Kammen, R. A., Collard, J. G. Rac downregulates Rho activity: reciprocal balance between both GTPases determines cellular morphology and migratory behavior. J Cell Biol. 147 (5), 1009-1022 (1999).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten