Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
El método de cultivo de embriones de roedores enteros utilizando el sistema de tipo de botella rotador Cultura
En este artículo
Resumen
Toda técnica de cultivo de embriones de ratón nos permite la cultura y embriones de rata Ex vivo Condición durante períodos limitados correspondientes a las etapas mitad de la gestación. En este protocolo de video, demostramos nuestros procedimientos estándar de cultivo de embriones de ratas después de todo E12.5 utilizando el sistema de botella de los rotadores, el tipo de cultivo.
Resumen
Toda una cultura de embriones (WEC) técnica ha sido desarrollada en 1950 por nuevas y sus colegas, y se aplica para la biología del desarrollo 1. Aunque el desarrollo y el crecimiento de los embriones de mamíferos son críticamente dependientes de la función de la placenta, la técnica del CME de ratón nos permite la cultura y la condición de embriones de rata ex vivo durante períodos limitados correspondientes a las etapas mitad de la gestación durante el día embrionario (E) de 6.5 E12.5 en el ratón o E8.5-E14.5 en la rata 2, 3, 4. En WEC, podemos directamente de destino deseado áreas de embriones utilizando finos capilares de vidrio porque los embriones pueden ser manipulados bajo el microscopio. Por lo tanto, el CME de roedores es una técnica muy útil cuando queremos estudiar los procesos dinámicos de desarrollo de los embriones de mamíferos postimplanted. Hasta la fecha, varios tipos de sistemas de CME han sido desarrollados 1. Entre ellos, el sistema rotatorio botella-el tipo de cultivo es el más popular y apto para el cultivo prolongado de embriones en mitad de la gestación, es decir, después de E9.5 y E11.5 en el ratón y la rata, respectivamente 1. En este protocolo de video, demostramos nuestros procedimientos estándar de WEC ratas después de E12.5 con un modelo perfeccionado del sistema original de los rotadores, que fue diseñado por nuevos y Cockroft 5, 6, y la introducción de diversas aplicaciones de la técnica del CME para los estudios en mamíferos de desarrollo la biología.
Protocolo
1. La creación del sistema WEC
- Conjunto de una membrana de 0,22 micras filtro a la entrada del tubo de silicona dentro del sistema de WEC a).
- Abra la válvula de un cilindro de gas que contiene O 2 (95%) y CO 2 (5%). El flujo de la mezcla de gas en el tambor a través de la botella de burbujas que contienen agua esterilizada.
- Ajustar el volumen del flujo de la mezcla de gas de 50 cc.
- Inserte el tubo de silicona a dejar en una botella de agua de salida y el flujo de la mezcla de gases.
- Girar el tambor a la velocidad de 20 rpm / min.
2. Preparación del medio de cultivo
- Rata descongelar inmediatamente a centrifugar (IC) de suero a 37,0 ° C b). Añadir D-glucosa (2 mg / ml) en suero descongelado en un vaso de precipitados en autoclave 100. El medio de cultivo debe estar preparado a nivel de cultivo primario (por ejemplo, usando una capucha).
- Añadir antibiótico-antimicótico (100X) que el líquido del suero, con 1: 400 dilución.
- Vaporizar isoflurano restantes (debido a la anestesia de las ratas durante la recogida de sangre) en el suero durante 20 minutos a temperatura ambiente (TA) c).
- Esterilizar el medio de cultivo utilizando un filtro de membrana de 0,45 micras.
- Verter 3,0 ml del medio en cada frasco de cultivo y sellar la parte superior de cada botella con un tapón de silicona, cubierta con papel de aluminio (ver ref. 14) d).
- Prepare tres o cuatro placas de Petri que contiene disposición e salina de Tyrode).
3. La anestesia de la rata y el aislamiento del útero
- Anestesiar a una rata de tiempo del embarazo profundamente con anestésicos por inhalación o por vía parenteral.
- Limpie la zona abdominal de la rata anestesiada embarazadas con etanol al 70%.
- Levante la piel con una pinza y exteriorización de la pared abdominal mediante la reducción de la piel con unas tijeras grandes f).
- Recogida de la pared abdominal con un par de pinzas y hacer en forma de U grandes incisiones longitudinales en la pared abdominal con una tijera grande hasta el nivel torácico g).
- Llevarse el intestino hacia el lado izquierdo con un par de pinzas y exponer un extremo del útero conectado al ovario.
- Levante el extremo del útero con una pinza y corta la posición entre el útero y ovario con unas tijeras de gran tamaño.
- Sacar el útero de la rata embarazada mediante la reducción de la grasa alrededor del útero hasta el otro extremo del útero.
- Transferencia al útero de una placa de Petri que contiene solución salina de Tyrode.
- La eutanasia a las ratas mediante la administración excesiva de anestésicos o la dislocación cervical después de la extirpación del útero.
4. La eliminación de los embriones en el útero
- Brevemente enjuague el útero en una solución salina de Tyrode y su transferencia a la segunda placa de Petri con un par de pinzas finas h).
- Bajo un microscopio binocular, recoger la pared del útero con una pinza fina y cortar la pared del útero en el lado opuesto a la mesometrio conexión con los vasos sanguíneos con tijeras rectas oftálmica.
- Inserte la punta de la tijera oftálmica recta en el espacio entre la pared uterina y la decidua. Cortar la pared uterina longitudinalmente a lo largo del lado antimesometrial.
- Grupo de la decidua en el lado mesometrial y conceptuses separa del útero con dos pares de pinzas finas i).
- Transferencia conceptuses a la tercera placa de Petri con una pipeta de vidrio esterilizado con un diámetro adecuado.
5. La disección de embriones de rata
- Inserte una punta de la microforceps en la decidua y hacer una incisión transversal en la decidua en todo el embrión con dos pares de pinzas.
- Inserte las puntas de la pinza en la decidua en el lado de la placenta y hacer dos incisiones longitudinales en la decidua a la cima.
- Retire la decidua placentaria en el lado de desgarramiento que con dos pares de pinzas. Retire la decidua restante con dos pares de pinzas.
- Recoger la membrana de Reichert, hacer una incisión horizontal en ella, y separado de la membrana del embrión en el lado anti-placentaria.
- Haz un pequeño agujero en el saco vitelino, cerca de la cabeza del embrión con los dos pares de pinzas y corta el saco vitelino con un par de tijeras curvas oftálmica. Es importante no dañar los vasos sanguíneos principales.
- Levante el amnios en el sitio alrededor de la cabeza del embrión con los dos pares de pinzas finas, y tire suavemente el embrión desde el saco vitelino por romper el amnios h). El cuerpo del embrión debe ser sacado de la bolsa de la yema para aumentar el suministro de oxígeno para el embrión en la etapa de gestación.
6. Cultivo de embriones todo
- Comprobar los daños en la placenta, saco vitelino, y la condición de latidos del corazón y la circulación sanguínea.
- Ser consciente de no estirar el cordón umbilical, la transferenciael embrión de un frasco de cultivo con una pipeta de vidrio esterilizado. Aporte de solución salina de Tyrode a las botellas de la cultura debe ser lo menos posible.
- Quitar un tapón de silicona no orificio del tambor rotatorio. Conectar el frasco de cultivo con un tapón con un agujero en el tambor rotatorio del sistema de WEC perpendicularmente. Tenga cuidado de no poner la fuerza en el tambor en direcciones inadecuadas desde el tambor rotatorio es un equipo muy bien. Los frascos que contienen el embrión disecados son transferidos a la cultura de uno en uno, la apertura de la puerta de la incubadora debe ser minimizado para evitar que la temperatura de la incubadora se reduce j).
- Después de 10 horas de la cultura, aumentar el volumen de flujo de la mezcla de gas de hasta 75 cc y hasta 100 cc después de 24 horas (Tabla 1).
- El medio de cultivo se debe cambiar alrededor de 24 horas mediante la transferencia de los embriones cultivados en una botella nueva cultura con el medio recién preparado. Aumentar el volumen de flujo de hasta 125 cc después de 34 horas y hasta 150 cc después de 48 horas (Tabla 1)
- De vez en cuando comprobar el estado de los embriones cultivados por contar el ritmo cardíaco (por ejemplo, 120-150/min es óptimo) y mediante la observación de la circulación sanguínea. Si es necesario contar el número de somitas para juzgar el crecimiento de los embriones en una solución salina de Tyrode. En el desarrollo normal, un somite se agrega en dos horas.
- Cuando WEC haya finalizado la alimentación de la mezcla de gas y desconecte el tubo de entrada y el filtro de membrana para evitar el reflujo en el tubo de entrada de la botella de burbujas.
7. Notas
- La temperatura dentro del sistema de WEC se mantiene constantemente en 37.0-37.5 ° C.
- 100% IC rata suero se utiliza rutinariamente en nuestra WEC de embriones de rata y ratón, y se mantiene a -20 ° C antes de su uso.
- Compramos rata IC suero, que se obtiene de las ratas que son anestesiados con isoflurano.
- Botellas desechables también están disponibles en Ikemoto Rika. Botellas y tapones de silicona debe ser esterilizados en autoclave.
- La disección de embriones debe realizarse a temperatura ambiente, porque el mantenimiento de los embriones a temperatura alta o baja durante la disección afectar el desarrollo posterior en el WEC.
- Herramientas para la disección se esterilizan con calor seco.
- La piel y la pared abdominal se debe cortar por separado para evitar la contaminación de los pelos en un plato como sea posible. Cambiamos un par de tijeras grandes y pinzas con un nuevo par de ellos cuando se corta la piel y aislar el útero, respectivamente.
- Con unas pinzas cuyas puntas están muy bien es muy importante para diseccionar los tejidos sin duda. Nos manualmente afilar las puntas de unas pinzas con una piedra y aceite de la máquina.
- Nosotros utilizamos un lado de la pinza como un cuchillo para evitar el exceso de presión a los embriones.
- Cuando la temperatura dentro del sistema de WEC disminuye al abrir la puerta varias veces, seguimos para encender la luz para mantener la temperatura dentro del sistema.
8. Los resultados representativos
La figura 1 muestra los procedimientos de la disección de los embriones de ratas y embriones de rata cultivadas.
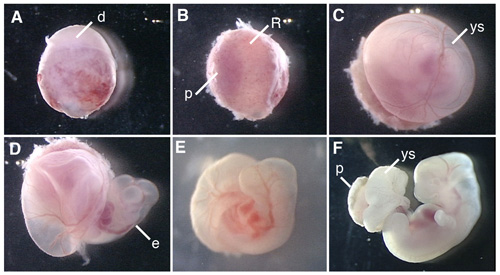
Figura 1. Cultivo de embriones enteros del embrión de rata E12.5. (A) Un embrión disección del útero de las ratas preñadas. (B) La eliminación de la decidua en el lado de la placenta. (C) La eliminación de la membrana de Reichert. (D) La apertura del saco vitelino. (E) La rata de cultivo de embriones en la botella durante 6 horas después del comienzo de la WEC. (F) El embrión de rata en cultivo durante 42 horas. d, decidua, R, la membrana de Reichert, p, la placenta, ys, del saco vitelino; e, embrión.
| 0 horas | 12 horas | 24 horas | 36 horas | 48 horas | |
| E12.5 embrión de rata | 95% 50 cc | 95% 75 cc (10 horas) | 95% de 100 cc | 95% 125 cc (34 horas) | 95% de 150 cc |
Tabla 1. Condición óptima de oxígeno.
Discusión
Hay dos pasos críticos en el CME de roedores para el éxito. En primer lugar, el procedimiento de disección debe ser precisa, no para los embriones de los daños, especialmente en los vasos sanguíneos. En segundo lugar, el procedimiento debe ser lo más rápido posible porque el oxígeno y los nutrientes no son suministrados a través de la placenta después del aislamiento del útero. Esto es crítico para mayores embriones. En el caso de las ratas después de WEC E12.5, debemos transferir embriones disecados en fra...
Divulgaciones
Agradecimientos
Agradecemos al Sr. Hajime Ichijo por los consejos de grabación en vídeo y útil para la edición de vídeo. También agradecemos a Drs.Yuji Tsunekawa y Yoshizaki Kaichi de tipo asistente para la grabación en vídeo. Este trabajo es apoyado por KAKENHI en B para jóvenes científicos y la ciencia del cerebro áreas prioritarias-molecular de MEXT de Japón. Queremos agradecer el apoyo de Global COE Programa "Centro de investigación básica y traslacional de la Ciencia del Cerebro Global" de MEXT de Japón y la investigación central para la Ciencia Evolutiva y de la Tecnología (CREST) de la Ciencia y la Corporación Japonesa de Ciencia Tecnología japonesa y Tecnología (JST) .
Materiales
| Name | Company | Catalog Number | Comments | |
| Nombre | Tipo | Empresa | Número de catálogo | Comentario |
| La creación de WEC | ||||
| WEC sistema (10-0.310) | Herramienta | Ikemoto Rika | 010-0310 | Otro pequeño modelo también está disponible. |
| Silicio enchufe sin un agujero | Herramienta | Ikemoto Rika | 010-032-08 | |
| Cilindros de gas mezcla | Herramienta | Nikko Sanso | - | Que contiene 95% de oxígeno y 5% de dióxido de carbono. La orden de encargo. |
| Regulador de gas | Herramienta | Ono Seisakusho | WR-11 | |
| 0,22 micras filtro Millex GS | Herramienta | Millipore | SLGS033SS | |
| Anestesia y aislamiento del útero | ||||
| Tijeras grandes | Herramienta | Napox | B-7H | |
| Fórceps | Herramienta | Napox | A-3-2 | |
| Eliminación de placa de Petri (90 mm x 15 mm) | Herramienta | Iwaki | SH90-15 | Profundidad de tipo plato es el mejor para la disección. |
| Isoflurano | Reactivo | Abbott | B506 | Para la anestesia |
| Pentobarbital sódico | Reactivo | Schering-Plough Animal Health | - | Para la anestesia |
| Tyrode solución salina | Reactivo | - | - | Según el protocolo en la referencia. 2. Guardar a 4 ° C. |
| Cronometrada embarazadas ratas Sprague-Dawley | Animal | Carlos Ríos Laboratorios Japón | - | |
| Preparación del medio de cultivo | ||||
| Cultura botella de vidrio | Herramienta | Ikemoto Rika | 010-032-05 | |
| Disposición frasco de cultivo | Herramienta | Ikemoto Rika | 010-032-06 | |
| Silicio enchufe con agujero | Herramienta | Ikemoto Rika | 010-032-07 | |
| Lámina de aluminio | Herramienta | Cualquier empresa | - | |
| Bolsa de autoclave | Herramienta | Hogy | HM-26 | Para las botellas de la cultura |
| Bolsa de autoclave | Herramienta | Hogy | HM-14A | De tapones de silicona |
| 0,45 micras filtro Millex HA | Herramienta | Millipore | SLHA033SS | |
| Tubo cónico de 50 ml | Herramienta | Becton Dickinson | 352070 | |
| Vaso de 100 ml | Herramienta | Iwaki | TE-32 | |
| Rata IC suero | Reactivo | Carlos Ríos Laboratorios Japón | - | Se refieren a: el Sr. Kunihiko Morisaki, TEL: +81- (0) 45-474-9336, Fax: +81- (0) 45-474-9340 |
| D (+)-glucosa | Reactivo | Wako | 041-00595 | |
| Los antibióticos líquidos antimyotic | Reactivo | Gibco | 15240 | |
| La disección de embriones | ||||
| Oftálmica recta tijeras | Herramienta | Napox | MB50-7 | Para el corte de la pared uterina |
| Oftálmica tijeras curvas | Herramienta | Napox | MB54-2 | Para el corte del saco vitelino |
| Pinzas # 5 | Herramienta | Vigor | T6715 | |
| Pinzas # 5F | Herramienta | Regine | T6819 | |
| Pipeta | Herramienta | - | - | Hecho a mano con pipeta Pasteur. |
| Bolsa de autoclave | Herramienta | Hogy | HM-4 | Para pipetas de vidrio |
| Microscopio binocular | Herramienta | Leica | Mz7s | |
| Luz | Herramienta | Leica | CLS 150XD | |
| Aceite de piedra | Herramienta | Uchida Yoko | 833-2000 | Para el afilado de las pinzas |
| Aceite de máquina | Herramienta | Uchida Yoko | 835-0000 | Para el afilado de las pinzas |
Referencias
- New, D. A. T., Copp, A. J., Cockroft, D. L. Intoroduction. In mammalian postimplantation embryos. In Mammalian Postimplantation Embryos A Practical Approach. , 1-14 (1990).
- Cockroft, D. L., Copp, A. J., Cockroft, D. L. Dissection and culture of post implantation embryos. In Mammalian Postimplantation Embryos A Practical Approach. , 15-40 (1990).
- Morris-Kay, G. M. Postimplantation mammalian embryos. Essential Developmental Biology A Practical Approach. , 55-66 (1993).
- Fujinaga, M., Tuan, R. S., Lo, C. W. In vitro culture of rodent embryos during the early postimplantation period. Developmental Biology Protocols. , 53-76 (2000).
- Eto, K., Takakubo, F. Improved development of rat embryos in culture during the period of craniofacial morphogenesis. J. Craniofac. Genet. Dev. Biol. 5, 351-355 (1985).
- New, D. A., Cockroft, D. L. A rotating bottle culture method with continuous replacement of the gas phase. Experientia. 35, 138-140 (1979).
- Osumi-Yamashita, N., Ninomiya, Y., Eto, K. Mammalian craniofacial embryology in vitro. Int. J. Dev. Biol. 41, 187-194 (1997).
- Inoue, T., Nakamura, S., Osumi, N. Fate mapping of the mouse prosencephalic neural plate. Dev. Biol. 219, 373-383 (2000).
- Nomura, T., Holmberg, J., Frisen, J., Osumi, N. Pax6-dependent boundary defines alignment of migrating olfactory cortex neurons via the repulsive activity of ephrin A5. Development. 133, 1335-1345 (2006).
- Inoue, Y. U., Asami, J., Inoue, T. Genetic labeling of mouse rhombomeres by Cadherin-6::EGFP-BAC transgenesis underscores the role of cadherins in hindbrain compartmentalization. Neurosci. Res. 63, 2-9 (2009).
- Calegari, F., Huttner, W. B. An inhibition of cyclin-dependent kinases that lengthens, but does not arrest, neuroepithelial cell cycle induces premature neurogenesis. J. Cell Sci. 116, 4947-4955 (2003).
- Osumi, N., Inoue, T. Gene transfer into cultured mammalian embryos by electroporation. Methods. 24, 35-42 (2001).
- Arai, Y. Role of Fabp7, a downstream gene of Pax6, in the maintenance of neuroepithelial cells during early embryonic development of the rat cortex. J. Neurosci. 25, 9752-9761 (2005).
- Takahashi, M., Nomura, T., Osumi, N. Transferring genes into cultured mammalian embryos by electroporation. Dev. Growth Differ. 50, 485-497 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados