È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Il metodo di coltura degli embrioni roditori intero utilizzando il Rotator tipo di sistema cultura Bottiglia
In questo articolo
Riepilogo
Tutta la tecnica di coltura degli embrioni del mouse ci permette di cultura e di embrioni di ratto Ex vivo durante i periodi limitati corrispondenti a fasi midgestation. In questo protocollo video, abbiamo dimostrato le nostre procedure standard di coltura degli embrioni di ratto dopo tutto E12.5 con il rotore di tipo sistema cultura bottiglia.
Abstract
Intera coltura degli embrioni (WEC), la tecnica è stata sviluppata nel 1950 da New e dei suoi colleghi, e applicato per la biologia dello sviluppo 1. Anche se lo sviluppo e la crescita di embrioni di mammifero sono criticamente dipendente dal funzionamento della placenta, WEC tecnica ci permette di topo cultura e di embrioni di ratto condizione di ex-vivo durante i periodi limitati corrispondenti a fasi midgestation durante il giorno embrionale (E) 6,5 E12.5 nel mouse o E8.5-E14.5 nel ratto 2, 3, 4. In WEC, possiamo direttamente target desiderato aree di embrioni con fini di vetro capillari, perché gli embrioni possono essere manipolati al microscopio. Pertanto, WEC roditore è una tecnica molto utile quando si vogliono studiare i processi di sviluppo dinamico di postimplanted embrioni di mammifero. Fino ad oggi, diversi tipi di sistemi sono stati sviluppati WEC 1. Tra questi, il rotore di tipo sistema di coltura bottiglia è più popolare e adatto a lungo termine cultura di embrioni a midgestation, cioè dopo la E9.5 e E11.5 nel topo e ratto, rispettivamente 1. In questo protocollo video, dimostriamo il nostro procedure standard del WEC ratto dopo E12.5 utilizzando un modello raffinato del sistema originale dei rotatori, che è stato progettato per nuovi e di Cockroft 5, 6, e introdurre le varie applicazioni della tecnica WEC per gli studi di sviluppo dei mammiferi biologia.
Protocollo
1. Impostazione del sistema WEC
- Misto una membrana di 0,22 micron filtro per il tubo di silicone di ingresso all'interno del sistema WEC a).
- Aprire la valvola di una bombola di gas contenente O 2 (95%) e CO 2 (5%). Flusso della miscela di gas nel tamburo attraverso la bottiglia contenente acqua bolle autoclave.
- Regolare il volume del flusso di miscela di gas a 50 cc.
- Inserire il tubo in silicone da lasciare in una bottiglia d'acqua e controllare il flusso di miscela di gas.
- Ruotare il tamburo alla velocità di 20 giri / min.
2. Preparazione del terreno di coltura
- Rat-disgelo immediatamente centrifugati (IC) di siero a 37,0 ° C b). Aggiungi D-glucosio (2 mg / ml) nel siero scongelati in un autoclave becher da 100 ml. Terreno di coltura devono essere preparati a livello di cultura principale (ad esempio, con un cappuccio).
- Aggiungi antibiotico-antimicotico (100X) liquidi al siero con 1: 400 di diluizione.
- Vaporizzare isoflurano rimanenti (a causa di anestesia dei ratti durante la raccolta del sangue) dal siero per 20 minuti a temperatura ambiente (RT), c).
- Sterilizzare il terreno di coltura utilizzando un filtro a membrana 0,45 micron.
- Versare 3,0 ml del mezzo in ogni bottiglia cultura e sigillare la parte superiore di ogni bottiglia con un tappo in silicone, coperto con un foglio di alluminio (vedi rif. 14) d).
- Preparare tre o quattro piastre di Petri contenenti disposizione e saline di Tyrode).
3. Anestesia del ratto e l'isolamento dell 'utero
- Anestetizzare un tempo in gravidanza ratto profondamente con anestetici inalatori o parenterale.
- Pulire la zona addominale del ratto anestetizzato incinta con il 70% di etanolo.
- Raccogliete la pelle con una pinza e esteriorizzare la parete addominale per tagliare la pelle con grandi forbici f).
- Raccogliete la parete addominale con un paio di pinze e fare incisioni di grandi dimensioni a forma di U longitudinale sulla parete addominale con le forbici di grandi dimensioni fino al livello toracico g).
- Poggiare l'intestino sul lato sinistro con un paio di pinze ed esporre un capo dell'utero collegato l'ovaio.
- Pick up alla fine del utero con un paio di pinze e tagliare la posizione tra l'utero e le ovaie con le forbici grandi.
- Togliere l'utero dal ratto in gravidanza, tagliando il grasso intorno dell'utero fino alla fine altri dell'utero.
- Trasferimento nell'utero di una piastra di Petri contenente soluzione salina Tyrode è.
- Euthanize il ratto dalla somministrazione eccessiva di anestetico o dislocazione cervicale dopo aver rimosso l'utero.
4. Rimozione di embrioni dall'utero
- Sciacquare brevemente l'utero in soluzione salina Tyrode e trasferimento al secondo piatto di Petri con un paio di belle pinze h).
- Sotto un microscopio binoculare, prendere la parete uterina, con un paio di pinze sottili e tagliare la parete uterina al lato opposto al mesometrium di collegamento con i vasi sanguigni con le forbici oftalmica dritto.
- Inserire la punta di forbici oftalmica direttamente nello spazio tra la parete uterina e decidua. Tagliare la parete uterina longitudinalmente lungo il lato antimesometrial.
- Clump la decidua a lato mesometrial e conceptuses separato dall'utero utilizzano due coppie di pinze bene i).
- Trasferimento conceptuses al piatto terza Petri con una pipetta di vetro sterilizzati con un diametro adeguato.
5. Dissezione di embrioni di ratto
- Inserire una punta del microforceps nella decidua e fare una incisione trasversale sul decidua intorno al concepito con due coppie di pinze.
- Inserire le punte della pinza nella decidua a lato placentare e fare due incisioni longitudinali sulle decidua verso l'alto.
- Rimuovere la decidua a lato placentare di ripping che con due coppie di pinze. Rimuovere il restante decidua con due coppie di pinze.
- Pick up membrana Reichert, fare un taglio orizzontale su di esso, e separare la membrana dalla concepimento al anti-placentare lato.
- Fai un piccolo foro sul sacco vitellino vicino alla testa di un embrione con le due coppie di pinze, e tagliare il sacco vitellino con un paio di forbici curve oftalmico. E 'importante per non danneggiare i vasi sanguigni principali.
- Sollevare il amnios presso il sito intorno alla testa di un embrione con le due coppie di una pinza sottile e delicatamente estrarre l'embrione del sacco vitellino strappando l'h amnios). Il corpo dell'embrione deve essere tirato fuori il sacco vitellino per aumentare l'apporto di ossigeno per l'embrione nella fase midgestation.
6. Embrione intera cultura
- Verificare danni sulla placenta, sacco vitellino, e la condizione di battere il cuore e la circolazione sanguigna.
- Essere consapevoli di non estende il cordone ombelicale, il trasferimentol'embrione di una bottiglia di cultura con una pipetta di vetro sterilizzati. Riporto di soluzione salina Tyrode di bottiglie di cultura dovrebbe essere il meno possibile.
- Rimuovere un non-foro spina silicio dalla tamburo dei rotatori. Collegare la bombola di cultura con una spina con un buco al tamburo dei rotatori del sistema WEC perpendicolarmente. Fare attenzione a non mettere vigore il tamburo in direzioni non adatti poiché il tamburo dei rotatori è un apparecchio molto fine. Le bottiglie contenenti l'embrione sezionato vengono trasferiti alla cultura uno per uno, l'apertura della porta d'ingresso del incubatore dovrebbe essere ridotto al minimo per evitare la temperatura dell'incubatore è diminuita j).
- Dopo 10 ore di cultura, di aumentare il volume del flusso di miscela di gas fino a 75 cc e fino a 100 cc dopo 24 ore (Tabella 1).
- Il terreno di coltura deve essere cambiato circa 24 ore con il trasferimento dell'embrione in coltura in una bottiglia nuova cultura di media preparati al momento. Aumentare il volume del flusso massimo di 125 cc dopo 34 hr e un massimo di 150 cc, dopo 48 ore (Tabella 1)
- Di tanto in tanto controllare lo stato degli embrioni coltivati contando tasso di battito cardiaco (cioè, 120-150/min è ottimale) e osservando la circolazione sanguigna. Se necessario contare il numero di somiti per giudicare la crescita di embrioni in soluzione salina di Tyrode. Nello sviluppo normale, uno somite si aggiunge in due ore.
- Quando WEC è finito, stop fornitura di miscela di gas e staccare il tubo di ingresso e la membrana del filtro al fine di evitare il riflusso nel tubo di aspirazione dalla bottiglia bubbling.
7. Note
- La temperatura all'interno del sistema WEC è costantemente mantenuto a 37,0-37,5 ° C.
- 100% ratto IC siero viene solitamente usata nei nostri WEC di embrioni di ratto e nel topo, e conservati a -20 ° C prima dell'uso.
- Acquistiamo ratto IC siero, che sono raccolti da ratti che sono anestetizzati con isoflurano.
- Bottiglie usa e getta sono disponibili anche presso Ikemoto Rika. Bottiglie e tappi in silicone devono essere sterilizzati in autoclave.
- Dissezione di embrioni deve essere eseguita a temperatura ambiente per il mantenimento degli embrioni a bassa o alta temperatura durante la dissezione influenzare lo sviluppo successivo in WEC.
- Strumenti per la dissezione vengono sterilizzati con calore secco.
- La pelle e la parete addominale dovrebbero essere tagliati separatamente per evitare contaminazioni di peli in un piatto il più possibile. Cambiamo un paio di forbici di grandi dimensioni e pinze con un nuovo paio di loro quando abbiamo tagliato la pelle e isolare l'utero, rispettivamente.
- Utilizzando pinze le cui punte vanno bene è molto importante per sezionare tessuti certamente. Noi manualmente affilare le punte delle pinze con una pietra e l'olio della macchina.
- Noi utilizziamo un lato della pinza come un coltello per evitare una pressione eccessiva agli embrioni.
- Quando la temperatura all'interno del sistema WEC diminuisce con l'apertura della porta ripetutamente, continuiamo ad accendere la luce per mantenere la temperatura all'interno del sistema.
8. Rappresentante risultati
La figura 1 mostra le procedure di dissezione dell'embrione ratto e gli embrioni di ratto in coltura.
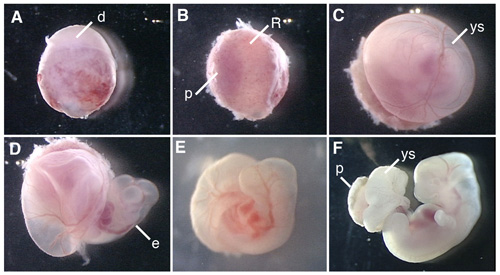
Figura 1. Coltura degli embrioni intero dell'embrione E12.5 ratto. (A) concepito sezionato dall'utero del ratto in gravidanza. (B) Rimozione della decidua a lato placenta. (C) Rimozione di membrana di Reichert. (D) L'apertura del sacco vitellino. (E) La coltura degli embrioni di ratto in bottiglia per 6 ore dopo l'inizio del WEC. (F) L'embrione di ratto in coltura per 42 ore. d, decidua, R; membrana di Reichert, p, placenta, ys, sacco vitellino, e, embrione.
| 0 ore | 12 ore | 24 ore | 36 ore | 48 ore | |
| E12.5 ratto embrione | 95% 50 cc | 95% 75 cc (10 hr) | 95% da 100 cc | 95% di 125 cc (34 ore) | 95% 150 cc |
Tabella 1. Condizioni ottimali di ossigeno.
Discussione
Ci sono due passaggi critici nel WEC roditori per il successo. In primo luogo, la procedura di dissezione dovrebbe essere accurato per non danneggiare gli embrioni, soprattutto vasi sanguigni. In secondo luogo, la procedura dovrebbe essere il più rapidamente possibile, perché l'ossigeno e nutrienti non sono più forniti attraverso la placenta dopo l'isolamento dall'utero. Questo è fondamentale per i vecchi embrioni. Nel caso del WEC ratto dopo E12.5, dovremmo trasferire embrioni sezionati in bottiglie di ...
Divulgazioni
Riconoscimenti
Ringraziamo il Sig. Hajime Ichijo per la video-registrazione e consigli utili per l'editing del video. Ringraziamo anche Drs.Yuji Tsunekawa e Kaichi Yoshizaki per gentile assistente per il video-registrazione. Questo lavoro è supportato da KAKENHI su B per giovani scienziati e di priorità Aree-Molecular Brain Science da MEXT del Giappone. Riconosciamo l'appoggio di Global COE Program "Centro di ricerca di base e traslazionale per la scienza del cervello globale" da MEXT del Giappone e il Nucleo di Ricerca per la Scienza e la Tecnologia evolutiva (CREST) da Science e Technology Corporation giapponese di scienza giapponese e Technology Agency (JST) .
Materiali
| Name | Company | Catalog Number | Comments | |
| Nome | Tipo | Azienda | Numero di catalogo | Commento |
| Impostazione WEC | ||||
| WEC sistema (10-0310) | Strumento | Ikemoto Rika | 010-0310 | Un altro piccolo modello è inoltre disponibile. |
| Tappo in silicone senza foro | Strumento | Ikemoto Rika | 010-032-08 | |
| Miscela di gas cilindro | Strumento | Nikko Sanso | - | Contenente 95% di ossigeno e di anidride carbonica del 5%. Ordine personalizzato. |
| Regolatore del gas | Strumento | Ono Seisakusho | WR-11 | |
| 0,22 micron filtro Millex GS | Strumento | Millipore | SLGS033SS | |
| Anestesia e isolamento dell'utero | ||||
| Forbici di grandi dimensioni | Strumento | Napox | B-7H | |
| Forcipe | Strumento | Napox | A-3-2 | |
| Piatto disposizione Petri (90 mm x 15 mm) | Strumento | Iwaki | SH90-15 | Profonda di tipo piatto è la migliore per la dissezione. |
| Isoflurano | Reagente | Abbott | B506 | Per l'anestesia |
| Di sodio pentobarbital | Reagente | Schering-Plough Animal Health | - | Per l'anestesia |
| Tyrode della salina | Reagente | - | - | Secondo il protocollo di rif. 2. Salva a 4 ° C. |
| Cronometrato in gravidanza ratto Sprague-Dawley | Animale | Fiumi Charles Laboratori Giappone | - | |
| Preparazione del terreno di coltura | ||||
| Cultura bottiglia di vetro | Strumento | Ikemoto Rika | 010-032-05 | |
| Smaltimento cultura bottiglia | Strumento | Ikemoto Rika | 010-032-06 | |
| Tappo in silicone con foro | Strumento | Ikemoto Rika | 010-032-07 | |
| Foglio di alluminio | Strumento | Ogni azienda | - | |
| Sacchetto in autoclave | Strumento | Hogy | HM-26 | Per le bottiglie di cultura |
| Sacchetto in autoclave | Strumento | Hogy | HM-14A | Per i tappi di silicone |
| 0,45 micron filtro Millex HA | Strumento | Millipore | SLHA033SS | |
| 50 ml tubo conico | Strumento | Becton Dickinson | 352070 | |
| Bicchiere da 100 ml | Strumento | Iwaki | TE-32 | |
| Rat IC siero | Reagente | Fiumi Charles Laboratori Giappone | - | Si riferiscono a: Sig. Kunihiko Morisaki, TEL: +81- (0) 45-474-9336; FAX: +81- (0) 45-474-9340 |
| D (+)-glucosio | Reagente | Wako | 041-00595 | |
| Antibiotico-antimyotic liquido | Reagente | Gibco | 15240 | |
| Dissezione di embrioni | ||||
| Forbici oftalmica dritto | Strumento | Napox | MB50-7 | Per il taglio della parete uterina |
| Forbici curve oftalmica | Strumento | Napox | MB54-2 | Per il taglio del sacco vitellino |
| Pinza # 5 | Strumento | Vigore | T6715 | |
| Pinza # 5F | Strumento | Regine | T6819 | |
| Pipetta di vetro | Strumento | - | - | Fatti a mano utilizzando pipetta Pasteur. |
| Sacchetto in autoclave | Strumento | Hogy | HM-4 | Per pipette in vetro |
| Microscopio binoculare | Strumento | Leica | Mz7s | |
| Luce | Strumento | Leica | CLS 150XD | |
| Olio di pietra | Strumento | Uchida Yoko | 833-2000 | Per l'affilatura di forcipe |
| Olio per macchine | Strumento | Uchida Yoko | 835-0000 | Per l'affilatura di forcipe |
Riferimenti
- New, D. A. T., Copp, A. J., Cockroft, D. L. Intoroduction. In mammalian postimplantation embryos. In Mammalian Postimplantation Embryos A Practical Approach. , 1-14 (1990).
- Cockroft, D. L., Copp, A. J., Cockroft, D. L. Dissection and culture of post implantation embryos. In Mammalian Postimplantation Embryos A Practical Approach. , 15-40 (1990).
- Morris-Kay, G. M. Postimplantation mammalian embryos. Essential Developmental Biology A Practical Approach. , 55-66 (1993).
- Fujinaga, M., Tuan, R. S., Lo, C. W. In vitro culture of rodent embryos during the early postimplantation period. Developmental Biology Protocols. , 53-76 (2000).
- Eto, K., Takakubo, F. Improved development of rat embryos in culture during the period of craniofacial morphogenesis. J. Craniofac. Genet. Dev. Biol. 5, 351-355 (1985).
- New, D. A., Cockroft, D. L. A rotating bottle culture method with continuous replacement of the gas phase. Experientia. 35, 138-140 (1979).
- Osumi-Yamashita, N., Ninomiya, Y., Eto, K. Mammalian craniofacial embryology in vitro. Int. J. Dev. Biol. 41, 187-194 (1997).
- Inoue, T., Nakamura, S., Osumi, N. Fate mapping of the mouse prosencephalic neural plate. Dev. Biol. 219, 373-383 (2000).
- Nomura, T., Holmberg, J., Frisen, J., Osumi, N. Pax6-dependent boundary defines alignment of migrating olfactory cortex neurons via the repulsive activity of ephrin A5. Development. 133, 1335-1345 (2006).
- Inoue, Y. U., Asami, J., Inoue, T. Genetic labeling of mouse rhombomeres by Cadherin-6::EGFP-BAC transgenesis underscores the role of cadherins in hindbrain compartmentalization. Neurosci. Res. 63, 2-9 (2009).
- Calegari, F., Huttner, W. B. An inhibition of cyclin-dependent kinases that lengthens, but does not arrest, neuroepithelial cell cycle induces premature neurogenesis. J. Cell Sci. 116, 4947-4955 (2003).
- Osumi, N., Inoue, T. Gene transfer into cultured mammalian embryos by electroporation. Methods. 24, 35-42 (2001).
- Arai, Y. Role of Fabp7, a downstream gene of Pax6, in the maintenance of neuroepithelial cells during early embryonic development of the rat cortex. J. Neurosci. 25, 9752-9761 (2005).
- Takahashi, M., Nomura, T., Osumi, N. Transferring genes into cultured mammalian embryos by electroporation. Dev. Growth Differ. 50, 485-497 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon