需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
鼠类全胚胎培养方法,使用的肩型瓶培养系统
摘要
全胚胎培养技术,使我们文化的大鼠和小鼠胚胎体外在midgestation阶段对应有限的时期条件。在这个视频协议,我们将演示后,用肩瓶型文化体系E12.5大鼠全胚胎培养我们的标准程序。
摘要
全胚胎培养(WEC)技术已在1950年开发新和他的同事,和发育生物学的1应用。虽然哺乳动物胚胎的发展和增长是严重依赖对胎盘功能,职业英语运动技术使我们能够在胚胎一天(五)6.5 E12.5相应midgestation阶段,在有限的时期在文化大鼠和小鼠胚胎体外条件鼠标或在大鼠2,3,4 E8.5 - E14.5。职业英语运动,我们可以直接目标所需的领域使用细的玻璃毛细管的胚胎,因为胚胎可以在显微镜下操作。因此,灭鼠职业英语运动是非常有用的技术时,我们要研究动态postimplanted哺乳动物胚胎的发育过程。到今天为止,几种类型的职业英语运动的系统已经开发1。其中,肩,瓶型文化体系是最流行 和最适合长期midgestation,即胚胎的文化,后E9.5和E11.5的小鼠和大鼠, 分别为1 。在这个视频协议,我们展示了我们的标准程序后E12.5使用了原来的旋转系统,这是由新的Cockroft 5,6设计精致模型大鼠职业英语运动,并引入职业英语运动技术的研究在哺乳动物发育的各种应用生物学。
研究方案
1。设立职业英语运动系统
- 联合0.22μm的滤膜过滤,职业英语运动系统内的进口硅管 ) 。
- 打开一个汽缸气体, 含 O 2(95%)和CO 2(5%)阀门。通过鼓泡瓶含有灭菌水鼓流入的气体混合物。
- 调整混合气体流量50立方厘米。
- 插入让出一瓶水硅管,并检查了混合气体的流量。
- 在20转/分的速度旋转的鼓。
2。培养基的制备
- 解冻大鼠立即离心(IC)血清在37.0 ° C B)。添加D -葡萄糖(2毫克/毫升)蒸压100毫升烧杯中进入解冻血清。培养基应准备在小学文化的层面(例如,使用遮光罩)。
- 1:400稀释血清添加抗生素antimycotic(100X)的液体。
- 蒸发剩余的异氟醚(由于麻醉大鼠在采血),从20分钟,在室温(RT)C)血清。
- 使用0.45微米的滤膜过滤,消毒的培养基。
- 在每个培养瓶中的培养基倒入3.0毫升,密封与 硅塞顶部,每个瓶子,用铝箔覆盖(见文献14)D )。
- 准备三个或四个处理的培养皿中,含有台氏生理盐水发送)。
3。麻醉大鼠和子宫的隔离
- 深深吸入或注射麻醉药麻醉超时孕鼠。
- 清洁麻醉用70%乙醇的孕鼠的腹部。
- 拿起镊子的皮肤和exteriorize 与 F大剪刀切割皮肤的腹壁 ) 。
- 拿起一双镊子腹壁和U形大上大剪刀腹壁纵切口胸G 级)。
- 熊远肠道一双镊子的左侧和揭露一端连接到卵巢子宫。
- 拿起一双镊子子宫底和大剪刀之间的子宫和卵巢切的位置。
- 从孕鼠的子宫,取出切割子宫的另一端,直到子宫周围的脂肪。
- 子宫转移到台氏培养皿中含有生理盐水。
- 安乐死大鼠,取出后,子宫过度管理的麻醉剂或颈椎脱位。
4。去除胚胎从子宫
- 简单地说,在台氏生理盐水冲洗子宫,并转移到第二一双细镊子h 的 Petri菜)。
- 在双目显微镜下,拿起一双细镊子的子宫壁和削减对面侧的子宫壁mesometrium使用眼科直剪刀的血管连接。
- 眼科直剪刀的尖端插入子宫壁和蜕膜之间的空间。 antimesometrial方沿纵向切子宫壁。
- 丛蜕膜在mesometrial一边单独conceptuses用细镊子一)两对从子宫。
- conceptuses转移到第三一个合适的直径灭菌玻璃吸管的Petri菜。
5。大鼠胚胎的剖析
- microforceps的尖端插入蜕膜和上横切口周围两个双钳conceptus蜕膜。
- 钳提示插入蜕膜,胎盘侧,使两个纵向切口顶端上的蜕膜。
- 在胎盘中取出,有两个双钳抓取蜕膜。两个双钳取出剩余的蜕膜。
- 拿起赖克特的膜,上水平切口,并在反胎盘侧conceptus的膜分开。
- 钳的两对卵黄囊胚胎的头部附近的一个小口子,和一双眼科弯剪刀切断与卵黄囊。重要的是不损伤主要血管。
- 羊膜拿起网站围绕胚胎的头两对细镊子,轻轻拔出撕破羊膜 h胚胎卵黄囊 ) 。卵黄囊,胚胎的身体应该拉到midgestation阶段,以增加胚胎的氧气供应。
6。全胚胎培养
- 检查胎盘,卵黄囊,心脏跳动和血液循环的条件的损害。
- 意识到不伸展脐带,转让一个培养瓶用消毒的玻璃吸管的胚胎。台氏生理盐水培养瓶,应尽可能少。
- 删除从肩鼓无孔硅插件。连接插头与一个职业英语运动系统的肩鼓垂直孔培养瓶中。要小心不要把鼓,因为在不适当的方向力肩鼓是一种非常优良的设备。瓶含有解剖胚胎被转移到一个开放的孵化器的前门文化之一应尽量避免孵化器的温度降低j) 。
- 经过10小时的文化,增加混合气体的流量后24小时至75毫升和100毫升(见表1)。
- 培养基应改为24小时各地转移到新的培养瓶中培养的胚胎与新鲜配制的中等。 34小时后增加的流量高达125 CC和高达150毫升后48小时(见表1)
- 偶尔检查计数心跳率(120-150/min即是最优的),并通过观察血液循环,培养胚胎的情况。如果需要计数的体节数判断胚胎在台氏生理盐水增长。在正常的发展,一个体节是在两小时内补充。
- 职业英语运动完成时,停止供应气体混合物和断开的入口管和膜过滤器,以避免回冒泡瓶从入口管流。
7。注释
- 职业英语运动系统内的温度始终保持在37.0-37.5 ° C。
- 100%大鼠IC血清是经常使用在我们的职业英语运动对大鼠和小鼠胚胎中,并在使用前保持在-20 ° C。
- 我们购买IC血清,这是从与异氟醚麻醉的大鼠收集大鼠。
- 一次性瓶上,也可从池本梨。瓶子和硅插头应高压灭菌。
- 清扫应在室温下进行的胚胎,因为胚胎在低温或高温期间保持夹层,影响职业英语运动的后续发展。
- 干热消毒清扫工具。
- 应切开皮肤和腹壁,单独成一碟尽可能避免污染的头发。我们当我们改变了他们的一双新的一双大剪刀和镊子切开皮肤,分离子宫,分别。
- 使用镊子,其秘诀是罚款是非常重要的解剖组织的肯定。我们用石头和油机手动提升产钳的提示。
- 我们使用镊子的一侧,像刀子一样,以避免过量的压力胚胎。
- 当职业英语运动系统内的温度降低反复开门,我们继续上的灯打开,以保持系统内部的温度。
8。代表性的成果
图1显示了解剖大鼠胚胎和体外培养的大鼠胚胎的程序。
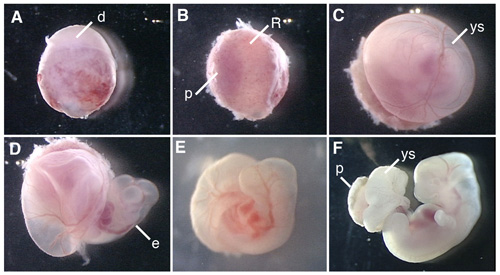
图1。E12.5大鼠胚胎全胚胎培养。 (A)从孕鼠的子宫解剖conceptus。 (b)取消蜕膜胎盘侧。 (三)赖克特的膜去除。 (四)开幕卵黄囊。 (五)在职业英语运动开始后6小时瓶大鼠胚胎培养。 (F)的大鼠胚胎培养42小时。 D,蜕膜,R;赖克特的膜,P,胎盘; YS,卵黄囊,E,胚胎。
| 0小时 | 12小时 | 24小时 | 36小时 | 48小时 | |
| E12.5大鼠胚胎 | 95%50立方厘米 | 95%,75 CC (10小时) | 95%的100毫升 | 95%的125毫升(34小时) | 95%的150 CC |
表1。最优氧条件。
讨论
有成功的灭鼠职业英语运动的两个关键步骤。首先,剥离过程应该是准确的,不破坏胚胎,特别是血管。其次,程序应尽快,因为氧气和营养通过胎盘从子宫隔离后不再提供。这是对年纪较大的胚胎的关键。在E12.5大鼠职业英语运动的情况下,我们应该在30分钟内转移到培养瓶解剖胚胎。
我们已经分析了野生型和标签少量细胞用荧光染料DII或DII -标记的细胞移植在大鼠胚胎的?...
披露声明
致谢
我们感谢肇一乘先生编辑视频录像和乐于助人的意见。我们也感谢Drs.Yuji Tsunekawa和凯驰吉崎实物录像助理。这项工作是支持KAKENHI青年科学家B和优先领域,分子由日本文部科学省的脑科学。我们承认,支持全球COE计划“全球脑科学的基础和转化研究中心”由文部科学省,日本和演化的科学和技术的核心研究(CREST)由日本科技公司从日本科学技术振兴机构(JST) 。
材料
| Name | Company | Catalog Number | Comments | |
| 名称 | 类型 | 公司 | 产品编号 | 评论 |
| 设置最多职业英语运动 | ||||
| 职业英语运动系统(10-0310) | 工具 | 池本丽卡 | 010-0310 | 另外一个小的模型也可用。 |
| 无孔的硅插件 | 工具 | 池本丽卡 | 010-032-08 | |
| 混合气体气瓶 | 工具 | 日光山庄 | - | 含95%氧气和5%的二氧化碳。自定义的顺序。 |
| 气体调节器 | 工具 | 小野制作所 | WR - 11 | |
| 0.22微米的过滤器Millex GS | 工具 | Millipore公司 | SLGS033SS | |
| 麻醉和子宫隔离 | ||||
| 大剪刀 | 工具 | Napox | B - 7H | |
| 镊子 | 工具 | Napox | A - 3 - 2 | |
| 处置培养皿 (90毫米× 15毫米) | 工具 | 磐 | SH90 - 15 | 深型的菜是最好的解剖。 |
| 异氟醚 | 试剂 | 雅培 | B506 | 麻醉 |
| 戊巴比妥钠 | 试剂 | 先灵葆雅动物保健 | - | 麻醉 |
| 台氏生理盐水 | 试剂 | - | - | 根据文献的协议。 2。保存在4 ° C。 |
| 定时妊娠的SD大鼠 | 动物 | 查尔斯河实验室日本 | - | |
| 培养基的制备 | ||||
| 文化玻璃瓶 | 工具 | 池本丽卡 | 010-032-05 | |
| 处置培养瓶 | 工具 | 池本丽卡 | 010-032-06 | |
| 硅孔插头 | 工具 | 池本丽卡 | 010-032-07 | |
| 铝箔 | 工具 | 任何公司 | - | |
| 灭菌袋 | 工具 | Hogy | HM - 26 | 对于培养瓶 |
| 灭菌袋 | 工具 | Hogy | HM - 14A | 硅插头 |
| 0.45微米的过滤器Millex医管局 | 工具 | Millipore公司 | SLHA033SS | |
| 50毫升锥形管 | 工具 | 碧迪 | 352070 | |
| 100毫升烧杯中 | 工具 | 磐 | TE - 32 | |
| 大鼠集成电路血清 | 试剂 | 查尔斯河实验室日本 | - | 请参阅:邦彦森崎先生, 电话:+81-(0)45-474-9336传真:+81-(0)45-474-9340 |
| D(+)-葡萄糖 | 试剂 | 瓦科 | 041-00595 | |
| 抗生素antimyotic液体 | 试剂 | Gibco公司 | 15240 | |
| 解剖胚胎 | ||||
| 眼科直剪刀 | 工具 | Napox | MB50 - 7 | 切割子宫壁 |
| 眼科弯剪刀 | 工具 | Napox | MB54 - 2 | 切割卵黄囊 |
| 钳#5 | 工具 | 活力 | T6715 | |
| 钳#5F | 工具 | 雷吉娜 | T6819 | |
| 玻璃吸管 | 工具 | - | - | 由手使用巴斯德吸管。 |
| 灭菌袋 | 工具 | Hogy | HM - 4 | 对于玻璃移液器 |
| 双目显微镜 | 工具 | 徕卡 | Mz7s | |
| 光 | 工具 | 徕卡 | 华彩150XD | |
| 用油石 | 工具 | 内田洋子 | 833-2000 | 钳锐化 |
| 机械油 | 工具 | 内田洋子 | 835-0000 | 钳锐化 |
参考文献
- New, D. A. T., Copp, A. J., Cockroft, D. L. Intoroduction. In mammalian postimplantation embryos. In Mammalian Postimplantation Embryos A Practical Approach. , 1-14 (1990).
- Cockroft, D. L., Copp, A. J., Cockroft, D. L. Dissection and culture of post implantation embryos. In Mammalian Postimplantation Embryos A Practical Approach. , 15-40 (1990).
- Morris-Kay, G. M. Postimplantation mammalian embryos. Essential Developmental Biology A Practical Approach. , 55-66 (1993).
- Fujinaga, M., Tuan, R. S., Lo, C. W. In vitro culture of rodent embryos during the early postimplantation period. Developmental Biology Protocols. , 53-76 (2000).
- Eto, K., Takakubo, F. Improved development of rat embryos in culture during the period of craniofacial morphogenesis. J. Craniofac. Genet. Dev. Biol. 5, 351-355 (1985).
- New, D. A., Cockroft, D. L. A rotating bottle culture method with continuous replacement of the gas phase. Experientia. 35, 138-140 (1979).
- Osumi-Yamashita, N., Ninomiya, Y., Eto, K. Mammalian craniofacial embryology in vitro. Int. J. Dev. Biol. 41, 187-194 (1997).
- Inoue, T., Nakamura, S., Osumi, N. Fate mapping of the mouse prosencephalic neural plate. Dev. Biol. 219, 373-383 (2000).
- Nomura, T., Holmberg, J., Frisen, J., Osumi, N. Pax6-dependent boundary defines alignment of migrating olfactory cortex neurons via the repulsive activity of ephrin A5. Development. 133, 1335-1345 (2006).
- Inoue, Y. U., Asami, J., Inoue, T. Genetic labeling of mouse rhombomeres by Cadherin-6::EGFP-BAC transgenesis underscores the role of cadherins in hindbrain compartmentalization. Neurosci. Res. 63, 2-9 (2009).
- Calegari, F., Huttner, W. B. An inhibition of cyclin-dependent kinases that lengthens, but does not arrest, neuroepithelial cell cycle induces premature neurogenesis. J. Cell Sci. 116, 4947-4955 (2003).
- Osumi, N., Inoue, T. Gene transfer into cultured mammalian embryos by electroporation. Methods. 24, 35-42 (2001).
- Arai, Y. Role of Fabp7, a downstream gene of Pax6, in the maintenance of neuroepithelial cells during early embryonic development of the rat cortex. J. Neurosci. 25, 9752-9761 (2005).
- Takahashi, M., Nomura, T., Osumi, N. Transferring genes into cultured mammalian embryos by electroporation. Dev. Growth Differ. 50, 485-497 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。