Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Метод грызунов Всего культуры эмбрионов использованием Rotator типа бутылки культуры система
В этой статье
Резюме
Всего техника культуре эмбрионов позволяет мыши культуры и крысиных эмбрионов Исключая виво Состоянии в течение ограниченного периода соответствующее середине беременности этапов. В этом видео-протокол, мы демонстрируем наши стандартные процедуры крысы целая культура эмбриона после E12.5 использовании поворотного устройства типа бутылки системе культуры.
Аннотация
Всего культивирования эмбрионов (ВЭС) методика была разработана в 1950 году по количеству новых и его коллегами, и применяется для биологии развития 1. Хотя развитие и рост эмбрионов млекопитающих критически зависят от функции плаценты, ВЭС техника позволяет мыши культуры и крысиных эмбрионов бывших естественных условиях в течение ограниченного периода соответствующее середине беременности этапах эмбрионального день (E) 6,5-E12.5 в мышь или E8.5-E14.5 у крыс 2, 3, 4. В ВЭС, мы можем непосредственно целевой требуемых областях эмбрионов с использованием тонких стеклянных капилляров, поскольку эмбрионы можно управлять под микроскопом. Таким образом, грызунов ВЭС очень полезный метод, когда мы хотим для изучения динамических процессов развития в postimplanted эмбрионов млекопитающих. На сегодняшний день, несколько видов ВЭС системы были разработаны 1. Среди тех, поворотное устройство типа бутылки культуре системы наиболее популярны и подходят для долгосрочных культуры эмбрионов в середине беременности, т. е. после E9.5 и E11.5 у мышей и крыс, соответственно 1. В этом видео-протокол, мы демонстрируем наши стандартные процедуры крысы ВЭС после E12.5 использованием изысканные модели оригинального поворотного устройства системы, который был разработан новый и 5 Кокрофт, 6, и внедрить различные приложения ВЭС технику для исследований в развитии млекопитающих биологии.
протокол
1. Настройка системы ВЭС
- Совместное 0,22 мкм мембранный фильтр для трубки кремния входе в системы ВЭС).
- Откройте клапан газового баллона содержащего O 2 (95%) и CO 2 (5%). Поток газовой смеси в барабан через пузырящийся флакон, содержащий автоклавного воды.
- Отрегулируйте расход газовой смеси до 50 вв.
- Вставить из кремния давайте трубку в бутылку с водой и проверить поток газовой смеси.
- Поворот барабана со скоростью 20 об / мин.
2. Подготовка питательной среды
- Оттепель крысы сразу же центрифугировали (IC) в сыворотке 37,0 ° С б). Добавить D-глюкозы (2 мг / мл) в талых сыворотки в автоклаве 100 мл стакан. Культура среда должна быть подготовлена на первичном уровне культуры (например, используя капот).
- Добавить противогрибковых антибиотиков (100X) жидкости сыворотки 1: 400 разбавления.
- Vaporize оставшиеся изофлуран (из-за наркоза у крыс во время сбора крови) из сыворотки в течение 20 минут при комнатной температуре (RT) с).
- Стерилизовать культуры среде с использованием 0,45 мкм мембранный фильтр.
- Залить 3,0 мл среды в каждой культуре бутылку и запечатать в верхней части каждой бутылке с кремнием вилку, покрытый алюминиевой фольгой (см. ссылку 14.) Г).
- Подготовка три или четыре чашки Петри распоряжении содержащих солевой электронной Тирода).
3. Анестезия у крыс и изоляция матки
- Обезболить тайм-беременные крысы глубоко с ингаляционных анестетиков или парентерально.
- Чистая брюшной области анестезии беременных крыс на 70% этанола.
- Возьмите кожи пинцетом и экстериоризироваться брюшной стенки за счет сокращения кожи с большими ножницами е).
- Возьмите брюшной стенки с парой щипцов и сделать П-образные продольные разрезы большой на брюшную стенку с большими ножницами до грудной г уровень).
- Медведь от кишечника к левой стороне с парой щипцов и выставить один конец матки связаны с яичника.
- Возьмите конец матки с парой щипцов и сократить положение между матки и яичников с большими ножницами.
- Выньте из матки беременных крыс, сокращая жир вокруг матки до другого конца матки.
- Передача матки к чашке Петри содержащих солевой Тирода.
- Усыпить крысу от излишнего администрирования анестетиков или цервикальной дислокации после удаления матки.
4. Удаление эмбрионов из матки
- Кратко промыть матку в физиологическом растворе Тирода и перенести его на второй чашке Петри с парой тонких щипцов ч).
- Под бинокулярный микроскоп, забрать стенки матки с парой тонких щипцов и сократить стенки матки на стороне, противоположной mesometrium соединения с кровеносными сосудами использованием офтальмологических прямые ножницы.
- Вставьте кончик офтальмологических прямые ножницы в пространство между стенки матки и децидуальной. Вырезать стенки матки продольно вдоль antimesometrial стороны.
- Кламп децидуальной на mesometrial стороне и отдельные оплодотворенные из матки с помощью двух пар тонких щипцов я).
- Передача оплодотворенные к третьей чашки Петри с стерилизованные стеклянные пипетки с подходящего диаметра.
5. Препарирование крысиных эмбрионов
- Вставьте один кончик microforceps в децидуальной и сделать поперечный надрез на децидуальной вокруг зародыш с двумя парами щипцами.
- Вставьте кончики пинцета в децидуальной в плацентарной стороны и сделать два продольных разреза по децидуальной к вершине.
- Удалить децидуальной в плацентарной стороны, разрывая на то, что с двумя парами щипцами. Удалите оставшиеся децидуальной с двумя парами щипцами.
- Возьмите мембраны Reichert, делают горизонтальный разрез на ней, так и отдельные мембраны от зародыш на анти-плацентарного стороны.
- Сделайте небольшое отверстие на желточный мешок у изголовья зародыш с двумя парами щипцы, и сократить желточный мешок с парой глазных изогнутые ножницы. Важно, чтобы не повредить крупные сосуды.
- Возьмите амнион на месте вокруг головы эмбриона с двумя парами тонких пинцетом и аккуратно вытащить зародыш из желточного мешка, оторвав амнион ч). Тело эмбриона должны быть выведены из желточного мешка, чтобы увеличить поставку кислорода для эмбриона на стадии середине беременности.
6. Всего культуры эмбриона
- Проверьте повреждения плаценты, желточный мешок, и состояние бьющееся сердце и кровообращение.
- Зная не растягивая пуповины, передачаэмбриона в культуре бутылку с стерилизованные стеклянные пипетки. Перенос соленой Тирода к культуре бутылки должны быть как можно меньше.
- Удалить без отверстия кремния вилку из ротатора барабан. Подключите культуры бутылку пробкой с отверстием для ротатора барабан ВЭС системы перпендикулярно. Будьте осторожны, чтобы не поставить силу на барабане в неподходящих направлениях с ротатором барабан очень тонкой техники. Бутылки с расчлененным эмбрионов переносятся в культуре один за другим; открытии входной двери инкубатора должны быть сведены к минимуму, чтобы избежать температура инкубатора снизился к).
- Через 10 ч культуры, увеличение объемного расхода газовой смеси до 75 см и до 100 мл через 24 ч (табл. 1).
- Питательной среды должно быть изменено около 24 часов, передавая культурные эмбрион в новой бутылке культуры с свежеприготовленной среды. Увеличение потока объемом до 125 см после 34 часов и до 150 мл через 48 ч (табл. 1)
- Время от времени проверяйте состояние культурного эмбрионов путем подсчета частоты сердцебиений (т.е. 120-150/min оптимально), и, наблюдая за кровообращение. Если требуется подсчитать количество сомитов судить рост зародышей в физиологическом растворе Тирода. В нормальном развитии, один сегмент добавляется в два часа.
- Когда ВЭС закончен, остановить поставку газовой смеси и отсоединить входе в трубу и мембранный фильтр, чтобы избежать обратного потока во впускной трубы от восходящей бутылку.
7. Примечания
- Температура внутри системы ВЭС является постоянно поддерживаются на 37.0-37.5 ° C.
- 100% крыс IC сыворотке обычно используется в наших ВЭС для крыс и мышей эмбрионы, и хранятся при температуре -20 ° С до использования.
- Мы покупаем крысы IC сыворотки, которая собирается от крыс, которые анестезировали изофлуран.
- Одноразовые бутылки также доступны Икемото Рика. Бутылки и силиконовыми заглушками необходимо обрабатывать в автоклаве.
- Препарирование эмбрионы должны быть выполнены при комнатной температуре, поскольку поддержание эмбрионов при низкой или высокой температуры во время вскрытия повлияют на дальнейшие развитие в WEC.
- Инструменты для вскрытия стерилизуют сухим жаром.
- Кожи и брюшной стенки должны быть сокращены отдельно, чтобы избежать загрязнения волос на блюдо, насколько возможно. Мы меняем пара крупных ножницы и пинцет с новой парой из них, когда мы сокращаем кожи и изолировать матку, соответственно.
- Использование щипцов чьи советы прекрасны очень важно, чтобы рассекать ткани конечно. Мы вручную резкость кончики пинцета с камня и машинного масла.
- Мы используем одну сторону щипцы, как нож, чтобы избежать избыточного давления в эмбрионы.
- Когда температура внутри ВЭС системы уменьшается, открывая дверь несколько раз, мы по-прежнему, чтобы включить свет, чтобы поддерживать температуру внутри системы.
8. Представитель результаты
На рисунке 1 показаны процедуры вскрытия эмбриона крысы и культурной крысиных эмбрионов.
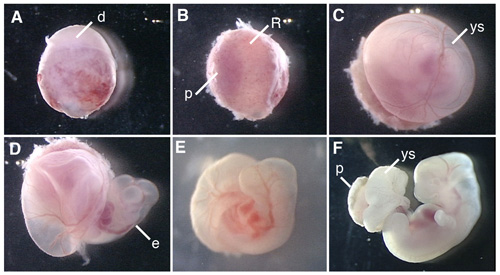
Рисунок 1. Всего культуры зародыш E12.5 крысы эмбриона. (А) зародыш расчлененный из матки беременных крыс. (В) удаление децидуальной на стороне плаценты. (C) Удаление мембраны Reichert в. (D) Открытие желточного мешка. (Е) культивирование эмбриона крысы в бутылке в течение 6 ч после начала ВЭС. (F) эмбриона крысы культивировали в течение 42 часов. д, децидуальной; R; мембраны Reichert в, р, плаценты; Ю.С., желточный мешок; е, эмбрион.
| 0 ч | 12 ч | 24 часа в сутки | 36 ч | 48 часов | |
| E12.5 крысы эмбриона | 95% 50 мл | 95% 75 мл (10 ч) | 95% 100 мл | 95% 125 см (34 час) | 95% 150 мл |
Таблица 1. Оптимальное состояние кислорода.
Обсуждение
Есть два важных шагов в грызун ВЭС для успеха. Во-первых, процедура вскрытия должна быть точной, чтобы не повредить эмбрионов, особенно кровеносные сосуды. Во-вторых, процедура должна быть как можно быстрее, потому что кислород и питательные больше не поставляется через плаценту после в...
Раскрытие информации
Благодарности
Мы благодарим г-н Хадзимэ Ichijo для видео-записи и полезные советы для редактирования видео. Мы также благодарим Drs.Yuji Tsunekawa и кайчи Yoshizaki за добрые помощник для видео-записи. Эта работа проводится при поддержке KAKENHI на молодых ученых и B в приоритетных областях,-молекулярной наук о мозге от MEXT Японии. Мы признаем, поддержке Глобального COE Программа «Базовые и трансляционных исследований Центра глобального науке мозга" от MEXT Японии и основной исследовательской эволюционной науки и техники (CREST) от японской науки и техники от японской корпорации науки и техники агентство (JST) .
Материалы
| Name | Company | Catalog Number | Comments | |
| Имя | Тип | Компания | Номер в каталоге | Комментарий |
| Настройка WEC | ||||
| WEC системы (10-0310) | Инструмент | Икемото Rika | 010-0310 | Другая маленькая модель также доступна. |
| Кремний подключить без отверстия | Инструмент | Икемото Rika | 010-032-08 | |
| Цилиндре газовой смеси | Инструмент | Nikko Sanso | - | Содержащие 95% кислорода и 5% углекислого газа. Индивидуальный заказ. |
| Газовый регулятор | Инструмент | Оно Seisakusho | WR-11 | |
| 0,22 мкм фильтр Millex GS | Инструмент | Millipore | SLGS033SS | |
| Анестезия и изоляция матки | ||||
| Большие ножницы | Инструмент | Napox | В-7Н | |
| Щипцы | Инструмент | Napox | -3-2 | |
| Удаление блюдо Петри (90 мм х 15 мм) | Инструмент | Иваки | SH90-15 | Глубокая типа блюдо лучше всего подходит для вскрытия. |
| Изофлюрана | Реагент | Abbott | B506 | Для анестезии |
| Фенобарбиталом натрия | Реагент | Schering-Plough Animal Health | - | Для анестезии |
| Тирода солевой | Реагент | - | - | Согласно протоколу, как в работе. 2. Сохранить при 4 ° C. |
| Временный беременных Sprague-Dawley крыс | Животное | Чарльз Реки лабораторий Японии | - | |
| Подготовка питательной среды | ||||
| Бутылки стеклянные культуры | Инструмент | Икемото Rika | 010-032-05 | |
| Бутылка удалением культуры | Инструмент | Икемото Rika | 010-032-06 | |
| Кремний вилка с отверстием | Инструмент | Икемото Rika | 010-032-07 | |
| Алюминиевая фольга | Инструмент | Любая компания, | - | |
| Автоклавирование сумки | Инструмент | Hogy | HM-26 | Для культуры бутылки |
| Автоклавирование сумки | Инструмент | Hogy | HM-14A | Для силиконовыми заглушками |
| 0,45 мкм фильтр Millex HA | Инструмент | Millipore | SLHA033SS | |
| 50 мл коническую трубку | Инструмент | Becton Dickinson | 352070 | |
| 100 мл стакан | Инструмент | Иваки | TE-32 | |
| Крыса IC сыворотке | Реагент | Чарльз Реки лабораторий Японии | - | См.: Г-н Кунихико Морисаки, TEL: +81- (0) 45-474-9336, факс: +81- (0) 45-474-9340 |
| D (+)-Глюкоза | Реагент | Вако | 041-00595 | |
| Антибиотик-antimyotic жидкости | Реагент | Гибко | 15240 | |
| Вскрытие эмбрионов | ||||
| Офтальмология прямыми ножницами | Инструмент | Napox | MB50-7 | Для резки стенки матки |
| Офтальмология изогнутые ножницы | Инструмент | Napox | MB54-2 | Для резки желточного мешка |
| Пинцет # 5 | Инструмент | Энергия | T6715 | |
| Пинцет # 5F | Инструмент | Регина | T6819 | |
| Стекло пипетки | Инструмент | - | - | Сделано вручную с помощью пипетки Пастера. |
| Автоклавирование сумки | Инструмент | Hogy | HM-4 | Для стеклянных пипеток |
| Бинокулярный микроскоп | Инструмент | Leica | Mz7s | |
| Свет | Инструмент | Leica | CLS 150XD | |
| Нефть камень | Инструмент | Uchida Yoko | 833-2000 | Для заточки щипцов |
| Машинное масло | Инструмент | Uchida Yoko | 835-0000 | Для заточки щипцов |
Ссылки
- New, D. A. T., Copp, A. J., Cockroft, D. L. Intoroduction. In mammalian postimplantation embryos. In Mammalian Postimplantation Embryos A Practical Approach. , 1-14 (1990).
- Cockroft, D. L., Copp, A. J., Cockroft, D. L. Dissection and culture of post implantation embryos. In Mammalian Postimplantation Embryos A Practical Approach. , 15-40 (1990).
- Morris-Kay, G. M. Postimplantation mammalian embryos. Essential Developmental Biology A Practical Approach. , 55-66 (1993).
- Fujinaga, M., Tuan, R. S., Lo, C. W. In vitro culture of rodent embryos during the early postimplantation period. Developmental Biology Protocols. , 53-76 (2000).
- Eto, K., Takakubo, F. Improved development of rat embryos in culture during the period of craniofacial morphogenesis. J. Craniofac. Genet. Dev. Biol. 5, 351-355 (1985).
- New, D. A., Cockroft, D. L. A rotating bottle culture method with continuous replacement of the gas phase. Experientia. 35, 138-140 (1979).
- Osumi-Yamashita, N., Ninomiya, Y., Eto, K. Mammalian craniofacial embryology in vitro. Int. J. Dev. Biol. 41, 187-194 (1997).
- Inoue, T., Nakamura, S., Osumi, N. Fate mapping of the mouse prosencephalic neural plate. Dev. Biol. 219, 373-383 (2000).
- Nomura, T., Holmberg, J., Frisen, J., Osumi, N. Pax6-dependent boundary defines alignment of migrating olfactory cortex neurons via the repulsive activity of ephrin A5. Development. 133, 1335-1345 (2006).
- Inoue, Y. U., Asami, J., Inoue, T. Genetic labeling of mouse rhombomeres by Cadherin-6::EGFP-BAC transgenesis underscores the role of cadherins in hindbrain compartmentalization. Neurosci. Res. 63, 2-9 (2009).
- Calegari, F., Huttner, W. B. An inhibition of cyclin-dependent kinases that lengthens, but does not arrest, neuroepithelial cell cycle induces premature neurogenesis. J. Cell Sci. 116, 4947-4955 (2003).
- Osumi, N., Inoue, T. Gene transfer into cultured mammalian embryos by electroporation. Methods. 24, 35-42 (2001).
- Arai, Y. Role of Fabp7, a downstream gene of Pax6, in the maintenance of neuroepithelial cells during early embryonic development of the rat cortex. J. Neurosci. 25, 9752-9761 (2005).
- Takahashi, M., Nomura, T., Osumi, N. Transferring genes into cultured mammalian embryos by electroporation. Dev. Growth Differ. 50, 485-497 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены