Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La formación de colonias de células (CFC) para el ensayo de células hematopoyéticas humanas
En este artículo
Resumen
La formación de colonias de células (CFC) de ensayo es un ensayo in vitro en progenitores hematopoyéticos que forman colonias en un medio semi-sólido. Una combinación de la morfología de la colonia, la morfología celular y citometría de flujo se utilizan para evaluar la capacidad de los progenitores para proliferar y diferenciarse a lo largo de los diferentes linajes hematopoyéticos.
Resumen
Hematopoyéticas humanas células madre / progenitoras se obtienen generalmente de la médula ósea, sangre del cordón umbilical o sangre periférica y se utilizan para estudiar la hematopoyesis y leucemogénesis. Tienen la capacidad de diferenciarse en linajes linfoides y mieloides. La formación de colonias de células (CFC) de ensayo se utiliza para estudiar la proliferación y el patrón de diferenciación de células progenitoras hematopoyéticas de su capacidad de formar colonias en un medio semisólido. El número y la morfología de las colonias formadas por un número fijo de células de entrada proporcionan información preliminar sobre la capacidad de los progenitores para diferenciarse y proliferar. Las células pueden ser cosechadas a partir de distintas colonias de la placa entera para evaluar aún más sus números y los estados de diferenciación mediante citometría de flujo y la evaluación morfológica de Giemsa diapositivas. Este ensayo es útil para evaluar la diferenciación mieloide linfoide, pero no. El mieloide término en este contexto se utiliza en su sentido más amplio para abarcar linajes granulocítica, monocítica, eritroide y megacariocítica.
Hemos utilizado este ensayo para evaluar los efectos de los oncogenes en la diferenciación de las células humanas primarias CD34 + derivadas de sangre periférica. Para este propósito las células se transducen con la construcción de control, ya sea por retrovirus o un concepto que expresa el oncogén de interés, en este caso-Nup98 Hoxa9. Contamos con un vector retroviral de uso común, MSCV-IRES-GFP, que expresa un mRNA bicistrónico que produce el gen de interés y un marcador GFP. Las células son pre-activado por el aumento en la presencia de citocinas durante dos días antes de la transducción retroviral. Después de dos días, las células GFP + se encuentran aisladas por la clasificación de células activadas por fluorescencia (FACS) y se mezcla con un medio semisólido que contiene metilcelulosa, complementado con las citocinas y se incuban hasta que las colonias aparecen en la superficie, por lo general 14 días. El número y la morfología de las colonias están documentados. A continuación se retiran las células de las placas, se lavan, se cuentan y sometidos a la citometría de flujo y el examen morfológico. La citometría de flujo con anticuerpos específicos para los marcadores de superficie celular expresadas durante la hematopoyesis proporciona información sobre el linaje y la etapa de maduración. Los estudios morfológicos de las células individuales bajo un microscopio después de Wright-Giemsa tinción de proporcionar más información con respecto a la descendencia y la maduración. Comparación de las células transducidas con el vector de control de vacío a los transducidas con un oncogén revela los efectos del oncogen en la diferenciación hematopoyética.
Protocolo
1. PREPARACIÓN DE LOS REACTIVOS
- Preparar soluciones estériles acciones 1000x de Fms relacionados con la tirosina quinasa 3 (FLT-3) ligando, de granulocitos / macrófagos factor estimulante de colonias (GM-CSF), factor de células madre (SCF), trombopoyetina (TPO), la interleuquina (IL) -3 , y la IL-6 de acuerdo con las instrucciones del fabricante. Prepare una solución estéril de acciones Retronectin (1mg/ml), también de acuerdo a las instrucciones del fabricante. Divide estas soluciones madre en pequeñas alícuotas y mantener a -20 ° C para evitar repetidos de congelación-descongelación.
- Prepare FBS al 2% en IMDM.
- Preparar el medio IMDM completo con una concentración final de 20% de SFB, 2 mM de glutamina, 100 unidades / ml penicilina / estreptomicina (PS). Añadir las citoquinas siguiente justo antes de su uso: 100 ng / ml ligando FLT-3, 20 ng / ml de GM-CSF, 100 ng / ml de SCF, 100 ng / ml TPO, 50 ng / ml de IL-3, y 100 ng / ml IL-6.
- Prepare un 1% de BSA en HBSS (Ca y Mg libre, sin rojo fenol) y el 2% de BSA en D-PBS (Ca y Mg libre). Esterilizar las soluciones al pasar por filtros de 0,22 micras jeringa y se almacenan a 4 ° C.
- Prepare un 0,02% de EDTA en HBSS y se almacenan a 4 ° C.
- Prepare Galv-pseudotyped retrovirus que codifica el ADN de interés y almacenar en alícuotas a -80 ° C. Este procedimiento está fuera del alcance de este artículo, pero es descrito en otra parte (1-3).
Para la tinción Giemsa
- Justo antes de su uso, filtrar la solución Wright / Giemsa dos veces a través de un filtro de documentos micras en una botella de vidrio limpia.
- Inmediatamente antes de su uso, preparar Wright / Giemsa buffer pH 6,4, mediante la mezcla de 50 ml del filtrado Wright / Giemsa solución de tinción y 200 ml de solución tampón fosfato, pH 6,4 - Giordano fórmula.
- Prepare una solución de tampón fosfato, pH 6,0 mediante la disolución de 27,3 g de KH 2 PO 4 y 4,62 g de Na 2 HPO 4 en el 3,5 LH 2 O.
- Prepare un 50% de metanol en H 2 O.
2. PROCEDIMIENTO
Descongelación y la pre-activación de las células CD34 +
- Descongelar un vial de células CD34 + congelados rápidamente a 37 ° C agitando suavemente hasta que el último cristal de hielo delgado es la izquierda y la transferencia de la suspensión celular (1 ml) a un tubo cónico de 50 ml. Enjuague suavemente fuera de las células restantes del vial con 1 ml de la temperatura ambiente del 2% de SFB / IMDM y añadir gota a gota en el tubo de 50 ml, mientras agita suavemente. Espere 3 minutos. A continuación, añada lentamente 2 ml de 2% de SFB / IMDM, mientras se mezcla suavemente, y esperar durante 3 minutos. Repita el procedimiento mediante la adición de 2% de SFB / IMDM que es el mismo volumen que la suspensión celular diluida en intervalos de 3 minutos, revolviendo suavemente entre las adiciones, hasta que el volumen final alcanza los 32 ml.
- Centrifugar a 250 xg durante 10 minutos a temperatura ambiente y separar el sobrenadante dejando alrededor de 0,5 ml.
- Lavar el sedimento en suspensión en 20 ml 2% de SFB / IMDM y centrifugado a 200 xg durante 8 minutos a temperatura ambiente.
- Eliminar el sobrenadante y suspender las células en medio IMDM completo en aproximadamente 0,5 x 10 6 células / ml. Tomar 10 l de la suspensión celular en un microtubo, mezclar con el mismo volumen de solución de azul tripán (0,4%) y contar con un hemocitómetro.
- Diluir las células de 0,1-0,15 x 10 6 células / ml mediante la adición de medio IMDM completo suplementado con las citoquinas (ver 1.3)
- Cultivar las células en un humidificado incubadora a 37 ° C con 5% de CO 2 durante 2 días.
Transducción retroviral por el virus de pre-carga
- En el día de la transducción, las células antes de iniciar el conteo de virus precarga para determinar el número de pozos que estar preparado.
- Diluir la solución madre Retronectin a 25 mg / ml y añadir 400 l de cada pocillo de una de 24 y no tratados con placa de cultivo de tejidos. Incubar durante 2 horas a temperatura ambiente en la campana de flujo laminar de bioseguridad para pre-capa.
- Eliminar la solución Retronectin y añadir 400 l de BSA al 2% en D-PBS en cada pocillo. Incubar durante 30 minutos a temperatura ambiente.
- Descongele soluciones virus de valores y mantener en hielo. Eliminar la solución de BSA, se añaden 0,5 ml de la preparación de virus a cada pocillo, y se centrifuga a 2200 xg a 4 ° C durante 15 minutos.
- Retire la solución de virus de los pozos y repita la carga de virus descritos en 2.10 tres veces más.
- Enjuague bien con agua fría cada HBSS 0,5 ml (+ Ca y Mg) o IMDM.
- Recoger la pre-activado las células CD34 + por centrifugación a 200 xg durante 8 minutos a temperatura ambiente.
- Resuspender las células en 0,1-0,15 x 10 6 células por 1,5 ml en medio IMDM completo con citoquinas.
- Añadir 1,5 ml de suspensión celular a cada pocillo y se incuba en un humidificado incubadora a 37 ° C con 5% de CO 2 durante 2 días.
Clasificación de células y la recolección de las células transducidas
- Suave pero completamente suspender las células en los anteriores virus de los platoss, y filtrar a través de un filtro de 50 micras de células CellTrics en un tubo cónico. Tomar 10 l de la suspensión celular en un microtubo, mezclar con un volumen igual de solución de azul tripán y contar con un hemocitómetro. Enjuague bien cada uno con 0,8 ml de EDTA 0,02% frío / HBSS (Ca y Mg libre sin rojo fenol) y añadir al tubo de la misma colección a través de un filtro de 50 micras de células CellTrics.
- Centrifugar las células a 200 xg durante 8 minutos a 4 ° C, y lavar el precipitado con agua fría HBSS (Ca y Mg libre sin rojo fenol) por centrifugación a 200 xg durante 8 minutos a 4 ° C.
- Resuspender el precipitado en 1% de BSA / HBSS (Ca y Mg libre sin rojo fenol) a una concentración de 15 x 10 6 / ml o un volumen mínimo de 0,250 ml de células de clasificación. Mantener las células en hielo en la oscuridad. Preparar un tubo que contiene 20% de SFB frío / IMDM / Glutamina / PS medio para la recogida de células seleccionadas. La clasificación se realiza en el Centro Clasificador de alta velocidad de la célula de la Alvin J. Siteman Cancer Center en la Universidad de Washington Escuela de Medicina con un MoFlo clasificador de alta velocidad (Dako, Glostrup, Dinamarca).
CFC ensayo
- Descongele el número requerido de 3 ml alícuotas de los medios de prueba de CFC. Agitar vigorosamente para mezclar y dejar que los tubos de soporte por lo menos 5 minutos a que todas las burbujas presentes a subir a la superficie antes de añadir las células.
- Para obtener la concentración de células para cada muestra ordenada, divide el número de células proporcionada por la planta de clasificación por el volumen de suspensión celular aproximados. Tome 3.000 virus transducidas células seleccionadas en un microtubo estéril que contiene 2% de SFB frío / IMDM. Pre-ajustar el volumen de 2% de SFB / IMDM de modo que el volumen de suspensión definitiva será de aproximadamente 0,3 ml.
- Suspender las células y la transferencia de la totalidad de 0,3 ml de suspensión celular a una alícuota de 3 ml de Methocult GF + H4435, que consiste en metilcelulosa al 1%, 30% de SFB, 1% BSA, 10 -4 M de 2-mercaptoetanol, 2 mM L-glutamina, 50 ng / ml de SCF, de 20 ng / ml de GM-CSF, 20 ng / ml de IL-3, 20 ng / ml de IL-6, 20 ng / ml de G-CSF, y 3 unidades / ml de eritropoyetina en IMDM. Humanos metilcelulosa enriquecido Media (R & D Systems), que consta de 1,3% de metilcelulosa, un 25% de SFB, 1% de BSA, 5 x 10 -5 M 2-mercaptoetanol, 2 mM L-glutamina, 50 ng / ml de SCF, de 20 ng / ml de GM-CSF, 20 ng / ml de IL-3, 20 ng / ml de IL-6, 20 ng / ml de G-CSF, y 3 unidades / ml de eritropoyetina en IMDM también se puede utilizar.
- Agitar vigorosamente para hacer la mezcla totalmente aumento y la caída 3-4 veces. Deje que el tubo de detenerse durante 3 min.
- Adjunte una calibre 16 de extremo romo aguja a una jeringa de 3 ml y elaborar 2,2 ml. No elaborar las burbujas grandes, expulsarlos al inicio pulsando un par de veces. Empuje de 1,1 ml cada una en dos de 30 mm no tratados plato y repartir la mezcla de manera uniforme por la rotación.
- Colocar placas duplicadas en una placa de 100 mm con un plato de agua que contiene 3 ml de agua estéril. Cultura de 14 a 17 días.
- Caracterización y calificación de las colonias de acuerdo a su morfología con un microscopio invertido con un aumento de 40x en una placa de cultivo marcada con una cuadrícula de puntuación. A los efectos de nuestro análisis, las colonias se clasifican en tres categorías: eritroide pura, mielomonocítica y mixto. Consulte las instrucciones del fabricante para la subclasificación colonia más.
- La placa de CFC ensayo completo se puede escanear sin ampliación mediante un escáner regulares a 600 dpi, y de baja potencia (40x) microfotografías de las colonias pueden ser tomadas con un microscopio invertido equipado con una cámara a color.
- Para su posterior análisis de la diferenciación y la proliferación de las células de la placa de CFC ensayo completo se recuperan mediante la suspensión de varios volúmenes de la temperatura ambiente del 2% de SFB / IMDM. Después de la centrifugación a 300 xg durante 10 min a 4 ° C, las células se resuspenden en FBS al 2% / IMDM, contados, y, o bien teñidas con anticuerpos para citometría de flujo o transferidos a las diapositivas utilizando una centrifugadora Cytospin para la tinción de Giemsa.
Tinción de anticuerpos y citometría de flujo
- Las células se centrifugan a 200 xg durante 8 minutos a 4 ° C y resuspender en frío un 50% de suero normal de ratón en HBSS (Ca y Mg libre sin rojo fenol).
- Colocar aproximadamente 5 x 10 5 células en 80 l por tubo (12 x 75 mm de fondo redondo de tubos) y mantener en hielo. Agregue la mezcla de anticuerpos (aproximadamente 20 l mezcla o solución de control negativo para los controles de no-anticuerpo) y se mezcla con ligeros golpes en los tubos. Prepare los tubos de calibración de control sin anticuerpos o con un anticuerpo anti-CD45 para cada fluorocromo. Se colocan los tubos en hielo en la oscuridad y se incuba durante 20 minutos. Mezclar con ligeros golpes en los tubos después de los primeros 10 minutos. Después de la incubación de 20 minutos, llenar los tubos con HBSS frío y centrifugar a 200 xg durante 8 minutos a 4 ° C. Resuspender el precipitado en paraformaldehído frío 0,5% / HBSS.
Las siguientes mezclas de anticuerpos se utilizan normalmente para nuestro análisis. Para la diferenciación mieloide: CD11b (ficoeritrina conjugado clon ICRF44) / CD33 (allophycocyanin conjugado clon WM53) / CD45 (ficoeritrina Cy7-congjugated clon HI30). Para la diferenciación eritroide: CD71 (ficoeritrina conjugado clon M-A712) / CD235a (aloficocianina conjugado clon GA-R2) / CD45 (ficoeritrina Cy7-congjugated clon HI30). - La citometría de flujo se lleva a cabo en el Centro clasificador de alta velocidad de la célula de la Alvin J. Siteman Cancer Center en la Universidad de Washington Escuela de Medicina en un citómetro de flujo FACScan actualizado a 5 colores y dos láseres (BD Biosciences) y se analizaron mediante CellQuest (BD Biosciences) o FlowJo v7.2.4 (Árbol Star, Inc., Ashland, Oregón, EE.UU.) de software.
La coloración de Giemsa
- Aproximadamente 30.000 células recuperadas de las placas de ensayo de CFC se ha descrito anteriormente se suspendió en 0,3 ml 2% de SFB / IMDM y trasladado a una diapositiva utilizando una centrifugadora Cytospin a 1.000 rpm durante 10 minutos a temperatura ambiente.
- Establecido nueve buques tinción con soluciones en el siguiente orden.
- El metanol absoluto
- Wright / Giemsa solución madre
- Wright / Giemsa, pH 6,4
- 50% de metanol en H 2 O
- H 2 O
- H 2 O
- Tampón fosfato, pH 6,0
- H 2 O
- H 2 O
- Colocar los portaobjetos en un soporte de diapositivas y la inmersión en metanol absoluto (# 1) durante 2 minutos y secar fuera el exceso de metanol.
- Inmediatamente, sumergir el soporte de diapositivas en Wright / Giemsa solución madre (# 2) durante 5 min.
- La transferencia de la compañía en Wright / Giemsa, pH 6.4 (# 3) y se incuba durante 10 min.
- Sumerja el transporte dos veces en metanol al 50% (# 4), 10 veces en H 2 O (# 5), otras 10 veces en H 2 O (# 6), y luego 5 veces con tampón fosfato, pH 6.0 (# 7) .
- La transferencia de la compañía en H 2 O (# 8) y se incuba durante 2 min. Repita el lavado de H 2 O (# 9).
- Permita que las diapositivas se seque al aire completamente en el vehículo. Eliminar todas las diapositivas y limpie la parte posterior de la diapositiva con empapado de metanol Kimwipes para eliminar las manchas. Coloque una gota de Cytoseal 60 y una cubierta de vidrio para sellar.
- Un recuento diferencial de 500 células se realiza para cada diapositiva de Giemsa utilizando un microscopio Olympus BX51. Las células se dividen en cinco categorías: células primitivas son blastos ni promielocitos, células intermedias mieloide incluyen mielocitos y metamielocitos; células maduras mieloide incluyen bandas, neutrófilos segmentados, monocitos y macrófagos, células intermedias incluyen las células eritroides con hemoglobinization intermedios, y son maduros células eritroides células con hemoglobinization completo. Fotomicrografías se toman con una cámara Olympus DP71, con un objetivo de aceite 60x.
3.0) Los resultados representativos:
- Ensayo de CFC: Parte de la población celular de entrada va a proliferar, diferenciarse y formar colonias en el medio semi-sólido durante el período de incubación de 14 a 17 días. En este experimento, es evidente que la expresión del oncogén Nup98-Hoxa9 causó la formación de prominentes rojo (colonias eritroides) (Figura 1) (3).
- La tinción de anticuerpos y citometría de flujo: inmunofenotipo por citometría de flujo de las células obtenidas a partir de placas de ensayo CFC proporciona información sobre el estado de diferenciación de la población de células. El uso combinado de anticuerpos frente a ciertos marcadores de diferenciación, el linaje y el grado de maduración de las células puede ser evaluada. En este caso CD235a se utilizó para identificar las células eritroides. Como se muestra en la Figura 2A, Nup98-Hoxa9 provocado un aumento en el porcentaje de CD235a + células eritroides, pero el brillo de expresión CD235a por estas células se disminuyó en comparación con los controles, lo que indica la inhibición de la maduración eritroide. En la Figura 2B, las células mieloides se identifican en virtud de su positividad CD33. Nup98-Hoxa9 causó una disminución en el número de células CD33 +, con una disminución en el brillo de expresión CD11b, en consonancia con la inhibición de la maduración mieloide (3). Así, los resultados muestran que la citometría de flujo Nup98-Hoxa9 causado una hiperplasia eritroide con la inhibición de la maduración tanto mieloides y eritroides.
- La tinción de Giemsa: El examen morfológico de células obtenidas a partir de placas de ensayo CFC proporciona información sobre el linaje y el grado de maduración de la población de células. Las conclusiones obtenidas morfológicamente pueden diferir de los obtenidos por los estudios de citometría de flujo, y por lo tanto estos métodos son complementarios entre sí (3). El experimento se repitió al menos tres veces, y cada vez que un recuento diferencial de 500 células se realiza para distinguir cinco categorías de células como se describió anteriormente. Ejemplos de estas células se señalan en la figura 3. Los resultados son tabulados y analizados con el fin de determinar si existen diferencias estadísticamente significativas entre el oncogén transducidas de la muestra y el control. En este caso, los resultados mostraron que Nup98-Hoxa9 causado un aumento global del números de las células, con hiperplasia eritroide y la inhibición de los eritrocitos y la maduración mieloide (3) (no se muestra).
LEYENDAS DE FIGURA

Figura 1: Los efectos de la Nup98-Hoxa9 CFC en la morfología humana.
Primaria humanos células CD34 + fueron transducidas retroviralmente, ya sea con el control MSCV-IRES-GFP vector o vector de expresión de Nup98-Hoxa9, y las células fueron ordenados por la positividad de las buenas prácticas agrarias. Mil células fueron sembradas en cada una de las dos placas duplicadas para el ensayo de CFC y el experimento se repitió tres veces cuatro independientes. Placas representativas sin amplificación (izquierda) y microfotografías de baja potencia del representante colonias eritroides (derecha) se muestra (3).
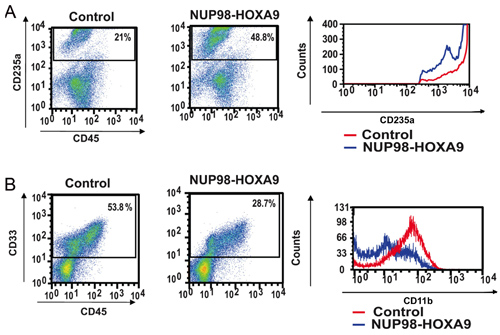
Figura 2: La citometría de flujo muestra la interrupción de los derechos humanos primarios CD34 + diferenciación de las células por Nup98-Hoxa9.
(A) La citometría de flujo para la diferenciación eritroide: Las células de las placas de CFC (ver Figura 1) se cosecharon y se tiñeron con anticuerpos CD45 y CD235a. El CD235a + puerta se representa en un histograma (panel derecho) para mostrar la expresión de CD235a en relación con las células control (B) por citometría de flujo para la diferenciación mieloide: Las células de las placas de CFC fueron cosechadas y se tiñen con CD45 y CD33. El CD33 + puerta se representa en un histograma para mostrar la expresión de CD11b en comparación con el control (panel derecho). Los porcentajes de células que entran en cada puerta se muestra (3).
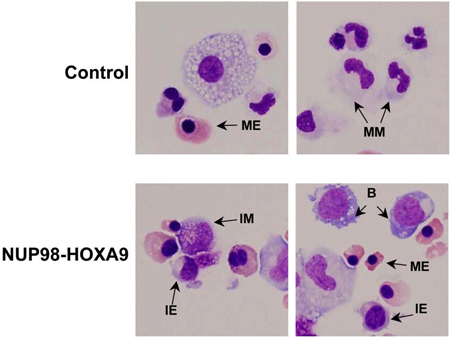
Figura 3: La morfología celular muestra la interrupción de la diferenciación por Nup98-Hoxa9 en comparación con el control de vectores.
Frotis Cytospin fueron preparados a partir de placas de CFC y se tiñeron con Giemsa. Fotomicrografías fueron tomadas de campos representativos con un objetivo de aceite de 60x. B: explosión; MM: mieloide madura, IM: mieloide intermedios, ME: madura eritroides, IE: intermedio eritroides (3).
Discusión
El ensayo de CFC se ha utilizado ampliamente para determinar la proliferación y diferenciación de los patrones de progenitores hematopoyéticos y para estudiar los efectos de los oncogenes (4, 5). Tiene la ventaja sobre los cultivos líquidos de ser un ensayo clonal, de tal manera que las colonias representan la progenie de un solo progenitor y puede ser eliminado de forma individual para su posterior análisis. La limitación de la prueba de CFC es que no es adecuado para la detección de los progenitores más inmadu...
Divulgaciones
Agradecimientos
Materiales
| Name | Company | Catalog Number | Comments |
| IMDM | Life Technologies | 12440 | |
| FBS | Stem Cell Technologies | 06150 | |
| L-Glutamine | Life Technologies | 25030 | |
| Penicillin/Streptomycin (PS) | Life Technologies | 15140 | |
| FLT-3 ligand | PeproTech Inc | 300-19 | |
| GM-CSF | PeproTech Inc | 300-03 | |
| SCF | PeproTech Inc | 300-07 | |
| TPO | PeproTech Inc | 300-18 | |
| IL3 | PeproTech Inc | 200-03 | |
| IL6 | PeproTech Inc | 200-06 | |
| Bovine Serum Albumin | Sigma-Aldrich | A7030 | |
| EDTA | Fisher Scientific | BP118 | |
| Retronectin | Takara Bio Inc | T100A | |
| HBSS | Life Technologies | 14175 | |
| PBS | Life Technologies | 14200 | |
| Trypan Blue solution (0.4%) | Sigma-Aldrich | T8154 | |
| Methocult GF+ H4435 | Stem Cell Technologies | 04445 | |
| Human Methylcellulose Enriched Media | R&D Systems | HSC005 | |
| Wright/ Giemsa stain | Harleco | 64571 | |
| Phosphate Buffer Solution, pH 6.4 - Giordano formula | Ricca Chemical Company | 1450 | |
| Methanol | Fisher Scientific | A412-4 | |
| Cytoseal 60 | Thermo Fisher Scientific, Inc. | 8310 | |
| Normal Mouse Serum | Rockland Immunochemicals | D208 | |
| Anti-Human CD11b phyc–rythrin-conjugated | BD Biosciences | 555388 | |
| Anti-Human CD33 allophycocyanin-conjugated | BD Biosciences | 551378 | |
| Anti-Human CD45 phyc–rythrin-Cy7-congjugated | BD Biosciences | 557748 | |
| Anti-Human CD71 phyc–rythrin-conjugated | BD Biosciences | 555537 | |
| Anti-Human CD235a allophycocyanin-conjugated | BD Biosciences | 551336 | |
| Anti-Human CD45 phyc–rythrin-Cy7-congjugated | BD Biosciences | 557748 | |
| 24-well non-treated tissue culture plates | BD Biosciences | 35-1147 | |
| 30 mm non-treated dish | Stem Cell Technologies | 27150 | |
| 100 mm tissue culture dish | Fisher Scientific | 08-757-12 | |
| Gridded scoring dishes | Stem Cell Technologies | 27500 | |
| 15 ml centrifuge tubes | BD Biosciences | 35-2097 | |
| 50 ml centrifuge tubes | BD Biosciences | 35-2070 | |
| Syringes 3 ml | Stem Cell Technologies | 28240 | |
| 16 gauge blunt-end, 1½ inch needle | Stem Cell Technologies | 28110 | |
| 50 μm CellTrics cell filter | Partec | 04-004-2327 | |
| Hemocytometer | Fisher Scientific | 0267110 | |
| TPX sample chambers | Thermo Fisher Scientific, Inc. | A78710018 | |
| Fisherbrand Superfrost/Plus Microscope Slides, Precleaned | Fisher Scientific | 12-550-15 | |
| Shandon filter cards | Thermo Fisher Scientific, Inc. | 5991022 | |
| Shandon cytospin slide holder | Thermo Fisher Scientific, Inc. | 59920063 | |
| Shandon Complete Staining Assembly 100 | Thermo Fisher Scientific, Inc. | 100 | |
| Kimwipes | Kimberly-Clark Corporation | 34155 | |
| 1 μm filter paper | VWR international | 28307-134 | |
| Inverted microscope | Nikon Instruments | Diaphot | |
| Microscope camera | Nikon Instruments | DS-F11 | |
| Microscope | Olympus Corporation | BX51 | |
| Microscope camera | Olympus Corporation | DP71 | |
| Scanner | Microtek | Scanmaker 4 | |
| Vortex mixer | Fisher Scientific | 12-812 | |
| Tissue culture incubator | Sanyo | MCO-18AIC | |
| Cytospin | Shandon, Inc. | Cytospin 2 | |
| Bench-top centrifuge | Eppendorf | 5810-R | |
| Water purification system | Barnstead | Nanopure-Diamond |
Referencias
- Takeda, A., Goolsby, C., Yaseen, N. R. NUP98-HOXA9 induces long-term proliferation and blocks differentiation of primary human CD34+ hematopoietic cells. Cancer Res. , 66-6628 (2006).
- Yassin, E. R., Abdul-Nabi, A. M., Takeda, A., Yaseen, N. R. Effects of the NUP98-DDX10 oncogene on primary human CD34+ cells: role of a conserved helicase motif. Leukemia. , (2010).
- Yassin, E. R., Sarma, N. J., Abdul-Nabi, A. M., Dombrowski, J., Han, Y., Takeda, A., Yaseen, N. R. Dissection of the transformation of primary human hematopoietic cells by the oncogene NUP98-HOXA9. PLoS One. 4, e6719-e6719 (2009).
- Nissen-Druey, C., Tichelli, A., Meyer-Monard, S. Human hematopoietic colonies in health and disease. Acta Haematol. 113, 5-96 (2005).
- Pereira, C., Clarke, E., Damen, J. Hematopoietic colony-forming cell assays. Methods Mol Biol. 407, 177-208 (2007).
- Coulombel, L. Identification of hematopoietic stem/progenitor cells: strength and drawbacks of functional assays. Oncogene. 23, 7210-7222 (2004).
- Hogge, D. E., Lansdorp, P. M., Reid, D., Gerhard, B., Eaves, C. J. Enhanced detection, maintenance, and differentiation of primitive human hematopoietic cells in cultures containing murine fibroblasts engineered to produce human steel factor, interleukin-3, and granulocyte colony-stimulating factor. Blood. 88, 3765-3773 (1996).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados