Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Colony Forming Cell (CFC)-Assay für humanen hämatopoetischen Zellen
In diesem Artikel
Zusammenfassung
Die Kolonie-bildenden Zellen (CFC)-Assay ist ein in vitro Assay, bei dem hämatopoetischen Vorläuferzellen bilden Kolonien in einem halbfesten Medium. Eine Kombination aus Koloniemorphologie, Zellmorphologie und Durchflusszytometrie werden verwendet, um die Fähigkeit der Vorläuferzellen zur Proliferation und Differenzierung entlang der verschiedenen hämatopoetischen Linien zu beurteilen.
Zusammenfassung
Humanen hämatopoetischen Stammzellen / Vorläuferzellen sind in der Regel aus Knochenmark, Nabelschnurblut oder dem peripheren Blut gewonnen und genutzt werden, um die Blutbildung und Leukämogenese studieren. Sie haben die Fähigkeit, sich in lymphoiden und myeloischen Linien zu differenzieren. Die Kolonie-bildenden Zellen (CFC)-Assay wird verwendet, um die Proliferation und Differenzierung von hämatopoetischen Vorläuferzellen Muster durch ihre Fähigkeit, Kolonien in einem halbfesten Medium Form zu studieren. Die Anzahl und die Morphologie der Kolonien, die durch eine feste Anzahl von Input-Zellen gebildet vorläufige Angaben über die Fähigkeit der Vorläuferzellen zu differenzieren und zu vermehren. Die Zellen können aus einzelnen Kolonien oder die ganze Platte geerntet werden, um weiter zu prüfen ihre Zahl und Differenzierung Staaten mittels Durchflusszytometrie und morphologische Beurteilung der Giemsa-gefärbten Objektträgern. Dieser Test ist nützlich für die Beurteilung der myeloischen aber nicht lymphoide Differenzierung. Der Begriff myeloischer in diesem Zusammenhang ist im weiteren Sinne verwendet, um granulozytäre, Monozyten, erythroiden und Megakaryozyten Linien umfassen.
Wir haben diesen Test verwendet werden, um die Auswirkungen der Onkogene auf die Differenzierung von primären humanen CD34 +-Zellen aus dem peripheren Blut gewonnen zu beurteilen. Zu diesem Zweck Zellen sind entweder mit Kontrolle retroviralen Konstrukt oder ein Konstrukt Expression des Onkogens von Interesse transduziert, in diesem Fall NUP98-HOXA9. Wir beschäftigen eine häufig verwendete retrovirale Vektor, MSCV-IRES-GFP, dass eine bicistronische mRNA, die das Gen von Interesse und ein GFP-Marker produziert ausdrückt. Die Zellen werden durch die in Gegenwart von Zytokinen für zwei Tage vor der retroviralen Transduktion voraktiviert. Nach zwei weiteren Tagen werden GFP +-Zellen durch Fluoreszenz-aktivierte Zellsortierung (FACS) isoliert und mit einer Methylcellulose-haltigen halbfesten Medium mit Zytokinen ergänzt und inkubiert, bis Kolonien auf der Oberfläche, in der Regel 14 Tage angezeigt werden. Die Anzahl und Morphologie der Kolonien sind dokumentiert. Die Zellen werden dann von den Platten entfernt, gewaschen, gezählt und einer Durchflusszytometrie und morphologische Untersuchung. Durchflusszytometrie mit spezifischen Antikörpern an die Zelloberfläche Marker während der Hämatopoese ausgedrückt gibt Auskunft über Herkunft und Reifung der Bühne. Morphologische Untersuchungen von einzelnen Zellen unter dem Mikroskop nach Wright-Giemsa-Färbung liefern weitere Informationen in Bezug auf Herkunft und Reifung. Vergleich von Zellen transduziert mit Kontrolle leeren Vektor zu den transduzierten mit einem Onkogen zeigt die Auswirkungen des Onkogens auf hämatopoetischen Differenzierung.
Protokoll
1. VORBEREITUNG DER REAGENZIEN
- Bereiten Sie sterile 1000x Stammlösungen von FMS-bezogene Tyrosinkinase 3 (FLT-3)-Liganden, Granulozyten / Makrophagen-Kolonie-stimulierenden Faktor (GM-CSF), stem cell factor (SCF), Thrombopoietin (TPO), Interleukin (IL) -3 und IL-6 nach den Anweisungen des Herstellers. Bereiten Sie sterile Retronectin Stammlösung (1mg/ml) auch nach den Anweisungen des Herstellers. Teilen Sie diesen Stammlösungen in kleinen Portionen und halten bei -20 ° C bis wiederholtes Einfrieren und Auftauen zu vermeiden.
- Bereiten Sie 2% FBS in IMDM.
- Bereiten Sie komplette IMDM-Medium mit einer Endkonzentration von 20% FBS, 2 mM Glutamin, 100 Einheiten / ml Penicillin / Streptomycin (PS). Fügen Sie die folgenden Zytokine unmittelbar vor dem Gebrauch: 100 ng / ml FLT-3-Ligand, 20 ng / ml GM-CSF, 100 ng / ml SCF, 100 ng / ml TPO, 50 ng / ml IL-3, und 100 ng / ml IL-6.
- Bereiten Sie 1% BSA in HBSS (Ca und Mg-frei, ohne Phenolrot) und 2% BSA in D-PBS (Ca und Mg-frei). Sterilisation der Lösungen, indem sie durch 0,22 um Spritzenfilter und lagern bei 4 ° C.
- Bereiten 0,02% EDTA in HBSS und lagern bei 4 ° C.
- Bereiten GaLV-pseudotypisiert Retrovirus Kodierung der DNA von Interesse und speichern in Aliquots bei -80 ° C. Dieses Verfahren ist nicht in den Anwendungsbereich dieses Artikels, ist aber an anderer Stelle (1-3) beschrieben.
Für Giemsa Färbung
- Unmittelbar vor Gebrauch filtern die Wright / Giemsa-Lösung zweimal durch 1 um Filterpapier in eine saubere Glasflasche.
- Unmittelbar vor dem Gebrauch vorbereiten Wright / Giemsa-Puffer pH 6,4, durch Mischen von 50 ml des gefilterten Wright / Giemsa-Lösung und 200 ml Phosphatpuffer, pH 6,4 - Giordano Formel.
- Bereiten Phosphatpufferlösung, pH 6,0 durch Auflösen von 27,3 g KH 2 PO 4 und 4,62 g Na 2 HPO 4 in 3,5 LH 2 O.
- Bereiten Sie 50% Methanol in H 2 O.
2. VERFAHREN
Auftauen und vor Aktivierung der CD34 +-Zellen
- Tauwetter ein Fläschchen eingefroren CD34 +-Zellen schnell bei 37 ° C durch leichtes Schütteln, bis eine letzte kleine Eiskristall ist links und Transfer der Zellsuspension (1 ml) zu einem 50 ml konischen Rohr. Vorsichtig abspülen die restlichen Zellen aus dem Fläschchen mit 1 ml Raumtemperatur 2% FBS / IMDM und fügen Sie sie der 50 ml Tube tropfenweise während vorsichtiges Schwenken. Warten Sie 3 Minuten. Anschließend langsam 2 ml 2% FBS / IMDM, während vorsichtiges Mischen und warten für 3 Minuten. Wiederholen Sie den Vorgang durch Zugabe von 2% FBS / IMDM, dass ist das gleiche Volumen wie die verdünnte Zellsuspension bei 3 min Intervallen, vorsichtiges Schwenken in zwischen den Zugaben, bis das Endvolumen erreicht 32 ml.
- Zentrifuge bei 250 xg für 10 Minuten bei Raumtemperatur und Entfernen des Überstandes und hinterließ rund 0,5 ml.
- Waschen des Pellets durch Suspendierung in 20 ml 2% FBS / IMDM und Zentrifugieren bei 200 xg für 8 Minuten bei Raumtemperatur.
- Entfernen Sie den Überstand und die Zellen in komplette IMDM Medium bei ca. 0,5 x 10 6 Zellen / ml. Nehmen Sie sich 10 ul der Zellsuspension in ein Mikroröhrchen, vermischen sich mit dem gleichen Volumen Trypanblau-Lösung (0,4%) und zählt mit einer Zählkammer.
- Verdünnen Sie die Zellen, um 0,1-0,15 x 10 6 Zellen / ml durch Zugabe von kompletten IMDM-Medium mit Zytokinen ergänzt (siehe 1.3)
- Kultur der Zellen in einem befeuchteten 37 ° C Inkubator mit 5% CO 2 für 2 Tage.
Retrovirale Transduktion durch Viren pre-loading
- Am Tag der Transduktion, zählen Zellen vor dem Start Virus Vorbelastung auf die Anzahl der Brunnen, um vorbereitet zu bestimmen.
- Verdünnen Sie die Retronectin Stammlösung auf 25 ug / ml, und fügen Sie 400 ul in jede Vertiefung einer 24-well nicht behandelten Gewebekulturplatte. Inkubieren für 2 Stunden bei Raumtemperatur in der Laminar-Flow-Biosicherheit Haube Vorstrich.
- Entfernen Sie die Retronectin Lösung und fügen 400 ul von 2% BSA in D-PBS in jede Vertiefung. Inkubieren für 30 Minuten bei Raumtemperatur.
- Thaw Virus-Stammlösungen und halten auf dem Eis. Entfernen Sie die BSA-Lösung, 0,5 ml Virus-Präparation in jede Vertiefung und Zentrifuge bei 2200 xg bei 4 ° C für 15 Minuten.
- Entfernen Sie den Virus-Lösung von Brunnen und wiederholen Sie den Virus loading in 2.10 noch dreimal beschrieben.
- Spülen Sie jede Vertiefung mit kaltem 0,5 ml HBSS (+ Ca und Mg) oder IMDM.
- Sammeln Sie die pre-activated CD34 +-Zellen durch Zentrifugation bei 200 xg für 8 Minuten bei Raumtemperatur.
- Resuspendieren der Zellen bei 0,1-0,15 x 10 6 Zellen pro 1,5 ml in komplettem IMDM-Medium mit Zytokinen.
- 1,5 ml Zellsuspension in jede Vertiefung und inkubieren in einem befeuchteten 37 ° C Inkubator mit 5% CO 2 für 2 Tage.
Zellsortierung und Sammlung von transduzierten Zellen
- Behutsam, aber gründlich die Zellen in den obigen Virus-geladenen Plattes und durch ein 50 um CellTrics Zelle Filter in einem konischen Rohr. Nehmen Sie sich 10 ul der Zellsuspension in ein Mikroröhrchen, vermischen sich mit dem gleichen Volumen Trypanblau-Lösung und rechnen mit einer Zählkammer. Spülen Sie jede Kavität mit 0,8 ml kalter 0,02% EDTA / HBSS (Ca und Mg-frei ohne Phenolrot) und fügen Sie die gleiche Sammlung Schlauch durch eine 50 um CellTrics Zelle filtern.
- Zentrifugieren Sie die Zellen bei 200 xg für 8 Minuten bei 4 ° C, und waschen Sie das Pellet mit kaltem HBSS (Ca und Mg-frei ohne Phenolrot) durch Zentrifugation bei 200 xg für 8 Minuten bei 4 ° C.
- Das Pellet in 1% BSA / HBSS (Ca und Mg-frei ohne Phenolrot) zu einer Konzentration von 15 X 10 6 / ml oder ein minimales Volumen von 0,250 ml für die Zell-Sortierung. Halten Sie die Zellen auf Eis im Dunkeln. Bereiten Sie ein Röhrchen mit kaltem 20% FBS / IMDM / Glutamin / PS Medium zum Sammeln der sortierten Zellen. Die Sortierung erfolgt auf der High Speed Cell Sorter Kern des Alvin J. Siteman Cancer Center an der Washington University School of Medicine mit einem MoFlo High-Speed-Sorter (Dako, Glostrup, Dänemark) durchgeführt.
CFC-Assay
- Thaw die erforderliche Anzahl von 3 ml Aliquots von CFC-Assay Medien. Vortex kräftig zu mischen und die Röhrchen stehen mindestens 5 min zu lassen alle Blasen an die Oberfläche, bevor Sie Zellen steigen.
- Um die Zellkonzentration für jede sortierte Stichprobe, teilen sich die Zellzahl durch die Sortieranlage von der ungefähren Zellsuspension Volumen zur Verfügung gestellt. Nehmen Sie 3.000 Virus-transduzierten, sortierten Zellen in eine sterile Mikroröhrchen mit kalten 2% FBS / IMDM. Pre-Einstellen der Lautstärke von 2% FBS / IMDM, so dass die endgültige Suspension Volumen wird ca. 0,3 ml werden.
- Suspend den Zellen und den Transfer der gesamten 0,3 ml Zellsuspension auf eine 3 ml Aliquot Methocult GF + H4435, die von 1% Methylcellulose besteht, 30% FBS, 1% BSA, 10 -4 M 2-Mercaptoethanol, 2 mM L-Glutamin, 50 ng / ml SCF, 20 ng / ml GM-CSF, 20 ng / ml IL-3, 20 ng / ml IL-6, 20 ng / ml G-CSF, und 3 Einheiten / ml Erythropoietin in IMDM. Menschliche Methylcellulose Enriched Media (R & D Systems), die von 1,3% Methylcellulose besteht, 25% FBS, 1% BSA, 5 x 10 -5 M 2-Mercaptoethanol, 2 mM L-Glutamin, 50 ng / ml SCF, 20 ng / ml GM-CSF, 20 ng / ml IL-3, 20 ng / ml IL-6, 20 ng / ml G-CSF, und 3 Einheiten / ml Erythropoietin in IMDM können ebenfalls verwendet werden.
- Vortex kräftig, um das Gemisch vollständig Aufstieg und Fall 3-4 mal. Lassen Sie den Schlauch stehen noch für 3 min.
- Bringen Sie einen 16-Gauge-blunt-end Nadel ein 3 ml Spritze und ziehen Sie 2,2 ml. Zeichnen Sie nicht bis große Blasen, vertreiben sie an den Anfang, indem Sie ein paar mal. Schieben Sie 1,1 ml jeweils in zwei 30 mm nicht behandelten Schale und breitete die Mischung gleichmäßig durch Drehen.
- Legen Sie doppelte Platten in einem 100 mm-Platte zusammen mit einer Schüssel Wasser mit 3 ml sterilem Wasser. Kultur für 14 bis 17 Tagen.
- Charakterisieren und Gäste den Kolonien nach ihrer Morphologie mit einem inversen Mikroskop bei 40facher Vergrößerung in einer Kulturschale mit einem Scoring-Gitter markiert. Pure erythroiden, myelomonozytäre und gemischt: Für die Zwecke unserer Test werden die Kolonien in 3 Kategorien eingeteilt. Siehe Anweisungen des Herstellers für weitere Kolonie Subklassifikation.
- Die gesamte FCKW-Assay Platte kann ohne Vergrößerung mit einem normalen Scanner bei 600 dpi, und Low-Power-(40x) Aufnahmen von Kolonien aufgenommen mit einem inversen Mikroskop mit einer Farbkamera ausgestattet werden können gescannt werden.
- Zur weiteren Analyse der Differenzierung und Proliferation, werden die Zellen aus dem gesamten CFC Assay-Platte durch die Aussetzung in mehreren Bänden der Raumtemperatur 2% FBS / IMDM erholt. Nach Zentrifugation bei 300 xg für 10 min bei 4 ° C werden die Zellen in 2% FBS / IMDM, gezählt und entweder mit Antikörpern für die Durchflusszytometrie gebeizt oder an Folien mit einem Cytospin Zentrifuge für Giemsafärbung resuspendiert.
Antikörper-Färbung und Durchflusszytometrie
- Centrifuge Zellen bei 200 xg für 8 min bei 4 ° C und resuspendieren in kaltem 50% normal Mausserum in HBSS (Ca und Mg-frei ohne Phenolrot).
- Es werden ca. 5 x 10 5 Zellen in 80 ul pro Röhrchen (12 x 75 mm Rundboden-Röhrchen) und halten Sie auf dem Eis. Add-Antikörper-Gemisch (ca. 20 ul Gemisch oder negativen Kontroll-Lösung für nicht-Antikörper-Kontrollen) zugeben und durch leichtes Klopfen der Rohre. Bereiten Kalibrierung Röhren ohne Antikörper oder mit einem anti-CD45 Antikörper für jedes Fluorochrom. Die Röhrchen auf Eis im Dunkeln inkubieren für 20 Minuten. Mix durch leichtes Klopfen Rohre nach den ersten 10 min. Nach der 20 min Inkubation, füllen Sie das Röhrchen mit kaltem HBSS und Zentrifuge bei 200 xg für 8 min bei 4 ° C. Das Pellet in kaltem 0,5% Paraformaldehyd / HBSS.
Die folgenden Mischungen von Antikörpern sind in der Regel für unsere Analyse verwendet. Für myeloische Differenzierung: CD11b (Phycoerythrin-konjugierten Klon ICRF44) / CD33 (allophycocyanin-konjugierte Klon WM53) / CD45 (Phycoerythrin-Cy7-congjugated Klon HI30). Für erythroiden Differenzierung: CD71 (Phycoerythrin-konjugierten Klon M-A712) / CD235a (Allophycocyanin-konjugierte Klon GA-R2) / CD45 (Phycoerythrin-Cy7-congjugated Klon HI30). - Die Durchflusszytometrie ist an der High Speed Cell Sorter Kern des Alvin J. Siteman Cancer Center an der Washington University School of Medicine an einem FACScan Durchflußzytometer aufgerüstet zu 5 Farben und zwei Lasern (BD Biosciences) durchgeführt und ausgewertet werden CellQuest (BD Biosciences) oder FlowJO v7.2.4 (Tree Star, Inc., Ashland, OR, USA) Software.
Giemsa-Färbung
- Rund 30.000 Zellen aus FCKW-Assay-Platten wieder oben beschrieben sind in 0,3 suspendiert ml 2% FBS / IMDM und auf einem Objektträger mit einem Cytospin Zentrifuge bei 1.000 rpm für 10 min bei Raumtemperatur.
- Set-up neun Färbung Gefäße mit Lösungen in der folgenden Reihenfolge.
- Absolute Methanol
- Wright / Giemsa-Stammlösung
- Wright / Giemsa-Puffer, pH 6,4
- 50% Methanol in H 2 O
- H 2 O
- H 2 O
- Phosphatpuffer, pH 6,0
- H 2 O
- H 2 O
- Legen Sie die Folien in eine Folie Träger und tauchen in absolutem Methanol (# 1) für 2 min und abtupfen überschüssige Methanol.
- Sofort tauchen die Spannplatte in Wright / Giemsa-Stammlösung (# 2) für 5 min.
- Übertragen Sie die Träger in Wright / Giemsa-Puffer, pH 6,4 (# 3) und Inkubation für 10 min.
- Tauchen Sie den Träger zweimal in 50% Methanol (# 4), 10-mal in H 2 O (# 5), weitere 10 Mal in H 2 O (# 6) und dann 5 Mal in Phosphatpuffer, pH 6.0 (# 7) .
- Übertragen Sie die Träger in H 2 O (# 8) und Inkubation für 2 min. Wiederholen Sie die Wäsche in H 2 O (# 9).
- Lassen Sie die Folien an der Luft trocknen vollständig in den Träger. Entfernen Sie jede Folie und wischen Sie die Rückseite der Folie mit Methanol getränkten Kimwipes um Flecken zu entfernen. Geben Sie einen Tropfen Cytoseal 60 und einem Deckglas zu versiegeln.
- Ein 500-Zelle Differentialblutbild ist für jeden Giemsa-gefärbten Folie mit einer Olympus BX51 Mikroskop durchgeführt. Die Zellen werden in fünf Kategorien unterteilt: primitive Zellen sind Blasten und Promyelozyten; Zwischen-myeloischen Zellen gehören Myelozyten und Metamyelozyten; reifen myeloischen Zellen gehören Bänder, segmentierten neutrophilen Granulozyten, Monozyten und Makrophagen, Zwischen-erythroiden Zellen sind Zellen mit mittleren hemoglobinization und reifen erythroiden Zellen sind Zellen mit voller hemoglobinization. Mikroaufnahmen sind mit einer Olympus DP71-Kamera mit 60x Öl-Objektiv aufgenommen.
3,0) repräsentative Ergebnisse:
- CFC-Assay: Einige der Input-Zell-Population wird zunehmen, zu differenzieren und bilden Kolonien auf dem halbfesten Medium während der 14 bis 17-tägigen Inkubationszeit. In diesem Experiment ist es offensichtlich, dass die Expression des NUP98-HOXA9 Onkogen die Bildung von markanten roten (erythroiden Kolonien) (Abbildung 1) (3) verursacht.
- Antikörper-Färbung und Durchflusszytometrie: Flow Immunphänotypisierung von Zellen aus FCKW-Assay-Platten gesammelt liefert Informationen über die Differenzierung Stand der Zellpopulation. Durch die kombinierte Verwendung von Antikörpern gegen bestimmte Differenzierungsmarker, kann die Linie und den Grad der Reifung von Zellen beurteilt werden. In diesem Fall CD235a wurde verwendet, um erythroiden Zellen zu identifizieren. Wie in Abbildung 2A gezeigt, verursacht NUP98-HOXA9 eine Zunahme des Anteils der CD235a + erythroiden Zellen, aber die Helligkeit des CD235a Ausdruck von diesen Zellen war im Vergleich zur Kontrollgruppe vermindert, was darauf hinweist Hemmung der erythroiden Reifung. In Abbildung 2B sind myeloischen Zellen durch ihre CD33-Positivität identifiziert. NUP98-HOXA9 verursacht eine Abnahme der Zahl der CD33 +-Zellen, mit einer Abnahme der Helligkeit von CD11b Expression, im Einklang mit Hemmung der myeloischen Reifung (3). So ist die Durchflusszytometrie Ergebnisse zeigen, dass NUP98-HOXA9 einer Erythroid Hyperplasie mit der Hemmung der beiden myeloischen und erythroiden Reifung verursacht.
- Giemsa-Färbung: Morphologische Untersuchung von Zellen aus FCKW-Assay-Platten gesammelt gibt Auskunft über die Herkunft und Reifegrad der Zellpopulation. Die Schlussfolgerungen erhalten morphologisch können von den durch durchflusszytometrische Studien gewonnenen unterscheiden und damit diese Methoden sind komplementär zueinander (3). Das Experiment ist mindestens 3 mal wiederholt, und jedes Mal, wenn ein 500-Zelle Differentialblutbild durchgeführt wird, um 5 Kategorien von Zellen zu unterscheiden, wie oben beschrieben. Beispiele für diese Zellen sind in Abbildung 3 hingewiesen. Die Ergebnisse sind tabellarisch dargestellt und analysiert, um festzustellen, ob es statistisch signifikante Unterschiede zwischen den Onkogen-transduzierten Probe und der Kontrolle. In diesem Fall zeigten die Ergebnisse, dass NUP98-HOXA9 eine allgemeine Erhöhung der Anzahl verursachts von Zellen, mit erythroiden Hyperplasie und Hemmung der beiden roten und weißen Reifen (3) (nicht dargestellt).
ABBILDUNG LEGENDS

Abbildung 1: Die Auswirkungen der NUP98-HOXA9 auf die menschliche CFC Morphologie.
Primäre humane CD34 +-Zellen wurden retroviral transduzierten entweder mit Kontrolle MSCV-IRES-GFP-Vektor oder Vektor, NUP98-HOXA9, und die Zellen wurden GFP-Positivität sortiert. Tausend Zellen wurden in jeweils zwei doppelte Platten für CFC-Assay ausgesät und der Versuch wurde 3 4 unabhängige mal wiederholt. Vertreter Platten ohne Vergrößerung (links) und Low-Power-Aufnahmen von repräsentativen erythroiden Kolonien (rechts) gezeigt werden (3).
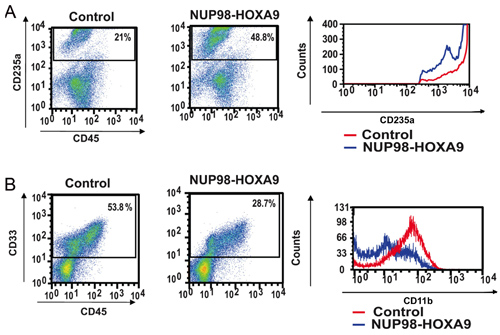
Abbildung 2: Die Durchflusszytometrie zeigt Störung des primären humanen CD34 +-Zell-Differenzierung durch NUP98-HOXA9.
(A) Durchflusszytometrie für erythroiden Differenzierung: Zellen aus dem CFC-Platten (siehe Abbildung 1) wurden geerntet und mit Antikörpern angefärbt, um CD45 und CD235a. Die CD235a + Tor wurde in einem Histogramm (rechts) aufgetragen, um die Expression von CD235a relativ zu Kontrollzellen zeigen (B) Durchflusszytometrie für myeloische Differenzierung: Zellen aus dem CFC-Platten wurden geerntet und mit CD45 und CD33 gefärbt. Die CD33 + Tor wurde in einem Histogramm aufgetragen, um CD11b Expression im Vergleich zur Kontrollgruppe (rechts) zeigen. Der prozentuale Anteil der Zellen fallen jedes Tor werden angezeigt (3).
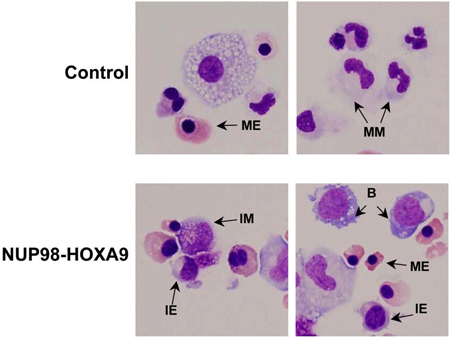
Abbildung 3: Zellmorphologie zeigt Störung der Differenzierung von NUP98-HOXA9 zu-Vektor-Regelung verglichen.
Cytospin Abstriche wurden von CFC-Platten hergestellt und mit Giemsa. Mikroaufnahmen wurden aus repräsentativen Bereichen mit einem 60x Öl-Objektiv aufgenommen. B: blast; MM: reifen myeloischen, IM: Zwischen myeloische, ME: mature erythroiden, IE: Zwischen erythroiden (3).
Diskussion
Der CFC-Assay wurde intensiv auf die Proliferation und Differenzierung von hämatopoetischen Vorläuferzellen Muster zu ermitteln und die Auswirkungen der Onkogene (4, 5) Studie verwendet. Es hat den Vorteil gegenüber flüssigen Kulturen zu einer klonalen Assay, so dass die Kolonien die Nachkommen eines einzigen Stammvater vertreten und können individuell für die weitere Analyse entfernt werden. Die Begrenzung der FCKW-Test ist, dass es nicht für den Nachweis von mehr unreife Vorläuferzellen oder hämatopoetische S...
Offenlegungen
Danksagungen
Materialien
| Name | Company | Catalog Number | Comments |
| IMDM | Life Technologies | 12440 | |
| FBS | Stem Cell Technologies | 06150 | |
| L-Glutamine | Life Technologies | 25030 | |
| Penicillin/Streptomycin (PS) | Life Technologies | 15140 | |
| FLT-3 ligand | PeproTech Inc | 300-19 | |
| GM-CSF | PeproTech Inc | 300-03 | |
| SCF | PeproTech Inc | 300-07 | |
| TPO | PeproTech Inc | 300-18 | |
| IL3 | PeproTech Inc | 200-03 | |
| IL6 | PeproTech Inc | 200-06 | |
| Bovine Serum Albumin | Sigma-Aldrich | A7030 | |
| EDTA | Fisher Scientific | BP118 | |
| Retronectin | Takara Bio Inc | T100A | |
| HBSS | Life Technologies | 14175 | |
| PBS | Life Technologies | 14200 | |
| Trypan Blue solution (0.4%) | Sigma-Aldrich | T8154 | |
| Methocult GF+ H4435 | Stem Cell Technologies | 04445 | |
| Human Methylcellulose Enriched Media | R&D Systems | HSC005 | |
| Wright/ Giemsa stain | Harleco | 64571 | |
| Phosphate Buffer Solution, pH 6.4 - Giordano formula | Ricca Chemical Company | 1450 | |
| Methanol | Fisher Scientific | A412-4 | |
| Cytoseal 60 | Thermo Fisher Scientific, Inc. | 8310 | |
| Normal Mouse Serum | Rockland Immunochemicals | D208 | |
| Anti-Human CD11b phyc–rythrin-conjugated | BD Biosciences | 555388 | |
| Anti-Human CD33 allophycocyanin-conjugated | BD Biosciences | 551378 | |
| Anti-Human CD45 phyc–rythrin-Cy7-congjugated | BD Biosciences | 557748 | |
| Anti-Human CD71 phyc–rythrin-conjugated | BD Biosciences | 555537 | |
| Anti-Human CD235a allophycocyanin-conjugated | BD Biosciences | 551336 | |
| Anti-Human CD45 phyc–rythrin-Cy7-congjugated | BD Biosciences | 557748 | |
| 24-well non-treated tissue culture plates | BD Biosciences | 35-1147 | |
| 30 mm non-treated dish | Stem Cell Technologies | 27150 | |
| 100 mm tissue culture dish | Fisher Scientific | 08-757-12 | |
| Gridded scoring dishes | Stem Cell Technologies | 27500 | |
| 15 ml centrifuge tubes | BD Biosciences | 35-2097 | |
| 50 ml centrifuge tubes | BD Biosciences | 35-2070 | |
| Syringes 3 ml | Stem Cell Technologies | 28240 | |
| 16 gauge blunt-end, 1½ inch needle | Stem Cell Technologies | 28110 | |
| 50 μm CellTrics cell filter | Partec | 04-004-2327 | |
| Hemocytometer | Fisher Scientific | 0267110 | |
| TPX sample chambers | Thermo Fisher Scientific, Inc. | A78710018 | |
| Fisherbrand Superfrost/Plus Microscope Slides, Precleaned | Fisher Scientific | 12-550-15 | |
| Shandon filter cards | Thermo Fisher Scientific, Inc. | 5991022 | |
| Shandon cytospin slide holder | Thermo Fisher Scientific, Inc. | 59920063 | |
| Shandon Complete Staining Assembly 100 | Thermo Fisher Scientific, Inc. | 100 | |
| Kimwipes | Kimberly-Clark Corporation | 34155 | |
| 1 μm filter paper | VWR international | 28307-134 | |
| Inverted microscope | Nikon Instruments | Diaphot | |
| Microscope camera | Nikon Instruments | DS-F11 | |
| Microscope | Olympus Corporation | BX51 | |
| Microscope camera | Olympus Corporation | DP71 | |
| Scanner | Microtek | Scanmaker 4 | |
| Vortex mixer | Fisher Scientific | 12-812 | |
| Tissue culture incubator | Sanyo | MCO-18AIC | |
| Cytospin | Shandon, Inc. | Cytospin 2 | |
| Bench-top centrifuge | Eppendorf | 5810-R | |
| Water purification system | Barnstead | Nanopure-Diamond |
Referenzen
- Takeda, A., Goolsby, C., Yaseen, N. R. NUP98-HOXA9 induces long-term proliferation and blocks differentiation of primary human CD34+ hematopoietic cells. Cancer Res. , 66-6628 (2006).
- Yassin, E. R., Abdul-Nabi, A. M., Takeda, A., Yaseen, N. R. Effects of the NUP98-DDX10 oncogene on primary human CD34+ cells: role of a conserved helicase motif. Leukemia. , (2010).
- Yassin, E. R., Sarma, N. J., Abdul-Nabi, A. M., Dombrowski, J., Han, Y., Takeda, A., Yaseen, N. R. Dissection of the transformation of primary human hematopoietic cells by the oncogene NUP98-HOXA9. PLoS One. 4, e6719-e6719 (2009).
- Nissen-Druey, C., Tichelli, A., Meyer-Monard, S. Human hematopoietic colonies in health and disease. Acta Haematol. 113, 5-96 (2005).
- Pereira, C., Clarke, E., Damen, J. Hematopoietic colony-forming cell assays. Methods Mol Biol. 407, 177-208 (2007).
- Coulombel, L. Identification of hematopoietic stem/progenitor cells: strength and drawbacks of functional assays. Oncogene. 23, 7210-7222 (2004).
- Hogge, D. E., Lansdorp, P. M., Reid, D., Gerhard, B., Eaves, C. J. Enhanced detection, maintenance, and differentiation of primitive human hematopoietic cells in cultures containing murine fibroblasts engineered to produce human steel factor, interleukin-3, and granulocyte colony-stimulating factor. Blood. 88, 3765-3773 (1996).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten